文章信息
- 刘翠翠, 胡梦蝶, 王志, 代俊, 姚娟, 李沛, 李志军, 陈雄, 李欣.
- LIU Cui-cui, HU Meng-die, WANG Zhi, DAI Jun, YAO Juan, LI Pei, LI Zhi-jun, CHEN Xiong, LI Xin.
- 鲁氏酵母胞内海藻糖积累过程的代谢特征分析
- Metabolic Characteristics of Intracellular Trehalose Accumulation in Zygosaccharomyces rouxii
- 中国生物工程杂志, 2017, 37(9): 41-47
- China Biotechnology, 2017, 37(9): 41-47
- http://dx.doi.org/DOI:10.13523/j.cb.20170906
-
文章历史
- 收稿日期: 2017-03-22
- 修回日期: 2017-05-08
2. 湖北安琪酵母股份有限公司 宜昌 443003
2. Hubei Angel Yeast Limited by Share Ltd, Yichang 443003, China
鲁氏酵母是一种产香性酵母菌,在传统发酵制品现代化生产中具有重要的作用[1]。然而,鲁氏酵母活性干酵母-酵母应用的主要形式-的不耐储藏的缺点严重阻碍了鲁氏酵母的应用[2]。因此,研制高耐受能力的鲁氏酵母菌株对推动鲁氏酵母在食品工业中的应用具有积极的作用。
海藻糖是由两分子葡萄糖通过α1-1糖苷键相连的非还原性双糖,在细菌、植物、真菌中均有发现[3]。在酵母中,海藻糖能有效地提升酵母细胞在高温、低温高渗透压、干燥、乙醇等逆境下的耐受水平[4-15]。通过基因工程强化酵母鲁氏酵母细胞胞内海藻糖合成能力并阻断其降解途径获得一定成功[16-18]。然而,受限于对鲁氏酵母食品安全性的要求,工程菌无法实际应用于生产中。通过定向驯化[19-20]或发酵代谢调控技术[21-22]获得高胞内海藻糖鲁氏酵母细胞成为最贴近应用需求的道路。这就需要对鲁氏酵母海藻糖积累的代谢特征有比较清晰的了解。
本研究以一株从民间传统酿造食品中分离出的鲁氏酵母菌为对象,研究了其胞内海藻糖积累过程中的氨基酸代谢、丙酮酸代谢和三羧酸循环代谢的响应特点,为研究鲁氏酵母新的胞内海藻糖发酵调控策略和遗传工程改造位点提供了理论基础。
1 材料与方法 1.1 材料 1.1.1 主要试剂和培养基氨基酸ECF衍生化试剂、氨基酸和有机酸色谱标准品均来自国药集团化学试剂有限公司。气相色谱内标物乙酸苯乙酯来自梯希爱(上海)化成工业发展有限公司。糖蜜购自湖北安琪酵母股份有限公司。
酵母活化培养基YEPD:10g/L酵母抽提物、20g/L蛋白胨、20g/L葡萄糖,pH5.0。
酵母种子和发酵糖蜜培养基:377.5ml/L糖蜜,11.5g/L酵母粉,45.5g/L KH2PO4,2.5g/L KCl,25g/L (NH4)2SO4,3g/L MgSO4·7H2O,自然pH。
1.1.2 主要实验仪器10L机械搅拌发酵罐来自上海环联生物工程设备有限公司,BL-75A高压灭菌锅来自上海博讯实业有限公司医疗设备厂,CT15RE离心机为日本日立公司生产,气相色谱7890B来自美国塞默飞公司,高压液相色谱U3000来自美国安捷伦公司,纯水仪购自英国ELGA公司,HNY-211B恒温振荡摇床购自天津欧诺公司。
1.1.3 实验菌株鲁氏酵母(Zygosaccharomyces rouxii)CCTCC M2013310由湖北工业大学功能酵母与酿造微生物研究室提供。
1.2 试验方法 1.2.1 菌种活化和种子液的制备采用两级培养策略制备鲁氏酵母以保证细胞的活力。鲁氏酵母首先在YEPD培养基中于30℃条件下活化24h后,转接10%活化液至发酵糖蜜培养基中,在相同条件下继续培养27h后,按10%的接种量将种子液转移入已灭菌的10L机械搅拌发酵罐中。
1.2.2 发酵调控策略控制10L机械搅拌发酵罐上,鲁氏酵母分批发酵策略为:初始发酵培养基装液量5L,接种量600ml,发酵温度设定为30℃,搅拌转速设定为400r/min,通气量为1vvm。采用3mol/L NaOH和3mol/L HCl调节发酵培养基pH维持在5.0。0.5‰的泡敌作为消泡剂以防止发酵过程中泡沫的积累。发酵总时长设定为24h,并每2h取样用于检测。
补料分批发酵策略:在分批发酵策略的基础上,于发酵第10h开始以恒定速率补加1 200ml糖蜜。
补料分批控温发酵策略:在补料分批发酵策略的基础上,于发酵第16h升温并维持2h。
1.2.3 生物量和胞内海藻糖浓度的测定适量发酵液于8 000r/min、4℃离心10min,菌体用于生物量和胞内海藻糖的检测。酵母细胞生物量用600nm的吸光度表示。胞内海藻糖采用硫酸-蒽酮法检测[23-24]。海藻糖浓度定义为每克干重酵母细胞所含有的海藻糖质量数,以mg/gDw表示。
1.2.4 胞外游离氨基酸的气相检测适量发酵液于8 000r/min、4℃离心10min,取适量上清进行ECF衍生化[25],衍生液用于胞外游离氨基酸浓度检测。乙酸苯乙酯作为内标物。
气相色谱条件:采用HP-5毛细血管色谱柱(30mm×0.32mm×0.25μm,安捷伦,美国);升温程序:柱温设定为70℃保留5min,然后以5℃/min上升到260℃,保留2min;进样口和检测器的温度均设定为280℃;进样量1μl;采用不分流模式;流速设定为1ml/min;载气为氮气;检测器为氢火焰离子检测器。
1.2.5 胞外有机酸的高压液相分析2ml发酵样品经离心后取滤液,并加入2.5ml乙酸乙酯(含0.10ml 2.3mol/L硫酸),振荡混合,5 000r/min离心3min,取1.0ml乙酸乙酯层并室温干燥。在干燥物中加入2.5ml流动相进行充分溶解,再于10 000r/min离心10min,过0.22μm滤膜,用于有机酸高压液相色谱检测。
高效液相色谱基本设置参数:色谱柱为安捷伦ZORBAXSB-Aq(150mm×4.6mm×5μm,Aglient,USA);柱温为30℃;进样量为10μl;检测波长为210nm;流速为0.6ml/min;流动相为含1%乙腈的1.75g/L K2HPO4溶液(H3PO4调pH至1.8)。
1.2.6 色谱数据的分析以标准品的保留时间为标准,对发酵样品中的色谱峰进行定性分析,以确定所对应的代谢产物。在定量分析中,气相色谱数据处理采用内标法,高压液相色谱数据采用外标法,以确定发酵样品中代谢产物的浓度。
2 结果与分析 2.1 不同发酵调控模式下的酵母生长和胞内海藻糖积累规律分析胞内海藻糖积累水平与细胞生长存在双重联系。细胞数的增加和海藻糖合成代谢强度的提高均有利于单位质量酵母细胞胞内海藻糖的积累。图 1显示了鲁氏酵母CCTCC M2013310在分批、分批补料和分批补料控温策略下的细胞生长和胞内海藻糖变化。补料策略或结合控温策略均有利于鲁氏酵母生物量的增加,其发酵终点的生物量分别比分批发酵策略提高了1.38倍和1.47倍,如图 1(a)所示。这两种策略也明显有助于鲁氏酵母细胞胞内海藻糖的积累,其最大积累浓度分别比分批发酵策略提高了67.97%和114.89%,如图 1(b)所示。需要注意的是,补料策略和控温策略的效果是有差异的。补料策略能避免胞内海藻糖在发酵中期开始的消耗,而控温策略能在发酵过程的某个时间段内进一步提高胞内海藻糖水平。
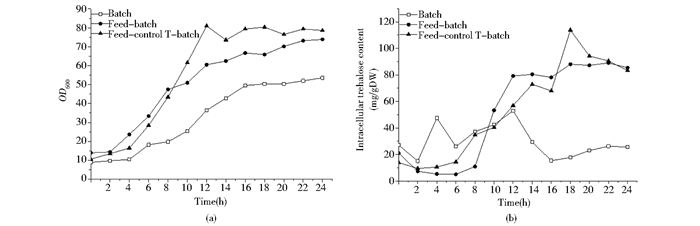
|
| 图 1 不同发酵调控模式下的鲁氏酵母CCTCC M2013310生长(a)和胞内海藻糖积累变化(b) Figure 1 The growth (a) and intracellular trehalose level (b) of Z. rouxii CCTCC M2013310 under different fermentation regulation strategy |
氨基酸参与了细胞众多的生理和代谢过程[26]。依据标准品保留时间,14种氨基酸被发现。然而,并不是所有氨基酸都显示规律性变化,因此,变化规律显著的氨基酸被选择进一步分析,包括涉及逆境响应的脯氨酸、甘氨酸、三羧酸循环中α-酮戊二酸结合点的谷氨酸与谷氨酰胺。需要说明的是,由于谷氨酸和谷氨酰胺的保留时间非常接近,发酵样品中这两种氨基酸无法有效地以单峰形式显示,因此它们被作为一个整体进行分析。图 2展现了鲁氏酵母CCTCC M2013310在三种不同发酵调控模式下(分批发酵模式、分批补料发酵模式和分批补料控温发酵模式)的脯氨酸(图 2a)、甘氨酸(图 2b)和谷氨酸与谷氨酰胺(图 2c)的变化过程。
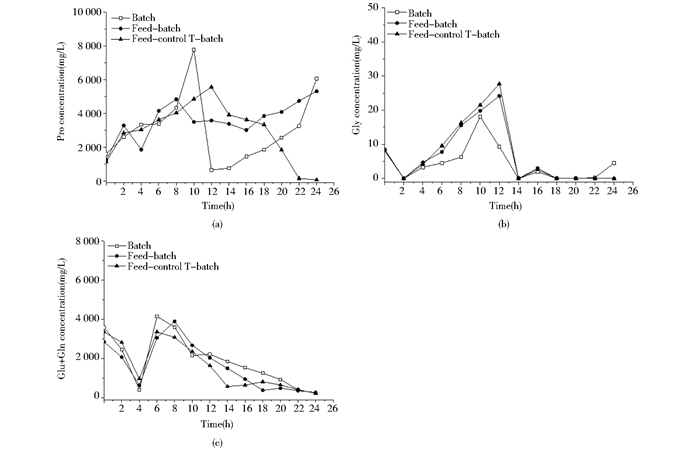
|
| 图 2 鲁氏酵母CCTCC M2013310在不同发酵调控策略下的游离氨基酸变化曲线 Figure 2 The amino acids change curve of Z. rouxii CCTCC M2013310 under different fermentation control strategy (a) Pro (b) Gly (c) Glu/Gln |
在不同的发酵策略下,脯氨酸表现出不同的响应特性。分批发酵策略下,脯氨酸浓度在发酵早期逐步积累,但是其浓度在10~14h急剧下降到500mg/L的水平,并在发酵后期再次逐步积累到6 000mg/L左右。分批补料和分批补料控温发酵模式下,脯氨酸在发酵前10h的变化趋势与分批发酵模式是相似的,在10~14h发酵期间,脯氨酸浓度基本上维持稳定。然而,在发酵后期,这两种发酵模式显示出了差别。分批补料发酵模式中,脯氨酸浓度逐步上升;补料控温发酵模式中,脯氨酸浓度逐渐下降。这些结果表明,碳源的补加和温度的变化对鲁氏酵母CCTCC M2013310脯氨酸的合成和利用存在影响。结合前面胞内海藻糖的数据分析显示,脯氨酸和海藻糖存在一定的相互关系。在鲁氏酵母CCTCC M2013310发酵后期,如果海藻糖水平维持恒定或下降,脯氨酸浓度增加;而海藻糖浓度增加时,脯氨酸浓度反而下降。这暗示鲁氏酵母CCTCC M2013310通过调控脯氨酸和海藻糖代谢共同应对发酵环境的变化和逆境。
在三种发酵模式中,游离甘氨酸、谷氨酸/谷氨酰胺变化的差异不大,都呈现出相同的变化趋势。甘氨酸浓度在发酵早期逐步增加,但在发酵中期被快速消耗,以低浓度维持到发酵结束。谷氨酸和谷氨酰胺在发酵早期经过消耗-积累阶段后,开始以缓慢的速率被逐步利用,直到发酵结束。这些结果表明,不同的发酵调控模式没有对鲁氏酵母CCTCC M2013310甘氨酸、谷氨酸和谷氨酰胺的合成和代谢产生显著影响。然而,需要对谷氨酸和谷氨酰胺给予更多的关注,它们涉及碳氮利用之间的平衡关系。虽然这里的数据无法提供它们之间的比例,但是整个变化趋势依然能提供一些线索。比较发酵后期图谷氨酸/谷氨酰胺的降低速率会发现补料控温分批策略下它们的消耗更快,而这个模式中的海藻糖积累水平是最高的,这暗示碳氮调控对鲁氏酵母CCTCC M2013310胞内海藻糖合成施加了影响。
2.3 有机酸代谢特征分析 2.3.1 丙酮酸溢流途径代谢物分析有机酸是微生物发酵调控和代谢研究中重要的一类代谢物[27]。发酵样品中有8种有机酸,涉及丙酮酸溢流代谢途径(丙酮酸、乳酸、乙酸)和三羧酸循环代谢途径(柠檬酸、α-酮戊二酸、琥珀酸、苹果酸),通过标准品的保留时间被确定。丙酮酸是机体代谢的中间产物,既处于糖酵解(EMP)途径的末端,又是连接EMP途径和三羧酸循环(TCA)的关键产物,它可经多条途径生成乙酸、乳酸、草酰乙酸等[9]。图 3展现了鲁氏酵母CCTCC M2013310在三种不同发酵调控模式下(分批发酵模式、分批补料发酵模式和分批补料控温发酵模式)的丙酮酸溢流代谢途径相关代谢物(图 3a丙酮酸、图 3b乳酸、图 3c乙酸)的变化过程。
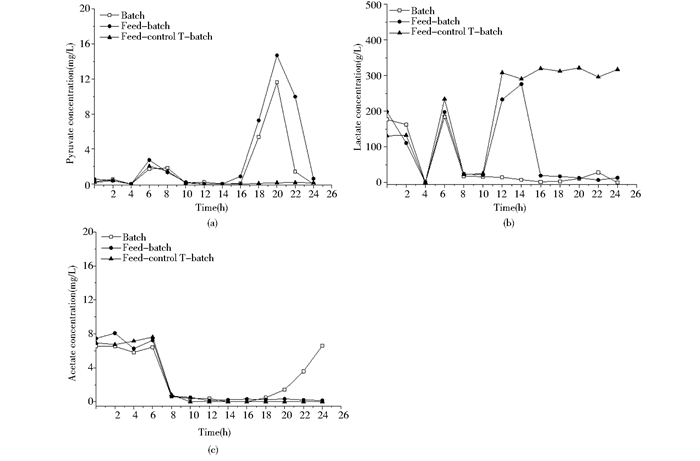
|
| 图 3 鲁氏酵母CCTCC M2013310在不同发酵调控策略下的丙酮酸溢流代谢途径中的代谢物变化曲线 Figure 3 Pyruvic acid metabolites change curve of the overflow metabolic pathways of Z. rouxii CCTCC M2013310under different fermentation control strategy (a) Pyruvic acid (b) Lactic acid (c) Acetic acid |
三种发酵调控模式间的丙酮酸变化差异只发生在发酵后期(16~24h)。分批模式和分批补料模式中胞外丙酮酸呈现积累-消耗过程,而分批补料控温模式下的胞外丙酮酸被完全抑制。对乳酸而言,其浓度在三种调控模式下的发酵前期(0~10h)都经过消耗-积累-再消耗的过程。当施加补料过程后,乳酸浓度大幅上升;再结合控温手段,乳酸浓度维持在300g/L水平。乙酸的变化除了在发酵后期(18~24h)有所不同外,其他发酵阶段的变化是一致的,即分为稳定、消耗、再稳定三个阶段。可见,补料和控温都能引起乳酸浓度的变化。因此,在三种不同发酵调控模式下(分批发酵模式、分批补料发酵模式和分批补料控温发酵模式),乳酸代谢比丙酮酸代谢对海藻糖积累更敏感,而乙酸代谢的敏感程度最低。同时,从浓度水平上可以看到,除酵母细胞典型的溢流产物乙醇外,乳酸也是鲁氏酵母CCTCC M2013310的丙酮酸溢流代谢途径的主要产物。
2.3.2 三羧酸循环代谢物分析在三羧酸循环代谢途径中,α-酮戊二酸和苹果酸被选中进行分析。图 4展现了鲁氏酵母CCTCC M2013310在三种不同发酵调控模式(分批发酵模式、分批补料发酵模式和分批补料控温发酵模式)下的三羧酸循环代谢途径相关代谢物(图 4a中的α-酮戊二酸、图 4b中的苹果酸)的变化过程。除发酵开始的前2h外,α-酮戊二酸浓度在分批发酵模式下的整个发酵周期都检测不到。当单一施加补料控制后,胞外α-酮戊二酸在补料阶段就能检测到,直到发酵18h被消耗完全。当在16~18h增加控温步骤后,α-酮戊二酸改变了减少趋势,其浓度维持在2.0~2.5mg/L水平。三种发酵控制模式下的苹果酸变化过程差异不大,在早期缓慢被消耗,而在10~12h被消耗完全,此后不再有积累。然而,需要注意的是,在补料控温分批发酵模式下,升温引起了胞外苹果酸的积累。由此推测,升温控制对三羧酸循环的影响要大于补料控制,且这种影响似乎是激活效应,引起大量中间代谢产物被积累从而释放到胞外。结合丙酮酸溢流代谢途径的代谢数据分析,乳酸的大量形成是由于活化的三羧酸循环中产生大量NADH,然而由于自然电子受体氧气的不足,导致大量的NADH参与了乳酸脱氢酶反应,使得乳酸大量积累,以维持鲁氏酵母CCTCC M2013310还原力的平衡。

|
| 图 4 鲁氏酵母CCTCC M2013310不同发酵调控模式下的三羧酸循环途径中的代谢物变化曲线 Figure 4 Metabolite changes in TCA of Z. rouxii CCTCC M2013310 under different fermentation control strategy (a) α-Ketoglutaric acid (b) Malate |
微生物通过调控代谢网络来适应生长环境的变化。脯氨酸和海藻糖都是微生物抗逆代谢物[14]。脯氨酸和胞内海藻糖的变化显示,鲁氏酵母CCTCC M2013310通过调节脯氨酸和胞内海藻糖的浓度形成互补联动来维持细胞的抗逆能力。因此,强化酵母胞内海藻糖水平的一个可选手段是抑制脯氨酸的形成来刺激海藻糖的合成。
酵母海藻糖积累的营养诱导因子之一是氮饥饿[2-3]。本研究中通过补加纯糖蜜引起碳氮比降低,而从实现氮营养的不足。然而,这将导致外源性无机铵离子缺乏,进而引起胞内谷氨酸与谷氨酰胺之间的转变能力下降。为避免对代谢过程的影响,鲁氏酵母CCTCC M 2013310利用外源谷氨酸/谷氨酰胺来弥补胞内代谢的不足,表现为胞外氨基酸浓度的下降。此外,氮饥饿还抑制了α-酮戊二酸向谷氨酸转变,是α-酮戊二酸积累的原因之一。
温度也酵母海藻糖积累的环境诱导因子之一[2-3]。温度逆境所引起的代谢调节范围要大于氮饥饿环境。在高温环境下,丙酮酸、α-酮戊二酸和丙酮酸积累,而乳酸维持高浓度水平。可见,升温能有效刺激鲁氏酵母CCTCC M2013310代谢活性。这个活性不仅促进胞内海藻糖的合成,同时也促进了糖酵解途径、丙酮酸溢流途径和三羧酸循环途径的活性,三者之间形成了耦合协调关系。糖酵解为海藻糖提供前体物(UDP-葡萄糖和6-磷酸葡萄糖),也为下游乳酸代谢供应丙酮酸,以消耗活化的三羧酸循环中所产生的大量NADH。
可见,鲁氏酵母CCTCC M2013310胞内海藻糖积累过程中,非海藻糖合成途径的代谢过程为海藻糖积累做出了相应的调整。针对这些响应特征,研究适当的发酵调控策略,将有助于开发更耐保藏的鲁氏酵母活性干酵母。
| [1] |
陈彬, 鲁绯, 王夫杰, 等. 耐盐酵母菌对发酵酱油风味作用及其应用的研究进展. 中国酿造, 2010, 29(6): 1-3. Chen B, Lu F, Wang F J, et al. Effect of salt-tolerant yeast on the flavor of soy sauce and its research progress. China Brewing, 2010, 29(6): 1-3. |
| [2] |
胡梦蝶, 陈雄, 李欣, 等. 不同胁迫条件对鲁氏酵母胞内海藻糖积累的影响研究. 食品工业科技, 2016, 37(11): 130-133. Hu M D, Chen X, Li X, et al. Intracellular trehalose metabolism characteristics of Zygosaccharomyces rouxii under different stresses. Science and Tecnology of Food Industry, 2016, 37(11): 130-133. |
| [3] |
Argüelles J C. Physiological roles of trehalose in bacteria and yeasts:a comparative analysis. Archives of Microbiology, 2000, 174(4): 217-224. DOI:10.1007/s002030000192 |
| [4] |
王碧莹, 孙溪, 肖冬光. 内源与(或)外源海藻糖对面包酵母耐冷冻性的影响研究. 酿酒科技, 2015, 258(12): 4-6, 11. Wang B Y, Sun X, Xiao D G. Effects of endogenous and/or exogenous trehalose on freezing-tolerance of baker's yeast. Brewing Technology, 2015, 258(12): 4-6, 11. |
| [5] |
方华, 李灏. 海藻糖与热激蛋白在酿酒酵母耐受乙醇胁迫中的作用. 中国生物工程杂志, 2014, 34(6): 84-89. Fang H, Li H. The Roles of trehalose and heat shock proteins for enhancing ethanol tolerance of Saccharomyces cerevisiae. China Biotechnology, 2014, 34(6): 84-89. |
| [6] |
谭海刚, 董健, 王光路, 等. 中性海藻糖酶基因缺失对面包酵母耐冷冻性的影响. 现代食品科技, 2014, 30(2): 66-71, 16. Tan H G, Dong J, Wang G L, et al. Effect of neutral trehalase genes deletion on the freeze-tolerant characteristics of bread yeast. Modern Food Science and Technology, 2014, 30(2): 66-71, 16. |
| [7] |
陈丽君, 肖冬光, 郭学武, 等. 面包酵母海藻糖含量与酵母耐性之间的关系. 食品工业科技, 2011, 32(8): 112-114. Chen L J, Xiao D G, Guo X W, et al. Correlation between the trehalose content and the stress resistance of the baker yeasts. Science and Tecnology of Food Industry, 2011, 32(8): 112-114. |
| [8] |
程书梅, 王昌禄, 顾金兰, 等. 海藻糖对耐盐酵母的影响. 中国酿造, 2005, 24(8): 8-11. Cheng S M, Wang C L, Gu J L, Chen MH, et al. Effect of trehalose on salt-tolerant yeast. China Brewing, 2005, 24(8):8-11. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zngz200508002&dbname=CJFD&dbcode=CJFQ |
| [9] |
吴苏生, 白亮, 郑祖亮, 等. 低温锻炼对酿酒酵母发酵特性的影响. 中国酿造, 2015, 34(5): 56-59. Wu S S, Bai L, Zhen Z L, Zhang Z L, et al. Effects of low-temperature adaptation on fermentation characteristics of Saccharomyces cerevisia. China Brewing, 2015, 34(5):56-59. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zngz201505025&dbname=CJFD&dbcode=CJFQ |
| [10] |
Wang P M, Zheng D Q, Chi X Q, et al. Relationship of trehalose accumulation with ethanol fermentation in industrial Saccharomyces cerevisiae yeast strains. Bioresource Technology, 2014, 152: 371-376. DOI:10.1016/j.biortech.2013.11.033 |
| [11] |
Sasano Y, Haitani K, Hashida K, et al. Simultaneous accumulation of proline and trehalose in industrial baker's yeast enhances fermentation ability in frozen dough. Journal of Bioscience and Bioengineering, 2012, 113(5): 592-595. DOI:10.1016/j.jbiosc.2011.12.018 |
| [12] |
Li H, Wang H L, Du J, et al. Trehalose protects wine yeast against oxidation under thermal stress. World Journal of Microbiology and Biotechnology, 2010, 26(6): 969-976. DOI:10.1007/s11274-009-0258-1 |
| [13] |
Yoshiyama Y, Tanaka K, Yoshiyama K, et al. Trehalose accumulation enhances tolerance of Saccharomyces cerevisiae to acetic acid. Journal of Bioscience and Bioengineering, 2015, 119(2): 172-175. DOI:10.1016/j.jbiosc.2014.06.021 |
| [14] |
Tapia H, Young L, Fox D, et al. Increasing intracellular trehalose is sufficient to confer desiccation tolerance to Saccharomyces cerevisiae. Proceedings of the National Academy of Science of the United States of America, 2015, 112(19): 6122-6127. DOI:10.1073/pnas.1506415112 |
| [15] |
Glatz A, Pilbat A M, Németh G L, et al. Involvement of small heat shock proteins, trehalose, and lipids in the thermal stress management in Schizosaccharomyces pombe. Cell Stress and Chaperones, 2016, 21(2): 327-338. DOI:10.1007/s12192-015-0662-4 |
| [16] |
Tan H G, Dong J, Wang G L, et al. Enhanced freeze tolerance of baker's yeast by overexpressed trehalose-6-phosphate synthase gene (TPS1) and deleted trehalase genes in frozen dough. J Ind Microbiol Biotechnol, 2014, 41(8): 1275-1285. DOI:10.1007/s10295-014-1467-7 |
| [17] |
Pérez-Torrado R, Matallana E. Enhanced fermentative capacity of yeasts engineered in storage carbohydrate metabolism. Biotechnology Progress, 2015, 31(1): 20-24. DOI:10.1002/btpr.v31.1 |
| [18] |
Dong J, Chen D D, Wang G L, et al. Improving freeze-tolerance of baker's yeast through seamless gene deletion of NTH1 and PUT1. J Ind Microbiol Biotechnol, 2016, 43(6): 817-828. DOI:10.1007/s10295-016-1753-7 |
| [19] |
周利, 汤岳琴, 孙照勇, 等. 基于连续发酵驯化的高耐盐性酿酒酵母的育种. 应用与环境生物学报, 2014, 20(3): 363-370. Zhou L, Tang Y Q, Sun Z Y, et al. Breeding of high salt-tolerant Saccharomyces cerevisiae strains based oncontinuous ethanol fermentation. Chin J Appl Environ Biol, 2014, 20(3): 363-370. |
| [20] |
Qiao C Q, Jia S R, Dai Y J, et al. Trehalose biosynthesis enhancement for six yeast strains under pressurized culture. Applied Biochemistry and Biotechnology, 2010, 160(2): 613-620. DOI:10.1007/s12010-008-8455-1 |
| [21] |
赵玉巧, 仲美荣, 顾玲玲, 等. 海洋中海藻糖产生菌的筛选及发酵条件优化. 微生物学杂志, 2010, 30(3): 50-54. Zhao Y Q, Zhong M R, Gu L L, et al. Screening and fermentation optim ization of trehalose-producing strain from marine. Jouranl of Microbiology, 2010, 30(3): 50-54. |
| [22] |
Chi Z, Wang J M, Chi Z M, et al. Trehalose accumulation from corn starch by Saccharomycopsis fibuligera A11 during 2-l fermentation and trehalose purification. Journal of Industrial Microbiology and Biotechnology, 2010, 37(1): 19-25. DOI:10.1007/s10295-009-0644-6 |
| [23] |
朴春红, 刘仁杰, 王丹, 等. 酵母体内海藻糖定量方法研究. 食品科技, 2010, 35(6): 284-286. Piao C H, Liu R J, Wang D, et al. Study of trehalose quantitative analysis of yeast extract. Food Science and Technology, 2010, 35(6): 284-286. |
| [24] |
谭海刚, 梅英杰, 关凤梅, 等. 蒽酮-硫酸法测定酵母中海藻糖的含量. 现代食品科技, 2006, 22(1): 125-126, 128. Tan H G, Mei Y J, Guan F M, et al. Determination of trehalose content by anthrone-sulphuric acid colorimetric method. Modern Food Science and Technology, 2006, 22(1): 125-126, 128. |
| [25] |
Tao X M, Liu Y M, Wang Y H, et al. GC-MS with ethyl chloroformate derivatization for comprehensive analysis of metabolites in serum and its application to human uremia. Analytical and Bioanalytical Chemistry, 2008, 391(8): 2881-2889. DOI:10.1007/s00216-008-2220-8 |
| [26] |
Gu P F, Su T Y, Qi Q S. Novel technologies provide more engineering strategies for amino acid-producing microorganisms. Applied Microbiology and Biotechnology, 2016, 100(5): 2097-2105. DOI:10.1007/s00253-015-7276-8 |
| [27] |
Chen Y, Jens N. Biobased organic acids production by metabolically engineered microorganisms. Current Opinion in Biotechnology, 2016, 37: 165-172. DOI:10.1016/j.copbio.2015.11.004 |
 2017, Vol. 37
2017, Vol. 37




