文章信息
- 冯源, 唐云, 徐蕾, 谭海刚.
- FENG Yuan, TANG Yun, XU Lei, TAN Hai-gang.
- 海藻多糖通过下调肝癌细胞Hep3B糖酵解途径抑制细胞增殖和迁移
- Algal Polysaccharides Inhibits Proliferation and Migration of Liver Cancer Cell Hep3B Via Down-regulation of EMP Pathway
- 中国生物工程杂志, 2017, 37(9): 31-40
- China Biotechnology, 2017, 37(9): 31-40
- http://dx.doi.org/DOI:10.13523/j.cb.20170905
-
文章历史
- 收稿日期: 2017-04-06
- 修回日期: 2017-05-03
2. 天津科技大学食品与营养安全教育部实验室 天津 300222;
3. 上海交通大学生命科学技术学院 上海 200240;
4. 青岛农业大学食品科学与工程学院 青岛 266109
2. Key Laboratory of Food and Nutrition Safety of Ministry of Education, College of Food Science and Biotechnology, Tanjin University of Science and Technology, Tianjin 300222, China;
3. College of Life Science and Technology, Shanghai Jiao Tong University, Shanghai 200240, China;
4. College of Food Science and Engineering, Qingdao Agricultural Unviersity, Qingdao 266109, China
海藻多糖(AP)是从海藻中提取的一种高分子碳水化合物,具有丰富的生物活性。它的结构是由多个单糖基通过糖苷键相连而成的,糖基可相同或者不同[1]。AP是多糖的一种,其极端的生存环境让它成为治疗癌症的优化选择。目前普遍认为,AP抗肿瘤的机制有:使肿瘤细胞膜特性改变、诱导肿瘤细胞凋亡,通过提高抑癌基因p53表达改变细胞形态;从而使细胞间通信恢复,加强抵御细胞抗自由基的能力[2]。但糖酵解(EMP)途径是否参与调节肿瘤细胞活动尚不明确。因此,本文以肝癌细胞为主要研究对象,探讨海藻多糖对其增殖和迁移的影响及其与EMP途径的关系。为AP抗肿瘤机制的进一步研究提供新的思路。
肿瘤细胞与大多数正常组织的细胞不同,其主要通过EMP获取能量,甚至在供氧充足时形成对“有氧糖酵解”的依赖,即“Warburg效应”[3]。EMP的三个限速酶分别已糖激酶(HK),6-磷酸果糖激酶-1(PFK-10)、丙酮酸激酶(PK),糖酵解终产物是乳酸。而正常组织获取能量的方式是糖的有氧氧化,仅在缺氧情况下进行EMP[4]。目前已发现在胰腺癌、肺癌、食管癌、宫颈癌和前列腺组织癌等癌症[5]中,EMP代谢水平高于正常组织,肿瘤同时也是一种代谢疾病的观点得到广泛认同[6]。
肝癌(hepatocellular carcinoma,HCC)是全世界最常见的恶性肿瘤之一,在肿瘤相关死亡中排第3,其中全世界55%的患者来自中国[7]。随着科技进步,免疫疗法、基因疗法和分子靶向治疗等生物治疗已成为继传统治疗肿瘤的新型疗法[8]。治疗恶性肿瘤最大的障碍来源于其侵袭和迁移的能力,肝癌细胞治疗临床肿瘤患者(90%)死亡的原因源于此[9]。目前临床缺乏有效抗肝癌增殖和迁移的药物,研制抗增殖迁移药物已成为肿瘤化疗亟待解决的问题。
1 材料与方法 1.1 材料 1.1.1 细胞HL02人正常肝细胞株、Hep3B人肝癌细胞株、HeLa宫颈癌细胞株、SW620结肠癌细胞株均购自美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.1.2 主要试剂1640培养基,胎牛血清(fetal bovine serum,FBS)均购自Gibco公司;AP由天津科技大学赠予;HK、PK酶活测定试剂和3-BrPA均购自Sigma公司;MTT和DMSO均购自Sigma公司;反转录试剂盒、BCA试剂盒、TRIzol试剂和IP细胞裂解液购自凯基生物:抗GAPDH抗体、抗HK-Ⅱ抗体、抗p-AKT抗体、抗Akt抗体均购自CST公司;乳酸化学法分析试剂盒购自Pierce公司;实时荧光定量PCR Mix购自Toyobo公司;蛋白质转膜设备和紫外分光光度计均购自Bio-Rad公司。其他试剂均为国产分析纯。
1.2 方法 1.2.1 细胞培养HL02、Hep3B、HeLa、SW480均为贴壁生长,复苏后将细胞平铺在细胞培养瓶中,培养基为含10% FBS的RPMI 1640完全培养基,轻轻铺平后放入培养箱,使细胞贴壁生长,培养箱参数为37℃恒温,5%二氧化碳饱和。传代频率3天一次,选用生长状态佳的细胞进行实验。
1.2.2 实验分组按上述方法培养细胞后。取第3~8代细胞进行实验。当细胞密度达80%~90%时,将RPMI 1640完全培养基更换为RPMI 1640无血清培养继续培养24h,使细胞同步化后再进行AP或3-BrPA干预实验。实验分为6组,分别为对照组(不做任何干预)和不同终浓度AP浓度剂量组[加入不同AP浓度(10mg/ml、20mg/ml、50mg/ml、100mg/ml、200mg/ml)]培养24h、48h、72h后,进行下一步实验。
1.2.3 总蛋白质量测定裂解液裂解细胞后,低温4℃,12 000r/min离心30min,取上清液中的总蛋白质绘制标准曲线。将细胞裂解后的上清液依次稀释,使其蛋白质浓度在标准曲线可信区间。
1.2.4 MTT测定细胞生长抑制率和细胞活性取对数生长期细胞接种于96孔板,每孔4 000细胞数。12h后,细胞贴壁生长,加入新鲜完全培养基和不同浓度的AP,分为5个处理组(终浓度为10mg/ml、20mg/ml、50mg/ml、100mg/ml和200mg/ml)。另有不给AP作为对照组,无细胞作为空白组。作用48h后,用MTT法在自动酶标仪上测定490nm吸光度。细胞生长抑制率(%)定义为:(对照组OD值-处理组OD值)/(对照组OD值-空白组OD值)×100%;细胞活力(%)定义为:(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)。
1.2.5 Western blot测定细胞总蛋白质浓度后,根据实验设计使用Loading Buffer制样加样。100V电泳1.5h后停止。100V、200mA电转膜1~2h,将膜放入含5%脱脂奶粉的TBST中孵育1h后加一抗,与摇床上4℃孵育过夜。TBST洗涤3次,每次10min。加二抗,于摇床上室温孵育2h,TBST洗涤3次,每次10min。用显影液显影,应用凝胶成像系统拍摄,对所得图像进行灰度值分析,以GAPDH为内参照。用Image J软件定量分析。
1.2.6 酶活性测定HK、PK活性测定用酶耦连比色法,具体操作遵循试剂盒说明书。加入酶提取液启动反应,酶活测定在25℃恒温下进行,在1cm宽的石英比色皿中用分光光度计于340nm下隔5s读取吸光值(B),共读取3min。以B对时间作图,取反应最初线性部分斜率计算酶活。
1.2.7 乳酸含量测定乳酸测定用化学比色法,具体操作遵循试剂盒说明书。
1.2.8 Transwell法检测细胞侵袭能力用胰酶消化对数期细胞后,制成为1×109/L细胞悬液。将100μl细胞悬液加入Transwell小室上层中,下室加入400μl完全培养基,每组设置三个平行复孔。于培养箱中培养48h后取出Transwell小室,用棉签轻轻擦去上室未穿透的细胞,冰预冷PBS缓冲液轻洗3次,4%多聚甲醛室温固定10min,0.1%结晶紫染色30min,在显微镜下随机选取5个视野计数穿膜细胞数目,取平均值,放大倍数为100倍。
1.2.9 实时荧光定量PCR细胞的总RNA使用Trizol提取后测浓度,取其中1μg反转录成cDNA,以其为模板进行qPCR,将肝癌Hep3B加入不同浓度AP后,对细胞内EMT信号通路中Marker mRNA表达水平进行检测。PCR反应条件为:94℃预变性3min; 94℃变性40s;55℃退火40s;72℃延伸40s;40个循环; 最后, 65℃ 5s, 每次升高0.5℃, 直至95℃。BioRad软件进行分析。
1.2.10 划痕修复实验对数期细胞在12孔板中培养,第二天用10μl枪头沿直线在孔低划线,PBS清洗两次,加入含相应浓度AP、3-BrPA和2.5%FBS的新鲜培养基培养,在倒置显微镜下拍照(×100),在划痕边缘等距离取距离培养,培养24h后,再拍照在同样的位置取距离。划痕修复率(%)=(0h划痕宽度-24h划痕宽度)/0h划痕宽度×100%。
1.2.11 统计学方法实验均独立重复三次,实验数据用均数±标准差表示;利用SPSS17.0和GraphPad Prism5软件进行统计学分析;多组间均数比采用T test,P<0.05表示差异具有统计学意义。
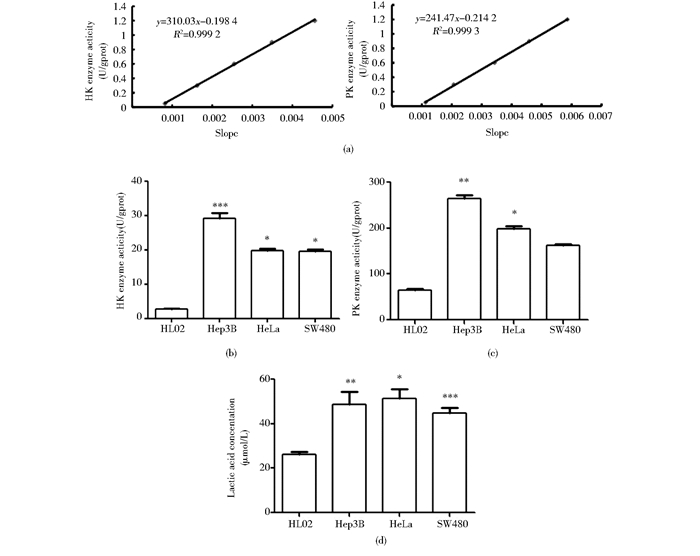
2 结果 2.1 癌细胞EMP表达水平高于正常细胞选用正常人肝细胞HL02、肝癌细胞Hep3B、宫颈癌细胞HeLa和结肠癌细胞SW480进行实验。用分光光度计测定细胞内HK和PK活性,标准曲线如图 1(a)所示。HK和PK分别是EMP途径的第一和第三个限速酶,测定酶活性分别如图 1(b)、(c)所示。癌细胞HK和PK活性均高于正常细胞HL02,差异具有统计学意义(P<0.05)。乳酸是EMP途径产物,在癌细胞中含量均高于HL02(P<0.05),见图 1(d)。肝癌细胞Hep3B差异最显著,故将其选为后续实验细胞株。
|
| 图 1 四株细胞内源性HK活性、PK活性和乳酸含量测定比较 Figure 1 The endogenous enzyme activity of HK, PK and concentration of lactic acid in four different cell lines (a) The standard curve of HK and PK enzyme activity (b) The HK enzyme activity measured by UV spectrophotometer (c) The PK enzyme activity measured by UV spectrophotometer (d) The Lactic concentration measured by assay kit Mean±SD. n=3. *P < 0.05 vs HL02;**P < 0.01 vs HL02;***P < 0.001 vs HL02 |
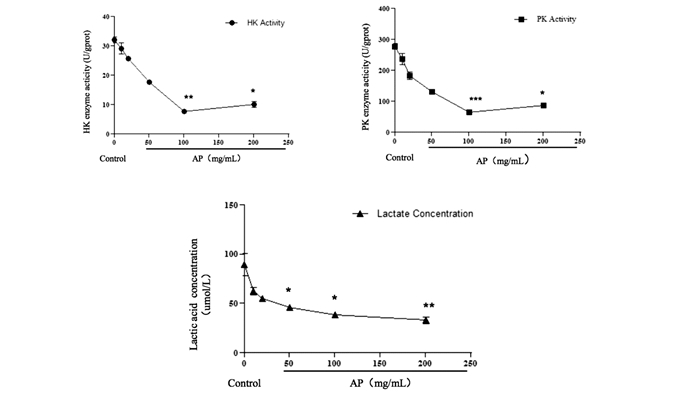
AP不同浓度处理Hep3B细胞48h后收集细胞,测定HK酶活力、PK酶活力和乳酸含量。结果表明,AP浓度为10~100mg/ml时,HK和PK酶活力随着AP浓度升高而降低。在AP浓度为100mg/ml时,HK和PK酶活力与对照组相比,分别降低了(74±3.9)%和(76±8.9)%,差异具有统计学意义(P<0.01,P<0.001),结果见图 2(a)、(b)。AP浓度为10~200mg/ml时,细胞内乳酸含量随着AP浓度升高而降低。在AP浓度为200mg/ml时,乳酸浓度为(36±4.2)μmol/L,比对照组降低了(60±5.8)%,差异具有统计学意义(P<0.01)。
|
| 图 2 海藻多糖对Hep3B细胞内源HK酶活力、PK酶活力和乳酸含量的影响 Figure 2 The effect of different concentration of algal polysaccharides(AP) on HK enzyme activity, PK enzyme activity and lactic acid concentration in Hep3B cell (a)The protein level of HK and PK in the Hep3B cell treated with AP (b) The viability of the Hep3B cell treated with AP (c) The immigration of the Hep3B cell treated with AP Mean±SD. n=3. *P < 0.05 vs Control; **P < 0.01 vs Control; ***P < 0.001 vs Control |
不同浓度AP(10~200mg/ml)分别处理Hep3B细胞24h、48h和72h后,细胞生长均得到抑制。处理48h,效果最显著。以48h为例,随着海藻糖的浓度增加(10mg/ml、20mg/ml、50mg/ml、100mg/ml、200mg/ml),肝癌细胞增长抑制率显著升高, 分别为(3.8±1.1)%、(15±2.1)%、(30±3.3)%、(56±3.9)%、(55±2.8)%,结果见图 3(a)。Transwell小室实验结果显示,不同浓度AP(10~200mg/ml)处理HepB3细胞48h后,细胞迁移数均能得到抑制,与AP浓度呈现依赖相关性(P<0.05)。AP浓度为200mg/ml时,Hep3B细胞迁移数为对照组的32±2.9%(P<0.01),见图 3(c)。利用qPCR进一步研究与细胞迁移密切相关的EMT途径标志蛋白:间充质标志物N-cadherin、上皮细胞标志物Occludin。N-cadherin随着AP浓度的升高mRNA表达水平降低(P<0.05),Occludin则相反(P<0.05),说明AP能抑制EMT发生,见图 3(b)。

|
| 图 3 不同浓度AP对肝癌细胞Hep3B迁移、增殖及EMT的影响 Figure 3 The effect of different concentration algal polysaccharides(AP) on migaration, proliferation of Hep3B cell and EMT pathway (a) The Hep3B growth inhibition rate tested by MTT assay (b) The relative gene mRNA expression of N-cadherin and Occludin after algal polysaccharides(AP) treatment tested using qPCR in Hep3B (c)The immigration of the Hep3B cell treated with different concentration algal polysaccharides(AP) according to Transwell **P < 0.01 vs control; #P < 0.05 vs occludin control; ##P < 0.01 vs occludin control |
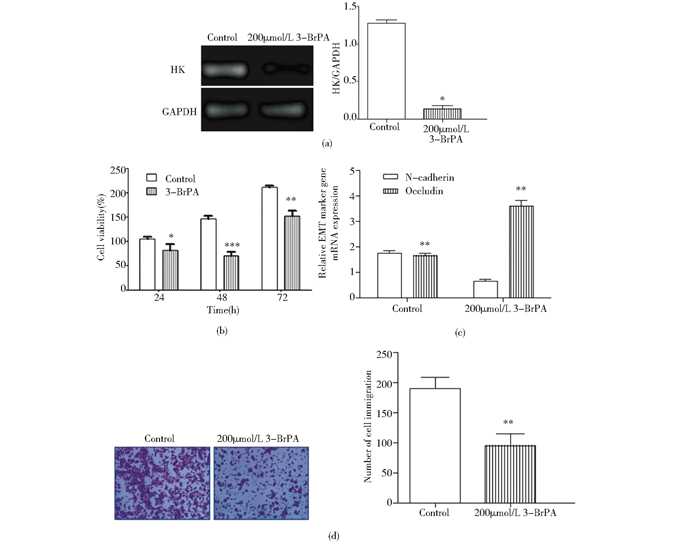
3-溴丙酮酸是(3-BrPA)是二型已糖激酶(HK-Ⅱ)抑制剂,基于可抑制EMP代谢水平,目前已作为一种新型抗肿瘤药物进入临床试验阶段[10]。Western blot结果显示,与对照组相比,3-BrPA(200μmol/L)处理组的HK表达明显下降(P<0.05) 证明3-BrPA有效抑制HK表达,见图 4(a)。MTT实验结果显示,3-BrPA(200μmol/L)处理组分别加药处理Hep3B细胞24h、48h和72h后,Hep3B细胞活性与对照组相比分别下降了(19±4.7)%,(52±5.8)%和(31±5.9)%。差异有统计学意义(P<0.05、P<0.001、P<0.01)。表明降低HK活性能抑制Hep3B细胞活力,见图 4(b)。Transwell小室迁移实验表明,与对照组相比,3-BrPA (200μmol/μl)处理组细胞迁移数下降了(48±6.1)%,差异具有统计学意义(P<0.01),表明3-BrPA有效下调HK活性并且能抑制Hep3B细胞迁移能力,见图 4(d)。利用qPCR进一步研究与细胞迁移相关的EMT途径标志蛋白:间充质标志物N-cadherin和上皮细胞标志物Occludin。3-BrPA处理组与对照组相比,N-cadherin mRNA表达水平下降(P<0.01),Occludin则相反(P<0.01),见图 4(c)。
|
| 图 4 HK抑制剂3-BrPA对Hep3B细胞活力、迁移作用和EMT的影响 Figure 4 The effect on viability, migration and EMT of the Hep3B cell treated with HK inhibitor 3-BrPA (a)The protein level of HK in the Hep3B cell treated with 3-BrPA (b) The viability of the Hep3B cell treated with 3-BrPA (c) The relative gene mRNA expression of EMT marker including N-cadherin and Occludin after 3-BrPA treatment tested using qPCR in Hep3B (d) The immigration of the Hep3B cell treated with 3-BrPA Mean±SD. n=3. * P < 0.05 vs Control; **P < 0.01 vs Control; ***P < 0.001 vs Control |
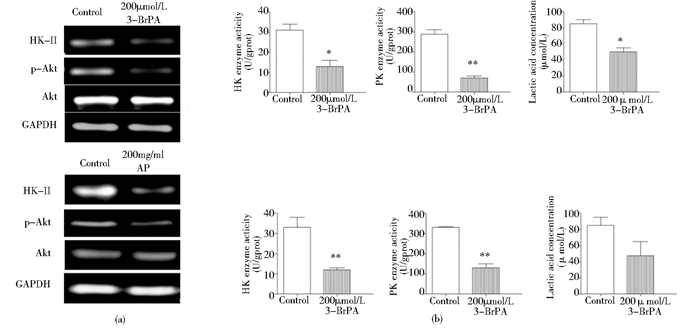
Western blot结果显示,AP或3-BrPA分别处理Hep3B后,肝癌细胞EMP限速酶HK和PK的活性、产物乳酸量均下降,Hep3B的EMP水平得到抑制,见图 5(b)。HK-Ⅱ蛋白和p-Akt表达水平较对照组均下降,且Akt蛋白水平没有发生变化,Akt信号通路受到抑制,见图 5(a)。证明AP与3-BrPA药物类似,都能下调EMP代谢水平,且抑制Akt信号通路。
|
| 图 5 AP与3-BrPA分别处理细胞时,对EMP代谢水平及Akt通路的影响 Figure 5 The effect of on the EMP pathway and akt signaling pathway in Hep3B cell with algal polysaccharides(AP) or 3-BrPA treatment (a) The protein level of HK-Ⅱ、p-Akt, Akt and GAPDH in the Hep3B cell treated with AP or 3-BrPA (b) The EMP metabolic levels of the Hep3B cell treated with AP or 3-BrPA Mean±SD. n=3. *P < 0.05 vs Control; **P < 0.01 vs Control |
Western Blot结果显示,AP与3-BrPA联合处理Hep3B后。HK蛋白表达水平较AP单用组要低,当3-BrPA浓度为200μmol/L、AP浓度为200mg/ml时,HK表达水平最低(P<0.01),且显著抑制p-Akt表达,见图 6(a)。AP与3-BrPA联合处理后,Hep3B细胞的活性和迁移能力均较AP单用组下降(P<0.01),见图 6(b)、(c)。

|
| 图 6 AP与3-BrPA联合应用对Hep3B细胞活力、迁移及Akt信号通路的影响 Figure 6 The effect of algal polysaccharides(AP) and 3-BrPA co-treatment on the cell viability, cell migration and Akt signaling pathway in Hep3B cell (a) The protein level of HK-Ⅱ、Akt、p-Akt and GAPDH in the Hep3B cell treated with AP and 3-BrPA (b) The viability of the Hep3B cell treated with AP and 3-BrPA (c) The immigration of the Hep3B cell treated with AP and 3-BrPA Mean±SD. n=3. *P < 0.05 vs Control; **P < 0.01 vs Control; ***P < 0.001 vs Control |
肿瘤细胞作为一种代谢异常疾病,在缺氧环境中能利用EMP产生能量,能量代谢中50%~70%依赖的是EMP。EMP途径的三个重要限速酶分别是HK、磷酸果糖激酶(PFK)、PK。基于此,抑制EMP代谢水平也是临床药物开发的靶点[11]。例如,葡萄糖转运体(Glut1) 抑制剂:Phloretin、Quercetin、STF31和WZB117等,靶向为HK-Ⅱ的3-BrPA、2-DG和Lonidamine等,靶向为PFK2的3PO等,靶向为为PK的TT-232等[12]。本文实验结果表明,不同来源癌细胞EMP代谢水平均高于正常细胞HK,尤其以肝癌细胞Hep3B最为显著,AP抑制EMP代谢水平。因此,AP能调节EMP代谢水平抑制Hep3B迁移和增殖。
目前了解的AP的功能有:增加机体免疫力、抗病毒、抗肿瘤、抗氧化、抗辐射等。它的抗肿瘤作用机制,主要认为与加强细胞免疫能力有关。它既可以激活T细胞、B细胞、NK细胞、CTL细胞、LAK细胞等免疫细胞的活性[13],也可以促进IL-1、TNF、C3等效应因子的生成,还能调节血象,抑制红细胞膜上Na+,K+,-ATPase活性,发挥强大的免疫网络功能,提高机体的整体抗肿瘤能力[14]。在本课题前期实验的结果表明,AP可双向调节面包酵母菌株(Saccharomyces cerevisiae BY-6) 的单倍体菌株9α的EMP代谢水平。所以我们提出设想:AP与EMP代谢水平在肿瘤细胞中是否存在调节关系,进而调节癌症细胞活动?本文实验结果首次证明,AP能抑制肝癌Hep3B细胞EMP代谢水平,存在浓度依赖性。Hep3B细胞活性和迁移率,随着AP浓度的上升而下降,也存在浓度依赖性。暗示新的AP抗肿瘤机制可能通过调节EMP代谢水平完成。基于AP对肝癌细胞迁移能力影响显著,我们检测了与细胞迁移密切相关的EMT标志物,EMT是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。并发现,随着AP浓度提升,上皮标志物Occludin mRNA表达水平上升,间质标志物N-Cadherin mRNA表达水平下降。提示AP可抑制肝癌细胞EMP代谢水平,低EMP代谢水平通过抑制EMT发生,从而下调Hep3B的迁移能力。我们本次实验采用AP混合物,下一步将具体鉴定是哪一种AP发挥功效。
在上一步实验中,我们证实AP对EMP代谢水平起抑制作用,且对癌细胞活性和迁移能力产生一定抑制效果。为了进一步研究EMP代谢水平下降是否可以直接抑制癌细胞的细胞活性和迁移能力。我们采用了已知能调节癌症EMP水平的药物3-BrPA。HK-Ⅱ抑制剂3-BrPA抑制EMP第一个限速酶的表达,3-BrPA可以直接烷基化HK-Ⅱ中的硫基使HK-Ⅱ失活,从而下调EMP代谢水平[15]。目前3-BrPA作为抗癌药物已进入二期临床试验阶段。将3-BrPA作用于肝癌Hep3B细胞时,EMP代谢水平降低,且伴随着肝癌细胞Hep3B细胞活性和迁移下降。因此提示,当癌症细胞中EMP水平发生变化时,会影响肿瘤发生的活动,如迁移和增殖。我们同时检测了与细胞迁移密切相关的EMT标志物,并发现,3-BrPA处理组上皮标志物Occludin mRNA表达水平上升而间质标志物N-Cadherin mRNA表达水平下降。提示3-BrPA通过下调HK活性抑制EMP代谢水平,EMP代谢水平的降低抑制EMT发生,从而导致Hep3B迁移能力下降。这与AP抑制Hep3B迁移和增殖的可能机制类似。虽然肿瘤细胞需通过EMP获取能量,对EMP具有高度依赖性,但是只抑制EMP往往不能有效杀死肿瘤细胞,将机制不同的多种ATP耗竭联合是提高疗效的方式之一[16]。本文实验将AP和3-BrPA联用后,抑制细胞活性百分比和抑制细胞迁移率显著高于单用AP组。
PI3K/Akt是细胞内重要的生存信号通路,关键分子是Akt。研究表明,激活后的Akt在高EMP的癌细胞中起到很强的抗凋亡作用[17]。Akt的持续性稳定表达能诱导EMT发生,使癌细胞的迁移能力增强[18]。因此,我们提出设想,PI3K/Akt信号是否参与AP和3-BrPA介导下调EMP代谢水平,从而抑制肝癌细胞迁移。Western blot显示,AP单独处理组和3-BrPA单独处理组,肝癌细胞EMP代谢水平下降,且伴随着Akt的磷酸化水平下降,总Akt水平保持不变。在AP+3-BrPA处理组中,Akt的磷酸化水平显著下降。证明AP和3-BrPA介导下调Hep3B的EMP代谢水平,而低EMP代谢水平抑制Hep3B迁移和增殖能力的机制可能与抑制PI3K/Akt信号通路有关。
总之,癌细胞中,EMP代谢水平高于正常细胞。AP能下调肝癌细胞Hep3B的EMP代谢水平,低EMP代谢水平可抑制细胞的增殖、细胞活力和迁移活动。而EMP低水平代谢抑制肝癌细胞活动的机制,可能与抑制EMT发生和PI3K/Akt信号通路相关。EMT和PI3K/Akt信号通路对EMP低代谢水平时抑制癌细胞迁移能力和增殖能力,存在生物叠加效应还是触发其他信号通路还需进一步验证。本文为阐述AP新的抗肿瘤机制累计实验数据,也为治疗肝癌提供了潜在的治疗方法和药物。
| [1] |
Wijesekara I, Pangestuti R, Kim S K. Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae. Carbohydrate Polymers, 2011, 84(1): 14-21. DOI:10.1016/j.carbpol.2010.10.062 |
| [2] |
Lee J C, Hou M F, Huang H W, et al. Marine algal natural products with anti-oxidative, anti-inflammatory, and anti-cancer properties. Cancer Cell International, 2013, 13(1): 55. DOI:10.1186/1475-2867-13-55 |
| [3] |
Kim J, Dang C V. Cancer's molecular sweet tooth and the Warburg effect. Cancer Research, 2006, 66(18): 8927-8930. DOI:10.1158/0008-5472.CAN-06-1501 |
| [4] |
Porporato P E, Dhup S, Dadhich R K, et al. Anticancer targets in the glycolytic metabolism of tumors:a comprehensive review. Frontiers in Pharmacology, 2011, 7(2): 2. |
| [5] |
Altenberg B, Greulich K O. Genes of glycolysis are ubiquitously overexpressed in 24 cancer classes. Genomics, 2004, 84(6): 1014-1020. DOI:10.1016/j.ygeno.2004.08.010 |
| [6] |
Gatenby R A, Gillies R J. Glycolysis in cancer:a potential target for therapy. The International Journal of Biochemistry & Cell Biology, 2007, 39(7): 1358-1366. |
| [7] |
Heimbach J, Kulik L M, Finn R, et al. Aasld guidelines for the treatment of hepatocellular carcinoma. Hepatology, 2017, 209(78): 124-128. |
| [8] |
Bruix J, Reig M, Sherman M. Evidence-based diagnosis, staging, and treatment of patients with hepatocellular carcinoma. Gastroenterology, 2016, 150(4): 835-853. DOI:10.1053/j.gastro.2015.12.041 |
| [9] |
Noy R, Pollard J W. Tumor-associated macrophages:from mechanisms to therapy. Immunity, 2014, 41(1): 49-61. DOI:10.1016/j.immuni.2014.06.010 |
| [10] |
Nilsson H, Lindgren D, Forsberg A M, et al. Primary clear cell renal carcinoma cells display minimal mitochondrial respiratory capacity resulting in pronounced sensitivity to glycolytic inhibition by 3-Bromopyruvate. Cell Death & Disease, 2015, 6(1): e1585. |
| [11] |
Xintaropoulou C, Ward C, Wise A, et al. A comparative analysis of inhibitors of the glycolysis pathway in breast and ovarian cancer cell line models. Oncotarget, 2015, 6(28): 25677. DOI:10.18632/oncotarget.v6i28 |
| [12] |
Ganapathy-Kanniappan S, Geschwind J F H. Tumor glycolysis as a target for cancer therapy:progress and prospects. Molecular Cancer, 2013, 12(1): 152. DOI:10.1186/1476-4598-12-152 |
| [13] |
Costa L S, Fidelis G P, Cordeiro S L, et al. Biological activities of sulfated polysaccharides from tropical seaweeds. Biomedicine & Pharmacotherapy, 2010, 64(1): 21-28. |
| [14] |
Zong A, Cao H, Wang F. Anticancer polysaccharides from natural resources:A review of recent research. Carbohydrate Polymers, 2012, 90(4): 1395-1410. DOI:10.1016/j.carbpol.2012.07.026 |
| [15] |
Shoshan M C. 3-Bromopyruvate:targets and outcomes. Journal of Bioenergetics and Biomembranes, 2012, 44(1): 7-15. DOI:10.1007/s10863-012-9419-2 |
| [16] |
Zheng J. Energy metabolism of cancer:Glycolysis versus oxidative phosphorylation (review). Oncology Letters, 2012, 4(6): 1151-1157. |
| [17] |
Liu Z, Zhang Y Y, Zhang Q W, et al. 3-Bromopyruvate induces apoptosis in breast cancer cells by downregulating Mcl-1 through the PI3K/Akt signaling pathway. Anti-cancer Drugs, 2014, 25(4): 447-455. DOI:10.1097/CAD.0000000000000081 |
| [18] |
Ha G H, Park J S, Breuer E K Y. TACC3 promotes epithelial-mesenchymal transition (EMT) through the activation of PI3K/Akt and ERK signaling pathways. Cancer Letters, 2013, 332(1): 63-73. DOI:10.1016/j.canlet.2013.01.013 |
 2017, Vol. 37
2017, Vol. 37




