文章信息
- 王云龙, 赵二霞, 李玉林.
- WANG Yun-long, ZHAO Er-xia, LI Yu-lin.
- Thymidine Kinase 1(TK1) 重组蛋白的表达、纯化及鉴定
- Expression, Purification and Identification of Thymidine Kinase 1 Recombinant Protein
- 中国生物工程杂志, 2017, 37(9): 15-22
- China Biotechnology, 2017, 37(9): 15-22
- http://dx.doi.org/DOI:10.13523/j.cb.20170903
-
文章历史
- 收稿日期: 2017-02-23
- 修回日期: 2017-06-17
2. 河南省生物工程技术研究中心 郑州 450001;
3. 郑州市生物制药重点实验室 郑州 450001
2. Henan Biotechnology Research Center, Zhengzhou 450001, China;
3. Zhengzhou Biopharmaceutical Key Laboratory, Zhengzhou 450001, China
胸苷激酶1[1](thymidine kinase 1,TK1) 在镁离子(Mg2+)和ATP参与的条件下可磷酸化脱氧胸苷为脱氧胸苷一磷酸, 是DNA补救合成途径的关键酶。TK1存在于细胞质中,呈细胞周期依赖性[2-4]。正常成人细胞中TK1含量极低(<2pmol/L),只有细胞过度增殖的情况下TK1浓度才会升高释放至体液,导致血清胸苷激酶1(STK1) 水平增加[5]。因此,TK1可作为肿瘤细胞标志物用于乳腺癌、肠胃癌、鼻咽癌、原发性肝癌等不同类型恶性肿瘤的早期检测,评估手术、放化疗等治疗效果及肿瘤复发风险等[6-15]。目前获得TK1抗原一方面通过多肽段的合成,多肽合成不仅获得的抗原数量有限,而且为了获得较强的免疫原性需要偶联生物大分子,而且无关蛋白质的引入也为单抗的筛选带来新问题。另一方面采用pET28a-TK1重组载体原核表达TK1蛋白,pET28a不能很好的实现蛋白质的可溶性表达,在变性复性的过程中容易使蛋白质失活。为了获得更加优质的TK1蛋白,本实验探索构建重组菌,采用大肠杆菌pET32a表达系统,通过优化IPTG浓度、温度、时间使BL21-pET32a-TK1重组菌表达目的蛋白的作用条件最佳,产物经镍离子亲和层析纯化后获得高纯度的TK1蛋白,经动物免疫制备单克隆抗体初步验证TK1重组蛋白的免疫原性和生物活性达到实验要求,为肿瘤科学及临床应用研究提供了物质支撑。
1 材料与方法 1.1 材料从GenBank搜索人TK1基因序列,由生工生物工程(上海)股份有限公司合成,引物序列如表 1所示。TK1抗体、表达载体pET32a购自生工生物工程(上海)股份有限公司,表达菌BL21、BALB/c小鼠、HRP标记兔抗鼠-IgG抗体由河南省生物工程技术研究中心提供,TK1阳/阴性血清取自郑州大学第一附属医院。
| Primer name | Primer sequence (5′-3′) | Restriction enzyme |
| 5 -Primer | GGAATTCCATATGAGCTGCATTAACCTGCCCA | EcoRI |
| 3 -Primer | CCGCTCGAGTCAGTTGGCAGGGCTGCA | XhoI |
1.2 主要试剂
甲叉双丙烯酰胺、β-巯基乙醇、TEMED购自Sigma,DNA Marker、ECL发光液购自北京康为世纪生物科技有限公司,IPTG、Taq DNA聚合酶、T4 DNA连接酶、限制性内切核酸酶XhoI、EcoRI购自TaKaRa公司,预染蛋白Marker购自国药集团化学试剂有限公司,PVDF膜购自Millipore公司。
1.3 方法 1.3.1 BL21-pET32a-TK1重组菌的构建(1) PCR扩增目的基因。反应条件:93℃预变性5min,93℃变性30s,60℃复性30s,72℃延伸40s,共30个循环,72℃延伸5min。扩增产物用0.7%琼脂糖凝胶电泳鉴定后用胶回收试剂盒回收。
(2) 目的基因片段和pET32a表达载体在37℃条件下用EcoRI、XhoI双酶切2h,鉴定后胶回收,在16℃、T4 DNA连接酶条件下过夜反应,转入感受态细胞BL21,挑取阳性单菌落,双酶切鉴定后送生工生物工程(上海)股份有限公司测序。
1.3.2 重组菌初步诱导将鉴定正确的BL21-pET32a-TK1大肠杆菌和转入空质粒的BL21-pET32a大肠杆菌(对照)同时进行诱导,确定是否有TK1蛋白表达及表达形式。
(1) 分别挑取BL21-pET32a-TK1和BL21-pET32a单菌落,扩大培养至A600为0.6~0.8。
(2) 取1ml菌液做对照(未诱导),剩余菌液加IPTG至终浓度为1mmol/L,37℃、180r/min震荡培养4h。
(3)8 000r/min、离心5min分别收取菌体和上清液,用PB重悬菌体。
(4) 超声波破碎菌体,10 000r/min、离心10min,分别收取沉淀和上清液。
1.3.3 初步诱导后SDS-PAGE检测以未诱导的BL21-pET32a-TK1大肠杆菌菌液、IPTG诱导的BL21-pET32a大肠杆菌菌液与IPTG诱导的BL21-pET32a-TK1大肠杆菌菌液做对照,对上述收取的样品处理后以5%浓缩胶,15%分离胶进行SDS-PAGE检测。
1.3.4 重组菌诱导表达条件优化分别从IPTG作用浓度、培养温度、培养时间三个因素对BL21-pET32a-TK1重组菌进行诱导表达,对超声破碎后菌液上清液进行SDS-PAGE检测确定最佳表达条件。
(1) 37℃诱导6h,IPTG浓度设定0.1mmol/L、0.2mmol/L、0.5mmol/L、1.0mmol/L、1.5mmol/L 5个水平[16],确定IPTG作用浓度。
(2) 用上述实验确定的最佳IPTG作用浓度诱导6h,温度设定25℃、30℃、37℃、40℃ 4个水平,确定培养温度。
(3) 用上述实验确定的最佳IPTG作用浓度、培养温度,时间设定2h、4h、6h、8h 4个水平,确定培养时间。
1.3.5 纯化TK1蛋白(1) 根据优化后的条件对重组菌进行诱导表达,8 000r/min、离心5min,收集菌体。冰浴条件下超声破碎(400W,工作5s,间歇5s,循环15min),10 000r/min、离心10min后取上清。
(2) 用AKTAprime Plus蛋白纯化仪纯化TK1蛋白,柱压限定小于0.3MPa。上样前依次用0.5mol/L NaOH(含0.05mol/L EDTA)、超纯水、3%硫酸镍、超纯水、PB(0.02mol/L、pH7.8) 将镍亲和层析柱[17-19]进行处理。上样流速为1ml/min,上样完成后用0mmol/L、20mmol/L、50mmol/L、80mmol/L、100mmol/L、200mmol/L咪唑蛋白洗脱液进行梯度洗脱,收集洗脱样品进行SDS-PAGE检测,并测其蛋白质浓度。
1.3.6 Western blot检测蛋白抗原性纯化的TK1蛋白样品处理后进行SDS-PAGE电泳,切下目的条带凝胶,转膜。将PVDF膜置于封闭液中封闭2h,加入1:4 000稀释的TK1抗体37℃孵育2h。加入1:4 000稀释的兔抗鼠-IgG酶标二抗37℃孵育1h,显色[20]。
1.3.7 制备多克隆抗体检测蛋白质免疫原性用获得的TK1重组蛋白添加佐剂腹腔免疫6~8周龄的BALB/c雌性小鼠3只,每次100μg/只,第三次免疫后用ELISA间接法(每孔包被TK1重组蛋白100ng,兔抗鼠-IgG酶标二抗1:4 000稀释),通过倍比稀释检测小鼠抗体血清效价。
1.3.8 筛选阳性单克隆细胞株选用免疫效果最好的小鼠,脾内加强免疫(20μg)后取其脾细胞和SP2/0细胞融合,通过有限稀释法、克隆化和ELISA检测(同1.3.7节)筛选出能稳定分泌抗TK1抗体的阳性单克隆细胞株[21]。
1.3.9 TK1单抗鉴定(1) 单抗亚型的鉴定:按照鼠单抗亚型鉴定试剂盒操作说明对上述筛选的阳性单克隆细胞株进行鉴定。
(2) 特异性检测:通过包被Trx蛋白(100ng/孔)、TK1标准品(50ng/孔),采用ELISA间接法(兔抗鼠-IgG酶标二抗1:4 000稀释)检测10株单抗的特异性。
(3) 竞争抑制实验取10株阳性单克隆细胞株培养上清液,各处理3份:样品稀释液稀释、上清液与TK1阳性血清混合、上清液与TK1阴性血清混合。确定该抗体是否仅与血清中TK1抗原结合。
2 结果与分析 2.1 BL21-pET32a-TK1重组菌的构建目的基因扩增后经0.7%琼脂糖凝胶电泳检测在约700bp处有目的条带,与预期结果相符(图 1)。重组质粒双酶切鉴定在约700bp处有目的条带和质粒条带,与预期结果相符(图 2)。
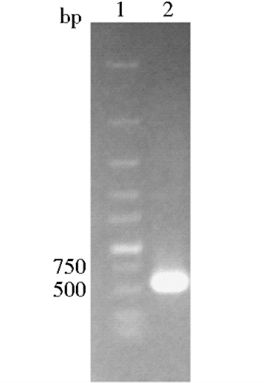
|
| 图 1 目的基因扩增 Figure 1 PCR of purpose gene 1:DNA Marker; 2:TK1 fragment |

|
| 图 2 pET32a-TK1质粒双酶切鉴定 Figure 2 Double digestion recombinant plasmid pET32a-TK1 1:DNA Marker; 2:Double digestion of pET32a-TK1 plasmid |
SDS-PAGE检测实验结果显示(图 3),在37℃、1.0 mmol/L IPTG作用浓度下诱导4h目的蛋白为可溶性表达。
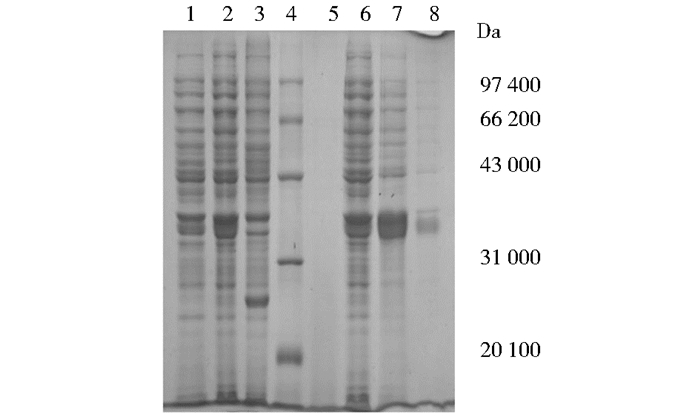
|
| 图 3 TK1蛋白初步诱导SDS-PAGE检测 Figure 3 SDS-PAGE detection of TK1 protein preliminary induced 1:Before induction of BL21-pET32a-TK1;2:After induction of BL21-pET32a-TK1;3:After induction of BL21-pET32a;4:Protein marker; 5:Bacteria liquid centrifugal supernatant after induction; 6:After induction of bacteria; 7:Centrifugal supernatant after ultrasonication; 8:Centrifugal sedimentation after ultrasonication |
(1) IPTG作用浓度确定:37℃诱导6h,通过改变IPTG浓度所得实验结果如图 4所示,灰度分析结果如图 5所示。结果显示IPTG在0.2mmol/L之后,增大浓度对蛋白质表达量影响不大,确定IPTG诱导浓度为0.2mmol/L。
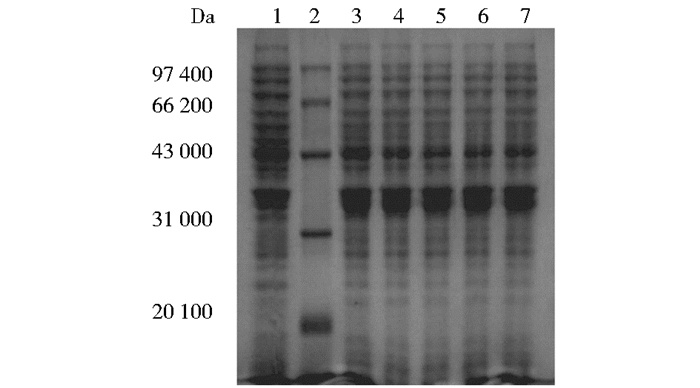
|
| 图 4 IPTG浓度优化SDS-PAGE检测 Figure 4 SDS-PAGE detection of IPTG concentration optimization 1:Before induction of BL21-pET32a- TK1;2:Protein marker; 3:IPTG 0.1mmol/L; 4:IPTG 0.2mmol/L; 5:IPTG 0.5mmol/L; 6:IPTG 1.0mmol/L; 7:IPTG 1.5mmol/L |

|
| 图 5 不同浓度IPTG灰度分析 Figure 5 Gray analysis of different IPTG concentration |
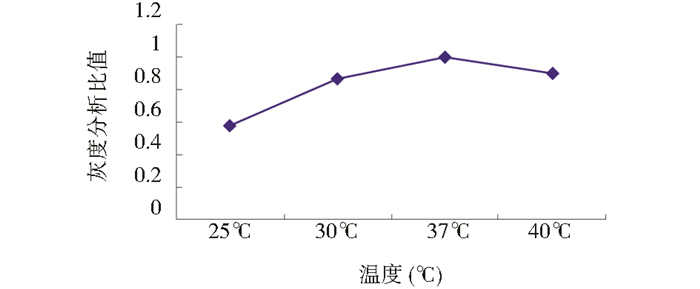
(2) 诱导温度确定:0.2mmol/L IPTG、诱导6h,通过改变诱导温度所得实验结果如图 6所示,灰度分析结果如图 7所示。结果显示,温度在37℃时目的蛋白TK1表达量最高。
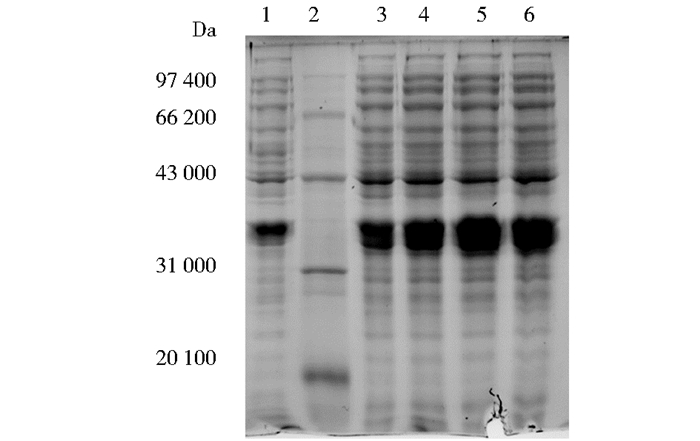
|
| 图 6 诱导温度优化SDS-PAGE检测 Figure 6 SDS-PAGE detection of induction temperature optimization 1:Before induction of BL21-pET32a- TK1;2:Protein marker; 3:25℃; 4:30℃; 5:37℃; 6:40℃ |
|
| 图 7 不同温度灰度分析 Figure 7 Gray analysis of different induction temperature |
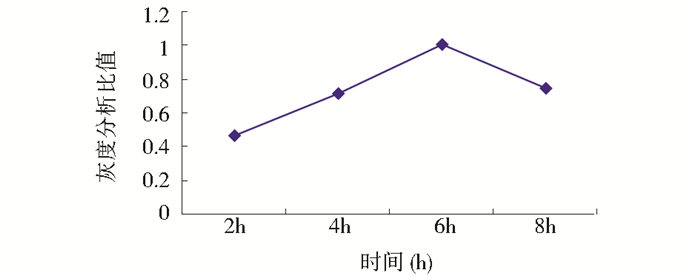
(3) 诱导时间确定:37℃、0.2mmol/L IPTG作用浓度下,通过改变诱导时间所得实验结果如图 8所示,灰度分析结果如图 9所示。结果显示,诱导6h时目的蛋白TK1表达量最高。

|
| 图 8 诱导时间优化SDS-PAGE检测 Figure 8 SDS-PAGE detection of induction time optimization 1:2h;2:4h;3:6h;4:8h;5:Before induction of BL21-pET32a- TK1;6:Protein marker |
|
| 图 9 不同时间灰度分析 Figure 9 Gray analysis of different induction time |
综上:该实验在37℃、IPTG作用浓度为0.2mmol/L条件下,诱导6h目的蛋白TK1表达量最高。
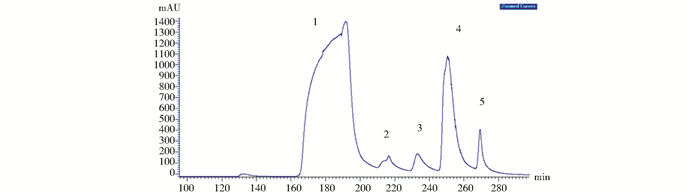
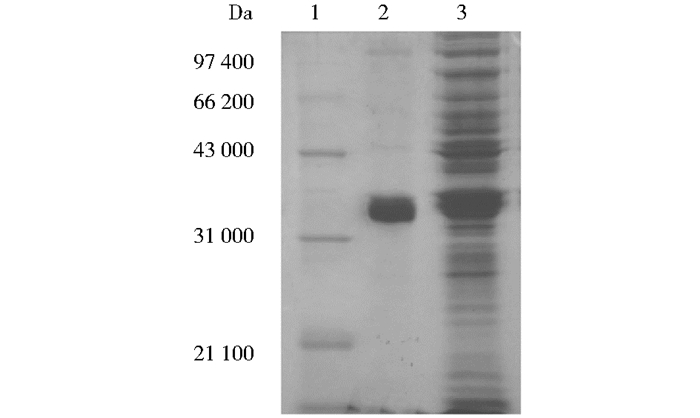
2.4 纯化TK1蛋白表达产物经镍离子亲和层析纯化(图 10),SDS-PAGE检测(图 11)在36kDa有明显的蛋白质条带,灰度分析纯度为87.3%,经紫外分光光度计检测浓度为2.48mg/ml。浓缩后蛋白质浓度为5.96mg/ml。
|
| 图 10 TK1蛋白亲和纯化 Figure 10 Affinity purification of TK1 protein 1:Upper sample; 2:20mmol/L imidazole elution peak; 3:50mmol/L imidazole elution peak; 4:80mmol/L imidazole elution peak; 5:100mmol/L imidazole elution peak |
|
| 图 11 纯化后SDS-PAGE检测 Figure 11 SDS-PAGE detection of after purification 1:Protein marker; 2:80mmol/L imidazole elution protein; 3:After induction of BL21-pET32a-TK1 |
Wesern blot检测结果如图 12所示。

|
| 图 12 Western blot检测 Figure 12 Western blot test 1:Protein marker; 2:TK1 protein |
结果显示(表 2),免疫后3只小鼠的抗体血清效价均达到1:1.28×105,且B小鼠免疫效果最好。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | 2.432 | 2.148 | 2.187 | 1.784 | 1.195 | 0.640 | 0.352 | 0.182 | 0.125 | 0.039 | 1.765 | 0.973 |
| B | 2.344 | 2.079 | 2.032 | 1.886 | 1.338 | 0.811 | 0.462 | 0.253 | 0.134 | 0.065 | 0.045 | 0.038 |
| C | 2.402 | 1.999 | 1.805 | 1.121 | 0.748 | 0.378 | 0.239 | 0.145 | 0.101 | 0.048 | 0.027 | 0.020 |
| Note:OD > 0.105 as positive response | ||||||||||||
2.7 筛选阳性单克隆细胞株
单克隆细胞上清液1:1.28×105稀释后通过ELISA间接法检测(表 3),成功筛选出10株阳性单克隆细胞,分别命名为1D8、1G3、2C10、3B7、3D5、4F9、4G3、5A6、5E3、6D5。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Cell lines | 1D8 | 1G3 | 2C10 | 3B7 | 3D5 | 4F9 | 4G3 | 5A6 | 5E3 | 6D5 | + | - |
| OD | 0.306 | 0.447 | 0.319 | 0.405 | 0.283 | 0.345 | 0.371 | 0.387 | 0.495 | 0.222 | 1.826 | 0.055 |
| Note:+, Positive control;-, Negative control;OD > 0.105 as positive response | ||||||||||||
2.8 TK1单抗鉴定
亚型鉴定结果如表 4所示,特异性检测结果如表 5所示,竞争性抑制检测结果如表 6所示,表明所得10株单抗仅与TK1抗原特异性结合,可用于检测方法的建立。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| Cell lines | 1D8 | 1G3 | 2C10 | 3B7 | 3D5 | 4F9 | 4G3 | 5A6 | 5E3 | 6D5 |
| Sub-type | IgG1 | IgG1 | IgG1 | IgG1 | IgG2a | IgG1 | IgG1 | IgG1 | IgG1 | IgG1 |
| 1D8 | 1G3 | 2C10 | 3B7 | 3D5 | 4F9 | 4G3 | 5A6 | 5E3 | 6D5 | Ab-TK1 | - | |
| Trx | - | - | - | - | - | - | - | - | - | - | - | - |
| TK1 | + | + | + | + | + | + | + | + | + | + | + | - |
| Note:+:positive response;-:negative response | ||||||||||||
| 1D8 | 1G3 | 2C10 | 3B7 | 3D5 | 4F9 | 4G3 | 5A6 | 5E3 | 6D5 | + | - | |
| A | 0.315 | 0.434 | 0.322 | 0.395 | 0.292 | 0.331 | 0.358 | 0.382 | 0.459 | 0.216 | 0.325 | 0.043 |
| B | 0.039 | 0.048 | 0.045 | 0.047 | 0.036 | 0.039 | 0.047 | 0.044 | 0.042 | 0.037 | 0.041 | 0.039 |
| C | 0.312 | 0.431 | 0.325 | 0.387 | 0.288 | 0.336 | 0.363 | 0.378 | 0.447 | 0.222 | 0.331 | 0.040 |
| Note:A, Diluted monoclonal antibody;B, Monoclonal antibody and TK1 positive serum mixture;C, Monoclonal antibody and TK1 negative serum mixture;+, Positive response;-, Negative response | ||||||||||||
3 讨论
TK1是DNA补救合成途径的关键酶。目前研究认为TK1可作为一种灵敏有效的肿瘤细胞增殖标志物。在近十年里,多个实验室制备了不同的抗TK1抗体用于肿瘤疾病的鉴定和监控,但灵敏度较低[5]。TK1的来源是业内积极研究和亟待解决的热点和难点。获取TK1抗原的方法有培养Raji细胞,从细胞提取物中纯化获得天然TK1蛋白[22];有分析TK1抗原表位,合成N端23肽(3~25)、C端20肽(206~225)、C端28肽(198~225) 等多肽段偶联生物大分子[5];有利用重组载体pET28a-TK1诱导表达TK1重组蛋白[16]。本实验采用大肠杆菌pET32a表达系统,选用的pET32a表达载体可以实现蛋白质的可溶性表达,his标签有利于目的蛋白从杂蛋白中分离纯化。与纯化天然蛋白质相比得到的蛋白质纯度更高;与合成多肽段偶联生物大分子相比,全蛋白质作为抗原免疫动物获得的抗体特异性和灵敏度更高。在本实验方法下可以快速、大量获得优质的TK1蛋白。在肿瘤标志物研究和临床检测试剂的研制上有很好的应用前景。
4 结论本实验成功构建能够表达TK1蛋白的重组菌BL21-pET32a-TK1,获得可溶性、抗原活性高、免疫原性强的TK1重组蛋白。为肿瘤科学及临床应用研究提供了物质支撑。
| [1] |
Munch-Petersen B, Cloos L, Jensen H K, et al. Human thymidine kinase 1. Regulation in normal and malignant cells. Adv Enzyme Regul, 1995, 35(1): 69-89. |
| [2] |
Kumar J K, Aronsson A C, Pilko G, et al. A clinical evaluation of the TK 210 ELISA in sera from breast cancer patients demonstrates high sensitivity and specificity in all stages of disease. Tumour Biol, 2016, 37(9): 11937-11945. DOI:10.1007/s13277-016-5024-z |
| [3] |
Gasparri F, Wang N N, Skog S, et al. Thymidine kinase 1 expression defines an activated G1 state of the cell cycle as revealed with site-specific antibodies and ArrayScanTM assays. European Journal of Cell Biology, 2009, 88(1): 779-785. |
| [4] |
Ke P Y, Yang C C, Tsai I C, et al. Degradation of human thymidine kinase is dependent on serine-13 phosphorylation:involvement of the SCF-mediated pathway. Biochem J, 2003, 370(1): 265-273. DOI:10.1042/bj20021335 |
| [5] |
周际, 李劲, 斯文·斯库格, 等. 一种多表位TK1抗体的制备及其在评估肿瘤患者治疗效果中的应用: 中国, CN102516390A. 2012-06-27. Zhou J, Li J, Skog S, et al. Preparation of A Multi Epitope TK1 Antibody and Its Application in Evaluating Therapeutic Effect of Tumor Patients:China, CN102516390A. 2012-06-27. |
| [6] |
He E, Xu X H, Guan H, et al. Thymidine kinase 1 is a potential marker for prognosis and monitoring the response to treatment of patients with breast, lung, and esophageal cancer and non-Hodgkin's lymphoma. Nucleosides Nucleotides Nucleic Acids, 2010, 29(1): 4-6. |
| [7] |
Rausch S, Hennenlotter J, Teepe K, et al. Muscle-invasive bladder cancer is characterized by overexpression of thymidine kinase 1. Urol Oncol, 2015, 33(10): 426-426. |
| [8] |
Chen G, He C, Li L, et al. Nuclear TK1 expression is an independent prognostic factor for survival in pre-malignant and malignant lesions of the cervix. BMC Cancer, 2013, 13(1): 249-249. DOI:10.1186/1471-2407-13-249 |
| [9] |
Du Y Y, Zhang Q J, Sun G P. Expression and clinical significance of cytokeratin-19 and thymidine kinase-1 in advanced gastrointestinal cancer. Chinese Medical Journal, 2016, 129(18): 2168-2172. DOI:10.4103/0366-6999.189919 |
| [10] |
朱艳哲, 马泰, 张从军, 等. 血清胸苷激酶1在肿瘤患者中的表达及临床意义. 安徽医科大学学报, 2015, 50(7): 1012-1015. Zhu Y Z, Ma T, Zhang C J, et al. The expression and clinical significance of serum thymidine kinase 1 in cancer patients. Acta Universitatis Medicinalis Anhui, 2015, 50(7): 1012-1015. |
| [11] |
刘秀菊, 周际, 李远, 等. 一种新肿瘤生长相关生物标志物胸苷激酶1临床应用进展. 中国药理学与毒理学杂志, 2011, 25(1): 123-126. Liu X J, Zhou J, Li Y, et al. Progress in clinical application of a new tumor growth related biomarker thymidine kinase 1. Chin J Pharmacol Toxicol, 2011, 25(1): 123-126. |
| [12] |
O'Neill K L, Zhang F, Li H, et al. Thymidine kinase 1——a prognostic and diagnostic indicator in ALL and AML patients. Leukemia, 2007, 21(3): 560-563. DOI:10.1038/sj.leu.2404536 |
| [13] |
Hallek M, Wanders L, Strohmeyer S, et al. Thymidine kinase:a tumor marker with prognostic value for non-Hodgkin's lymphoma and a broad range of potential clinical applications. Ann Hematol, 1992, 65(1): 1-5. DOI:10.1007/BF01715117 |
| [14] |
He Q, Zou L, Li H, et al. Concentration of thymidine kinase 1 in serum (S-TK1) is a more sensitive proliferation marker in human solid tumors than its activity. Oncology Reports, 2005, 14(4): 1013-1019. |
| [15] |
Wang Y, Jiang X, Dong S, et al. Serum TK1 is a more reliable marker than CEA and AFP for cancer screening in a study of 56, 286 people. Cancer Biomark, 2016, 16(4): 529-536. DOI:10.3233/CBM-160594 |
| [16] |
庞丽君, 王珊珊, 吴云, 等. 胸苷激酶1原核表达载体的构建表达及鉴定. 医药论坛杂志, 2015, 36(8): 6-8. Pang L J, Wang S S, Wu Y, et al. Construction, expression and identification of Thymidine kinase 1 prokaryotic expression vector. J Medical Forum, 2015, 36(8): 6-8. |
| [17] |
陈爱春, 彭伟, 汪生鹏. 亲和标签在重组蛋白表达与纯化中的应用. 中国生物工程杂志, 2012, 32(12): 93-103. Chen A C, Peng W, Wang S P. Application of affinity tags in the expression and purification of recombinant proteins. China Biotechnology, 2012, 32(12): 93-103. |
| [18] |
任广威. 组氨酸标签蛋白纯化介质的合成及其应用研究. 杭州: 浙江工商大学, 食品科学与生物技术学院, 2011. Ren G W. Sythesis and Application of His-tagged Protein Purification Medium. Hangzhou:Zhejiang Gongshang University, College of Food Science and Biotechnology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10353-1015553058.htm |
| [19] |
Birringer M S, Perozzo R, Kut E, et al. High-level expression and purification of human thymidine kinase 1:quaternary structure, stability, and kinetics. Protein Expression and Purification, 2006, 47(1): 506-515. |
| [20] |
王云龙, 张春艳, 邓黎黎, 等. EB病毒融合蛋白Zta-P54在大肠杆菌中的表达、纯化及鉴定. 生物技术通报, 2014, 7(1): 173-178. Wang Y L, Zhang C Y, Deng L L, et al. Expression, purification and identification of Zta-P54 fusion protein in escherichia coli of epstein-barr virus. Biotechnology Bulletin, 2014, 7(1): 173-178. |
| [21] |
葛新杰. NT-proBNP单克隆抗体的研制及ELISA定量检测方法的建立. 郑州: 郑州大学, 生命科学学院, 2015. Ge X J. Development of Monoclonal Antibody NT-proBNP and Establishment of ELISA Quantitative Detection Method. Zhengzhou:Zhengzhou University, School of Life Science, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10459-1015302535.htm |
| [22] |
赵群莉. 血清胸苷激酶单克隆抗体酶促化学发光试剂盒的研制. 天津: 天津医科大学, 免疫学, 2013. Zhao Q L. The Development of the Kit of the Enzyme Chemiluminescence Detection for Serum Thymidine Kinase with Monoclonal Antibody. Tianjin:Tianjin Medical University, Immunology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10062-1013321652.htm |
 2017, Vol. 37
2017, Vol. 37




