文章信息
- 赖木兰, 陈雪岚.
- LAI Mu-lan, CHEN Xie-lan.
- 蛋白质赖氨酸乙酰化修饰对中间代谢的调控研究
- Devolopment of Regulation of Protein Lysine Acetylation on Intermediate Metabolism
- 中国生物工程杂志, 2017, 37(9): 126-133
- China Biotechnology, 2017, 37(9): 126-133
- http://dx.doi.org/DOI:10.13523/j.cb.20170917
-
文章历史
- 收稿日期: 2017-05-09
- 修回日期: 2017-06-28
蛋白质赖氨酸乙酰化(lysine actylation, KAc)是一种普遍存在于三界系统中的、可逆的、高度受调控的蛋白质翻译后修饰方式[1]。早期研究表明,真核生物核小体中组蛋白的KAc修饰能改变核染色体结构并调控基因的表达。随着研究的深入,科研工作者逐渐将目光转移至非组蛋白中的KAc修饰的研究。Hirschey等[2]利用纳升级液相色谱-质谱-质谱串联(Nano-HPLC/MS/MS)分析小鼠肝脏线粒体中133个蛋白质的KAc作用并鉴定了277个KAc位点;Huang等[3]也用同样的方法在红酵母多孢菌(Saccharopolyspora erythraea)的363个蛋白质中鉴定了664个独特的KAc位点,对其进一步研究发现中间代谢酶的KAc修饰可精确的调控初级代谢和次级代谢进程。
丰富的KAc修饰在原核生物的代谢路径中也扮演着十分重要的角色。Zhang等[4]结合免疫富集和质谱分析等方法在大肠杆菌(Escherichia coli)的349个乙酰化的蛋白质中鉴定了1 070个KAc位点。Mo等[5]通过肽初步分离、抗体富集和液相层析串联质谱等方法也在蓝藻(Synechocystis)的513个乙酰化蛋白质中鉴定了776个KAc位点,且发现大部分KAc位点存在于中间代谢酶中。这些中间代谢酶丰富的KAc位点的发现对深入研究代谢酶的乙酰化修饰作用机制具有重要的里程碑意义。同时,KAc修饰的高度保守性和功能特异性为研发相关疾病的针对性药物提供了理论依据,也为因新陈代谢异常所引发的高发病率的代谢疾病、Ⅱ型糖尿病、肥胖和癌症等的治疗提供了新思路。本文主要对可逆的乙酰化和去乙酰化的酶类、蛋白质乙酰化修饰对原核生物及真核生物中间代谢的调控和相关疾病的关系进行概述,为深入研究蛋白质乙酰化修饰提供参考。
1 可逆的乙酰化和去乙酰化KAc是指以乙酰-CoA等乙酰基供体为辅因子的赖氨酸乙酰化转移酶(lysine acetyl tran sferases,KATS)对蛋白质的赖氨酸残基进行的乙酰化修饰作用。赖氨酸的脱乙酰化则是通过赖氨酸脱乙酰化酶(lysine deacetylase,KDAC)水解赖氨酸残基上的ε-N-乙酰基实现的。由于赖氨酸残基常存在于中间代谢酶的活性位点上,因此中间代谢酶可逆的KAc修饰作用可调控其酶活性进而调控相应的生命活动。以下就KATS和KDAC的种类分别进行概述。
1.1 KATs真核生物的KATs主要包括Gcn5相关的乙酰基转移酶(Gcn5-related N-acety-transferase,GNAT)家族、MYST(MOZ、Ybf2/Sas3、Sas2、Tip60) 家族、应答元件结合蛋白(P300/CBP)辅助激活蛋白类、类固醇受体辅活化因子(SRC)家族和转录激活因子TAFII类[6]等,以上均能对染色质和核外蛋白的分布、稳定性以及蛋白质与蛋白质之间的相互作用进行调控。虽然在含有丰富的KAc修饰的线粒体中没有发现相应的KATs[7],但Wagner和Payne[8]发现线粒体基质中的碱性环境和丰富的乙酰-CoA的存在有利于线粒体蛋白乙酰化;同时,Fan等[9]在癌细胞的线粒体中发现了乙酰化转移酶(acetyl-CoA acetyltransferase 1,ACAT1),且线粒体KAc修饰受乙酰-CoA和NAD+水平的调节。
在原核生物中也找到了相应的KATs。Barak等[10]发现E. coli中的KATs主要是ACS和CheY;在肠道沙门氏菌(Salmonella enterica)和枯草芽孢杆菌(Bacillus subtilis)中也发现了Gcn5类似物KATS-Pat/AcuA/YfiQ,且细菌的乙酰化修饰作用依赖于乙酰磷酸化代谢水平[11]。
1.2 KDAC真核生物的KDAC主要包括两个家族:Zn2+依赖性的Rpd3/Hda1家族和NAD+依赖性的SIRTS家族[11]。Rpd3/Hda1家族主要包含KDAC1~11等11种KDACs,其酶活性可以被古曲抑菌素(trichostatin A,TSA)抑制。SIRTS家族包括7种KDACs,该家族的酶活性受烟酰胺(nicotinamide,NAM)的抑制[11],且有报道称SIRT家族与应激反应、衰老、Ⅱ型糖尿病、肥胖、癌症和心血管疾病的发生有密切联系[1]。
原核生物的KDAC则相对简单,在2015年前,E. coli和S. enterica中的脱乙酰化酶只鉴定到了SIRT家族中的CobB[11]。在2015年Tu等[12]开发了一种“夹芯片”策略,在E. coli蛋白质组中发现了新型KDACs。他们证实,YcgC是一种丝氨酸水解酶,其使用Ser200作为赖氨酸脱乙酰化的催化亲核试剂;体内表征证明YcgC通过催化转录阻遏物RutR的Lys52和Lys62的脱乙酰化来调节转录,且YcgC是E. coli中唯一已知的KDAC与CobB靶向底物不同。YcgC细菌同源物的分析证实,它们也表现出KDAC活性。因此,YcgC代表了一个新的原核家族KDACs。
2 KAc修饰调控细胞代谢可逆的KAc修饰对代谢酶活性的调控包括对酶的浓度、催化活性及对底物的亲和力三方面的调控作用,且是细胞内主要的代谢调控因素。几乎所有的代谢反应,包括糖代谢、TCA循环、N循环、脂肪酸代谢、氨基酸代谢等的中间代谢酶都存在KAc修饰作用(图 1)。以下将总结新陈代谢反应中几种典型的中间代谢酶的KAc修饰作用和KAc作用的位点,并分析KAc作用在原核生物和真核生物的代谢中的调控机制。
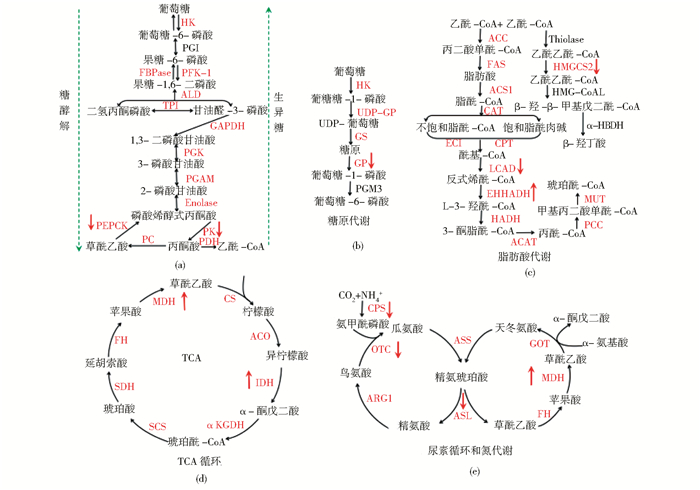
|
| 图 1 代谢酶的乙酰化作用[1] Figure 1 Acetylation regulation of metabolic enzymes[1] (a) Glycolysis, gluconeogenesis (b) Glycogen metabolism (c) Fatty acid metabolism (d) Tricarboxylic acid (TCA) cycle and the urea cycle and nitrogen metabolism (e)Are illustrated Metabolic enzymes are colored in red if their acetylations have been identified or black if not. The red arrows, facing up or down, next to the enzymes indicate a stimulatory or inhibitory effect |
在E. coli、S. enterica、Bacillus subtilis和Mcobacterium smegmatis等诸多微生物中都研究了可逆的KAc作用对新陈代谢的影响[13-14]。Wang等[15]报道在S. enterica中,磷酸甘油酸变位酶(glyceraldehyde phosphate dehydrogenase,GapA)、乙酰辅酶A(isocitrate lyase,AceA)和异柠檬酸脱氢酶激酶(isocitrate dehydrogenase kinase,AceK)均是通过可逆的乙酰化来调节酶活性从而引导代谢流的方向,当葡萄糖作为细胞的唯一碳源时,代谢流趋向于糖酵解方向;当柠檬酸盐作为细胞的唯一碳源时,乙醛酸旁路被激活,代谢流趋向于糖异生方向。同时,Jones和O’Connor[6]发现E. coli中异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)的K230位点可逆的乙酰化修饰对其活性有重要的影响,K230突变酶的催化常数(Kcat)减少到野生型菌株的1.1%。虽已有报道指出IDH在K230存在乙酰化作用,但目前研究者利用串联质谱法尚未找到该修饰位点,因此科研工作者可能应结合更多的方法来研究和发现新的赖氨酸乙酰化位点。
2.1.2 KAc修饰调控中心碳代谢过程当脂肪酸为主要碳源时,结核分枝杆菌(Mycobacterium tuberculosis)采用乙醛酸分流和甲基柠檬酸循环来补充TCA循环,其中异柠檬酸裂解酶(isocitrate lyase,ICL)是催化双官能异柠檬酸和甲基柠檬酸裂解的酶,当ICL在甲基柠檬酸循环中则扮演甲基柠檬酸裂解酶(methylcitrate lyase,MCL)角色,以满足此菌在脂肪酸中的生长[16]。Bi等[17]用胰蛋白酶消化M. tuberculosis的全细胞裂解物与乙酰赖氨酸特异性抗体混合后,再应用液相色谱-串联质谱(LC-MS/MS)分离和定位富集肽,结果在异柠檬酸裂解酶上鉴定了三个赖氨酸乙酰化位点(K322、K331和K392);进一步在这三个位点上进行定点突变,分析对ICL和MCL活性影响,结果发现这些残基的突变明显改变ICL的活性:用谷氨酰胺(K392Q)取代K392导致ICL的酶活约上升至WT酶的2.2倍;K331Q也能增加ICL的酶活,增加了约70%;用精氨酸替代K392或K322并不显著的影响ICL的酶活,而替代K331使ICL的酶活提高了50%;值得关注的是,用谷氨酰胺(K322Q)取代K322却降低了ICL的酶活,约为WT酶的43%。对MCL的活性影响结果如下:用谷氨酰胺替代这三个残基并不改变MCL的酶活;用精氨酸替代K392,使MCL酶活约增加50%,替代K322及K331不改变MCL酶活。进一步研究表明,M. tuberculosis可根据培养基中碳源的变化而改变ICL1中K392乙酰化修饰水平从而改变酶活,如在葡萄糖培养基中添加丙酸盐或乙酸盐可观察到ICL1中K392乙酰化修饰水平增加,相应的酶活也提高。因此,M. tuberculosis可根据外界碳源的变化通过KAc作用来调节MCL和ICL的酶活,使其在特定的环境达到相应的状态以满足生命活动需求。
2.1.3 KAc修饰调控次级代谢酶活性虽然在大量原核生物的初级代谢酶中鉴定了许多KAc位点,但对次生代谢酶的KAc作用却知之甚少。Ishigaki等[18]对灰色链霉菌(Streptomyces griseus)中的链霉素生物合成的相关酶StrM(脱氧糖-参与链霉素生物合成的差相异构酶)采用2-DE进行蛋白质组学和质谱分析,结果表明StrM是高度乙酰化的且K70是其主要的乙酰化位点。为了证明K70乙酰化作用对StrM和产链霉素的影响,他们在K70位点上引入了突变并构建了三个菌株:①ΔstrM∷apr(strm基因被安普酶素的耐药基因盒所替代);② strm-K70Q;③ strm-K70R。结果显示:① 号菌在第4天的链霉素产量是原始菌株的千分之一,② 号菌株基本不产链霉素,③ 号菌在第4天的链霉素产量是原始菌株的百分之一;与原始菌株相比:② 号菌和③ 号菌中的StrM蛋白明显减少,且② 号菌中的StrM蛋白减少的更为显著,相应的是不仅StrM蛋白活性降低且稳定性亦降低。因此,strm基因在K70位点的乙酰化作用是保证其酶活的关键。
2.2 KAc修饰对真核生物中间代谢的调控 2.2.1 KAc修饰调控糖代谢流磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxykinase1,PEPCK1) 是糖异生代谢途径中的关键酶,而丙酮酸激酶(pyruvate kinase,PK)则是推动糖酵解的关键酶(图 1a)。Zhao等[19]以人的肝细胞为研究对象,用质谱法在PEPCK1中鉴定了三个乙酰化的赖氨酸残基(K70、K71和K594) 位点并发现高浓度葡萄糖会增加PEPCK1的乙酰化,降低其稳定性,从而影响其酶活;在不含葡萄糖的培养基中添加氨基酸会减少PEPCK1的乙酰化,其稳定性则增加且使代谢流流向糖异生途径。因此,PEPCK1是否乙酰化是对细胞外营养成分改变的一种响应并决定代谢流方向。Jiang等[20]对HEK293、HepG2、Chang’s和HEK293T四种细胞的研究也进一步证实,去乙酰化作用可以提高PEPCK1的稳定性,而乙酰化作用后的PEPCK1的稳定性降低。同时,Lv等[21]在对肌细胞的研究中发现PK的K305残基端的乙酰化会降低其对底物PEP的亲和力,从而改变代谢流的方向。因此,PEPCK1的稳定性和PK的活性均是通过可逆的KAc作用来调节的,从而使代谢流流向糖酵解或糖异生代谢途径并且这种变化是对胞外可利用能源做出的直接应答。
2.2.2 KAc修饰保持糖原稳态在葡萄糖依赖性的细胞中,葡萄糖缺乏时,糖原磷酸化酶(glycogen phosphorylase,GP)是保持细胞中糖原稳态的关键酶之一,已知GP催化糖原分解代谢的限速步骤为糖原磷酸化生成糖原-1-磷酸(图 1b)。通过亲和纯化等方法在多种肝细胞中都发现了GP在K470和K796两个残基上有乙酰化作用,Zhang等[22]为了探究GP中赖氨酸的乙酰化作用,以Chang’s肝细胞为研究对象,用脱乙酰酶抑制剂NAM和TSA处理细胞后发现GP的乙酰化作用增加了2倍,而其酶活降低了75%,表明乙酰化作用负调控此酶活性;将K470和K796同时突变为GPK2Q,发现其与原始株相比酶活降低了55%,且其酶活不受脱乙酰酶抑制剂的抑制,表明K470和K796这两个位点是影响GP酶活的主要位点;进一步研究揭示KAc调控GP酶活的机制是:GP乙酰化作用加速了GP的脱磷酸化作用从而抑制了其活性。作者同时研究发现,胰岛素和胰高血糖素即是通过影响GP中K470和K796残基端可逆的乙酰化来调控其活性,从而维持机体内的血糖浓度平衡。
2.2.3 KAc修饰调控TCA循环中间代谢酶活性在动物细胞中,参与TCA循环的7个酶都经过KAc修饰[19],其中苹果酸脱氢酶(malate dehydrogenase,MDH)是TCA循环的中间代谢酶之一(图 1d),其以NAD+为辅基催化苹果酸氧化为延胡索酸的可逆反应。Zhao等[19]用人的肝脏为材料,应用串联液谱法-串联质谱法(LC/LC-MS/MS)和傅里叶变换离子回旋共振质谱法定量分析MDH的KAc修饰,在MDH中鉴定了4个赖氨酸乙酰化(K185、K301、K307和K314) 位点;进一步研究发现,高浓度葡萄糖使MDH的乙酰化水平增加60%,且抑制脱乙酰化酶的活性会使MDH的活性提高1倍。除了以上四个乙酰化位点外,Hebert等[23]在研究MDH的KAc位点时发现在K239的乙酰化修饰亦会提高MDH的活性。以上研究表明乙酰化作用是MDH酶活的正调控,其乙酰化水平决定TCA循环水平。
2.2.4 KAc修饰调控脂肪酸途径中间代谢酶活性近几年的研究指出:乙酰-CoA、长链酰基-CoA(long-chain acyl-CoA dehydrogenase,LCAD)和3-羟-3甲基戊二酰-CoA合成酶2(3-hydroxy-3-methylglutaryl CoA synthase 2,HMGCS2) 这三个重要的脂肪酸代谢酶的去乙酰化作用都受SIRT3的调控[24]。LCAD是脂肪酸氧化的关键酶(图 1c),Bharathi等[24]对小鼠肝脏的线粒体蛋白质的研究中指出K318和K322的赖氨酸残基是调控LCAD酶活的两个关键位点,并确定K318和K322的乙酰化受SIRT3调控,且其被SIRT3去乙酰化后,LCAD的活性增强。Chen等在[25]研究ΔSirt3小鼠心肌细胞线粒体的提取物中时亦发现:在营养不良的情况下,LCAD是高乙酰化的,而这一效应在sirt3缺陷小鼠中更为明显,且在过度肥大的小鼠中,LCAD都是相对高乙酰化的。但sirt3缺陷小鼠中LCAD的酶活却减少了40%,脂肪酸代谢路径下调,脂质在心脏中的积累。因此,由sirt3基因所调控LCAD的去乙酰化作用可以大量减少脂质在心脏的积累。
HMGCS2是β-羟基丁酸合成的限速酶(图 1c)。Shimazu等[26]应用液谱法-串联质谱法(LC-MS/MS)和免疫共沉淀法(anti-FLAG)在ΔSirt3鼠的肝脏线粒体中鉴定了HMGCS2的K310、K447和K473三个高乙酰化位点;同时在未敲除SIRT3鼠中发现禁食24h后SIRT3的表达水平下调,且较原始小鼠HMGCS2的乙酰化水平降低了58%;而SIRT3敲除鼠在禁食24h后HMGCS2是高乙酰化的,较之于未敲除SIRT3鼠的乙酰化水平提高了72%。因此推测,HMGCS2的去乙酰化作用受SIRT3脱乙酰化酶调控。那么,HMGCS2的赖氨酸乙酰化作用是怎样影响其催化活性的呢?已知HMG-CoA的合成是从乙酰-CoA转乙酰基到HMGCS2中的C166开始的,而H301是C166上的H+受体,因此C166和H301之间需要最合适的距离[26]。Shimazu等[26]对赖氨酸乙酰化HMGCS2的分子动力学的研究表明,在K310、K447及K473三个位点的乙酰化作用增加了H301-C166和乙酰-CoA之间的距离,使活性位点与乙酰-CoA的乙酰基的有效撞击减少而不能正常的启动反应。因此,HMGCS2的催化活性降低。同时,Hölper等[27]在患有糖尿病鼠(Db/Db)的肝脏线粒体中只发现K310的乙酰化水平提高了两倍,此结果再一次的验证了Shimazu等[26]的观点:糖尿病动物体内HMGCS2在K310的高乙酰化是对变化的代谢条件(过度营养或胰岛素分泌障碍)的应答。
2.2.5 KAc修饰调控N循环中间代谢酶活性氨基甲酰磷酸合成酶1(carbamoyl phosphate synthetase 1, CPS1) 是催化尿素循环中解氨毒的关键酶(图 1e)。Matthew等[28]在研究小鼠的肝脏线粒体的CPS1时发现,其97个赖氨酸残基中就有70个是被乙酰化的。Takashi等[29]进一步研究显示SIRT5可使CPS1脱乙酰化并上调其活性;当小鼠禁食或用高蛋白喂食时,肝脏线粒体中的NAD+增加会引发SIRT5促使CPS1脱乙酰化从而使氨基酸分解代谢增加;在同样状态时,Δsirt5敲除鼠中CPS1活性降低并显示血氨浓度升高。以上结果表明,CPS1的活性对N循环有重要影响,而其活性受乙酰化水平的调控,如其乙酰化水平发生异常,则可能引起机体病变。
鸟氨酸转氨甲酰基酶(ornithine carbamoyltransferase,OTC)和精胺琥珀酸裂解酶(argininosuccinate lyase,ASL)是尿素循环中的关键酶。Yu等[30]对HEK293T和Chang’s肝细胞的研究表明,OTC在K88残基端的乙酰化作用是调控其酶活的关键,用p53、TSA和NAM处理细胞能增强OTC的乙酰化,但抑制了OTC的活性。葡萄糖浓度降低,使OTC的乙酰化水平降低;氨基酸浓度提高,OTC的乙酰化水平增加;但未报道OTC的脱乙酰化酶。而Hallows等[31]对Sirt3敲除鼠的肝细胞的研究进一步说明,STRT3能使OTC脱乙酰化,并提高OTC的活性。因此,OTC乙酰化受胞外葡糖糖及氨基酸等营养物质的调控,且OTC的去乙酰化作用受SIRT3脱乙酰化酶的调控进而调控N循环的流向。
研究发现ASL上的突变会导致常见的新生儿琥珀酸糖尿症[32]。Zhao等[19]在HEK293T细胞的ASL中鉴定了K69和K288两个乙酰化位点,用TSA和NAM处理细胞后使K288残基端的乙酰化水平提高了2.8倍。增加葡萄糖的浓度使ASL的乙酰化增加2.7倍,但ASL的活性却降低了50%;氨基酸的加入使ASL在K288的乙酰化水平降低,但增加了ASL的活性。因此,ASL中的赖氨酸残基乙酰化表现为ASL酶活的负调控,当细胞外含有低浓度葡萄糖和高浓度氨基酸时,ASL的脱乙酰水平增加,细胞优先利用氨基酸提供能量,使N循环加速。
3 蛋白质的乙酰化与疾病的关系从前所述中,我们已经窥见在哺乳动物中参与脂肪途径和N循环等的中间代谢酶中,赖氨酸的乙酰化水平变化可能会带来疾病隐患。以下将总结蛋白质赖氨酸乙酰化修饰的改变所涉及的慢性肥胖、糖尿病、线粒体疾病、癌症和心脑血管疾病等疾病细胞中特定酶的KAc水平及其在特定位点上的KAc作用的变化。这些特殊的变化及其相应的调控系统研究的进一步完善将为研究这些疾病的发病机制及为这些疾病的治愈提供全新的思路。
3.1 KAc与慢性肥胖的关系胰岛素抵抗(insulin resistance,IR)是指机体组织对胰岛素的反应下降,即一定量胰岛素产生的生物学效应低于正常水平,是肥胖、糖耐量减退或2型糖尿病、高胰岛素血症、高血压、高脂血症等的共同发病基础,瘦素缺乏可导致IR[33]。瘦素是由肥胖基因编码、脂肪组织分泌的蛋白质激素,其主要功能是抑制食欲、增加能量的消耗,如其缺乏会引起肥胖并进一步引发2型糖尿病等疾病。Hölper等[27]在对瘦素受体突变的小鼠肝脏线粒体的研究中指出,TCA循环中的两个关键酶苹果酸脱氢酶(malate dehydrogenase 2,Mdh2,K314) 和富马酸盐水合酶(fumarate hydratase,Fh,K63) 在小鼠肝脏线粒体中的乙酰化水平降低。因此,对MDH2上K314及Fh上K63的可逆乙酰化修饰的研究,将可能诠释在出现慢性肥胖症时调控TCA循环代谢酶活的变化机制。
3.2 KAc与癌细胞代谢的关系异柠檬酸脱氢酶2(isocitrate dehydrogenase 2 IDH2) 是NADPH的主要来源之一。Yu等[34]研究表明,IDH2的活性是影响癌细胞代谢的重要因素,而SIRT3在其K413的脱乙酰化作用是潜在的癌细胞代谢中IDH2活性的重要的功能调控因子。
几乎所有癌细胞的营养供应都是通过有氧糖酵解途径利用葡萄糖来实现的,而磷酸甘油酸酯激酶1(phosphoglycerate kinase 1,PGK1) 是糖酵解代谢路径中的重要酶之一。研究表明PGK1与肝癌进展相关,Hu等[35]在肝癌组织细胞中鉴定了PGK1的K323位点的乙酰化作用能促进其酶活性及癌细胞增殖和肿瘤的发生;同时发现PGK1在癌细胞中是过度表达的,且PGK1表达与肝癌患者存活呈负相关,Δpgk1会明显降低癌细胞增殖和肿瘤发生。
3.3 KAc与糖尿病的关系氨基酸是蛋白质的构件分子,细胞可以利用氨基酸进行生物合成。谷氨酸脱氢酶(glutamate dehydrogenase,GDH)是氨基酸代谢中的关键酶,其催化α-酮戊二酸转化为谷氨酸盐的可逆反应。在鼠的肝细胞中鉴定了该酶的15个乙酰化位点,但是在患有糖尿病鼠的肝脏中却检测到其K162和K415的乙酰化水平降低[27];且发现GDH的去乙酰化作用受SIRT3和SIRT4两个去乙酰化酶的调控[36]。因此,K162和K415两个位点的赖氨酸乙酰化水平的降低可能与糖尿病的发生相关,这个发现为糖尿病的诊断和治疗提供了新的思路和新的目标。
PEPCK1是2型糖尿病评估中的重要标志物,SIRT2蛋白是负责PEPCK1脱乙酰化的主要酶,而西汀(Sirtinol)是一种特异性SIRT1和SIRT2抑制剂。Zhang等[37]发现抑制SIRT家族的活性使PEPCK1(K70、K71) 的乙酰化水平增加,而KAc作用后的PEPCK1不稳定,所以Sirtinol能够抑制SIRT2活性而降低肝脏的PEPCK1蛋白水平,并防止丙酮酸诱导的血糖升高。因此,SIRT2活性的抑制在糖异生代谢路径中有重要的作用,其可能是糖尿病治疗的新型分子靶点,也可能揭示去乙酰化酶的潜在糖尿病治疗机制。
3.4 KAc与心血管疾病的关系许多研究表明SIRT去乙酰化酶家族在维持心血管系统稳定中有重要的作用。心血管疾病的调控机制主要包含两个方面:一个是血管内皮功能紊乱与内皮细胞的氧化损伤调节,另一个是血管内皮的稳态和重塑调节。
SIRT家族中SIRT1直接参与到内皮依赖性的血管舒张调节中,国内王琪琳和窦建民[38]和王义平和雷群英[39]对此都有总结。在剪应力状态下,SIRT1与一氧化氮合成酶的结合增强,使其脱乙酰化以激活内皮细胞合成NO的活性;SIRT1对血管功能的调控也可间接地通过诱导内皮细胞生长因子及其受体2、一氧化氮合酶的表达并改变HIF-2α(Hypoxia-inducible factors 2α)的乙酰化状态来实现[40-41]。免疫学分析表明,HIF-2a K741可以被CBP乙酰化,被SIRT1去乙酰。脱乙酰化的HIF-2a能使线粒体中锰超氧化物歧化酶2(manganese superoxide dismutase 2, SOD2) 的转录水平增加[41]。近几年的研究表明SOD2也是SIRT3的靶标,脱乙酰化的SOD2活性增加能更好地清除生物体内的氧自由基[42]。
SIRT1也参与调节心血管内皮稳态和重塑的多个基因的表达,其中部分基因的调控需要叉头转录因子(forkhead transcription factor, FoxO1) 来介导[43]。FoxO1作为心血管发育的负调节因子,其脱乙酰化在心血管生成中发挥关键作用,SIRT1与FoxO1结合并使其脱乙酰化以抑制其抗心血管生成活性[43];而MicroRNA-34a能诱导内皮细胞衰老,其主要是通过抑制SIRT1活性从而增强FoxO1乙酰化来阻止心血管生成[44]。这些发现揭示了SIRT1是心血管的内皮基因表达的关键调节剂,其异常将导致心血管疾病的发生。
4 展望本文阐述了几种重要的中间代谢酶的KAc位点及这些位点可逆KAc修饰对酶活性的影响,并列举了可逆KAc修饰是如何调控细胞代谢和对于几种高发病率疾病,如慢性肥胖、糖尿病和癌症等患者体内特定赖氨酸位点KAc水平的变化及SIRT家族如何维持心血管稳态。随着研究的深入,越来越多的乙酰化酶抑制剂和乙酰化酶激活剂被用于以上疾病的临床治疗。目前乙酰化酶抑制剂主要有四类,包括短链脂肪酸类(丁酸钠、丙戊酸)、氧肟酸类(TSA和SAHA)、环形四肽类(Trapoxin A、Apicidin和FR901128) 和苯甲酰胺类(CI994和MS-275) 等[45];乙酰化酶激活剂主要是一些能激活Sirtuins的小分子,包括多酚白藜芦醇(通过提高机体内NAD+水平激活SIRT1)、新型SRT1720(比多酚白藜芦醇更有效地刺激Sirtuins活性)、吡啶衍生物[恶唑(4, 5-b)吡啶]和新型DHP(1, 4-二氢吡啶)衍生物化合物等[46]。虽然针对乙酰化水平的异常引起的疾病有相关的研究,但是对核外蛋白质的乙酰化研究的时间较短,许多KAc位点可逆乙酰化调节酶以及乙酰化位点对酶活和酶分布的影响仍未知。因此需要我们不断地探索新路径来探明这一系列问题,最终为人类的健康服务。
| [1] |
Guan K L, Xiong Y. Regulation of intermediary metabolism by protein acetylation. Cell, 2011, 36(2): 108-116. |
| [2] |
Hirschey M, Shimazu T, Huang J Y, et al. SIRT3 Regulates mitochondrial protein acetylation and intermediary metabolism. Cold Spring Harbor Symposia on Quantitative Biology, 2011, 76(23): 267-277. |
| [3] |
Huang D, Li Z H, You D, et al. Lysine acetylproteome analysis suggests its roles in primary and secondary metabolism in Saccharopolyspora erythraea. Applied Microbiology and Biotechnology, 2015, 99(3): 1399-1413. DOI:10.1007/s00253-014-6144-2 |
| [4] |
Zhang K, Zheng S, Yang J S, et al. Comprehensive profiling of protein lysine acetylation in Escherichia coli. Journal of Proteome Research, 2013, 12(2): 844-851. DOI:10.1021/pr300912q |
| [5] |
Mo R, Yang M K, Chen Z, et al. Acetylome analysis reveals the involvement of lysine acetylation in photosynthesis and carbon metabolism in the model Cyanobacterium synechocystis sp. PCC 6803. Journal of Proteome Research, 2015, 14(2): 1275-1286. DOI:10.1021/pr501275a |
| [6] |
Jones J, O'Connor C. Protein acetylation in prokaryotes. Proteomics, 2011, 11(15): 3012-3022. DOI:10.1002/pmic.201000812 |
| [7] |
Xing S F, Poirier Y. The protein acetylome and the regulation of metabolism. Trends in Plant Science, 2012, 17(7): 423-430. DOI:10.1016/j.tplants.2012.03.008 |
| [8] |
Wagner G, Payne R. Widespread and enzyme-independent Nε-acetylation and Nε-succinylation of proteins in the chemical conditions of the mitochondrial matrix. Journal of Biological Chemistry, 2013, 288(40): 29036-29045. DOI:10.1074/jbc.M113.486753 |
| [9] |
Fan J, Shan C L, Kang H B, et al. Tyr Phosphorylation of PDP1 toggles recruitment between ACAT1 and SIRT3 to regulate the pyruvate dehydrogenase complex. Molecular Cell, 2014, 53(4): 534-548. DOI:10.1016/j.molcel.2013.12.026 |
| [10] |
Barak R, Prasad K, Shainskaya A, et al. Acetylation of the chemotaxis response regulator CheY by acetyl-CoA synthetase purified from Escherichia coli. Journal of Molecular Biology, 2004, 342(2): 383-401. DOI:10.1016/j.jmb.2004.07.020 |
| [11] |
Hu L, Lima B, Wolfe A. Bacterial protein acetylation:the dawning of a new age. Molecular Microbiology, 2010, 77(1): 15-21. DOI:10.1111/j.1365-2958.2010.07204.x |
| [12] |
Tu S, Guo S J, Chen C J, et al. YcgC represents a new protein deacetylase family in prokaryotes. Biochemistry, 2015, 4(e05322): 1-17. |
| [13] |
Hayden J, Brown L, Gunawardena H, et al. Reversible acetylation regulates acetate and propionate metabolism in Mycobacterium smegmatis. Microbiology, 2013, 159(9): 1986-1999. |
| [14] |
Bernal V, Castano-Cerezo S, Gallego-Jara J, et al. Regulation of bacteriral physiology by lysine acetylation of proteins. New Biotechnology, 2014, 31(6): 586-595. DOI:10.1016/j.nbt.2014.03.002 |
| [15] |
Wang Q Y, Zhang Y K, Yang C, et al. Acetylation of metabolic enzymes coordinates carbon source utilization and metabolic flux. Science, 2010, 327(5968): 1004-1007. DOI:10.1126/science.1179687 |
| [16] |
Hentchel K, Escalante-Semerena J. Acylation of biomolecules in prokaryotes:a widespread strategy for the control of biological function and metabolic stress. Microbiology and Molecular Biology Reviews, 2015, 3(79): 321-346. |
| [17] |
Bi J, Wang Y H, Yu H G, et al. Modulation of central carbon metabolism by acetylation of isocitrate lyase in Mycobacterium tuberculosis. Scientific Reports, 2016, 7(44826): 1-11. |
| [18] |
Ishigaki Y, Akanuma G, Minoru Y, et al. Protein acetylation involved in streptomycin biosynthesis in Streptomyces griseus. Journal of Proteomics, 2017, 155: 63-72. DOI:10.1016/j.jprot.2016.12.006 |
| [19] |
Zhao S, Xu W, Jiang W, et al. Regulation of cellular metabolism by protein lysine acetylation. Science, 2010, 327(5968): 1000-1004. DOI:10.1126/science.1179689 |
| [20] |
Jiang W, Wang S, Xiao M, et al. Acetylation regulates gluconeogenesis by promoting PEPCK1 degradation via recruiting the UBR5 ubiquitin ligase. Molecular Cell, 2011, 43(1): 33-44. DOI:10.1016/j.molcel.2011.04.028 |
| [21] |
Lv L, Li D, Zhao D, et al. Acetylation targets the M2 isoform of pyruvate kinase for degradation through chaperone-mediated autophagy and promotes tumor growth. Molecular Cell, 2011, 42(2): 719-730. |
| [22] |
Zhang T F, Wang S W, Lin Y, et al. Acetylation negatively regulates glycogen phosphorylase by recruiting protein phosphatase 1. Cell Metabolism, 2012, 15(1): 75-87. DOI:10.1016/j.cmet.2011.12.005 |
| [23] |
Hebert A, Dittenhafer-Reed K, Yu W, et al. Calorie restriction and SIRT3 trigger global reprogramming of the mitochondrial protein acetylome. Molecular Cell, 2013, 49(1): 186-199. DOI:10.1016/j.molcel.2012.10.024 |
| [24] |
Bharathi S, Zhang Y X, Mohsen A, et al. Sirtuin 3(SIRT3) protein regulates long-chain acyl-CoA dehydrogenase by deacetylating conserved lysines near the active site. Journal of Biological Chemistry, 2013, 288(47): 33837-33847. DOI:10.1074/jbc.M113.510354 |
| [25] |
Chen T S, Liu J N, Li N, et al. Mouse SIRT3 Attenuates hypertrophy related lipid accumulation in the heart through the deacetylation of LCAD. Plosone, 2015, 11(5): 1-18. |
| [26] |
Shimazu T, Hirschey M, Hua L, et al. SIRT3 Deacetylates mitochondrial 3-hydroxy-3-methylglutaryl CoA synthase 2 and regulates ketone body production. Cell Metabolism, 2010, 12(6): 654-661. DOI:10.1016/j.cmet.2010.11.003 |
| [27] |
Hölper S, Nolte H, Bober E, et al. Dissection of metabolic pathways in the Db/Db mouse model by integrative proteome and acetylome analysis. Molecular BioSystems, 2015, 11(3): 908-922. DOI:10.1039/C4MB00490F |
| [28] |
Matthew J R, John C N, Jason M H, et al. Label-free quantitative proteomics of the lysine acetylome in mitochondria identifies substrates of SIRT3 in metabolic pathways. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6601-6606. DOI:10.1073/pnas.1302961110 |
| [29] |
Takashi N, David J L, Marcia C H, et al. SIRT5 deacetylates carbamoyl phosphate synthetase 1 and regulates the urea cycle. Cell, 2009, 137(3): 560-570. DOI:10.1016/j.cell.2009.02.026 |
| [30] |
Yu W, Li nY, Yao J, et al. Lysine 88 acetylation negatively regulates ornithine carbamoyltransferase activity in response to nutrient signals. Journal of Biological Chemistry, 2009, 284(20): 13669-13675. DOI:10.1074/jbc.M901921200 |
| [31] |
Hallows W, Yu W, Smith B, et al. Sirt3 promotes the urea cycle and fatty acid oxidation during dietary restriction. Molecular Cell, 2011, 41(2): 139-149. DOI:10.1016/j.molcel.2011.01.002 |
| [32] |
Trevisson E, Salviati L, Baldoin M, et al. Argininosuccinate lyase deficiency:mutational spectrum in Italian patients and identification of a novel ASL pseudogene. Human Mutation, 2007, 28(7): 694-702. DOI:10.1002/humu.v28:7 |
| [33] |
Mlinar B, Marc J, Janez A, et al. Molecular mechanisms of insulin resistance and associated diseases. International Journal of Clinical Chemistry, 2007, 375(1-2): 20-35. |
| [34] |
Yu W, Dittenhafer-Reed K, Denu J. SIRT3 protein deacetylates isocitrate dehydrogenase 2(IDH2) and regulates mitochondrial redox status. Journal of Biological Chemistry, 2012, 287(17): 14078-14086. DOI:10.1074/jbc.M112.355206 |
| [35] |
Hu H L, Zhu W W, Qin J, et al. Acetylation of PGK1 promotes liver cancer cell proliferation and tumorigenesis. Hepatology, 2017, 65(2): 515-528. DOI:10.1002/hep.v65.2 |
| [36] |
Zhu Y M, Yan Y F, Principe D, et al. SIRT3 and SIRT4 are mitochondrial tumor suppressor proteins that connect mitochondrial metabolism and carcinogenesis. Cancer & Metabolism, 2014, 65(2): 15. |
| [37] |
Zhang M M, Pan Y D, Dorfman R, et al. Sirtinol promotes PEPCK1 degradation and inhibits gluconeogenesis by inhibiting deacetylase SIRT2. Scientific Reports, 2016, 7(7): 1-10. |
| [38] |
王琪琳, 窦建民. 赖氨酸乙酰化在代谢相关疾病中的调控机制. 生命的化学, 2013, 33(6): 678-683. Wang Q L, Dou J M. The regulatory mechanism of lysine acetylation in the metabolism-related diseases. Chemistry of Life, 2013, 33(6): 678-683. |
| [39] |
王义平, 雷群英. 乙酰化对代谢的调控及其在代谢相关疾病中的作用. 中国科学:生命科学, 2015, 45(11): 1083-1092. Wang Y P, Lei Q Y. Regulation of metabolism by lysine acetylation and its role in metabolic diseases. Scientia Sinica Vitate, 2015, 45(11): 1083-1092. |
| [40] |
Heather L C, Cole M A, Tan J J, et al. Metabolic adaptation to chronic hypoxia in cardiac mitochondria. Basic Research in Cardiology, 2012, 107(3): 268. DOI:10.1007/s00395-012-0268-2 |
| [41] |
Yoon H, Shin S H, Shin D H, et al. Differential roles of Sirt1 in HIF-1alpha and HIF-2alpha mediated hypoxic responses. Biochemical and Biophysical Research Communications, 2014, 444(1): 36-43. DOI:10.1016/j.bbrc.2014.01.001 |
| [42] |
Tao R, Coleman M C, Pennington J D, et al. Sirt3-mediated deacetylation of evolutionarily conserved lysine 122 regulates MnSOD activity in response to stress. Molecular Cell, 2010, 40(6): 893-904. DOI:10.1016/j.molcel.2010.12.013 |
| [43] |
Michael P, Laleh G, Danila B, et al. SIRT1 controls endothelial angiogenic functions during vascular growth. Genes Development, 2007, 21(20): 2644-2658. DOI:10.1101/gad.435107 |
| [44] |
Zhao T, Li J, Chen A F. MicroRNA-34a induces endothelial progenitor cell senescence and impedes its angiogenesis via suppressing silent information regulator 1. American Journal Physiology Endocrinology Metablism, 2010, 299(1): E110-E116. DOI:10.1152/ajpendo.00192.2010 |
| [45] |
吕斌娜, 梁文星. 蛋白质乙酰化修饰研究进展. 生物技术通报, 2015, 31(4): 166-174. Lv B N, Liang W X. Advances in protein acetylation modification. Biotechnology Bulletin, 2015, 31(4): 166-174. |
| [46] |
Jose M V, Francisco J A. Sirtuin activators and inhibitors. Biofactors, 2012, 38(5): 349-359. DOI:10.1002/biof.v38.5 |
 2017, Vol. 37
2017, Vol. 37



