文章信息
- 王曦, 陈熙明, 浦铜良.
- WANG Xi, CHEN Xi-ming, PU Tong-liang.
- 溶葡球菌酶高效表达与应用
- Progress on High Efficient Expression and Application of Lysostaphin
- 中国生物工程杂志, 2017, 37(9): 118-125
- China Biotechnology, 2017, 37(9): 118-125
- http://dx.doi.org/DOI:10.13523/j.cb.20170916
-
文章历史
- 收稿日期: 2017-03-27
- 修回日期: 2017-05-29
2. 中国科学院西北生态环境研究院 兰州 730000
2. Northwest Institute of Eco-Environment and Resources, Chinese Academy of Sciences, Lanzhou 730000, China
金黄色葡萄球菌是一种对人与动物健康构成严重威胁的病原微生物[1]。20世纪40年代,人们将青霉素投用于临床,治疗由金黄色葡萄球菌所引起的感染。但是,在1942年却发现金黄色葡萄球菌对青霉素产生了耐药性。为了进一步治疗由金黄色葡萄球菌所引起的感染,科学家后续研制出一种新的窄谱抗生素——甲氧西林。然而,在1960年即发现部分金黄色葡萄球菌对甲氧西林也产生了耐药性,将该株金黄色葡萄球菌分离并命名为MRSA(methicillin-resistant S. aureus)。近年来,以MRSA为代表的耐药菌在临床上日益盛行,给抗感染治疗带来巨大难题,因此急需寻找抗MRSA的新药物。
有学者发现,溶葡球菌酶对金黄色葡萄球菌有溶菌效果[2]。溶葡球菌酶是一种分子质量约为27 000Da的Zn2+依赖蛋白酶,等电点(pI)是9.5,最适pH为7.5,具有肽链内切酶活性,专一性地作用于细菌细胞壁肽聚糖的Gly五肽桥联[3],从而使细胞壁破裂,其溶菌活性不受细菌生长周期的影响,对任何细胞时期的金黄色葡萄球菌都有杀灭作用,而且不产生耐药性。研究发现[4-5],Gly五肽桥联大多存在于葡萄球菌细胞壁中,而金黄色葡萄球菌细胞壁中含量最多,因此,溶葡球菌酶对金黄色葡萄球菌(尤其是MRSA)具有很好的溶菌杀菌效果。
近年来,随着基因工程技术的迅速发展,溶葡球菌酶实现了在乳酸杆菌和大肠杆菌等表达系统中高效表达。异源表达的溶葡球菌酶在理化性质和酶活性等方面与天然溶葡球菌酶没有本质区别,相比天然溶葡球菌酶获得途径,异源表达更容易实现[6]。本文对溶葡球菌酶的来源、作用机制、不同表达系统及其应用进行了综述。
1 溶葡球菌酶20世纪60年代,Schlndler与Schuhardt[7]从一株模仿葡萄球菌(Staphylococcus simulans)培养物中发现并分离得到溶葡球菌酶。
2 溶葡球菌酶作用机制金黄色葡萄球菌是革兰氏阳性菌,肽聚糖是其细胞壁的重要组成部分,保持细胞形态,保护细胞不会渗透性涨破。如图 1所示,金黄色葡萄球菌肽聚糖是由N-乙酰葡糖胺与N-乙酰胞壁酸残基交替组成的,胞壁酸与四肽链(D-丙氨酸、D-谷氨酰胺、L-赖氨酸、D-丙氨酸)连接在一起,而四肽链和甘氨酸五肽桥通过单链赖氨酸残基的ε-氨基连接在一起,另一边由丙氨酸羧基连接。如图 2所示,溶葡球菌酶首先合成以493个氨基酸构成的前酶原,其由N端36个氨基酸构成的前导肽指导进入分泌途径,分泌至胞外。前酶原的N端有15个由13个氨基酸构成的重复序列,这些重复序列使溶葡球菌酶前酶源的活性比成熟溶葡球菌酶的活性低70%。这些重复序列经分泌的半胱氨酸蛋白酶降解之后形成有活性的溶葡球菌酶。成熟的溶葡球菌酶分子由两部分组成:N端蛋白酶区域(PD),具有蛋白酶催化活性;C端细胞壁靶向区域(CWT),CWT引导溶葡球菌酶结合到金葡菌表面的受体上,作用于金黄色葡萄球菌细胞壁肽聚糖交联结构中的Gly五肽桥联,从而使细胞裂解,达到破壁溶菌的效果[8]。
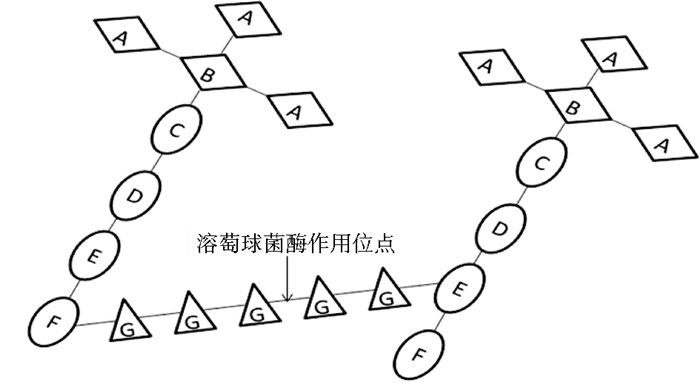
|
| 图 1 金黄色葡萄球菌肽聚糖结构和溶葡球菌酶水解位点 Figure 1 Staphylococcus aureus peptidoglycan structure and hydrolysis site of lysostaphin A:N-acetylglucosamine; B:Nacetylmuramicacid; C:L-alanine; D:D-glutamine; E:L-lysine; F:D-alanine; G:L-glycine |

|
| 图 2 成熟溶葡球菌酶形成过程 Figure 2 Formative process of mature lysostaphin |
外源基因表达系统中,应用最早的是原核表达系统。原核表达系统是研究的比较成熟的表达系统, 主要采用基因克隆技术通过构建表达载体将外源目的基因导入宿主菌的方法,使目的基因在宿主菌中表达出目的产物,其优点在于易于培养操作、繁殖周期短、成本低、基因背景与表达特性清楚。因此,可作为外源基因表达的首选系统[9]。近年来,采用基因工程技术手段构建溶葡球菌酶高产菌株已成为溶葡球菌酶研究的重要态势。目前,溶葡球菌酶基因已实现在大肠杆菌和乳酸杆菌中成功表达(表 1)。
| 表达系统 | 种类 | 载体 | 产量 |
| 原核表达系统 | 大肠杆菌(E.coliJM83) | pET296(+) | - |
| 大肠杆菌(E.coli JM83) | TOP10F | - | |
| 大肠杆菌(E.coli BL21) | pET23 | 20mg/L | |
| 大肠杆菌(E.coli BL21) | pET28a | 22mg/L | |
| 大肠杆菌(E.coli BL21) | pET32a | 30mg/L | |
| 乳酸杆菌(NZ3900) | NICE | 300mg/L | |
| 真核表达系统 | 毕赤酵母(GS115) | pPIC9 | 500mg/L |
| 山羊乳腺细胞 | Ad-dl327 | 10μg/ml | |
| HeLa细胞 | pcDNA3.1 | - | |
| 转基因小鼠乳腺细胞 | pcDNA3 | 1.3mg/ml | |
| 奶牛乳腺细胞 | - | 14mg/ml |
3.1.1 溶葡球菌酶基因在大肠杆菌中表达
早期实现溶葡球菌酶异源表达是通过大肠杆菌表达系统实现的。Chan等[10]与Szweda等[11]将来自葡萄球菌的一段溶葡球菌酶基因导入大肠杆菌质粒中进行异源表达。Chan将1.5kb大小的溶葡球菌酶基因插入表达载体pET296(+),采用电击法将质粒pLY202转化进大肠杆菌(E.coli JM83),通过筛选获得阳性克隆,对其进行摇瓶培养。结果表明:溶葡球菌酶在大肠杆菌中表达的酶活是11 500U/L(活性单位:金黄色葡萄球菌悬浊液10min内A620减少一半,定义为一个活性单位)。Szweda等再次将溶葡球菌酶基因导入大肠杆菌质粒(TOP10F)中,经发酵表达溶葡球菌酶,其活性(约为26 667U/L)相对前者有所提高。针对溶葡球菌酶的产量,很多专家学者为其付出了巨大努力。Szweda等[12]与Zhang等[13]分别构建获得新质粒pET23Lys和pET28a-lys (pET-lys)。质粒pET23Lys与pET28a-lys分别转化大肠杆菌E. coli BL21(DE3) 与E. coli BL21 (λDE3),于LB培养基中培养,用终浓度为0.1mmol/L的IPTG(异丙基硫代-β-D-半乳糖苷)诱导,最终将发酵液上清纯化,分别获得约20mg/L与22mg/L的溶葡球菌酶,二者产物表达量差异并不大。为了进一步能在产量上有所突破,Farhangnia等[14]将溶葡球菌酶基因克隆入表达载体pET32a,构建得到新质粒pET32a-lys (pET-lys),转化大肠杆菌BL21 (DE3),对其采用IPTG诱导表达并纯化,得到30mg/L溶葡球菌酶。虽然在不断地优化大肠杆菌表达系统,使溶葡球菌酶的活性增强,产量有所提升,但是,利用大肠杆菌表达系统进行大规模生产还存在诸多问题有待解决。例如, 采用大肠杆菌表达的外源蛋白,大部分属于胞内表达,增加了蛋白质纯化的难度;目的产物的表达量较低;表达菌株的不稳定性;表达蛋白质错误折叠;等等。所以此项技术还有待进一步提高。
3.1.2 溶葡球菌酶基因在乳酸杆菌中表达相对大肠杆菌而言,乳酸杆菌是原核表达系统中应用较多的另一类表达系统。其中大肠表达系统表达的蛋白质大部分属于胞内表达,使下游纯化工作变的尤为困难。而乳酸杆菌新陈代谢途径简单清楚,基因背景已知,因此可作为首选的异源表达系统[15]。Mierau等[16]将溶葡球菌酶基因导入由乳酸链球菌素控制的基因表达载体-NICE(pNZ8148),构建得到新质粒(pNZ1709),在构建过程中由于氯霉素抗性基因与lacF基因发生交换,对此命名为pNZ1710,用其转化乳酸杆菌NZ3900(pNZ1710),用10ng/ml的乳酸链球菌素进行诱导表达,发现溶葡球菌酶在细胞质中表达量为100mg/L。同年Mierau等[17]用同样的方法将溶葡球菌酶基因在乳酸杆菌中表达,通过调节发酵条件(pH、温度、乳酸链球菌素的添加量),使溶葡球菌酶产量由100mg/L上升到300mg/L。尽管原核表达相关技术目前已非常成熟,能够在较短的时间内得到目的产物,但是,仍然存在很多难以克服的困难。例如,溶葡球菌酶很多以包涵体的形式出现, 即宿主菌表达的目的蛋白在胞内相互聚集形成低活性的固体颗粒,属于细胞内不溶性表达,致使产物纯化难度增大;另外,原核表达系统翻译后加工修饰功能不够完善。例如,表达的目的蛋白,部分肽链在折叠过程中出现特异性错误聚合,致使形成完全解链或者未成熟的蛋白质,致使目的产物活性较低。
3.2 真核表达系统相较于原核表达系统,真核表达系统的翻译后修饰功能更加完善。例如,mRNA在经过核糖体与内质网后形成的蛋白质不具活性,在一系列的加工后(二硫键的形成、糖基化、信号序列的加工等),表达的外源蛋白更接近原始天然蛋白质。目前,在基因工程研究中最常用的真核表达系统主要有酵母菌和哺乳动物细胞,溶葡球菌酶基因已实现在毕赤酵母、山羊乳腺细胞、HeLa细胞、转基因小鼠乳腺细胞、奶牛乳腺细胞中成功表达(表 1)。所以,采用真核表达系统表达目的蛋白越来越受到人们的重视[18]。
3.2.1 溶葡球菌酶基因在毕赤酵母中表达毕赤酵母(Pichia pastoris)是近年来高效表达外源蛋白使用较多的宿主菌,有超过1 000种外源蛋白已实现成功表达。毕赤酵母表达系统具备较完善的表达调控机制及对表达产物具有修饰功能,表达过程中不会产生内毒素,有利于蛋白质表达。因此,毕赤酵母也是目前应用最多、最广泛的表达系统之一,具有良好的应用前景[19-20]。Zhao等[21]将溶葡球菌酶基因克隆入毕赤酵母表达载体(pPIC9),电转化毕赤酵母菌株(GS115),后期采用甲醇诱导表达,通过摇瓶培养获得80mg/L的溶葡球菌酶。之后为了评估毕赤酵母对溶葡球菌酶中试产品生产的潜能,将毕赤酵母作为宿主,对溶葡球菌酶基因及序列做了相关优化,通过2L发酵培养,得到500mg/L溶葡球菌酶。这个产量是目前溶葡球菌酶在毕赤酵母菌中表达得到的最高产量。Schotte等[22]研究发现,毕赤酵母甲醇利用快型菌株的甲硫氨酸残基发生O-甲基L-高丝氨酸错配,降低了氧和甲醇的需求量,能够进一步提高重组蛋白的表达水平。目前,毕赤酵母在发酵过程中仍存在的问题是:需高溶氧,高甲醇,甲醇易燃有安全隐患,同时发酵周期较长等。总体而言,相较于原核表达系统,毕赤酵母表达系统表达的溶葡球菌酶表达水平大幅提高。
3.2.2 溶葡球菌酶基因在山羊乳腺细胞中表达将溶葡球菌酶基因导入山羊乳腺细胞中,乳腺细胞分泌的溶葡球菌酶对山羊乳房炎有治疗效果。Fan等[23]将含有溶葡球菌酶基因的腺病毒载体导入处于非哺乳期的山羊右乳房,同时将含有大肠杆菌lacZ基因的腺病毒导入同一山羊的左乳房作为对照,发现山羊的右乳腺分泌物中有10μg/ml的溶葡球菌酶产生,说明分泌的溶葡球菌酶对山羊的乳房炎起到了一定的治疗作用,但是山羊乳腺中溶葡球菌酶的表达量很低,同时免疫系统对表达载体及溶葡球菌酶有免疫反应,致使治疗效果不理想。Huang等[24]针对山羊乳腺细胞中表达的溶葡球菌酶生物活性比较低做了进一步研究。通过对溶葡球菌酶基因进行点突变,结果发现溶葡球菌酶N端第125位天冬酰胺(Asn)糖基化导致溶葡球菌酶的酶活较低,此项研究提高了山羊乳腺细胞分泌的溶葡球菌酶活性。目前而言,形成一种能够避免对治疗蛋白本身做出免疫响应的方法仍具有很大的挑战性。
3.2.3 溶葡球菌酶在HeLa细胞中表达目前,溶葡球菌酶在HeLa细胞中表达鲜有报道。Klein等[25]在溶葡球菌酶C端加上His标签,作为筛选标记。将溶葡球菌酶基因插入哺乳动物表达载体(pcDNA3.1) 中,构建得到组成型表达载体(pcDNA-lys),用pcDNA-lys转化HeLa细胞,48h后用免疫印迹法检测到HeLa细胞中有溶葡球菌酶积累。用HeLa细胞做固体金黄色葡萄球菌抑菌实验,发现有较大抑菌圈出现。首先,说明表达的溶葡球菌酶有活性;其次,说明溶葡球菌酶在HeLa细胞中以两种方式表达,即胞内表达和胞外分泌表达。综上所述,利用HeLa细胞表达溶葡球菌酶,在产量上可能有很大突破,这主要取决于HeLa细胞的自身特性。例如,细胞株自身不会衰老死亡,可无限分裂繁殖,并且增殖速率异常快,所以利用HeLa细胞表达溶葡球菌酶未来有很大的发展前景。
3.2.4 溶葡球菌酶基因在转基因小鼠乳腺细胞中表达Kerr等[26]将成熟的溶葡球菌酶基因导入真核表达载体(pcDNA3) 获得新质粒(pCMV-Lys),同时将人生长激素(hGH)编码序列作为信号肽插入质粒(pCMV-Lys)中,构建得到质粒(pSec-Lys),将其导入转基因小鼠乳腺细胞中,发现在小鼠乳腺细胞中有溶葡球菌酶表达,但此酶无活性。为了恢复溶葡球菌酶的活性,对溶葡球菌酶基因做了进一步改造,将125位与232位的天冬酰胺(Asn)转换成谷氨酰胺(Gln),得到改造载体(Sec-Gln125, 232-Lys),将其导入转基因小鼠乳腺细胞,最终在小鼠乳汁中获得1.3mg/ml的溶葡球菌酶,发现表达的溶葡球菌酶对转基因小鼠的乳房炎具有治疗作用。溶葡球菌酶基因在转基因小鼠乳腺细胞中成功表达,为未来溶葡球菌酶作为一种兽药应用奠定了基础。
3.2.5 溶葡球菌酶基因在奶牛乳腺细胞中表达由金黄色葡萄球菌引起的奶牛乳腺炎已占到奶牛乳房疾病的30%,抗生素治疗率低于15%,事实证明其治疗难度较大。奶牛乳腺炎是奶牛较常见的疾病,对奶牛业生产构成极大的威胁。此种疾病会使奶牛乳房发炎肿胀,产奶量大幅下降。Wall等[27]将溶葡球菌酶基因导入奶牛乳腺细胞中,使乳腺细胞分泌表达溶葡球菌酶,使溶葡球菌酶分泌于牛奶中,结果表明,牛奶中溶葡球菌酶的量达到了0.9~14mg/ml,而牛奶中溶葡球菌酶的量只需3mg/ml就可治愈由金黄色葡萄球菌引起的奶牛乳腺炎。此方法对奶牛乳腺炎的治疗相比抗生素治疗效果更持久、更安全,不会出现耐药性。所以,此项研究为未来奶牛乳腺炎的治疗具有指导作用。
4 溶葡球菌酶应用本文将溶葡球菌酶应用分为三部分:兽药应用、临床应用和其他应用(表 2)。
| 类型 | 实例 |
| 兽药应用 | 治疗小鼠乳腺炎 |
| 治疗奶牛子宫内膜炎 | |
| 治疗奶牛乳房炎 | |
| 临床应用 | 治疗人皮肤烧伤创面MRSA感染 |
| 治疗人鼻腔金黄色葡萄球菌感染 | |
| 其他应用 | 抗流感病毒 |
| 治疗小鼠血液MRSA感染 | |
| 治疗人血清MRSA感染 |
4.1 兽药应用 4.1.1 治疗小鼠乳腺炎
利凯等[28]研究了溶葡球菌酶对小鼠乳腺炎的治疗效果, 发现溶葡球菌酶能有效减少金黄色葡萄球菌感染,采取乳头灌注的方式给药,实验结果显示,溶葡萄球菌酶能有效降低金黄色葡萄球菌感染, 减少组织损伤, 消除炎症,对革兰氏阳性菌引起的小鼠乳腺炎治疗效果明显。但是有学者研究表明,将溶葡萄球菌酶与部分裂解酶、阳离子抗菌肽和抗生素协同作用能更有效治疗小鼠乳房炎。例如,Schmelcher等[29]分别用溶葡球菌酶和噬菌体K细胞内溶素作用于患病小鼠乳腺,溶葡球菌酶和噬菌体K细胞内溶素对金葡菌CFU分别仅降低了0.63、0.81个对数单位。但是将二者结合起来作用于患病区,降低的金黄色葡萄球菌CFU是溶葡球菌酶与噬菌体K细胞内溶素分别作用的5.3倍与4.1倍。说明溶葡球菌酶和噬菌体K细胞内溶素协同作用治疗金黄色葡萄球菌引起的小鼠乳腺炎疗效更佳。因此,将溶葡萄球菌酶与部分裂解酶、阳离子抗菌肽和抗生素联合使用治疗小鼠乳腺炎会有更好的疗效。
4.1.2 治疗奶牛子宫内膜炎奶牛子宫内膜炎主要是生产或产后初期由病原菌引起的子宫内膜感染所形成的繁殖性障碍疾病,发病率较高,经常造成奶牛屡配不孕、长期不孕致使淘汰,对奶牛生产造成严重影响。张继恩等[30]采取奶牛子宫内灌注给药的方法研究溶葡萄球菌酶对奶牛子宫内膜炎的疗效。结果显示,溶葡球菌酶对奶牛子宫内膜炎具有很好的疗效。袁怀兵[31]采用和张继恩同样的给药方式,治疗奶牛急慢性子宫内膜炎,结果表明其疗效比抗生素治疗提高了13%,说明溶葡球菌酶治疗奶牛子宫内膜炎疗效显著,且明显优于抗生素治疗。关于溶葡球菌酶在治疗奶牛子宫内膜炎的同时是否存在溶葡球菌酶在奶牛体内和在牛奶中有残留,以及是否影响牛奶质量等相关问题,陆锦春等[32]做了相关研究。作者采用子宫灌注的方式,给健康与患病的奶牛注入不同浓度的溶葡萄球菌酶后,在血液和牛奶中没有发现溶葡球菌酶积累,说明溶葡球菌酶在治疗奶牛子宫内膜炎的同时,对奶牛健康和奶质是安全的。
4.1.3 治疗奶牛乳房炎奶牛乳房炎是直接导致奶牛产奶量急剧下降的关键因素之一,牛奶质量下降,会导致奶牛过早淘汰,对奶牛业造成巨大损失。抗生素治疗乳房炎效果不理想,并且容易导致耐药菌出现及抗生素残留。目前我国正处于奶牛业快速发展时期,相关技术和设施不够完善,因此,乳房炎造成的损失十分严重,阻碍了我国奶牛业的发展。所以,研发一种安全有效的防治奶牛乳房炎的新药物(溶葡球菌酶)非常必要。蒋司嘉等[33]采用重组溶葡萄球菌酶三个剂量,采用乳池灌注给药的方式作用于患有乳房炎的乳区,对奶牛乳房炎治愈率分别为75.0%、83.3%、91.7%,说明溶葡球菌对奶牛乳房炎的疗效十分显著。关文怡等[34]就溶葡球菌酶对奶牛隐性乳房炎的治疗做了相关研究,结果显示,溶葡球菌酶对奶牛隐性乳房炎的治疗是安全有效的。Hoernig等[35]研究发现,单一溶葡球菌酶治疗奶牛隐性乳房炎的疗效比复合溶葡球菌酶的疗效好。溶葡球菌酶在治疗奶牛乳房炎的过程中,能够解决传统抗生素治疗过程中出现的耐药性和牛奶中高残留问题,有利于提高牛奶的产量及品质,降低奶牛乳房炎对养殖产业造成的损失。
4.2 临床应用 4.2.1 对人皮肤烧伤创面MRSA感染治疗MRSA自发现以来,其感染范围不断扩大,现已成为重要的致病菌之一[36]。在烧伤创面感染中,创面一经发现感染,便会出现化脓、溃烂,其中MRSA感染占较大比例,极大地增加了治疗难度。杨雄等[37]对67位的烧伤创面用复合溶葡球菌酶制剂进行处理,结果发现患者烧伤创面感染均得到有效控制。聂学等[38]对32例感染MRSA的烧伤患者采用复合溶葡球菌酶治疗,持续一个疗程后,大部分创面愈合,表明复合溶葡球菌酶能有效治疗烧伤后期MRSA感染,而且对患者无免疫反应。烧伤创面MRSA感染一直以来是临床治疗的一大难题,溶葡球菌酶弥补了抗生素治疗的缺陷,为患者治疗带来了福音。
4.2.2 对人鼻腔携带金黄色葡萄球菌感染治疗有报道显示,溶葡球菌酶对人鼻腔携带的金黄色葡萄球菌有清除效果。20世纪70年代Quickel等[39]采用溶葡球菌酶喷鼻剂局部治疗鼻腔金黄色葡萄球菌感染,分别在治疗第5天与第11天对治疗区域与对照区域进行活菌计数,结果发现溶葡球菌酶的治愈率达到了91%,由此可见,溶葡萄球菌酶治疗鼻腔金黄色葡萄球菌感染效果良好。
4.3 其他应用施强等[40]采用以溶葡球菌酶与溶菌酶为主要成分的溶葡球菌复合酶对体外抗流感病毒做了相关研究。发现溶葡球菌复合酶对抗流感病毒疗效明显,表明其可作为一种有效的抗流感药物。Kokaikun等[41]对血液与器官感染MRSA的小鼠采用静脉注射的方式将溶葡球菌酶作用于患病小鼠,发现溶葡球菌酶可清除小鼠血液与器官中感染的MRSA。同时,将溶葡球菌酶与青霉素或万古霉素组合,能够进一步提高对MRSA的治疗效果。Oluola等[42]研究发现,溶葡球菌酶对刚出生的感染MRSA的小鼠具有明显的治疗作用。此外,Desbois等[43]研究发现,溶葡球菌酶与抗菌肽钙联蛋白协同作用对人血清中感染的MRSA具有清除作用。因此,可以预见溶葡球菌酶会有更好的应用潜力。
5 前景与展望近年来,由于抗生素的大量使用,多种耐药菌的出现使许多疾病的治疗难度增大。以MRSA为例,治疗由MRSA引起的各种感染极为困难。溶葡球菌酶对MRSA有很好的治疗作用,并且不产生耐药性,在动物体内无残留,对正常组织无刺激、无致突变性,安全有效。因此,对溶葡球菌酶的研究备受人们的关注,使其成为研究的新热点。随着基因工程技术的迅速发展,通过不同表达系统将溶葡球菌酶基因进行外源表达,此项技术将在医药以及工业生产中变的尤为重要。目前,溶葡球菌酶只完成Ⅰ和Ⅱ期临床试验,以现在的研究水平,要实现溶葡球菌酶产业化,还有很长的路要走。随着现代科学技术的迅速发展,可以预见,溶葡球菌酶具有广阔的应用前景。
致谢 感谢我的导师浦铜良老师和中国科学院西北生态环境研究院陈熙明老师的悉心指导和帮助。| [1] |
Szweda P, SchielmannM, Kotlowski R, et al. Peptidoglycan hydrolases-potential weapons against Staphylococcus aureus. Appl Microbiol Biotechnol, 2012, 96(5): 1157-1174. DOI:10.1007/s00253-012-4484-3 |
| [2] |
Wu J A, Kusuma C, Mond J J, et al. Lysostaphin disrupts Staphylococcus aureus and Staphylococcusepidermidis biofilms on artificial surfaces. Antimicrobial Agents and Chemotherapy, 2003, 47(11): 3407-3414. DOI:10.1128/AAC.47.11.3407-3414.2003 |
| [3] |
Schmelcher M, Donovan D M, Loessner M J. Bacteriophage endolysins as novelantimicrobials. Future Microbiol, 2012, 7(10): 1147-1171. DOI:10.2217/fmb.12.97 |
| [4] |
Michael W C, Kerstin E, Gordon L A. Mechanism and suppression of lysostaphin resistance in oxacillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother, 2001, 45(5): 1431-1437. DOI:10.1128/AAC.45.5.1431-1437.2001 |
| [5] |
王永, 刘沐荣, 万海同, 等. 聚乙二醇修饰重组溶葡球菌酶的初步研究. 中国生物工程杂志, 2013, 33(6): 12-17. Wang Y, Liu M R, Wan H T, et al. Chemical modification of lysostaphin with activated polyethlene glycol. China Biotechnology, 2013, 33(6): 12-17. |
| [6] |
García-Cano I, Campos-Gómez M, Contreras-Cruz M, et al. Expression, purification, and characterization of a bifunctional 99-kDa peptidoglycan hydrolase from Pediococcus acidilactici ATCC 8042. Appl Microbiol Biotechnol, 2015, 99(20): 8563-8573. DOI:10.1007/s00253-015-6593-2 |
| [7] |
Schindler C A, Schuhardt V T. Lysostaphin:A new bacteriolytic agent for the staphylococcus. Proc Natl Acad Sci USA, 1964, 51(3): 414-421. DOI:10.1073/pnas.51.3.414 |
| [8] |
Freire Bastos M C, Coutinho B G, Coelho M L, et al. Lysostaphin:A staphylococcal bacteriolysin with potential clinical applications. Pharmaceuticals, 2010, 3(4): 1139-1161. DOI:10.3390/ph3041139 |
| [9] |
郭广君, 吕素芳, 王荣富. 外源基因表达系统的研究进展. 科学技术与工程, 2006, 6(5): 1671-1678. Guo G J, Lu S F, Wang R F. Progress on the expression system of heterologous gene. Science Technology and Engineering, 2006, 6(5): 1671-1678. |
| [10] |
Chan E C. Expression and purification of recombinant lysostaphin in Escherichia coil. Biotechnology Lettters, 1996, 18(17): 833-838. |
| [11] |
Szweda P, Gorczyca G, Filipkowski P, et al. Eficient production of Staphylococcus simulans lysostaphin in benchtop bioreactor by recombinant Escherichia coli. Preparative Biochemistry and Biotechnology, 2014, 44(4): 370-381. DOI:10.1080/10826068.2013.829499 |
| [12] |
Szweda P, Kotłowski R, Kur J. Neweffective sources of the Staphylococcus simulans lysostaphin. Journal of Biotechnology, 2005, 117(2): 203-213. DOI:10.1016/j.jbiotec.2005.01.012 |
| [13] |
Zhang B W, Tao S G, Ma H M, et al. Lysis of mastitis pathogens isolated from dairy cow milk samples by purified recombinant lysostaphin. African Journal of Biotechnology, 2012, 11(20): 4649-4659. |
| [14] |
Farhangnia L, Ghaznavi-Rad E, Mollaee N, et al. Cloning, expression, and purification of recombinant lysostaphin from Staphylococcus simulans. Jundishapur J Microbiol, 2014, 7(5): e10009. |
| [15] |
Morello E, Bermúdez-Humarán L G, Llull D, et al. Lactococcus lactis, an efficient cell factory for recombinant protein productionand secretion. Journal of Molecular Microbiology Biotechnology, 2008, 14(1-3): 48-58. |
| [16] |
Mierau I, Leij P, Swam I V, et al. Industrial-scale production and purification of a heterologous protein in Lactococcus lactis using the nisin-controlled gene expression system NICE:The case of lysostaphin. Microbial Cell Factories, 2005, 4(1): 1-9. DOI:10.1186/1475-2859-4-1 |
| [17] |
Mierau I, Olieman K, Mond J, et al. Optimization of the Lactococcus lactis nisin-controlled gene expression system NICE for industrial applications. Microbial Cell Factories, 2005, 4(1): 1-12. DOI:10.1186/1475-2859-4-1 |
| [18] |
Müller D, Bayer K, Mattanovich D. Potentials and limitations of prokaryotic and eukaryotic expression systems for recombinant protein production-a comparative view. Microbial Cell Factories, 2006, 61(1): 260-262. |
| [19] |
刘晓明, 姜宁, 张爱忠, 等. 杂合抗菌肽在毕赤酵母中的表达及其活性测定. 中国生物工程杂志, 2016, 36(2): 81-89. Liu X M, Jiang N, Zhang Z A, et al. Expression of hybird antibacterial peptides in Pichia yeast and identification of its biological activity. China Biotechnology, 2016, 36(2): 81-89. |
| [20] |
傅小蒙, 孔令聪, 裴志, 等. 毕赤酵母表达系统优化策略概述. 中国生物工程杂志, 2015, 35(10): 86-90. Fu X M, Kong L C, Pei Z, et al. Advance in the research of antimicrobial peptides gene expression in Pichia pastor. China Biotechnology, 2015, 35(10): 86-90. |
| [21] |
Zhao H L, Blazanovic K, Choi Y, et al. Gene and protein sequence optimization for high-level production of fully active and aglycosylated lysostaphin in Pichia pastoris. Applied and Environmental Microbiology, 2014, 80(9): 2746-2753. DOI:10.1128/AEM.03914-13 |
| [22] |
Schotte P, Dewerte I, Groeve M D, et al. Pichia pastoris MutS strains are prone to misincorporation of O-methyl-l-homoserine at methionine residues when methanol is used as the sole carbon source. Microbial Cell Factories, 2016, 15(1): 1-9. DOI:10.1186/s12934-015-0402-6 |
| [23] |
Fan W, Plaut K, Bramley A J, et al. Persistency of adenoviral-mediated lysostaphin expression in goat mammary glands. American Dairy Science Association, 2004, 87(3): 602-608. DOI:10.3168/jds.S0022-0302(04)73202-6 |
| [24] |
Huang C Y, Hsu J T, Chung P H, et al. Site-specific N-glycosylation of caprine lysostaphin restricts its bacteriolytic activity toward Staphylococcus aureus. Animal Biotechnology, 2013, 24(2): 129-147. DOI:10.1080/10495398.2012.760469 |
| [25] |
Klein M, Krönke M, Krut O. Expression of lysostaphin in HeLa cells protects from host cell killing by intracellular Staphylococcus aureus. Medical Microbiology and Immunology, 2006, 195(3): 159-163. DOI:10.1007/s00430-006-0014-1 |
| [26] |
Kerr D E, Plaut K, Bramley A J, et al. Lysostaphin expression in mammary glands confers protection against staphylococcal infection in transgenic mice. Nature Biotechnology, 2001, 19(1): 66-70. DOI:10.1038/83540 |
| [27] |
Wall R J, Powell A M, Paape M J, et al. Genetically enhanced cows resist intramammary Staphylococcus aureus infection. Nature Biotechnology, 2005, 23(4): 445-451. DOI:10.1038/nbt1078 |
| [28] |
利凯, 马利芹, 徐彤, 等. 重组溶葡萄球菌酶对金葡菌诱导实验性小鼠乳腺炎的防治研究//京津冀畜牧兽医科技创新交流会暨新思想、新观点、新方法论坛论文集, 京津冀畜牧兽医科技创新交流会暨新思想、新观点、新方法论坛, 保定, 2008, 北京: 中国畜牧兽医学会, 2008: 2519-2522. Li K, Ma L Q, Xu T, et al. The Study of Recombinant Lysostaphin on the Prevention and Treatment of Experimental Mastitis in Mice Induced by Staphylococcus aureus//Proceedings of Beijing, Tianjin and Hebei Animal Husbandry and Veterinary Science and Technology Innovation Exchange Cum Collection of New Ideas, New Ideas, New Methods Forum and Symposium. Proceedings of Beijing, Tianjin and Hebei Animal Husbandry and Veterinary Science and Technology Innovation Exchange Cum Collection of New Ideas, New Ideas, New Methods Forum.Hebei Baoding, 2008, Beijing:Chinese Association of Animal Science and Veterinary Medicine, 2008:2519-2522. |
| [29] |
Schmelcher M, Powell A M, Becker S C, et al. Chimeric phage lysins act synergistically with lysostaphin to kill mastitis-causing staphylococcusaureus in murine mammary glands. Applied and Environmental Microbiology, 2012, 78(7): 2297-2305. DOI:10.1128/AEM.07050-11 |
| [30] |
张继恩, 吴聪明, 孙永学, 等. 重组溶葡萄球菌酶对奶牛子宫内膜炎的疗效研究//首届中国兽药大会暨中国畜牧兽医学会动物药品学分会2008年学术年会论文集, 首届中国兽药大会暨中国畜牧兽医学会动物药品学分会2008年学术年会, 天津, 2008, 北京: 中国畜牧兽医学会, 2008: 17-23. Zhang J E, Wu C M, Sun Y X, et al.The Study of Recombinant Lysostaphin on Treatment Trial of Endometritis in Dairy Cattle//Proceedings of the First Chinese Veterinary Drug Assembly Animal and Drug Eessays Proceedings of the 2008 Annual Conference of Animal and Veterinary Medicine of China Animal and Veterinary Society, Proceedings of the First Chinese Veterinary Drug Assembly Animal and Drug Eessays Proceedings of the 2008 Annual Conference of Animal and Veterinary Medicine of China Animal and Veterinary Society, Tianjin, 2008, Beijing:Chinese Association of Animal Science and Veterinary Medicine, 2008, 17-23. |
| [31] |
袁怀兵. 重组溶葡萄球菌酶对奶牛子宫内膜炎的疗效研究. 当代畜禽养殖业, 2013, 12(19): 6-7. Yuan H B. The study of recombinant lysostaphin on treatment trial of endometritis in dairy cattle. Modern Animal Husbandry, 2013, 12(19): 6-7. |
| [32] |
陆锦春, 陈华鹏, 马怀彦, 等. 重组溶葡萄球菌酶在患子宫内膜炎奶牛体内的药代动力学与残留研究. 疾病防治, 2012, 122(2): 40-44. Lu J C, Chen H P, Ma H Y, et al. Pharmacokinetics and residue of recombinant lysostaphin in dairy cows with endometritis. Disease Prevention, 2012, 122(2): 40-44. |
| [33] |
蒋司嘉, 张继恩, 吴聪明, 等. 重组溶葡萄球菌酶对奶牛乳房炎的疗效研究. 中国兽药杂志, 2011, 45(12): 23-28. Jiang S J, Zhang J E, Wu C M, et al. Therapeutic efficacy of recombinant lysostaphin on bovine mastitis. China Journal of Veterinary Medicine, 2011, 45(12): 23-28. DOI:10.3969/j.issn.1002-1280.2011.12.009 |
| [34] |
关文怡, 李桂伶, 郭海龙. 重组溶葡萄球菌酶对奶牛隐性乳房炎的治疗试验. 山东畜牧兽医, 2014, 18(9): 13-14. Guan W Y, Li J L, Guo H L. Effect of recombinant lysostaphin on subclinical mastitis in dairy cows. Shangdong Journal of Animal Science and Veterinary Medicine, 2014, 18(9): 13-14. |
| [35] |
Hoernig K J, Donovan D M, Pithua P, et al. Evaluation of a lysostaphin-fusion protein as a dry-cow therapy for Staphylococcus aureus mastitis in dairy cattle. American Dairy Science Association, 2016, 99(6): 4638-4646. DOI:10.3168/jds.2015-10783 |
| [36] |
Orlin I, Rokney A, Onn A, et al. Hospital clones of methicillin-resistant Staphylococcus aureus are carried by medical students even before healthcare exposure. Antimicrobial Resistance & Infection Control, 2017, 6(1): 15. |
| [37] |
杨雄, 刘凤彬, 刘洋. 溶葡萄球菌酶对控制烧伤创面MRSA感染的临床观察. 中国实用医药, 2010, 5(18): 95-96. Yang X, Liu F B, Liu Y. Clinical observation of lysostaphin treatment of burn wounds MRSA infection. China Practical Medicine, 2010, 5(18): 95-96. DOI:10.3969/j.issn.1673-7555.2010.18.060 |
| [38] |
聂学, 李文生, 杨文元. 复合溶葡萄球菌酶治疗烧伤后期感染创面的疗效观察. 中国实用医药, 2011, 6(3): 157-158. Nie X, Li W S, Yang W Y. Curative effect of compound Lysostaphin cures burn wound infection in the late stage. China Practical Medicine, 2011, 6(3): 157-158. |
| [39] |
Quickel J R, Selden R, Caldwell J R, et al. Efficacy and safety of topical lysostaphin treatment of persistent nasal carriage of Staphylococcus aureus. Applied Microbiology, 1971, 22(3): 446. |
| [40] |
施强, 居丽雯, 朱献忠, 等. 溶葡萄球菌复合酶体外抗流感病毒效果研究. 中国卫生检验杂志, 2006, 16(12): 1439-1442. Shi Q, Ju LW, Zhu X Z, et al. Effect of compound lysostaphin on influenza virus in vitro. Chinese Journal of Health Laboratory Technology, 2006, 16(12): 1439-1442. DOI:10.3969/j.issn.1004-8685.2006.12.013 |
| [41] |
Kokaikun J F. Lysostaphin as a treatment for systemic Staphylococcus aureus infection in a mouse model. Journal of Antimicrobial Chemotherapy, 2007, 60(5): 1051-1059. DOI:10.1093/jac/dkm347 |
| [42] |
Oluola O, Kong L, Fein M, et al. Lysostaphin in treatment of neonatal Staphylococcus aureus infection. Antimicrobial Agents & Chemotherapy, 2007, 51(6): 2198-2200. |
| [43] |
Desbois A P, Gemmell C G, Coote P J. In vivo efficacy of the antimicrobial peptide ranalexin in combination with the endopeptidase lysostaphin against wound and systemic meticillin-resistant Staphylococcus aureus (MRSA) infections. International Journal of Antimicrobial Agents, 2010, 35(6): 559-565. DOI:10.1016/j.ijantimicag.2010.01.016 |
 2017, Vol. 37
2017, Vol. 37




