文章信息
- 胡可越, 程宁辉, 王新泉.
- HU Ke-yue, CHENG Ning-hui, WANG Xin-quan.
- 人类Grx3蛋白与转录因子p65相互作用的研究
- The Interaction Study Between Human Grx3 Protein and Transcription Factor p65
- 中国生物工程杂志, 2017, 37(9): 1-6
- China Biotechnology, 2017, 37(9): 1-6
- http://dx.doi.org/DOI:10.13523/j.cb.20170901
-
文章历史
- 收稿日期: 2017-03-03
- 修回日期: 2017-07-09
谷氧还蛋白(glutaredoxin,Grx)是巯基氧化还原酶家族的重要成员之一,目前已经被证实其广泛地存在于各种生物体内。谷氧还蛋白是以一种依靠谷胱甘肽(GSH)来将蛋白质上二硫键还原成巯基的一种酶蛋白[1-2]。
在谷氧还蛋白系统中电子依次从Grx蛋白传递到谷胱甘肽(GSH),再传递给谷胱甘肽还原酶,最终传递到NADPH。而Grx最终会在核苷酸还原酶等其他一些酶的作用下,打开二硫键,重新恢复其还原性[3]。
Grx蛋白最早被发现时是一种核糖核苷酸还原酶的受体。目前已有的研究表明,Grx蛋白可以与细胞凋亡的信号调控激酶1(apoptosis signal-regulating kinase 1,ASK1) 相连,Grx与ASK1相连之后可以抑制ASK1的生理活性,而当Grx1被氧化之后,ASK1与Grx1不再结合,ASK1被释放出来进而启动了细胞凋亡程序[4]。Grx还可以通过NF-κB途径,与NF-κB结合,来抑制多巴胺介导的细胞凋亡。总而言之,Grx在信号通路中的作用,大多都是抵抗细胞凋亡和氧化应激[4]。由此可见,Grx系统对细胞维持自身的还原环境有着重要的作用。而氧化还原力对蛋白质、脂类及核酸的修饰有着重要的影响,因此Grx在很大程度上操纵着细胞的生命状态, 并且与人体多种疾病相关[5-7]。
通过体外的蛋白质偶联实验我们可以确定两个蛋白质能够在体外相互结合,为这两个蛋白质在体内存在相互联系提供强有力的佐证。另外已有的研究表明,Grx3蛋白对NF-κB信号通路的活性有十分显著的影响[4]。通过研究体外环境下Grx3和p65存在相互作用,我们希望为Grx3如何介入人体的NF-κB信号通路提出一个合理的猜想。
1 材料与方法 1.1 材料与仪器Grx3与p65的基因均从生物合成公司购买。大肠杆菌表达载体pGEX-6p-1为购买的商品化载体,具体如图 1所示。E. coli DH5α与BL21 (DE3) 为实验室保存菌株。大肠杆菌超声破碎采用Sonic的超声波细胞破碎仪,PreScission Protease酶为实验室自制的用于切割GST-tag与GSH偶联位点的酶,Resourse Q离子层析柱、Superdex-200 10/300分子筛、AKTA快速液相色谱仪(FPLC)均购买自GE Healthcare公司。
|
| 图 1 pGEX-6p-1大肠杆菌表达载体 Figure 1 pGEX-6p-1 E. coli vector |
所需构建的克隆为pGEX-6p-1-p65(p65 3-305截短体)及pGEX-6p-1-Grx3。
首先对目的基因进行PCR扩增,引物由生物合成公司进行制备,目的基因完成扩增后和载体采用以下50μl酶切反应体系进行酶切:
NEB酶切buffer4 5μl
EcoRI-HF 1μl
BamHI-HF 1μl
DNA底物 2μl
灭菌双蒸水 41μl
PCR产物与载体在37℃进行酶切反应3~5h,酶切反应结束后利用试剂盒对酶切产物进行回收。将酶切后的目的片段与载体通过T4连接酶进行连接,采用以下20μl连接反应体系进行连接:
酶切后的PCR片段 10μl
酶切后载体 2μl
T4DNA liagase 1μl
10×连接缓冲液 2μl
灭菌双蒸水 5μl
反应在室温下进行3~5h,将所获的产物使用DH5α感受态进行转化,挑取适量的单菌落接种于已经加入含100μg/ml的Amp 5ml LB培养基的BD管中培养8~12h,利用试剂盒提取质粒进行相应酶切的鉴定,选取定结果为阳性的克隆进行测序,获得目的克隆。
1.3 目的蛋白表达在BL21感受态细胞中加入2~3μl含目的蛋白基因的质粒,在冰上冰浴40min左右,42℃热激90s后再放回冰上孵育5min,再往感受态细胞中加入400μl LB培养基(无菌操作),在37℃下缓慢摇晃复苏培养40min,晾干,等待复苏培育结束之后进行涂板操作。最后放入37℃烘箱,避光培养10~14h。
将表达质粒转化入BL21(DE3) 感受态细胞中,选取单菌落加入到含100μg/ml Amp 50ml LB培养基的锥形瓶中培养8~10h,待瓶子菌液足够浑浊之后,取10ml菌液加入到到含1%Amp的1L LB培养基的大瓶中,将大瓶放入37℃摇床,220r/min扩大培养3~5h,待瓶中的大肠杆菌达到平衡期之后,将大瓶降温至16℃左右,每瓶加入500μl 1mol/L IPTG进行诱导,之后再将大瓶放回到摇床,在16℃、220r/min的条件下过夜培养。
次日用1L的收集菌液专用离心桶取出菌液,在8℃、4 000r/min的转速下离心。弃掉上清,加入HBS缓冲液将大瓶底部的菌体重悬,超声破碎之后,将菌液在13 000g的转速下离心1.5h,分离上清和沉淀。
1.4 目的蛋白纯化 1.4.1 亲和层析柱纯化在使用亲和层析柱纯化蛋白质之前需要用GST柱上样缓冲液来平衡亲和柱,破碎细胞离心后得到的蛋白质上清液,让上清液两次通过层析柱,使带有GST标签的目的蛋白与GST琼脂糖凝胶充分结合,最后用GST清洗缓冲溶液清洗亲和柱上非特异结合的杂蛋白约20个柱体积。完成层析过程之后,加入适量PreScission Protease酶和GST酶切缓冲溶液,酶切8~12h,次日收集含有目的蛋白的缓冲溶液。
1.4.2 离子层析柱纯化蛋白质缓冲液在经过浓缩之后注入Resourse Q离子层析柱,通过不同的盐梯度对柱上的蛋白质溶液进行洗脱,完成蛋白质的初步纯化[8]。
1.4.3 分子筛凝胶层析纯化Superdex200分子筛购自GE Healthcare公司,蛋白质缓冲液在经过浓缩之后注入Superdex200分子筛,通过不同分子质量的蛋白质析出时间的差异,完成蛋白质的二次纯化。
1.4.4 蛋白质偶联在通过各种不同的方法分离纯化得到所需要的目的蛋白之后,需要在特定的缓冲溶液(200mmol/L NaCl,50mmol/L Tris-Cl pH8.0,0.025mmol/L CuCl2)中进行蛋白质偶联实验,需要将两个目的蛋白进行稀释,并将物质的量浓度调至1:1。
完成蛋白质的稀释过程之后,两种蛋白质各取1ml,再加入80μl 1mol/L DTT,在冰上冰浴30~60min,保证蛋白质处于一种还原状态。再将冰浴过的蛋白质加入到已经消毒灭菌过的透析袋中,用夹子夹紧防止蛋白质泄漏,将整个透析袋放入到含有2L缓冲溶液的大烧杯中,将烧杯放在磁力搅拌器上搅拌48h。两天之后回收蛋白质溶液。
2 结果分析 2.1 p65的分析纯化结果我们将破碎大肠杆菌获得的p65蛋白依次通过亲和层析柱纯化、离子层析柱纯化和分子筛凝胶层析纯化过后获得了较纯的p65蛋白,其分子质量约为35kDa,具体如图 2所示,将所获的蛋白质置于4℃冰箱保存用于进行下一步实验。
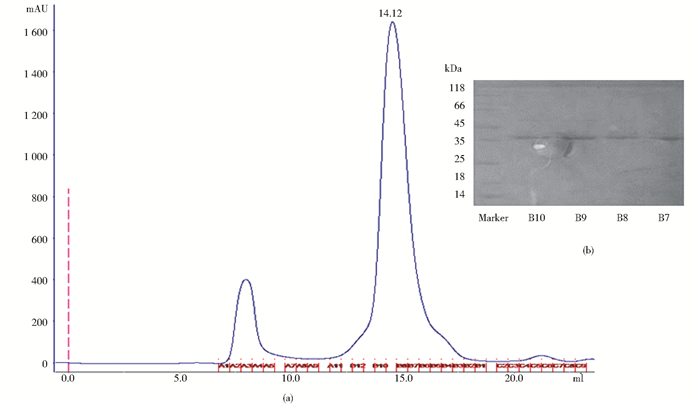
|
| 图 2 p65分子筛层析图(a)及SDS-PAGE分析结果(b) Figure 2 Size-exclusion chromatography (SEC) (a) and SDS-PAGE (b) in the final step purification of p65 The horizental axis represents the volume (ml) and the vertical axis represents the absorbance at 280 nm(mAU). There are two distinct peaks in the SEC, and p65 belongs to the last one with peak positionat 14.12ml. The corresponding B10~B7 fractions and protein marker are tested by SDS-PAGE stained by coomassie brilliant blue |
我们将破碎大肠杆菌获得的Grx3蛋白依次通过亲和层析柱纯化、离子层析柱纯化和分子筛凝胶层析纯化过后获得了较纯的Grx3蛋白,其分子质量同样约为35kDa,纯化所获得的Grx3蛋白条带位置相对p65较为靠上,其分子质量也较大,具体如图 3所示。将所获的蛋白质置于4℃冰箱保存用于进行下一步实验。
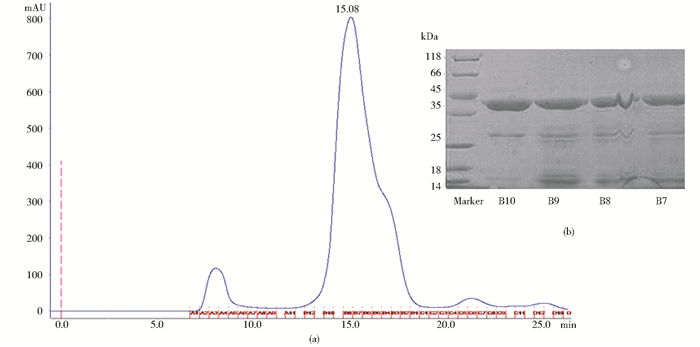
|
| 图 3 Grx3分子筛层析图(a)及SDS-PAGE分析结果(b) Figure 3 Size-exclusion chromatography (SEC) (a) and SDS-PAGE (b) in the final step purification of p65 The horizental axis represents the volume (ml) and the vertical axis represents the absorbance at 280nm (mAU). There are three distinct peaks in the SEC, and Grx3 belongs to the middle one with peak position at 15.08ml. The corresponding B10~B7 fractions and protein marker are tested by SDS-PAGE stained by coomassie brilliant blue |
图 3中在蛋白质主条带的下方,25kDa靠上处存在一条明显的条带,实际上蛋白纯化过程中的脱落的GST标签,其在分子筛层析图上对应最后一个较为明显的峰,由于其和Grx3析出处的主峰分子质量接近,导致仅能观察到后面半个峰。因此在进行SDS-PAGE分析时也会观察到这些条带。而14~18kDa附近的条带则为蛋白质降解产生的杂带,实际上蛋白质随着时间的推移降解会变得越发明显,因此纯化获得的Grx3蛋白需要尽快投入下一步实验中。
2.3 蛋白质偶联结果分析回收经过48h偶联实验的透析袋,将其中的样品取出,制备SDS-PAGE样品,进行跑胶,回收结果如图 4所示。
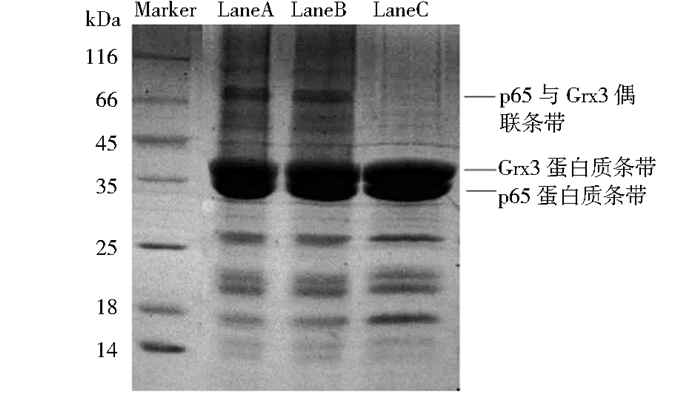
|
| 图 4 偶联实验SDS-PAGE分析结果 Figure 4 SDS-PAGE result of crosslinking experienment LaneA, LaneB and LaneC are protein samples from crosslinking experienment, we use non-reduced loading buffer without 5mmol/L DDT in LaneA and LaneB, in Lane C we use reduced loading buffer with 5mmol/L DDT |
从上述SDS-PAGE分析结果可以看到,经过48h偶联反应之后,LaneA和LaneB在66kDa以上位置有一条明显的蛋白质条带,其相对分子质量符合p65与Grx3蛋白1:1结合的相对分子质量大小,并且在下方同样可以看到明显的p65与Grx3蛋白对应的条带。值得一提的是,在图 4中p65条带之所以显示在35kDa蛋白标记下方是因为,p65的浓度相对较高,导致较长的拖尾现象,其实际大小如图 3b所示,是超过35kDa的。根据实验结果我们发现在LaneC条带上明显观察到偶联条带不复存在,说明两个蛋白质在还原性环境下解除了偶联。
3 讨论相对于研究比较完善的硫氧还蛋白系统,当前对于谷氧还蛋白系统的研究相对略显单薄,而Grx3作为谷氧还蛋白系统的重要一员,对其的研究在同类研究中也略为滞后。本文所研究的Grx3蛋白最先是由Witte等[4]在利用酵母双杂交技术筛选与PKC-theta (protein kinase C-theta)的有可能相关作用的一个蛋白质时被发现的,并且后续的研究证实Grx3蛋白可以通过NF-κB信号通路,抑制多巴胺介导的细胞凋亡过程,同时Grx3作为一种巯基氧化还原酶对机体的炎症反应和维持自身的还原性均有着重要的作用。但是之前的相关研究,没有具体指出Grx3介入NF-κB信号通路的机制。
本文在进行实验研究时首先建立了合理的实验猜想,p65在之前广泛的实验研究中已经被证实对NF-κB信号通路下游反应具有重要的调控作用,本文在研究过程中大胆假设了Grx3通过与p65的相互作用介入了NF-κB信号通路并进行了后续的研究。
首先我们通过一系列的纯化步骤,获取了相对较纯的p65和Grx3蛋白,相对较纯的两种蛋白质的提取是进行一下步偶联实验的基础。之后我们通过偶联实验(图 4)观察到了p65蛋白和Grx3蛋白在氧化性条件下,在70kDa附近位置多出了一条偶联条带,此条带的相对分子质量大小恰好符合p65与Grx3蛋白1:1结合的相对分子质量的大小。而使用还原型上样缓冲溶液的样品的SDS-PAGE分析结果指出,在还原性条件下两个蛋白质不能形成偶联,因此我们可以结合Grx3作为一种巯基氧化还原酶的特性,猜想其极大可能在氧化性条件下通过二硫键与p65结合,因此其在还原性条件下二硫键被打开而使得两者不再结合。
目前通过研究得到了Grx3与p65在体外能够相互结合的结论,并且两者有极大可能是通过二硫键进行结合的。在全长Grx3蛋白上仅有5个半胱氨酸残基,未来可以通过单点突变和多点突变的方式进一步确定这两者是否以二硫键的方式结合到一起,甚至能够以此确认两个蛋白质的结合位点。此次体外偶联实验发现了Grx3与p65在体外能够相互结合的事实,基于这样的事实可以为Grx3对NF-κB信号通路的影响提出一个可能的解释,即Grx3蛋白可能通过调控p65来达到影响NF-κB信号通路的效果。综上所述,本次实验研究成果对Grx3的功能与结构的进一步研究找到了一个新的方向,也为Grx3蛋白在人体信号通路中所处的位置提供了一定的依据。
| [1] |
Haunhorst P, Berndt C, Eitner S, et al. Characterization of the human monothiol glutaredoxin 3(PICOT) as iron-sulfur protein. Biochemical & Biophysical Research Communications, 2010, 394(2): 372-376. |
| [2] |
Martin J L. Thioredoxin——a fold for all reasons. Structure, 1995, 3(3): 245-250. DOI:10.1016/S0969-2126(01)00154-X |
| [3] |
Fernandes A P, Holmgren A. Glutaredoxins:glutathione-dependent redox enzymes with functions far beyond a simple thioredoxin backup system. Antioxidants & Redox Signaling, 2004, 6(6): 63-74. |
| [4] |
Witte S, Villalba M, Bi K, et al. Inhibition of the c-Jun N-terminal kinase/AP-1 and NF-kappaB pathways by PICOT, a novel protein kinase C-interacting protein with a thioredoxin homology domain. Journal of Biological Chemistry, 2000, 275(3): 1902-1909. DOI:10.1074/jbc.275.3.1902 |
| [5] |
Häberlein I, Würfel M, Follmann H. Non-redox protein interactions in the thioredoxin activation of chloroplast enzymes. BiochimicaEtBiophysicaActa, 1992, 1121(3): 293-296. |
| [6] |
Bandyopadhyay S, Gama F, Molina-Navarro M M, et al. Chloroplast monothiol glutaredoxins as scaffold proteins for the assembly and delivery of [2Fe-2S] clusters. Embo Journal, 2008, 27(7): 1122-1133. DOI:10.1038/emboj.2008.50 |
| [7] |
Li H, Mapolelo D T, Dingra N N, et al. The yeast iron regulatory proteins Grx3/4 and Fra2 form heterodimeric complexes containing a [2Fe-2S] cluster with cysteinyl and histidyl ligation. Biochemistry, 2009, 48(40): 9569-9581. DOI:10.1021/bi901182w |
| [8] |
郭云萍, 孙璐, 张立剑, 等. 无标签重组人硫氧还蛋白的大规模表达、纯化及活性检测. 中国生物工程杂志, 2012, 32(8): 62-67. Guo Y P, Sun L, Zhang L J, et al. Expression, purification and characterization of non-taged recombinant human thioredoxin. China Biotechnology, 2012, 32(8): 62-67. |
 2017, Vol. 37
2017, Vol. 37




