文章信息
- 贺霖伟, 刘璋敏, 冯雁, 崔莉.
- HE Lin-wei, LIU Zhang-min, FENG Yan, CUI Li.
- 谷氨酸依赖型氨基转移酶的高通量筛选方法及其应用
- High Throughput Screening Method and Application for L-glutamate Specific Aminotransferase
- 中国生物工程杂志, 2017, 37(8): 59-65
- China Biotechnology, 2017, 37(8): 59-65
- http://dx.doi.org/DOI:10.13523/j.cb.20170809
-
文章历史
- 收稿日期: 2017-02-08
- 修回日期: 2017-04-12
氨基转移酶(aminotransferase, EC 2.6.1.X)作为生物催化剂有高立体选择性、高区域选择性和高底物特异性等诸多优势[1],尤其是以谷氨酸依赖型氨基转移酶,在工业上常用于催化合成重要的药物中间体。Yoshikane等[2]以谷氨酸依赖型氨基转移酶PPAT生产预防和治疗糖尿病的药物吡哆胺,提高了生产效率;Cho等[3]利用嗜热L-氨基酸氨基转移酶,以L-谷氨酸为氨基供体合成抗高血压药物高苯丙氨酸,降低了生产成本。然而,天然酶在催化活性及底物选择性等方面还不尽理想[4],应用蛋白质工程技术提升对非天然底物的催化能力,将扩展其在工业生产中的应用范围。
利用定向进化或半理性分子设计所建立的大容量突变库,为获得催化性能提升的突变体奠定了基础[5]。然而常规针对氨基转移酶产物的HPLC等检测手段通量有限,极大地限制了获得突变体的效率。基于紫外/荧光等光学检测方法具有操作简便、筛选通量高等优势,得到了研究者的关注[6]。根据转氨反应中氨基供体或氨基受体的不同特点[7],已开发了基于氨基供体邻二甲苯二胺[8]、对硝基苯乙胺[9],或基于氨基受体丙酮酸[10]的高通量筛选方法。而针对谷氨酸依赖型氨基转移酶的高通量筛选方法目前尚未见报道。
谷氨酸依赖型氨基转移酶的氨基供体为L-谷氨酸,在氨基转移酶作用下脱氨形成α-酮戊二酸;而L-谷氨酸脱氢酶以α-酮戊二酸为底物,消耗NADH生成NAD+,使340 nm处的吸光值下降。在本研究中,我们依据氨基转移酶目标反应偶联L-谷氨酸脱氢酶信号指示反应,能消耗NADH引起340 nm处吸光值变化的性质(图 1),建立和优化了双酶偶联的氨基转移酶高通量筛选方法,并将其应用于大肠杆菌氨基转移酶WecE的分子改造,为探索谷氨酸依赖型氨基转移酶的分子进化奠定了基础。
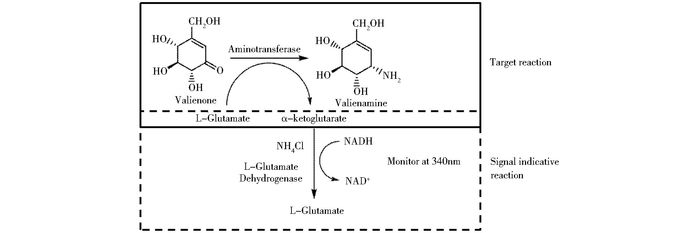
|
| 图 1 谷氨酸依赖型氨基转移酶-谷氨酸脱氢酶偶联反应 Figure 1 L-glutamate specific aminotransferase-L-glutamate dehydrogenase coupling reaction |
大肠杆菌E.coli BL21(DE3)、质粒pET28a(+)购自Novagen公司;包含大肠杆菌氨基转移酶wecE基因的质粒pET28a(+)-wecE和WecE Tyr 321突变库由本实验室保存。
1.1.2 培养基1L自动诱导培养基中含10 g胰蛋白胨、5 g酵母粉、6 ml甘油、0.5 g葡萄糖、2 g乳糖、9.0 g Na2HPO4·12H2O、3.4 g KH2PO4、2.675 g NH4Cl、0.71 g NaSO4和0.24 g MgSO4。
1.1.3 试剂与仪器L-谷氨酸脱氢酶(L-GDH)和邻苯二甲醛(OPA)购自Sigma公司;还原型辅酶I二钠(NADH)和磷酸吡哆醛(PLP)购自阿拉丁公司;井冈霉烯酮由药明康德公司合成;PrimeStar Max DNA聚合酶和DnaseⅠ购自TaKaRa公司;限制性内切酶DpnⅠ购自Thermo Fisher公司;PCR产物纯化试剂盒购自上海捷瑞公司。其他均为国产分析纯试剂。
多功能酶标仪(Molecular Device),微生物菌落自动筛选系统(Molecular Device),96孔板振荡培养箱(Taitec),PCR仪(Eppendorf),高速冷冻离心机(Hitachi),高效液相色谱系统(Agilent)。
1.2 谷氨酸依赖型氨基转移酶-谷氨酸脱氢酶偶联高通量筛选方法的建立 1.2.1 信号指示反应体系辅因子NADH浓度与L-谷氨酸脱氢酶浓度的确定取100 μl终浓度为0.2 mmol/L、0.4 mmol/L和0.8 mmol/L的NADH溶液(50 mmol/L PBS,pH 7.5),在96孔板中测定340 nm处吸光值,确定NADH最佳指示浓度。
在100 μl底物溶液中(0.4 mmol/L NADH、2.5 mmol/L NH4Cl、50 μmol/L α-酮戊二酸、50 mmol/L PBS,pH 7.5) 分别加入0.2 U/ml、0.5 U/ml和1U/ml L-谷氨酸脱氢酶,于25℃测定340 nm处吸光值在5 min内的变化,确定信号指示酶的浓度。
1.2.2 α-酮戊二酸检测限的确定在100 μl反应体系中(0.5 U/ml L-谷氨酸脱氢酶、0.4 mmol/L NADH、2.5 mmol/L NH4Cl、50 mmol/L PBS,pH 7.5) 分别加入20 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L和500 μmol/L α-酮戊二酸。于25℃测定340 nm处吸光值在5 min内的变化。
1.2.3 L-谷氨酸脱氢酶偶联高通量筛选方法背景干扰的测定将带有wecE基因的重组菌接入微孔板A-D行,将不含wecE基因的空白菌接入微孔板E-H行。参照1.3.2和1.2.4中的方法进行微孔板培养和活力检测,比较重组菌和空白菌偶联反应速率差异,测定筛选方法应用于WecE分子改造时的背景干扰。
1.2.4 L-谷氨酸脱氢酶偶联筛选方法在96孔浅孔板中进行转氨反应,50 μl反应体系中含0.5 mmol/L井冈霉烯酮、0.1 mmol/L磷酸吡哆醛、20 mmol/L L-谷氨酸和35 μl粗酶液,37℃培养箱中反应1 h。加入L-谷氨酸脱氢酶进行检测,100 μl反应体系中含0.5 U/ml L-谷氨酸脱氢酶、0.4 mmol/L NADH、2.5 mmol/L NH4Cl和50 μl转氨反应液,在酶标仪上检测5 min内340 nm处吸光值的变化。
1.3 大肠杆菌氨基转移酶WecE的分子改造 1.3.1 大肠杆菌氨基转移酶WecE定点饱和突变库的构建以pET28a(+)-wecE质粒为模板,在Tyr 321位点设计简并引物(Y321-F: GGTGTTTCATNNKATTCCGCTGC, Y321-R: GCAGCGGAATMNNATGAAACACC,下划线为改变的密码子,N代表A/T/C/G,K代表G/T,M代表A/C),全质粒PCR构建定点饱和突变库,将扩增得到的片段经DpnⅠ处理除去模板质粒后转化大肠杆菌E.coli BL21(DE3)。
1.3.2 微孔板培养和菌体破碎将突变体单菌落接种于96孔浅孔板(200 μl LB培养基/孔,卡那霉素终浓度50 μg/ml),37℃,400 r/min培养12 h。转接50 μl过夜培养的菌液至96孔深孔板(1 ml自动诱导培养基/孔,卡那霉素终浓度50 μg/ml),37℃,400 r/min培养4 h后,于25℃诱导表达20 h。4 000 r/min,4℃离心30 min收菌,将深孔板储存于-80℃冰箱备用。浅孔板中加入50 μl 60%甘油,置于-80℃冰箱作为母板保存。
采用溶菌酶法破碎菌体。将深孔板在-80℃冰箱中放置2 h,室温放置1 h,重复以上操作两次。每孔加入70 μl溶菌缓冲液(0.5 mg/ml溶菌酶、0.7 U/ml DnaseI、50 mmol/L PBS,pH 7.5) 重悬菌体,并转移至新的96孔浅孔板,于37℃培养箱中放置90 min,使菌体充分破碎。4 000 r/min,4℃离心30 min,小心吸取35 μl上清酶液至新的96孔浅孔板,参照1.2.4方法测定突变体活力。
1.4 突变体表达纯化和酶学性质表征 1.4.1 突变体表达纯化将培养12 h的突变体种子液按照1%的接种量转接至装有250 ml LB培养基(卡那霉素终浓度50 μg/ml)的摇瓶中。37℃,220 r/min培养至OD600约0.6~0.8,加入终浓度为0.5 mmol/L IPTG,于25℃,220 r/min诱导表达8 h。6 000 r/min,4℃离心15 min收菌。Ni-NTA亲和层析纯化目的蛋白,考马斯亮蓝法测定蛋白浓度。
1.4.2 突变体催化活力验证采用50 μl含5 mmol/L井冈霉烯酮、0.1 mmol/L磷酸吡哆醛、20 mmol/L L-谷氨酸和6 mg/ml酶液的催化体系。37℃水浴反应1 h,加入50 μl甲醇终止反应,采用浓度为0.15 mol/L邻苯二甲醛(OPA)柱前在线衍生化方法进行检测[11],验证突变体催化活力。
2 结果与讨论 2.1 谷氨酸依赖型氨基转移酶-谷氨酸脱氢酶偶联高通量筛选方法的建立 2.1.1 信号指示反应体系辅因子NADH浓度与L-谷氨酸脱氢酶浓度的确定不同NADH起始浓度和L-谷氨酸脱氢酶偶联浓度,是光学信号检测的影响因素,优化NADH起始浓度和L-谷氨酸脱氢酶偶联浓度,可以提高筛选的准确性,降低干扰。当NADH浓度为0.2mmol/L、0.4 mmol/L和0.8 mmol/L时,对应的吸光值为0.4、0.7和1.1(图 2a)。根据朗伯比尔定律,吸光值在0.2~0.8范围内误差较小,因此我们选择0.4 mmol/L NADH进行L-谷氨酸脱氢酶偶联检测。

|
| 图 2 影响谷氨酸依赖型氨基转移酶-谷氨酸脱氢酶偶联检测体系的各因素 Figure 2 Factors that affect L-glutamate specific aminotransferase-L-glutamate dehydrogenase coupling detection system (a) Absorbance at 340 nm of NADH under different initial concentration (b) The reaction rate of L-glutamate dehydrogenase under different enzyme loading ●:0.2 U/ml, ■:0.5 U/ml and ▲:1 U/ml (c) Limit of detection of L-glutamate dehydrogenase by double reciprocal plot (d) The timeline curve of target transamination reaction |
我们比较了不同浓度条件下L-谷氨酸脱氢酶对反应速率的影响(图 2b)。在0.2U/ml、0.5U/ml和1U/ml L-谷氨酸脱氢酶催化下,反应速率分别为6.3 mAbs/min、15.2 mAbs/min和28.6 mAbs/min。0.2 U/ml L-谷氨酸脱氢酶催化条件下,反应速率过慢,易受NADH自分解和菌体蛋白消耗等背景干扰的影响;而1 U/ml催化条件下,过快的反应速率将影响96孔板筛选时的平行性;因此我们选择背景干扰小,样品平行性好的0.5 U/ml L-谷氨酸脱氢酶进行高通量筛选。
2.1.2 α-酮戊二酸检测限的确定α-酮戊二酸的检测限决定了其在谷氨酸依赖型氨基转移酶高通量筛选的应用范围。由图 2c可知,在底物浓度为20 μmol/L~500 μmol/L时,v-1与[S]-1呈良好的线性关系。L-谷氨酸脱氢酶最低可以检测20 μmol/L α-酮戊二酸,本方法灵敏度高,可以用于原始催化活力较低的氨基转移酶的筛选。
2.1.3 目标转氨反应时间的确定对于活力相对较低的氨基转移酶,产物α-酮戊二酸的生成速度较慢,需要先将转氨反应产物浓度积累至偶联信号的检测阈值。微孔板培养条件下,WecE的表达量为0.5 mg/ml。利用2.1.2中L-谷氨酸脱氢酶反应速率与α-酮戊二酸浓度的拟合方程,测定了0.5 mg/ml WecE的转氨反应时间进程(0.5 h、1 h和2 h)。图 2d结果表明,在转氨反应30 min时产物α-酮戊二酸的含量为22 μmol/L,1 h为47 μmol/L,说明反应1 h内,α-酮戊二酸的增加量与反应时间呈线性关系,转氨反应保持一定的速率进行。转氨反应进行1 h产物α-酮戊二酸的浓度达到高通量筛选方法的检测限,选择1 h作为后续高通量筛选过程中的目标转氨反应时间。
2.1.4 微孔板筛选背景干扰为了考察菌体蛋白和内源α-酮戊二酸对谷氨酸依赖型氨基转移酶-谷氨酸脱氢酶偶联高通量筛选的影响,我们比较了重组菌与空白菌对应的L-谷氨酸脱氢酶反应速率差异。含有wecE基因的重组菌所对应的L-谷氨酸脱氢酶反应速率为15.6 mAbs/min,而不含wecE基因的空白菌对应的反应速率为5.8 mAbs/min,因此重组菌对应的反应速率是空白菌的三倍,空白对照干扰较小,WecE催化转氨反应生成的α-酮戊二酸是筛选方法中光学信号的首要因素。利用L-谷氨酸脱氢酶偶联筛选方法可以有效地识别催化活性提高的突变体产生α-酮戊二酸水平的变化,达到高通量筛选的目的。
2.2 氨基转移酶突变库的建立与筛选WecE催化的天然底物为TDP-4-羰基-6-脱氧-D-葡萄糖,其晶体结构[12]中Loop 9(Val318-Ile322) 形成了天然底物核苷结合口袋,是影响其底物识别的关键区域。其中321位的酪氨酸与外醛亚胺过渡态中磷酸吡哆醛C5的羟基形成氢键相互作用,是影响催化活力的关键氨基酸残基。我们选取Tyr 321构建定点饱和突变库,应用L-谷氨酸脱氢酶偶联高通量筛选方法对大肠杆菌糖氨基转移酶WecE进行分子改造。
以Y321-F和Y321-R为上下游引物,pET28a(+)-wecE质粒为模板,全质粒PCR扩增构建定点饱和突变库。电泳结果如图 3a所示,在6 000 bp左右位置有清晰的目的条带,大小与预测一致。为了使筛选过程中有95%的几率覆盖所有20种氨基酸[13],我们在定点饱和突变库中挑取180个单克隆至96孔板中进行培养。
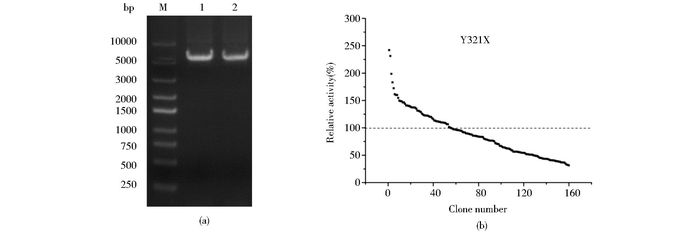
|
| 图 3 Tyr 321饱和突变库的构建与筛选 Figure 3 The construction and screening of Tyr 321 site-directed saturation mutagenesis (a) PCR products of site-directed saturation mutagenesis in Tyr 321 M: 10 kb DNA Marker; Lane 1-2: PCR products (b) The screening result in Tyr 321 site-directed saturation mutagenesis |
为了检测突变对酶活性的影响,我们以微孔板中野生型WecE对应的L-谷氨酸脱氢酶反应速率为催化活力参照,设置为100%,探究Y321X突变对于催化活性的影响(图 3b)。Y321X饱和突变库中,有10%突变体的催化活力是野生型的1.5倍,是潜在的优良突变体;50%突变体的催化活力基本没有改变;40%突变体的催化活力出现了明显的下降,这表明Tyr 321位点突变后对酶活力有着较为显著的影响,在WecE催化转氨反应的过程中发挥了重要作用。
我们将微孔板中野生型对应的L-谷氨酸脱氢酶反应速率的1.5倍作为筛选阈值,找到所有催化活性提高的突变体,富集到新的微孔板中再次进行筛选。结果显示Y321X饱和突变库中发现了一个活性提高的突变体。经测序分析为Y321F。
2.4 突变体催化活力表征为了比较突变体Y321F与野生型催化活性的差异,我们在500 ml摇瓶中对突变体和野生型进行了诱导表达和蛋白纯化。SDS-PAGE结果如图 4a所示,突变体Y321F与野生型WecE均得到了有效的纯化,纯度在95%以上,且蛋白分子量与理论值一致(约为42 kDa)。

|
| 图 4 野生型与突变体蛋白的表达纯化与性质表征 Figure 4 The purification and characterization of mutant protein and wild type protein (a) SDS-PAGE analysis of expression and purification of mutant Y321F and wild type M: Protein molecular weight standard; 1: The lysate supernatant of wild type protein; 2: Elution of wild type protein with 50 mmol/L imidazole; 3: Elution of wild type protein with 200 mmol/L imidazole; 4: The lysate supernatant of mutant protein; 5: Elution of mutant protein with 50 mmol/L imidazole; 6: Elution of mutant protein with 200 mmol/L imidazole (b) HPLC analysis of reaction mixture catalyzed by mutant Y321F and wild type 1: HPLC analysis of reaction mixture catalyzed by mutant Y321F; 2: HPLC analysis of reaction mixture catalyzed by wild type; 3: HPLC analysis of reaction mixture without enzyme as blank control |
通过高效液相色谱测定反应产物井冈霉烯胺的浓度,表征突变体与野生型的催化活力(图 4b)。突变体Y321F催化得到0.62 mg/L井冈霉烯胺,野生型则得到0.14 mg/L井冈霉烯胺,因此突变体催化活力比野生型提高了3.4倍,与微孔板筛选结果一致。这表明L-谷氨酸脱氢酶偶联高通量筛选方法可以较为准确地筛选到对非天然底物井冈霉烯酮催化活力明显提升的突变体。
3 结论本研究针对谷氨酸依赖型氨基转移酶建立了L-谷氨酸脱氢酶偶联高通量筛选方法并优化了偶联检测条件。根据朗伯比尔定律,在0.2~0.8范围内的吸光值是光学信号的可信区间,对不同浓度NADH的吸收信号比较发现,0.4 mmol/L的NADH在340 nm处的吸光值为0.7,能够在确保检测结果准确性的前提下使突变体的筛选范围最大化;L-谷氨酸脱氢酶偶联浓度影响偶联反应速率和偶联信号的强度,我们对L-谷氨酸脱氢酶的偶联浓度进行了优化,确定了L-谷氨酸脱氢酶偶联浓度为0.5 U/ml时背景干扰小、样品平行性好。该筛选方法准确,灵敏,α-酮戊二酸最低检测限达到20 μmol/L,可以应用于原始催化活力较低的氨基转移酶的筛选。
我们应用该筛选方法,对大肠杆菌氨基转移酶WecE进行了分子改造。选择了1 h作为转氨偶联时间。背景干扰实验结果表明,该筛选方法空白对照的干扰较小,WecE催化的转氨反应是筛选过程的限速步骤。构建并筛选Tyr321定点饱和突变库,有50%突变体的催化活力出现了明显的提高或降低,表明该残基对催化过程发挥着重要的作用。复筛后我们挑选到一株催化活性明显改善的突变体Y321F,对其进行表达纯化和性质表征后,发现催化活力比野生型提高了3.4倍。
本研究初步应用L-谷氨酸脱氢酶偶联高通量筛选方法,对谷氨酸依赖型氨基转移酶WecE进行了分子改造,对其工业化应用有着重要的研究意义。
| [1] |
Taylor P P, Pantaleone D P, Senkpeil R F, et al. Novel biosynthetic approaches to the production of unnatural amino acids using transaminases. Trends in biotechnology, 1998, 16(10): 412-418. DOI:10.1016/S0167-7799(98)01240-2 |
| [2] |
Yoshikane Y, Tamura A, Yokochi N, et al. Engineering mesorhizobium loti pyridoxamine-pyruvate aminotransferase for production of pyridoxamine with l -glutamate as an amino donor. Journal of Molecular Catalysis B:Enzymatic, 2010, 67(1-2): 104-110. DOI:10.1016/j.molcatb.2010.07.013 |
| [3] |
Cho B K, Seo J H, Kim J, et al. Asymmetric synthesis of unnatural L-amino acids using thermophilic aromatic L-amino acid transaminase. Biotechnology and Bioprocess Engineering, 2006, 11(4): 299-305. DOI:10.1007/BF03026244 |
| [4] |
Chica R A, Doucet N, Pelletier J N. Semi-rational approaches to engineering enzyme activity:combining the benefits of directed evolution and rational design. Current Opinion in Biotechnology, 2005, 16(4): 378-384. DOI:10.1016/j.copbio.2005.06.004 |
| [5] |
Wenda S, Illner S, Mell A, et al. Industrial biotechnology-the future of green chemistry?. Green Chemistry, 2011, 13(11): 3007-3047. DOI:10.1039/c1gc15579b |
| [6] |
Han X, Bao Z, Zhao H. High throughput screening and selection methods for directed enzyme evolution. Industrial & Engineering Chemistry Research, 2015, 54(16): 4011-4020. |
| [7] |
Mathew S, Shin G, Shon M, et al. High throughput screening methods for ω-transaminases. Biotechnology and Bioprocess Engineering, 2013, 18(1): 1-7. DOI:10.1007/s12257-012-0544-x |
| [8] |
Green A P, Turner N J, O'Reilly E. Chiral amine synthesis using ω-transaminases:An amine donor that displaces equilibria and enables high-throughput screening. Angewandte Chemie International Edition, 2015, 126(40): 10890-10893. |
| [9] |
Baud D, Ladkau N, Moody T S, et al. A rapid, sensitive colorimetric assay for the high-throughput screening of transaminases in liquid or solid-phase. Chemical Communications, 2015, 51(97): 17225-17228. DOI:10.1039/C5CC06817G |
| [10] |
Truppo M D, Turner N J, Rozzell J D. Efficient kinetic resolution of racemic amines using a transaminase in combination with an amino acid oxidase. Cheminform, 2009, 40(33): 2127-2129. |
| [11] |
Cui L, Zhu Y, Guan X, et al. De novo biosynthesis of β-valienamine in engineered streptomyces hygroscopicus 5008. ACS Synthetic Biology, 2016, 5(1): 15-20. DOI:10.1021/acssynbio.5b00138 |
| [12] |
Wang F, Singh S, Xu W, et al. Structural basis for the stereochemical control of amine installation in nucleotide sugar aminotransferases. ACS Chemical Biology, 2015, 10(9): 2048-2056. DOI:10.1021/acschembio.5b00244 |
| [13] |
Reetz M T, Kahakeaw D, Lohmer R. Addressing the numbers problem in directed evolution. Chembiochem:a European Journal of Chemical Biology, 2008, 9(11): 1797-1804. DOI:10.1002/cbic.v9:11 |
 2017, Vol. 37
2017, Vol. 37




