文章信息
- 易喻, 王敏君, 梅建凤, 陈建澍, 张彦璐, 应国清.
- YI Yu, WANG Min-jun, MEI Jian-feng, CHEN Jian-shu, ZHANG Yan-lu, YING Guo-qing.
- 细菌内毒素电化学生物传感器的构建及性能表征
- Construction and Characterization of Electrochemical Biosensor based on Endotoxin Aptameer
- 中国生物工程杂志, 2017, 37(8): 46-50
- China Biotechnology, 2017, 37(8): 46-50
- http://dx.doi.org/DOI:10.13523/j.cb.20170807
-
文章历史
- 收稿日期: 2017-03-08
- 修回日期: 2017-03-22
细菌内毒素是Richard Pfeiffer在1892~1895年间从热灭活的霍乱弧菌(Vihrio cholerae)溶解物中发现的[1]。检测和分离非肠道用药品尤其是注射针剂中的细菌内毒素成了生产工艺中的重要环节[2]。目前,用于检测内毒素的方法主要有:家兔热原试验法、鲎实验法、酶联免疫测定法和生物传感器等[3]。核酸适体由于其易于修饰、靶标分子分子范围广、特异性高[4-6]等优点常常被选为生物元件。其中电化学分析技术作为一种具有灵敏度高、操作简单、实时检测等优点的分析方法,已经广泛地应用于生物传感器中,将其与核酸适体相结合构建新一代核酸适体电化学传感器,已成为分析与生命学科交叉的重要研究领域之一[7]。Voss等[8]报道用细菌内毒素结合蛋白CD14结构的两条多肽类似物制备了细菌内毒素生物传感器。Priano等[9]报道了利用细菌内毒素中和蛋白(ENP)作为识别分子,建立了用于检测细菌内毒素的电化学方法。左明艳[10]通过两条适配体与内毒素形成三明治结构的方式,构建了检测细菌内毒素的磁珠适配体传感器。国内外构建了不同类型的生物传感器,但是以内毒素为目标物质的电化学适体传感器在国内还未见报道。
本文构建的电化学核酸适体生物传感器是以核酸适体作为识别元件(敏感元件),将己知序列的核酸适配体EAQ2[11]作为探针,根据电化学信号变化检测细菌内毒素的一种生物传感器。结合适体与电化学分析两方面的优点,能将微小环境的变化转化为可测的电信号,对内毒素进行定性定量分析,弥补了当前内毒素检测中存在的操作复杂,耗时长,灵敏度低等缺陷。
1 材料与方法 1.1 材料 1.1.1 试剂氨基修饰的核酸适体序列:NH2-(CH2)6-5′-ATGAGAGCGTCGGTGTGGTAT-GCTCACCCCCTGCGGCGCCGTTACGCGGTCCTTGTGTAGGAGGGTGCGGAAGTA-3′(上海生工公司);铁氰化钾、三水·亚铁氰化钾、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基-琥珀酰亚胺(NHS)、吗啉乙磺酸(MES),阿拉丁试剂;3-巯基丙酸(MPA),由国药集团化学试剂有限公司供应;牛血清白蛋白(BSA)购自上海神航生物科技有限公司;三羟甲基氨基甲烷(Tris)购自上海伯奥生物科技有限公司;氧化铝粉、抛光绒布、金电极(CHI101)、铂丝电极(CHI115)、饱和甘汞电极(CHI111),由上海辰华仪器公司供应;其他试剂均为分析纯,实验室所用水为二次去离子水。核酸适体缓冲液(pH= 7.4):50 mmol/L Tris-HCl,120 mmol/L NaCl,5 mmol/L KCl,1 mmol/L MgCl2,1 mmol/L CaCl2。
1.1.2 仪器电化学工作站(CHI 760E型;上海辰华仪器公司);超声波清洗器(天津奥特赛恩斯仪器有限公司);台式高速冷冻离心机(Thermo Fisher公司)
1.2 方法 1.2.1 金电极表面的处理采用电化学清洗方法对金电极表面进行处理。处理前均依次采用1 μM、0.3 μM和0.05 μM氧化铝粉打磨抛光金电极。用二次去离子水将金电极表面清洗干净,再分别用无水乙醇和二次去离子水将电极超声清洗两次,每次5 min。将上述二次去离子水超声后的电极吹干后置于0.5 mol/L H2SO4溶液中,在0~1.6 V的电压,扫描速度为100 mV/s的参数下进行循环伏安扫描,直到循环伏安曲线稳定接近至裸金电极标准曲线(图 1)。
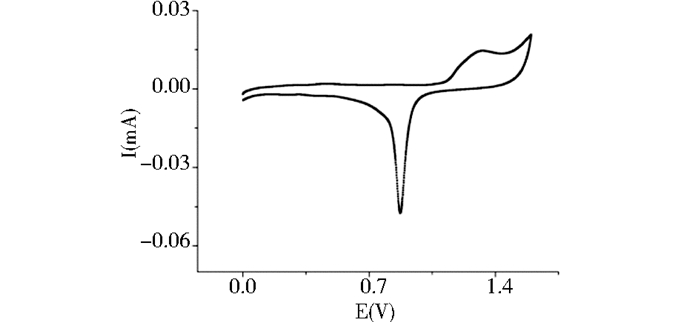
|
| 图 1 裸金电极在0.5 mol/L H2SO4中的标准循环伏安图 Figure 1 The standard cyclic voltammetric peak of Au electrode in 0.5 mol/L H2SO4 |
将已抛光的裸金电极浸置于200 μl 200 mmol/L的3-巯基丙酸中,在室温条件下避光组装数小时,取出后用无水乙醇冲洗金电极表面用以除去电极表面物理吸附的巯基丙酸分子,得到修饰了MPA-SAMs的金电极。将此修饰电极置于10 mmol/L pH7.4的PBS缓冲液包含2 mmol/L K3Fe(CN)6、K4Fe(CN)6·3H2O的电解液中,进行循环伏安和电化学阻抗谱的表征。循环伏安的参数为:-0.3~0.6 V电压范围,100 mV/s的扫描速率。电化学阻抗谱的参数为:扫描频率范围为0.1 Hz~100 kHz,振幅为5 mV。
1.2.3 核酸适体的固定与表征核酸适体的预处理:为了使核酸适体形成稳定的二级结构,将合成的干膜状核酸适体溶解于核酸适体缓冲溶液中,于-20℃中保存备用。
将上述MPA修饰的金电极放入含有20 mmol/L EDC和20 mmol/L NHS的ME酸性缓冲体系中活化羧基端,随后在200 nmol/L的NH2-ss DNA体系中静置40 min。经洗涤缓冲液冲洗、吹干,进行循环伏安和电化学阻抗谱的表征。生物传感器的修饰过程如图 2所示。
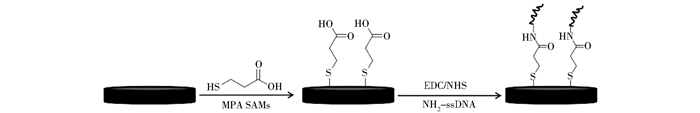
|
| 图 2 核酸适体的固定原理 Figure 2 The principle of immobilization of aptamer |
将处理好的裸金电极于0.5 mol/L H2SO4中电解抛光,在0~1.6 V电压范围内进行循环伏安扫描,得到图 3所示的稳定的循环伏安图。经过10圈循环伏安扫描后的金电极与干净的金电极标准图基本一致,说明采用电化学清洗的方法能达到较好的清洗效果,可以进行下一步修饰。
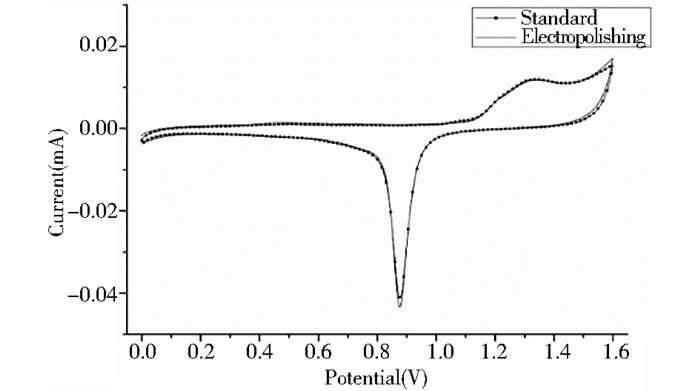
|
| 图 3 裸金电极在0.5 mol/L H2SO4中的循环伏安图 Figure 3 Cyclic voltamograms of the bare gold electrode in 0.5 mol/L H2SO4 |
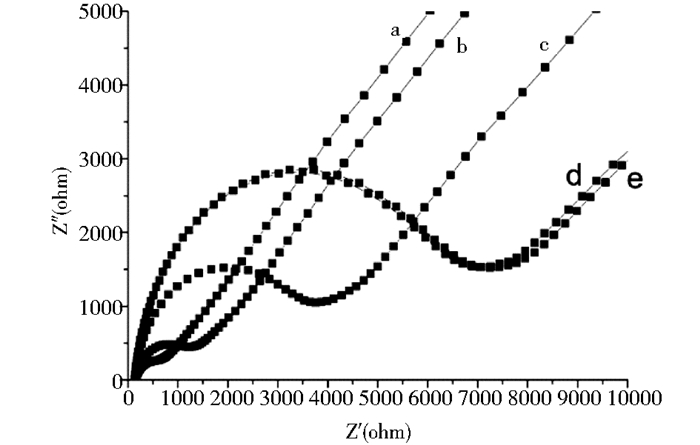
本实验对MAP-SAMs分别进行了1 h、6 h、9 h、12 h、24 h不等的组装时间考察,通过循环伏安和电化学阻抗谱两种方法对不同组装时间的结果进行表征。图 4(需删除不同组装时间下金电极的)为循环伏安表征情况。比较图中的循环伏安曲线可知,当MPA自组装到金电极表面后,电解液中[Fe(CN)6]3-/4-的峰电流减小,峰电位差变大,反应可逆性变差,这是由于MPA的羧基端在电解液中呈电负性,在一定程度上阻碍电子在金电极表面的传递,导致峰电流下降。图 5(需删除不同组装时间下金电极的)为电化学交流阻抗谱表征情况。一般情况下,阻抗谱图上的高频率部分是受动力学控制的区域,低频率部分是受扩散控制的区域,修饰MPA的金电极(b-e)与裸金电极(a)比较,在高频率区出现一个直径较大的圆弧,表明在此区修饰电极的电阻相对裸电极要大,与循环伏安实验结果相符合。自组装分子在金基底上的成膜分为两个阶段[12],第1步快速吸附过程,短时间内就可完成,第2步为金电极表面膜的重组过程,所需时间较长。从电化学表征的结果中我们可以发现,随着组装时间的增加,0~6h之间膜表面的覆盖率增加,6~12h之间基本不发生变化,组装24h膜覆盖面反而降低。因此选择6 h为MPA修饰到金电极表面的组装时间。
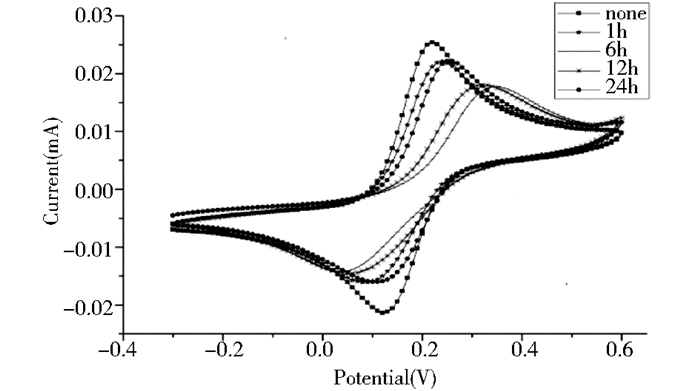
|
| 图 4 MPA修饰的金电极在电解液中的循环伏安 Figure 4 Cyclic voltamograms of the MPA SAMs electrode |
|
| 图 5 MPA修饰的金电极在电解液中的交流阻抗谱 Figure 5 Nyquist plots of the MPA SAms electrode in PBS(10 mmol/L, pH 7.4) solution containing 2 mmol/L Fe(CN)63-/4- a:裸金电极;b:组装1 h;c:组装24 h;d:组装12 h;e:组装6 h |
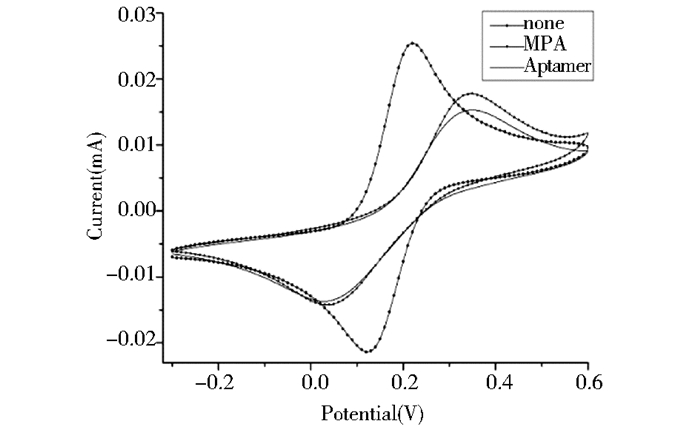
图 6为金电极不同修饰步骤下的循环伏安表征情况。因为核酸适体由核苷酸组成,本身呈电负性,固定到金电极表面后,使阻碍电子传递的能力提高,电阻增大,导致峰电流下降,但不明显。
|
| 图 6 不同修饰情况下金电极的循环伏安 Figure 6 Cyclic voltammograms of gold electrodes under different modification conditions |
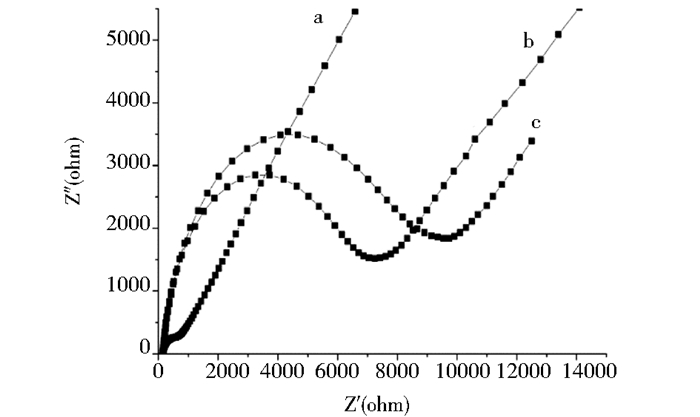
图 7为金电极不同修饰步骤下的交流阻抗谱表征情况。该研究使用的生物元件为单链核苷酸,与细菌内毒素作用产生的电信号变化相对较弱,而电化学阻抗具有良好的界面表征作用,以小振幅的正弦波电位为扰动信号,能与体系产生相关线性,但不会对生物大分子造成干扰。从图 7中可以发现,当核酸适体固定到金电极表面后,高频部分的圆弧半径扩大了,这是由于核酸磷酸骨架的负电荷存在静电排斥作用[13],限制了金电极表面的电子交换,导致阻值增加。
|
| 图 7 不同修饰情况下金电极的阻抗 Figure 7 Nyquist plots of gold electrodes under different modification conditions a:裸金电极;b:MPA修饰后的金电极;c:核酸适体固定后的金电极 |
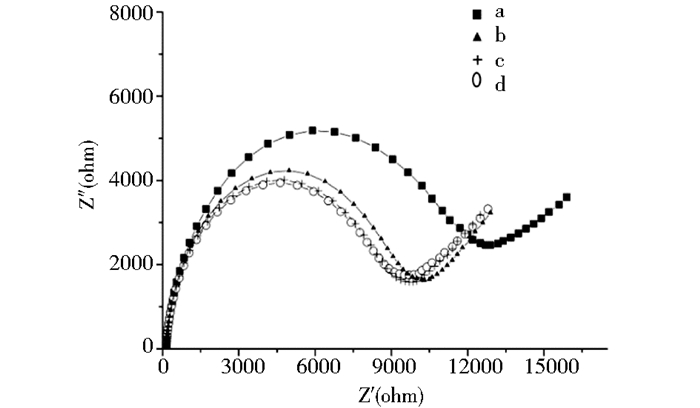
核酸适体对内毒素的特异性测定主要是检验筛得的核酸适体是否只对内毒素有亲和性,而不会结合其他的化学或者生物物质。内毒素结构中含有脂多糖和蛋白。牛血清白蛋白是普遍存在的蛋白,很多生物制品和生物技术药物中都含有这种蛋白质,并且与内毒素一样都含有蛋白和多糖结构。图 8为生物传感器在不同BSA浓度下孵育后的交流阻抗谱图。说明当BSA浓度小于5×10-7 g/ml时,生物传感器无明显信号输出,而一般生物样品中BSA的浓度远远小于5×10-7 g/ml,因此,在实际环境中此生物传感器具有一定的选择性。4支同一批次修饰的电极在进行电化学表征时都表现出了相近的电化学相应信号,说明所构建的传感器具有可接受的重现性。将构建好的生物传感器浸入一系列不同浓度的细菌内毒素中孵育30 min后发现在0.001 EU/ml~0.1 EU/ml有良好的线性关系如图 9。
|
| 图 8 核酸适体生物传感器在不同BSA浓度下的阻抗 Figure 8 Nyquist plots of the biosensor incubating in different concentration of BSA a:5×10-6 g/ml;b:5×10-7 g/ml;c:5×10-8 g/ml;d:无BSA修饰 |

|
| 图 9 阻值变化量与内毒素浓度对数的线性关系 Figure 9 The linear relationship between the ΔR and logarithmic of endotoxin concentration |
综上所述,本文构建了一种核酸适体生物传感器用于检测内毒素。本方法采用核酸适体作为传感器的识别元件,结合电化学分析中的循环伏安和交流阻抗两种方法,实现了生物传感器的分步构建表征。其次,在检测内毒素的过程中不受牛血清白蛋白干扰,灵敏度高,检测限可达0.001 EU/ml并且在0.001~0.1 EU/ml内毒素浓度范围内呈现良好的线性关系。本研究构建的电化学核酸适体生物传感器在国内还不曾报道,具有无需标记、检测限低等特点,有望用于实际生物样品中内毒素含量的检测。
| [1] |
Petsch D, Anspach F B. Endotoxin removal from protein solutions. J Biotechnol, 2000, 76(2-3): 97-119. DOI:10.1016/S0168-1656(99)00185-6 |
| [2] |
蔡彤, 张国来, 李波, 等. 84种注射用药品细菌内毒素检查法的方法学研究. 中国药学杂志, 2010, 24(8): 812-816. Cai T, Zhang G L, Li B, et al. Study of bacteria endotoxin in test on 84 drugs for injection. China Pharmacy, 2010, 24(8): 812-816. |
| [3] |
汪玲, 王桂平. 细菌内毒素的检测方法及其应用概况. 中国药师, 2003, 6(5): 316-317. Wang L, Wang G P. Detection and application of bacterial endotoxin. China Pharmacist, 2003, 6(5): 316-317. |
| [4] |
Burgstaller P, Girod A, Blind M. Aptamers as tools for target prioritizIation and lead identification. Drug Discov Today, 2002, 7(24): 1221-1228. DOI:10.1016/S1359-6446(02)02522-9 |
| [5] |
徐发良, 肖觉. SELEX技术的靶标范围拓展. 第二军医大学学报, 2012, 33(4): 432-435. Xu F L, Xiao J. Expanding targets for systematic evolution of ligands by exponential enrichment (SELEX). Academic Journal of Second Military Medical University, 2012, 33(4): 432-435. |
| [6] |
He F, Tang Y, Wang S, et al. Fluorescent amplifying recognition for DNA G-quadruplex folding with a cationic conjugated polymer:a platform for homogeneous potassium detection. Journal of the American Chemical Society, 2005, 127(35): 12343-12346. DOI:10.1021/ja051507i |
| [7] |
王军, 冯毅, 范必威. 血红蛋白电化学分析检测的研究进展. 广东微量元素科学, 2007, 14(6): 7-12. Wang J, Feng Y, Fan B W. Development of electrochemical analysis and determination of hemoglobin. Guangdong Trace Elements Science, 2007, 14(6): 7-12. |
| [8] |
Voss S, Fischer R, Jung G, et al. A fluorescence-based synthetic LPS sensor. Journal of the American Chemical Society, 2007, 129(3): 554-561. DOI:10.1021/ja065016p |
| [9] |
Priano G, Pallarola D, Battaglini F. Endotoxin detection in a competitive electrochemical assay:synthesis of a suitable endotoxin conjugate. Analytical Biochemistry, 2007, 362(1): 108-116. DOI:10.1016/j.ab.2006.12.034 |
| [10] |
左明艳. 基于SELEX技术筛选前白蛋白的核酸适配体及磁珠适配体传感器检测细菌内毒素的应用. 合肥: 中国科学技术大学, 2014. Zuo M Y. Selection of aptamer for prealbumin protein using SELEX and detecting endotoxin with the magnetic aptasensor. Hefei: University of Science and Technology of China, 2014. |
| [11] |
Ying G, Zhu F, Yi Y, et al. Selecting DNA aptamers for endotoxin separation. Biotechnology Letters, 2015, 37(8): 1-5. |
| [12] |
Ulman A. Formation and structure of self-assembled monolayers. Chemical Reviews, 1996, 96(4): 1533-1554. DOI:10.1021/cr9502357 |
| [13] |
Cai H, Lee M H, Hsing I M. Label-free protein recognition using an aptamer-based impedance measurement assay. Sensors & Actuators B Chemical, 2006, 114(1): 433-437. |
 2017, Vol. 37
2017, Vol. 37




