文章信息
- 孙一平, 王越, 金镇, 王晓岩, 孙磊, 张璇, 冯冲, 周效华.
- SUN Yi-ping, WANG Yue, JIN Zhen, WANG Xiao-yan, SUN Lei, ZHANG Xuan, FENG Chong, ZHOU Xiao-hua.
- SHBG基因敲除小鼠模型的建立及其表型分析
- Establishment and Phenotype Analysis of SHBG Knockout Mouse Model
- 中国生物工程杂志, 2017, 37(8): 39-45
- China Biotechnology, 2017, 37(8): 39-45
- http://dx.doi.org/DOI:10.13523/j.cb.20170806
-
文章历史
- 收稿日期: 2017-01-03
- 修回日期: 2017-04-28
2. 上海南方模式生物研究中心 上海 201203
2. Shanghai Research Center for Biomodel Organism, Shanghai 201203, China
性激素结合球蛋白(sex hormone-binding globulin, SHBG),是一种能结合性激素甾体的球蛋白,主要由肝脏产生,胎盘[1]等不同的性甾体激素靶组织亦有产生。SHBG能特异性地与性激素结合并参与其转运,调控血液中有生物活性的性激素浓度[2], 同时也受胰岛素、甲状腺素等多种因素的调节, 其中胰岛素是其代谢的重要调节激素[3]。
妊娠期糖尿病(gestational diabetes mellitus,GDM)的发病机制与2型糖尿病相似,妊娠期胰岛素抵抗的增加和胰岛β细胞分泌的减少也是其发病的病理生理基础。目前认为SHBG的低水平表达可作为2型糖尿病发生的独立危险因素[4-5],是高胰岛素血症性胰岛素抵抗的一个标志[6-8]。
最近研究发现,SHBG基因启动子(TAAAA)n重复多态与糖代谢异常有关,这种重复多态性可以影响血液循环中的SHBG水平,对易发生糖尿病等并发症的高危个体的早期识别具有重要的价值[9-10],我们研究表明GDM孕妇外周血的SHBG基因(TAAAA)n多态的等位基因及基因型数目、类型、频率存在一定的差异,8/8、8/9基因型的妇女易患GDM,而胎盘中SHBG基因启动子(TAAAA)n重复多态与GDM无关[11-12]。我们通过RNA干扰与基因沉默技术研究了胎盘滋养层合体细胞中SHBG的自分泌作用机制[13-14],通过胎盘滋养层合体细胞胰岛素抵抗模型的建立,研究了SHBG对其胰岛素信号的转导和胰岛素抵抗的影响[15]。
目前对SHBG基因在2型糖尿病和GDM发病中的作用及机制的研究多集中在细胞系和组织水平,因此我们应用Cre-Loxp重组系统,首次建立SHBG全身性基因敲除纯和小鼠模型,以期在动物水平上进一步阐述GDM中SHBG基因的功能及作用机制。
1 材料与方法 1.1 材料与试剂含SHBG的BAC宿主菌购自BAC PAC资源中心(Children’s Hospital Oakland Research Institute)Bac:RPCI-23-240I24。打靶所用ES细胞购自EuMMCR公司。限制性内切酶、T4 DNA连接酶及聚合酶、Taq酶及PCR相关试剂购自TaKaRa公司。常规化学试剂主要购自Sigma和上海化学试剂公司。胶回收Kit购自华舜生物公司。ES细胞培养所需的DMEM培养基(高糖,ES细胞级)、胎牛血清(ES细胞级)、更昔洛韦、G418、青链霉素、LIF、胰蛋白酶等分别购自Gibco BRL公司、Sigma公司、Chemicon公司。质粒抽提试剂盒及DNA提取试剂盒购于Qiagen公司。实验中所用C57BL/6J小鼠,EIIa-Cre小鼠购于上海南方模式生物研究中心。囊胚供体受体、新生仔鼠、野生型、杂合子及基因敲除小鼠均按照无特定病原(specific pathogen free,SPF)级动物饲养标准饲养。
1.2 方法 1.2.1 SHBG条件性基因敲除打靶载体的构建从Ensembl数据库中(http://www.ensembl.org/index.html)获得SHBG基因组序列,根据基因组序列设计打靶载体。小鼠SHBG-001转录本共有8个外显子,根据生物信息学分析,flox区域为第4~7号外显子,loxp、neo、frt等元件放在内含子中,flox区域剔除后可造成移码突变,并使其蛋白翻译提前终止,如图 1所示。运用ET克隆的方法构建SHBG基因第4~7号外显子两侧插入loxp位点的条件性剔除载体如图 2所示。大致过程如下:首先以BAC质粒为模板DNA,PCR扩增A、B二个小同源臂。将A臂和B臂克隆至pBR322-2S质粒的HindⅢ & BamHI,利用该质粒和BAC克隆,通过同源重组方式,获得A区域到B区域之间包含有5′和3′同源臂的DNA片段的Retrieve质粒;以PL452质粒为模板DNA,SHBG-L1,SHBG-L2为引物。PCR直接扩增出含Neo的L片段,以PL451质粒为模板DNA,SHBG-F1,SHBG-F2为引物。PCR直接扩增出含Neo的F片段。然后将含Neo的L片段经过同源重组knock in到上述获得的含Retrieve质粒中,得到SHBG-Ln质粒,并用限制性内切酶及测序鉴定;将含有SHBG-Ln质粒的EL350菌株经阿拉伯糖诱导,使Cre重组酶表达以去除PL452引入的neo基因;获得SHBG-Cre质粒;将上述SHBG-Cre质粒与含Neo的F片段共同转入EL350菌株,经过同源重组完成第二次neo knock in,构建载体pBR322-MK-SHBG-cko,并用限制性内切酶及测序鉴定。具体步骤及条件见相关参考文献[16]。
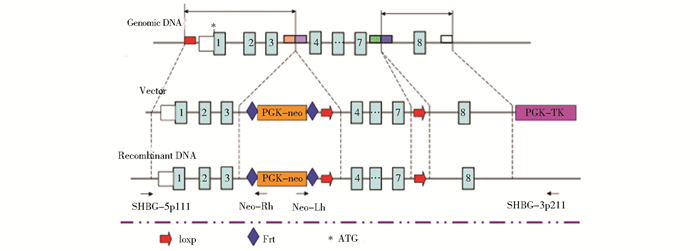
|
| 图 1 SHBG基因打靶位点示意 Figure 1 The modes of SHBG targeting strategy |
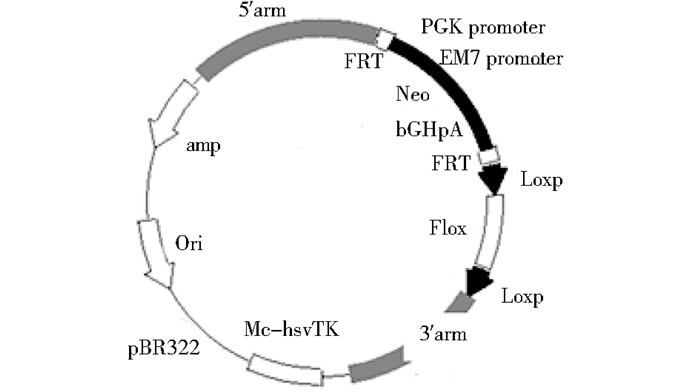
|
| 图 2 SHBG条件性基因打靶载体示意 Figure 2 Diagram of the strategy to generate SHBG targeting vector |
转染前经NotⅠ酶将打靶载体线性化,ES细胞用胰酶消化后重悬于PBS中, ES细胞浓度为1.5×107/ml。取35μg载体DNA与0.8ml细胞混匀后加入电穿孔槽中,以240V、500μF的电参数进行电穿孔,将电击后的细胞分入已铺好滋养层细胞的培养皿中,置于CO2孵箱培养。ES细胞在电穿孔24h和48h后分别换含有选择药物G418(终浓度为250mg/L)和Gancyclovir(终浓度为2μmol/L)的培养液进行选择性培养,第7~8天挑取ES细胞克隆。将挑取的抗性ES克隆充分消化后转移至96孔培养板上培养并提取基因组DNA, 通过PCR及回收胶再次酶切测序筛选出中靶ES细胞克隆.在SHBG打靶同源重组臂外侧分别设计SHBG-5p112和SHBG-3p211引物,在neo序列上设计Neo-Rh和Neo-Lh引物(图 1)。所需引物序列为:SHBG-5p111:GTGTGTGTGGGTATGGAGTGTTTGTG;Neo-Rh:GGCCTACCCGCTTCCATTGCTC;SHBG-3p211: TTGGTTGAGTGCTTGTCTGCTATGC;Neo-Lh:CCGTGCCTTCCTTGACCCTGG。用SHBG-5p111与Neo-Rh引物配对,鉴定5′臂同源重组,反应条件为:95 ℃ 4 min变性后,94℃ 45 s,65.9℃ 3min 30s进行35个循环后,72 ℃ 10 min,同源重组克隆应扩增出4kb片段;用SHBG-3p211和Neo-Lh引物配对鉴定3′臂同源重组,反应条件为95 ℃ 5 min变性后,94 ℃ 30 s,65.9℃ 3min30 s进行35个循环,72 ℃延伸10 min,同源重组克隆应扩增出4kb片段。
1.2.3 囊胚注射制备嵌合体小鼠囊胚取自交配后3.5d的C57BL/6J母鼠,每枚囊胚注射15个阳性ES细胞,挑选注射后形态正常及透明带完整的囊胚移植到2.5d假孕母鼠子宫中,每侧移植8~10枚,产下的后代即为嵌合体小鼠。
1.2.4 嵌合体小鼠的获得及PCR鉴定嵌合小鼠出生后,挑选毛色嵌合率大于50%的雄性鼠与C57BL/6J纯系小鼠交配即获得ES细胞来源的鼠。提取小鼠鼠尾基因组DNA,同ES细胞鉴定条件与反应体系, PCR法鉴定选取阳性杂合子小鼠即SHBG-Flox杂合小鼠。
1.2.5 SHBG基因敲除小鼠的获得及表型分析将获得的SHBG-Flox杂合小鼠与Ella-Cre小鼠交配,并通过子代自交, 最终获得SHBG基因敲除的纯合子小鼠(SHBG-/-小鼠)。肉眼观察各基因型组间小鼠在外观及行为上是否具有明显差异,小鼠生殖能力是否受到影响。
2 结果 2.1 SHBG条件性基因敲除打靶载体的构建构建的SHBG基因条件性敲除载体pBR322-MK-SHBG-cko,经多个限制性内切酶酶切鉴定和测序证实,成功获得FRT位点至第二个LoxP位点之间片段存在的SHBG条件性基因敲除打靶载体pBR322-MK-SHBG-cko[16]。经SalI酶切后获得大小分别为7 553bp,6 764bp,906bp 3个片段,酶切电泳及测序如图 3所示。
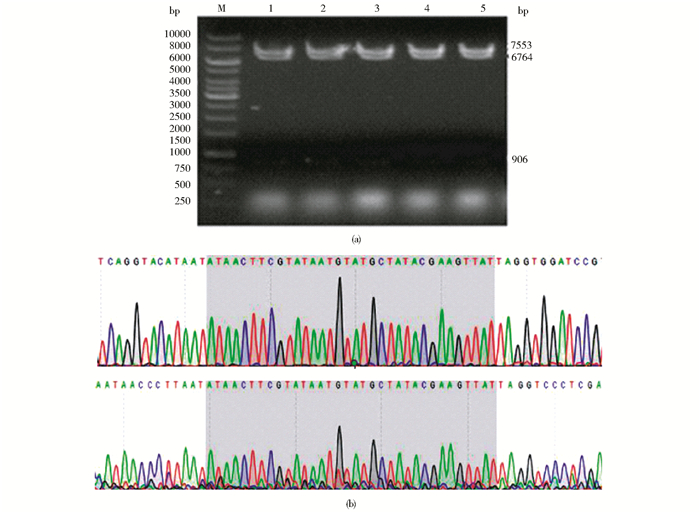
|
| 图 3 pBR322-MK-SHBG-cko质粒DNA经SalI酶切后的电泳及测序 Figure 3 Electrophoresis and sequencing analysis of products of digested pBR322-MK-SHBG-cko plasmid by SalI enzyme |
电转后获得抗性ES细胞克隆119个,经抽提96孔板中胚胎干细胞的基因组DNA,PCR筛选阳性克隆,同源重组克隆应扩增出4kb片段, 检测到有5个同源重组克隆,克隆号分别为:1#-G1、A2、H5、2#-F1、G1(图 4a),再通过胶回收试剂盒回收5′重组臂及3′重组臂的PCR产物,酶切、测序确认后最终获得2枚正确同源重组克隆胚胎干细胞1#-A2、2#-G1(图 4b)。
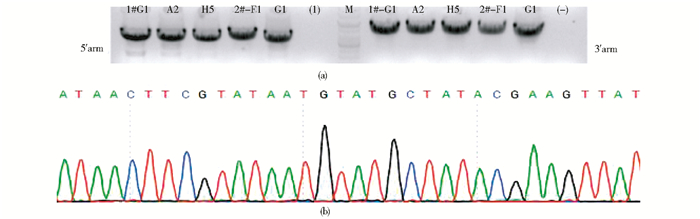
|
| 图 4 PCR鉴定同源重组阳性的胚胎干细胞克隆(a)酶切测序鉴定同源重组阳性的胚胎干细胞克隆(b) Figure 4 Identification of targeted ES cell clones by PCR(a) and Identification of targeted ES cell clones by sequencing analysis(b) |
通过ES细胞的囊胚注射和胚胎移植,1#-A2、2#-G1克隆共注射141枚胚胎,制作12只受体,共出生12只小鼠,其中7只雄性为> 50%嵌合雄鼠。嵌合体雄鼠与野生型C57BL/6J小鼠交配,来自1#-A2克隆的1只雄鼠共获得ES细胞来源的嵌合体小鼠5只。经PCR鉴定其中3只同源重组克隆扩增出4kb片段,即为为SHBG-flox阳性杂合子小鼠(图 5)。
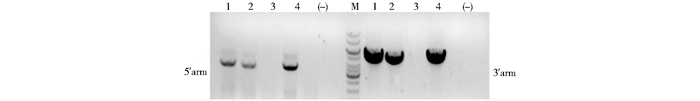
|
| 图 5 通过PCR鉴定出同源重组阳性的F1代小鼠 Figure 5 Identification of targeted F1 mice by PCR 1, 2, 4:Positive control; 3:wild type; (-):negative control |
SHBG-flox小鼠与Ella-Cre小鼠杂交,获得SHBG基因敲除杂合子(SHBG+/-)小鼠,再与Flp小鼠交配一代后与C57BL/6J小鼠进行交配去除干扰基因, 后代小鼠多次自交后进行剪尾鉴定,成功获得去Neo全身性基因敲除(SHBG-/-)的小鼠模型如图 6所示,说明SHBG基因敲除没有导致纯合子小鼠胚胎致死。表型上,SHBG敲除纯合子、杂合子及未敲除正常小鼠毛色无明显差异。
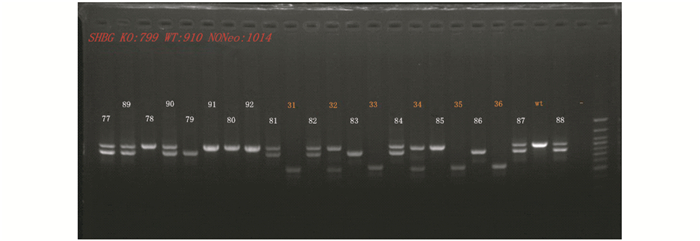
|
| 图 6 通过PCR鉴定出SHBG-/-的小鼠 Figure 6 Identification of SHBG-/- mice by PCR 77、81、82、84、87、88、89、90: SHBG+/-; 79、83、86:SHBG-/-; 78、80、85、91、92: wild type; 31、33、35、36: SHBG(含neo)+/+; 32、34: SHBG(含neo)+/- |
将基因型为SHBG-/-的小鼠合笼交配,雌性小鼠于怀孕19~21d后顺利生出健康幼鼠,可得出SHBG-/-雌雄小鼠均可孕,小鼠生育能力不受SHBG基因缺失的影响。初步观察发现幼鼠与同期野生型幼鼠的生长发育和活动状态无明显异常。
3 讨论SHBG 的基因编码区位于人类第17对染色体的短臂(p12~13),由8个外显子和7个内含子组成,长约3kb。由两个相同的单体组成,每个单体包括3个二硫键和3个结构域,即一个甾体结合域,一个二聚体化结构域和一个膜受体结合域[2]。基于SHBG与胰岛素抵抗相关研究多集中在细胞系及组织水平,缺乏从整体动物水平着手的相关研究,我们已用基因沉默的手段证明了胎盘中SHBG表达与滋养细胞增殖呈正相关,与凋亡呈负相关[12-13]。目前通过基因敲除建立稳定的实验动物模型已成为研究基因功能的金标准。SHBG基因敲除的动物模型至今仍未见报道,因此我们构建了SHBG基因敲除小鼠模型,希望能够进一步在动物体内研究该基因的功能。
我们是利用Cre/LoxP这一特异性重组酶系统来实现条件性基因敲除。Cre-LoxP系统来源于噬菌体,可以介导位点特异的DNA重组。该系统含有两个组成成分:一是LoxP序列位点,由两个13bp的反向重复序列和一个8bp的核心序列组成,其中中间的8个碱基决定LoxP的方向;二是Cre重组酶,由噬菌体编码,可识别LoxP序列,介导LoxP位点特异性重组,可引起两个同向LoxP位点间DNA序列的缺失。若将Cre重组酶置于组织或细胞特异性启动子之下,可以得到组织/细胞特异性表达的Cre小鼠,即Cre工具小鼠。将获得的flox小鼠与全身表达的Cre小鼠和带有细胞特异性表达的Cre小鼠交配繁殖,获得全敲杂合子小鼠和在特定细胞目标基因不表达的小鼠,即条件性基因敲除小鼠。此外,可与控制Cre表达的其他诱导系统(比如CreERT2)相结合,可实现对某一基因时空两方面的调控。
根据Cre/LoxP条件性基因敲除技术原理,前期实验构建SHBG条件性敲除打靶载体,通过胚胎干细胞重组获得正确同源重组克隆,通过囊胚注射制备嵌合体小鼠,嵌合体小鼠传代获得在目标DNA序列的两端各放置一个loxP序列且可稳定遗传的flox(flanked by loxP)小鼠。将其与全身表达的Ella-Cre鼠交配,获得全身SHBG基因敲除杂合鼠;与Flp小鼠及野生型小鼠交配,去除neo及Cre等干扰因素后,多次自交获得基因型为全身性敲除的纯合小鼠。
通过对SHBG基因全身敲除小鼠模型的初步表型分析,SHBG-/-小鼠的生长发育水平与同年龄、同性别野生型对照小鼠相比,无显著统计学差异,且基因敲除纯和小鼠具有正常的繁殖生育能力。今后我们将应用胰岛素耐量试验、糖耐量试验、高胰岛素-正葡萄糖钳夹法等方法建立小鼠胰岛素抵抗评价平台,力求在整体动物水平评价SHBG基因敲除小鼠在妊娠期的胰岛素抵抗变化,通过免疫组化、RT-PCR及Western等方法研究SHBG基因在GDM的发病机制中的作用及调控机制。
| [1] |
Schobert R, Bernhardt G, Biersack B, et al. Steroid conjugates of dichloro (6-aminomethylnicotinate) platinum(Ⅱ):effects on DNA, sex hormone binding globulin, the estrogen receptor, and various breast cancer cell lines. Chem Med Chem, 2007, 2(3): 333-342. DOI:10.1002/(ISSN)1860-7187 |
| [2] |
Hammond G L, Bocchinfuso W P. Sex hormone-binding globulin:gene organization and structure/function analyses. Horm Res, 1996, 45(3-5): 197-201. DOI:10.1159/000184787 |
| [3] |
Hammond G L, Wu T S, Simard M, et al. Evolving utility of sex hormone-binding globulin measurements in clinical medicine. Curr Opin Endocrinol Diabetes Obes, 2012, 19(3): 183-189. DOI:10.1097/MED.0b013e328353732f |
| [4] |
Mehrabian F, Rezae M. Sex hormone binding globulin measurement before conception as a predictor of gestational diabetes in women with polycystic ovarian syndrome. J Res Med Sci, 2013, 18(8): 637-640. |
| [5] |
Tong G, Hua X, Zhong Y, et al. Intensive insulin therapy increases sex hormone-binding globulin in newly diagnosed type 2 diabetic patients. Eur J Endocrinol, 2014, 170(2): 237-245. DOI:10.1530/EJE-13-0557 |
| [6] |
Wallace I R, McKinley M C, Bell P M, et al. Sex hormone binding globulin and insulin resistance. Clinical Endocrinology, 2013, 78(3): 321-329. DOI:10.1111/cen.12086 |
| [7] |
Perry J R, Weedon M N, Langenberg C, et al. Generic evidence that raised sex hormone binding globulin(SHBG)levels reduce the risk of type 2 diabetes. Hum Mol Genet, 2010, 19(3): 535-544. DOI:10.1093/hmg/ddp522 |
| [8] |
Ding E L, Song Y, Manson J E, et al. Plasma sex steroid hormones and risk of developing type 2 diabetes in women:a prospective study. Diabetologia, 2007, 50(10): 2076-2084. DOI:10.1007/s00125-007-0785-y |
| [9] |
Xita N, Tsatsoulis A, Chatzikyriakidou A, et al. Association of the(TAAAA)n repeat polymorphism in the sex hormone-binding globulin (SHBG) gene with polycystic ovary syndrome and relation to SHBG serum levels. J Clin Endocrinol Metab, 2003, 88(12): 5976-5980. DOI:10.1210/jc.2003-030197 |
| [10] |
Haiman C A, Riley S E, Freedman M L, et al. Common genetic variation in the sex steroid hormone-binding glogulin (SHBG) gene and circulating shbg levels among postmenopausal women:the Multiethnic Cohort. J Clin Endocrinol Metab, 2005, 90(4): 2198-2204. DOI:10.1210/jc.2004-1417 |
| [11] |
练思宇, 金镇, 孙磊, 等. 性激素结合球蛋白基因启动子(TAAAA)n重复多态与妊娠期糖尿病发病的关系. 中华妇产科杂志, 2014, 49(2): 138-139. Lian S Y, Jin Z, Sun L, et al. Association of the (TAAAA)n repeat polymorphism of SHBG gene promoter with gestational diabetes mellitus. Chinese Journal of Obstetrics and Gynecology, 2014, 49(2): 138-139. |
| [12] |
息小雪, 练思宇, 张璇, 等. 胎盘性激素结合球蛋白基因启动子n重复多态与妊娠期糖尿病关系研究. 中国实用妇科与产科杂志, 2015, 31(12): 1142-1145. Xi X X, Lian S Y, Zhang X, et al. Analysis of the relationship between SHBG gene(TAAAA)n polymorphism in placenta and GDM. Chinese Journal of Practical Gynecology and Obstetrics, 2015, 31(12): 1142-1145. |
| [13] |
孙倩, 孙磊, 金镇, 等. RNA干扰技术抑制SHBG基因表达对滋养细胞凋亡的影响. 中国医科大学学报, 2013, 42(8): 689-692. Sun Q, Sun L, Jin Z, et al. Effect of siRNA-mediated SHBG gene silencing on apoptosis of trophoblasts. Journal of China Medical University, 2013, 42(8): 689-692. |
| [14] |
范杰慧, 金镇, 孙倩, 等. RNA干扰SHBG基因表达对滋养细胞增殖的影响. 中国优生与遗传杂志, 2015, 23(2): 3-7. Fan J H, Jin Z, Sun Q, et al. Effect of RNA silence SHBG gene on proliferation of trophoblasts. Chinese Journal of Birth Health & Heredity, 2015, 23(2): 3-7. |
| [15] |
姜洁璇, 孙磊, 金镇, 等. 性激素结合球蛋白和葡萄糖转运蛋白在妊娠期糖尿病胎盘组织中的表达及相关性. 中国医科大学学报, 2015, 44(1): 5-9. Jiang J X, Sun L, Jin Z, et al. Expression of SHBG and GLUT in gestational diabetes placenta tissue and their correlation. Journal of China Medical University, 2015, 44(1): 5-9. |
| [16] |
王越, 金镇, 孙磊, 等. 小鼠性激素结合球蛋白条件基因打靶载体的构建. 中国医科大学学报, 2015, 44(03): 203-208. Wang Y, Jin Z, Sun L, et al. Construction of targeting vector for conditional knockout of murine SHBG. Journal of China Medical University, 2015, 44(03): 203-208. DOI:10.3969/j.issn.0258-4646.2015.03.003 |
 2017, Vol. 37
2017, Vol. 37




