文章信息
- 秦梦菲, 孙鸿, 宋浩.
- QIN Meng-fei, SUN Hong, SONG Hao.
- 分枝杆菌细胞裂解液催化甾体激素C1, 2位脱氢反应的研究
- Studies on the 3-Ketosteriod-1-Dehydrogenation of Steroid Hormone by Cellular lysates of Mycobacterium
- 中国生物工程杂志, 2017, 37(8): 23-30
- China Biotechnology, 2017, 37(8): 23-30
- http://dx.doi.org/DOI:10.13523/j.cb.20170804
-
文章历史
- 收稿日期: 2017-02-23
- 修回日期: 2017-03-17
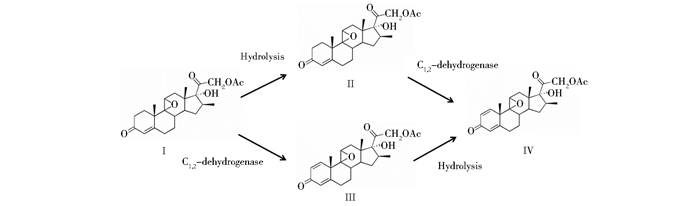
甾体激素药物作为抗生素之后的第二大类药物广泛用于治疗和预防许多疾病[1],例如消炎,利尿,避孕,促孕,抗雄激素和抗癌剂等[2-3]。甾药的高需求促生了另一重要产业的蓬勃发展——甾药中间体(甾药前体)的提取与制备。微生物法制备甾药前体的工艺因其环境污染小,反应步骤少、产品损失低、收率高等突出优势[4-5],广泛应用于工业生产[6]。近年来,通过微生物的生物转化对甾体化合物进行脱氢、氧化、羟化及侧链切割等反应而获得多种药物中间体[7-9]。如图 1所示,Ⅳ是用于生产9-氟甾体激素(如地塞米松,倍他米松,曲安西龙等)的关键前体[10-11],以Ⅰ为底物生产Ⅳ的生物转化过程包括水解反应和C1, 2位脱氢反应,根据反应顺序不同可区分为Ⅰ、Ⅱ、Ⅳ和Ⅰ、Ⅲ(9β, 11β-环氧-17α, 21-二羟基-16β-甲基孕-1, 4-二烯-3, 20-二酮-21-醋酸酯)、Ⅳ两种可能的反应机制。但是关于9(11)-环氧甾体生物转化的研究还未见报道,反应机制也没有完全阐明。
|
| 图 1 Ⅰ转化为Ⅳ的反应机制 Figure 1 The reaction mechanism of Ⅰ to Ⅳ |
分枝杆菌(Mycobacterium sp.)是重要的工业菌株,能够利用甾体作为唯一的碳源,将其开环降解为自身提供能量[12-14]。分枝杆菌可以表达KSTD,Wang等[15-16]为使植物甾醇降解后的中间体9-OHAD(9α-羟基雄甾-4-烯-3, 17-二酮)大量积累且稳定存在,敲除了编码KSTD的关键基因:kstD1、kstD2、kstD3和kstDM;Zhang等[17]为积累ADD(雄甾-1, 4-二烯-3, 17-二酮),从Mycobacterium neoaurum JC-12获得编码KSTD的ksdd基因并在Bacillus subtilis 168中表达。目前,对于甾体化合物的生物转化大多都基于基因工程改造的微生物或分离纯化的酶催化[18]。这些方法可以使甾体化合物的转化率有一定的提高,但甾体底物溶解度差[19]、微生物发酵过程染菌[20]以及分离纯化酶的高成本都是制约其工业应用的关键问题。
本实验以Mycobacterium sp. MS136为出发菌株,首次提出用分枝杆菌细胞裂解液生产甾药前体,并阐明了底物Ⅰ转化为产物Ⅳ的反应机理。通过在分枝杆菌中分别过表达kstD、kstD3和kstDM基因提高KSTD的活性,并优化缓冲液pH,从而提高甾药前体Ⅳ的转化率,为将来的工业化生产提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养基本文涉及的所有质粒和菌株信息详见表 1。质粒pMV261购自Biosci公司,基因kstD,kstD3和kstDM由Genewiz公司合成。
| Strain or plasmid | Relevant genotype and description | Reference or source |
| Strains | ||
| Mycobacterium sp. MS136 | Mycobacterium sp. CGMCC 13532 | This work |
| E. coli BL21(DE3) | used to express foreign protein | This work |
| Plasmids | ||
| pUC57-kstD | Ampr,carries kstD | This work |
| pUC57-kstD3 | Ampr, carries kstD3 | This work |
| pUC57—kstDM | Ampr, carries kstDM | This work |
| pMV261 | Kanr,Shuttle vector of mycobacterium and E. coli,carrying the heat shock hsp60 promoter | Telentietal. (1997) |
| pMV261-kstD | Kanr,carries kstD | This work |
| pMV261-kstD3 | Kanr,carries kstD3 | This work |
| pMV261-kstDM | Kanr,carries kstDM | This work |
| pET-28a | Kanr,E. coli expression vector | Novagen |
| pET-kstD | Kanr,carrie s kstD | This work |
| pET-kstD3 | Kanr,carries kstD3 | This work |
| pET-kstDM | Kanr,carries kstDM | This work |
分枝杆菌液体培养基:甘油10 g/L、酵母提取物10 g/L、磷酸氢二铵1.5 g/L、磷酸氢二钾0.5 g/L、磷酸二氢钾0.5 g/L、吐温80 2.5 g/L、无水硫酸镁10 g/L、硫酸亚铁0.5 g/L、硫酸锌0.2 g/L,pH 7.2~7.3;固体培养基添加15 g/L琼脂粉。
1.1.2 试剂及仪器T4 DNA连接酶、限制酶BamHI和HindIII购自Fermentas公司;Gibson组装预混液购于NEB公司;质粒小提试剂盒、普通DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根公司;Ⅰ、Ⅱ和Ⅳ均购自上海博顿生物化工有限公司;氢化可的松、PMS(吩嗪硫酸甲酯)购于Solarbio公司。所用仪器:超声破碎仪(SCIENTZ)、高效液相色谱仪(Waters)、电转仪(Ependorf)。
1.1.3 引物用于PCR的引物见表 2。| Primers | Sequences(5′~3′) |
| kstD-F | CCCGATCCGGAGGAATCACGGATCCATGACCACCGAAACCGCTGG |
| kstD-R | AACTACGTCGACATCGATAAGCTTTTAAGACGGCTGAGCAGATTC |
| kstD3-F | CCCGATCCGGAGGAATCACGGATCCATGTCTGACTCTGACCTGGAATTC |
| kstD3-R | TAACTACGTCGACATCGATAAGCTTTTATTCAGCAGAAGACTGGGTAGC |
| kstDM-F | CCCGATCCGGAGGAATCACGGATCCATGTTCTACATGACCGCTCAGG |
| kstDM-R | TAACTACGTCGACATCGATAAGCTTTTAAGCTTTACCAGCCAGGTGC |
| pMV261-F | CAGCGAGGACAACTTGAGCCGT |
| pMV261 | RACATCAGAGATTTTGAGACACA |
| T7 | ACATCCACTTTGCCTTTCTC |
| T7ter | TGCTAGTTATTGCTCAGCGG |
1.2 方法 1.2.1 全细胞转化底物Ⅰ
培养Mycobacterium sp. MS136的方法如下:将Mycobacterium sp. MS136细胞接种于5 ml液体培养基中,30 ℃过夜培养。转接到另一装有50 ml液体培养基的250 ml锥形瓶中,30 ℃、200 r/min培养5 h(OD600达到0.5~0.6),添加终浓度为0.1g/L的诱导剂氢化可的松,30℃ 200r/min培养24h。10 000 r/min离心5 min收集菌体,用pH 7.0的0.2mol/L磷酸盐缓冲液(PBS)洗涤两次后重悬菌体至OD600达到2.0。取50 ml细胞悬浮液转入250ml锥形瓶中,加入1 g/LⅠ、2.5 mmol/L PMS和7 %乙醇,30 ℃、200 r/min反应。
1.2.2 细胞裂解液转化底物Ⅰ取40 ml Mycobacterium sp. MS136细胞悬浮液进行超声破碎,超声功率500 W,破碎时间5 s,间歇时间5 s,总共需要20 min,全程冰上操作。如果破碎后的细胞出现混浊现象,应重复超声操作。将破碎后的细胞裂解液转入250ml锥形瓶中,加入1 g/LⅠ、2.5 mmol/L PMS和7%乙醇,30 ℃、200 r/min反应。
1.2.3 KSTD氨基酸序列分析利用DNAman软件对已获的C1, 2位脱氢酶氨基酸序列新金分枝杆菌Mycobacterium neoaurum ATCC 25795(kstDGenbank ID:GQ476982、kstD3 Genbank ID:KF772210)和新金分枝杆菌Mycobacterium neoaurum NwIB-01(kstDMGenbank ID:GQ228843)与耻垢分枝杆菌Mycobacterium smegmatis(MSMEG5941)的C1, 2位脱氢酶氨基酸序列进行多序列对比分析。
1.2.4 重组质粒的构建如图 2所示,以pMV261-kstD的构建为例,以合成的质粒pUC57-kstD为模板,按照表 2的引物扩增各目的基因片段并纯化回收。所得PCR产物kstD基因片段分别与线性化的pMV261载体(HindⅢ和BamHI限制性酶切)通过Gibson assembly无缝连接法组装在一起,从而构建重组质粒pMV261-kstD,使基因片段置于hsp60启动子的控制下。重组质粒pMV261-kstD3和pMV261-kstDM的构建方法相同。

|
| 图 2 重组质粒pMV261-kstD的构建 Figure 2 The construction of the recombinant plasmid pMV261-kstD |
将质粒pET-28a及上述PCR产物kstD、kstD3和kstDM基因分别进行HindⅢ和BamHI双酶切,胶回收相应基因片段和同时双酶切的pET-28a质粒,按照比例连接获得重组质粒pET-kstD、pET-kstD3和pET-kstDM。
1.2.5 重组质粒的转化将菌体用无菌水洗2次,5 000r/min离心,最终重悬于无菌水中。利用电转化法[21]将重组质粒pMV261-kstD,pMV261-kstD3和pMV261-kstDM导入宿主菌株Mycobacterium sp. MS136,电转化条件:电压1.8 kV,电击杯孔径1mm,电击两次;确认电击频率4~5/ms范围,电击处理后的感受态于冰上放置5 min,利用终浓度为50 μg/ml卡那霉素抗性平板筛选转化子。
将上述获得的重组质粒pET-kstD、pET-kstD3和pET-kstDM转化至新鲜制备的表达宿主BL21(DE3) 感受态细胞中,并将其涂布于含有50 μg/ml卡那霉素抗性平板,37 ℃恒温隔夜培养。
1.2.6 样品的提取、检测与定量反应液混匀后,迅速吸取适量,用稀释剂(乙腈:水=5: 5)稀释10倍后经0.25μm滤膜过滤,取滤液上紫外液相检测。色谱条件:色谱柱:BDS HYPERSIL C18色谱柱(150 mm×4.6mm,5μm);检测器:Waters 2489 UV/Vis;泵:Waters e2695;流动相:乙腈:水=3: 7;柱温:40 ℃;检测波长为240 nm;流速1.2 ml/min。定量方法:使用相同的色谱条件测定Ⅱ和Ⅳ标准品的标准溶液,绘制浓度-峰面积标准曲线,对Ⅱ和Ⅳ定量。用生成产物的摩尔数除以底物的摩尔数即可得生成物的转化率。
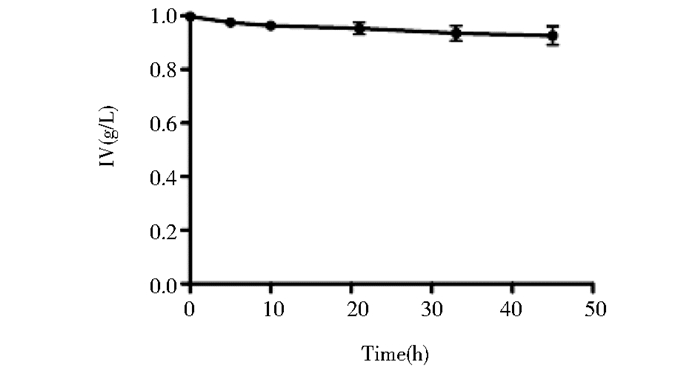
2 结果与讨论 2.1 比较全细胞转化法与细胞裂解液转化法分别用Mycobacterium sp. MS136全细胞和细胞裂解液转化底物Ⅰ。表 3中,利用分枝杆菌MS136全细胞转化1 g/L底物Ⅰ反应45h,底物Ⅰ只残余5%的量,对产物Ⅱ的转化率为60.3%,反应体系中检测不到产物Ⅳ的积累;表明分枝杆菌MS136菌株有可能将底物Ⅰ水解后进一步代谢,导致产物Ⅳ无法积累。而细胞裂解液转化1 g/L底物Ⅰ反应45h,底物Ⅰ残余量为20%,反应体系中产物Ⅳ转化率为56.8%。由图 3可知,1 g/L底物Ⅳ在细胞裂解液中反应45h后,Ⅳ剩余0.92 g/L,说明以Ⅳ为底物时,细胞裂解液不能将其进一步降解。
| 转化45 h | 全细胞转化法 | 细胞裂解液转化法 |
| Ⅰ(g/L) | 0.052 | 0.204 |
| Ⅱ(g/L) | 0.519 | 0.054 |
| Ⅲ(g/L) | NT | NT |
| Ⅳ(g/L) | NT | 0.485 |
| NT:not tested | ||
|
| 图 3 分枝杆菌细胞裂解液转化Ⅳ的产物生成曲线 Figure 3 Time courses of the conversion Ⅳ by cellular lysates of Mycobacterium sp. MS136 |
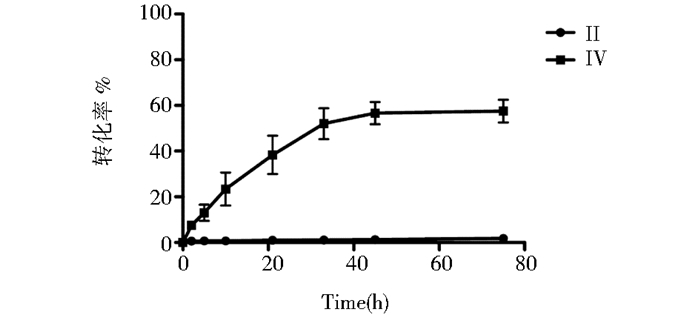
1 g/L底物Ⅰ在pH7.0的分枝杆菌细胞裂解液中反应,分别在2h,5h,10h,21h,33h、45h和76h取样,检测产物的生成情况。如图 4所示,产物Ⅳ随时间不断增加,45h Ⅳ的转化率达到最高值56.8%,而Ⅱ的转化率始终较低。在产物中始终未检测到Ⅲ,说明分枝杆菌细胞裂解液转化Ⅰ的反应顺序是Ⅰ、Ⅱ、Ⅳ。
|
| 图 4 分枝杆菌细胞裂解液转化Ⅰ的产物生成曲线 Figure 4 Time courses of the conversionⅠ to Ⅱand Ⅳby cellular lysates of Mycobacterium sp. MS136 |
1 g/L底物Ⅰ在pH 7.0的PBS中反应,只有产物Ⅱ的生成,45 h后,Ⅱ的转化率为6.7%(图 5)。说明Ⅰ发生C-21脱乙酰化反应即水解反应是自发进行的,而C1, 2脱氢反应是酶催化反应。

|
| 图 5 磷酸盐缓冲液转化Ⅰ的产物生成曲线 Figure 5 Time course of the conversion Ⅰ to Ⅱ by PBS |
分枝杆菌细胞裂解液分别以Ⅰ和Ⅱ为底物进行生物转化,如图 6所示,45h Ⅳ的转化率几乎相同(分别是56.8 %和57.3%)。以上数据说明在分枝杆菌细胞裂解液转化Ⅰ的反应中:(1)反应顺序为Ⅰ自发水解形成Ⅱ,Ⅱ经kstD催化为Ⅳ;(2)从Ⅱ到Ⅳ的C1, 2脱氢酶催化反应是关键步骤。

|
| 图 6 分枝杆菌细胞裂解液转化Ⅰ和Ⅱ的产物生成曲线 Figure 6 Time courses of the conversion Ⅰ and Ⅱ to Ⅳ by cellular lysates of Mycobacterium sp. MS136 |
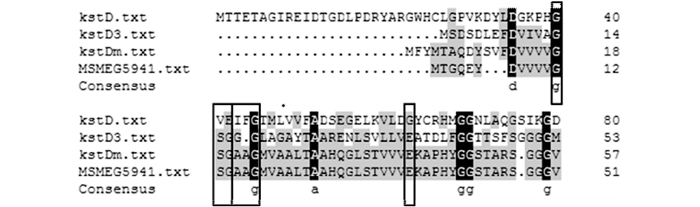
已获得的KSTD氨基酸序列与耻垢分枝杆菌Mycobacterium smegmatis的C1, 2位脱氢酶氨基酸序列比对分析结果如图 7所示,MSMEG5941和kstDM的氨基酸序列同源性最高,为88%;与kstD3和kstD的同源性较低,分别为36%和12%。kstD3和kstDM的黄素腺嘌呤二核苷酸结合位点(Flavin adenine dinucleotidebinding,FAD-binding)与Van等[22]推测的KSTD的FAD-binding序列一致,即GSG(G/A)(G/A)(G/A)X17E。根据KSTD氨基酸序列比对分析结果,与kstD和kstD3相比,kstDM和MSMEG5941的氨基酸序列同源性最高,可能其脱氢酶活性最高。
|
| 图 7 KSTD氨基酸序列分析 Figure 7 Amino acid sequence alignments of KSTD |
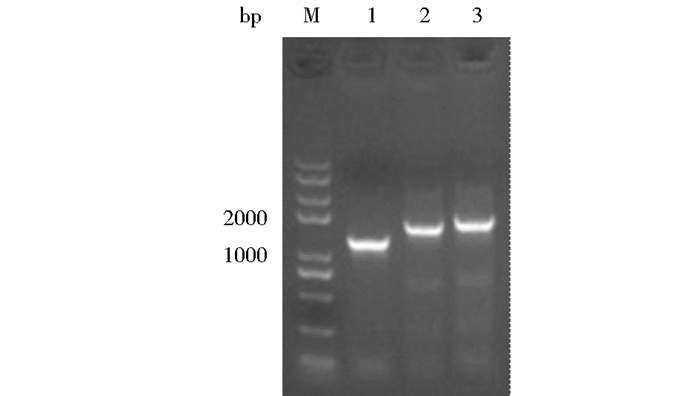
分枝杆菌中kstD、kstD3和kstDM的基因长度分别为1 200bp、1 560bp和1 713bp,以合成的质粒为模板进行扩增PCR,产物经1%琼脂糖电泳检测,在2 000bp以下可见3条明显的特异性条带(图 8),与目的片段的大小位置相符。将目的基因连接到载体pMV261上,转入E.coli DH5α中,提取重组质粒pMV261-kstD、pMV261-kstD3和pMV261-kstDM,采用质粒测序引物pMV261-F和pMV261-R进行PCR验证和测序验证,结果表明各重组质粒构建成功。通过测序引物T7和T7ter对重组质粒pET-kstD、pET-kstD3和pET-kstDM进行PCR验证和测序验证,结果表明各重组质粒构建成功。
|
| 图 8 kstD、kstD3和kstDM的PCR产物 Figure 8 PCR productions of kstD、kstD3 and kstDM |
对分枝杆菌重组菌株MS136-kstD,MS136-kstD3,MS136-kstDM细胞裂解液的转化特性进行研究,考察其对Ⅰ的转化效率,用HPLC法检测产物Ⅳ的生成情况,同时以导入pMV261空白载体的出发菌株细胞裂解液作对照。如图 9所示,1 g/L底物Ⅰ在pH7.0的分枝杆菌细胞裂解液中反应45 h后,重组菌株MS136-kstD,MS136-kstD3和MS136-kstDM Ⅳ的转化率分别为60.6%,69.5%和78.4%,出发菌株Ⅳ的转化率为56.8%,最多提高了38.9%。以上数据表明过表达kstD基因(特别是kstDM)后,kstD的活力明显提高,加速脱氢反应,导致Ⅳ大量积累。

|
| 图 9 出发菌与重组菌的转化率比较 Figure 9 Time courses of the conversion Ⅰ to Ⅳ by cellular lysates of Mycobacterium sp. MS136 |
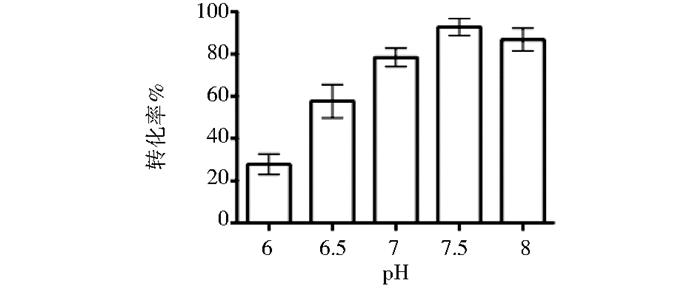
缓冲液的pH不同会影响底物Ⅰ的转化。本实验对比了重组菌株MS136-kstDM细胞裂解液pH值分别为6,6.5,7,7.5,8时Ⅳ的转化率,反应条件为底物投料量1 g/L反应45 h。由图 10可知,pH7.5最佳,此时Ⅳ的转化率达到92.8%,其原因可能是碱性条件加速水解反应,使Ⅰ更易水解为Ⅱ,再由KSTD酶催化为Ⅳ; 也可能是pH7.5时KSTD酶活更高,而pH 8的裂解液降低了KSTD酶活,导致Ⅳ的转化率有所下降。
|
| 图 10 pH对产物Ⅳ转化率的影响 Figure 10 The effect of pH on conversion rate of Ⅳ |
对大肠杆菌重组菌株BL21(DE3)-kstD,BL21(DE3)-kstD3,BL21(DE3)-kstDM细胞裂解液的转化特性进行研究,考察其对Ⅰ的转化效率,用HPLC法检测产物Ⅳ的生成情况。如图 11所示,1 g/L底物Ⅰ在pH7.5的大肠杆菌细胞裂解液中反应45 h后,重组菌株BL21(DE3)-kstD,BL21(DE3)-kstD3,BL21(DE3)-kstDM Ⅳ的转化率分别为48.7%,71.6 %和79.5 %,比分枝杆菌重组菌株MS136-kstDM(92.8 %),BL21(DE3)-kstDM Ⅳ的转化率低,其原因可能是分枝杆菌Mycobacterium sp. MS136自身含有编码C1, 2位脱氢酶的基因,且能翻译出有活性的脱氢酶,而大肠杆菌BL21(DE3) 则不能。

|
| 图 11 大肠杆菌重组菌的转化率比较 Figure 11 Time courses of the conversion Ⅰ to Ⅳ by cellular lysates of E.coli BL21(DE3) |
产物Ⅳ是用于生产9-氟甾体激素(如地塞米松,倍他米松,曲安西龙等)的关键前体[10-11]。本实验以Mycobacterium sp. MS136为出发菌株,通过细胞裂解液转化Ⅰ生产Ⅳ,并阐明了Ⅰ转化为Ⅳ的反应机理,即Ⅰ先自发水解为中间体Ⅱ,Ⅱ经kstD催化发生C1, 2位脱氢反应转化为产物Ⅳ。为提高产物Ⅳ的转化率,在分枝杆菌中分别过表达编码kstD的关键基因:kstD、kstD3和kstDM,并优化缓冲液pH,结果表明1 g/L底物Ⅰ在pH7.5的重组菌株MS136-kstDM细胞裂解液中反应45 h,产物Ⅳ的转化率为92.8%,比优化前提高了63.4 %。本研究首次提出用分枝杆菌细胞裂解液生产甾药前体,为甾体激素类药物的定向转化和工业化生产提供了理论依据。
| [1] |
Tong W Y, Dong X. Microbial biotransformation:recent developments on steroid drugs. Recent Pat Biotechnol, 2009, 3(2): 141-153. DOI:10.2174/187220809788700157 |
| [2] |
Croxatto H B. Progestin implants. Steroids, 2000, 65(10-11): 681-685. DOI:10.1016/S0039-128X(00)00124-0 |
| [3] |
Hughes D T, Sperandio V. Inter-kingdom signalling:communication between bacteria and their hosts. Nat Rev Microbiol, 2008, 6(2): 111-120. DOI:10.1038/nrmicro1836 |
| [4] |
Bragin J, Saowakhon S, Manosroi A. A novel one-step biotransformation of cortexolone-21-acetate to hydrocortisone acetate using Cunninghamella blakesleeana ATCC 8688a. Enzyme Microb Technol, 2007, 41(3): 322-325. DOI:10.1016/j.enzmictec.2007.02.014 |
| [5] |
Funder J W. Minireview:aldosterone and mineralocorticoid receptors:past, present, and future. Endocrinology, 2010, 151(11): 5098-5102. DOI:10.1210/en.2010-0465 |
| [6] |
García J L, Uhía I, Galán B. Catabolism and biotechnological applications of cholesterol degrading bacteria. Microb Biotechnol, 2012, 5(6): 679-699. DOI:10.1111/mbt.2012.5.issue-6 |
| [7] |
Bragin E Y, Shtratnikova V Y, Dovbnya D V, et al. Comparative analysis of genes encoding key steroid core oxidation enzymes in fast-growing Mycobacterium spp. strains. J Steroid Biochem Mol Biol, 2013, 138(10): 41-53. |
| [8] |
Xie R, Shen Y, Qin N, et al. Genetic differences in ksdD influence on the ADD/AD ratio of Mycobacterium neoaurum. J Ind Microbiol Biotechnol, 2015, 42(4): 507-513. DOI:10.1007/s10295-014-1577-2 |
| [9] |
Cruz A, Angelova B, Fernandes P, et al. Study of key operational parameters for the side-chain cleavage of sitosterol by free mycobacterial cells in bis-(2-ethylhexyl) phthalate. Biocatal Biotransform, 2004, 22(3): 189-194. DOI:10.1080/10242420412331283297 |
| [10] |
Fokina V V, Sukhodol'skaya G V, Gulevskaya S A, et al. The 1(2)-dehydrogenation of steroid substrates by Nocardioides simplex VKM Ac-2033D. Microbiology, 2003, 72(1): 24-29. DOI:10.1023/A:1022265720470 |
| [11] |
Fokina V V, Donova M V. 21-Acetoxy-pregna-4(5), 9(11), 16(17)-triene-21-ol-3, 20-dione conversion by Nocardioides simplex VKM Ac-2033D. J Steroid Biochem Mol Biol, 2003, 87(4-5): 319-325. DOI:10.1016/j.jsbmb.2003.10.002 |
| [12] |
Donova M V. Transformation of steroids by actinobacteria:a review. Applied Biochemistry and Microbiology, 2007, 43(1): 5-18. |
| [13] |
Donova M V, Egorova O V. Microbial steroid transformations:Current state and prospects. Appl Microbiol Biotechnol, 2012, 94(6): 1423-1447. DOI:10.1007/s00253-012-4078-0 |
| [14] |
Fernandes P, Cruz A, Angelova B, et al. Microbial conversion of steroid compounds:Recent developments. Enzyme Microb Technol, 2003, 32(6): 688-705. DOI:10.1016/S0141-0229(03)00029-2 |
| [15] |
Wang F Q, Yao K, Xu L Q, et al. Characterization and engineering of 3-ketosteroid-△1-dehydrogenase and 3-ketosteroid-9α-hydroxylase in Mycobacterium neoaurum ATCC 25795 to produce 9α-hydroxy-4-androstene-3, 17-dione through the catabolism of sterols. Metabolic Engineering, 2014, 24: 181-191. DOI:10.1016/j.ymben.2014.05.005 |
| [16] |
Wang F Q, Wei W, Fan S Y, et al. Inactivation and augmentation of the primary 3-ketosteroid-Δ1-dehydrogenase in Mycobacterium neoaurum NwIB-01:biotransformation of soybean phytosterols to 4-androstene-3, 17-dione or 1, 4-androstadiene-3, 17-dione. Appl Environ Microbiol, 2010, 76(13): 4578-4582. DOI:10.1128/AEM.00448-10 |
| [17] |
Zhang W Q, Shao M L, Rao Z M, et al. Bioconversion of 4-androstene-3, 17-dione toandrost-1, 4-diene-3, 17-dione by recombinant Bacillus subtilis expressing ksdd gene encoding 3-ketosteroid-Δ1-dehydrogenasefrom Mycobacterium neoaurum JC-12. J Steroid Biochem MolBiol, 2013, 135(1): 36-42. |
| [18] |
Li Y, Lu F, Sun T, et al. Expression of ksdD gene encoding 3-ketosteroid-Δ1-dehydrogenase from Arthrobacter simplex in Bacillus subtilis. Lett Appl Microbiol, 2007, 44(5): 563-568. DOI:10.1111/lam.2007.44.issue-5 |
| [19] |
Malaviya A, Gomes J. Androstenedione production by biotransformation of phytosterols. Bioresource Technology, 2008, 99(15): 6725-6737. DOI:10.1016/j.biortech.2008.01.039 |
| [20] |
Shao M, Zhang X, Rao Z, et al. Enhanced production of androst-1, 4-diene-3, 17-dione by Mycobacterium neoaurum JC-12 using three-stage fermentation strategy. PLoS One, 2015, 10(9): e0137658. DOI:10.1371/journal.pone.0137658 |
| [21] |
Flett F, Mersinias V, Smith C P. High efficiency intergeneric conjugal transfer of plasmid DNA from Escherichia coli to methyl DNA-restricting streptomycetes. FEMS Microbiol Lett, 1997, 155(2): 223-229. DOI:10.1111/j.1574-6968.1997.tb13882.x |
| [22] |
Van D G, Hessels G I, Van G R, et al. Targeted disruption of the kstD geneencoding 3-ketosteroid-Δ1-dehydrogenase isoenzyme of Rhodococcus erythropolis SQ1. Appl Environ Microbiol, 2000, 66(5): 2029-2036. DOI:10.1128/AEM.66.5.2029-2036.2000 |
 2017, Vol. 37
2017, Vol. 37




