文章信息
- 刘延娟, 李旭娟, 袁航, 刘娴, 高艳秀, 龚明, 邹竹荣.
- LIU Yan-juan, LI Xu-juan, YUAN Hang, LIU Xian, GAO Yan-xiu, GONG Ming, ZOU Zhu-rong.
- 融合酰基载体蛋白可增强大肠杆菌重组蛋白的可溶性和热稳定性
- Fusing the Acyl Carrier Protein Enhances the Solubility and Thermostability of the Recombinant Proteins in Escherichia coli
- 中国生物工程杂志, 2017, 37(7): 115-123
- China Biotechnology, 2017, 37(7): 115-123
- http://dx.doi.org/DOI:10.13523/j.cb.20170718
-
文章历史
- 收稿日期: 2017-01-09
- 修回日期: 2017-03-11
2. 云南省农业科学院甘蔗研究所 开远 661600
2. Sugarcane Research Institute, Yunnan Academy of Agricultural Sciences, Kaiyuan 661600, China
大肠杆菌表达系统具有遗传背景清楚、培养周期短、操作简单和目的基因表达水平高等特点,已成为当前重组蛋白生产的主要途径[1]。但是,很多异源功能蛋白在此系统中经常以不溶的包涵体形式获得高效表达,后续纯化需要繁琐的变性和复性过程[2]。目前,针对此问题已有一些手段(如降低温度[3]、更换宿主菌[4]、使用增溶融合标签[5])能够促进重组蛋白的可溶性表达。其中,基于增溶标签的融合基因表达策略因效果显著而被广泛采用[5],这些增溶标签包括大肠杆菌的麦芽糖结合蛋白(MBP)[6]、硫氧还蛋白(Trx)[7]和一些超酸性[含有高比例的酸性氨基酸残基(aa)]小分子蛋白(msyB、yjgD[8-9])等。另外,蛋白质的热稳定性也影响到它的功能、活性和长期保存,特别对一些工业酶制剂和多肽类药品而言尤为重要[10]。目前,普遍是通过基因突变法来筛选蛋白质的耐热突变体,效果虽好,但过程复杂且通常仅适用于某一特定靶蛋白[10-11]。除此之外,也有少许研究使用热稳定融合标签来提高一些靶蛋白的热稳定性,具有简捷方便和一定的通用性[12-16]。这类用过的蛋白融合标签中的多数也具有超酸性,如大肠杆菌的msyB和yjgD[8-9, 14])以及人-synuclein蛋白[14-15]、拟南芥微管蛋白[14]和核酮糖-1, 5-二磷酸羧化/加氧酶(Rubisco)活化酶长链型[16]的酸性尾部。因此,综合来看,酸性蛋白融合标签似乎同时具有增强蛋白质可溶性和热稳定性的作用。
酰基载体蛋白(acyl carrier protein,ACP)是脂肪酸生物合成途径的必要组分,携带脂酰基穿梭于脂肪酸合成酶系中[17]。大肠杆菌ACP是一个高度酸性、由77个氨基酸组成的小分子肽链,它第37位的丝氨酸残基与它的辅基(磷酸泛酰巯基乙胺)上的磷酸基团相连,其辅基另一端的-SH基又与脂酰基通过硫脂键相连从而使ACP携带上脂酰基[17]。大肠杆菌ACP具备酸性蛋白融合标签的几个关键特性,如分子小、酸度大和细菌内源性。
本工作拟使用三个热不稳定靶蛋白,包括小桐子抗坏血酸过氧化物酶1(JcAPX1)[14, 16, 18]、大豆短链型Rubisco活化酶2(GmRCA2)[19]和大肠杆菌高丝氨酸O-转琥珀酰酶(EcMetA)[20],检验大肠杆菌ACP作为融合标签是否能有效增强大肠杆菌重组蛋白的可溶性和热稳定性。
1 材料与方法 1.1 材料质粒pET32a(+)和大肠杆菌菌株DH5、BL21(DE3) 均为本实验室保存。含小桐子抗坏血酸过氧化物酶1基因(JcAPX1)的大肠杆菌表达载体pET(JcAPX1) 为本实验室先前构建[14]。限制性内切核酸酶Nde Ⅰ和Xho Ⅰ、DNA连接酶和Phusion高保真DNA聚合酶购自Thermo Scientific公司;细菌基因组DNA提取试剂盒、质粒DNA提取试剂盒和DNA凝胶纯化试剂盒购自北京Tiangen公司;TransZol试剂、反转录试剂盒、PCR mix、DNA和蛋白质分子质量标准均为北京Transgene公司产品;其他生化试剂均为国产分析纯。引物(表 1)合成和DNA测序均由北京华大基因公司完成。
| Name | Sequence (5′ → 3′) | Remarks |
| EcACP-5Xh | GTGTCCTCGAGAGCACTATCGAAGAACG | Xho Ⅰ① |
| EcACP-3Xh | GATTACTCGAGAGCCTGGTGGCCGTTGATG | Xho Ⅰ |
| EcACPm-Fw | TGGGCGCGGATGGTCTTGACACCGTTGAGCTG | |
| EcACPm-Rv | GACCATCCGCGCCCAGGTCTTCAA | |
| GmRCA2-5Nd | GCTGTCATATGGCTGTAGAAGAGAAGAAAGAGATTG | Nde Ⅰ |
| GmRCA2-3Xh | GATTACTCGAGAGATTGGAAGAAAGTTCCCCTGTTA | Xho Ⅰ |
| EcMetA-5Nd | GCGTTCATATGCCGATTCGTGTGCC | Nde Ⅰ |
| EcMetA-3Xh | GATTACTCGAGGTCCAGCGTTGGATTCATG | Xho Ⅰ |
| Pt7Up-Fw | ACCGCGAAATTAATACGACTCAC | Upstream of T7 promoter in pET32a(+) |
| Tt7Dw-Rv | ACCGGATATAGTTCCTCCTTTCAG | Downstream of T7 terminator in pET32a(+) |
| Note: ① The sites of introduced restriction enzymes are underlined | ||
1.2 方法 1.2.1 基因克隆及其大肠杆菌表达载体构建
用TransZol试剂提取大豆幼苗叶片总RNA,取少量反转录后作为PCR模板。利用引物GmRCA2-5Nd、GmRCA2-3Xh(根据GenBank中参考序列NM_001253316设计)和Phusion高保真DNA聚合酶扩增大豆Rubisco活化酶2基因GmRCA2。GmRCA2的PCR片段纯化后用Nde Ⅰ和Xho Ⅰ双酶切,然后与经同样双酶切的载体pET32a(+)片段连接,构建成其大肠杆菌表达载体pET(GmRCA2),重组克隆用基因上游引物GmRA2-5Nd和载体pET32a(+)下游引物Tt7Dw-Rv通过菌落PCR鉴定。另外,直接以试剂盒提取的大肠杆菌DH5基因组DNA为模板,利用引物EcMetA-5Nd、EcMetA-3Xh[根据GenBank中参考序列NC_000913 (4214280..4215209nt)设计]扩增大肠杆菌MetA基因EcMetA。EcMetA的PCR片段纯化后也通过Nde Ⅰ和Xho Ⅰ双酶切克隆到载体pET32a(+)上,构建成其大肠杆菌表达载体pET(EcMetA),重组克隆用基因上游引物EcMetA-5Nd和载体pET32a(+)下游引物Tt7Dw-Rv通过菌落PCR鉴定。随后,用载体pET32a(+)上、下游引物Pt7Up-Fw和Tt7Dw-Rv对质粒pET(GmRCA2) 和pET(EcMetA)进行双向测序,验证所扩增的目标基因。接着,利用引物EcACP-5Xh、EcACP-3Xh和突变引物EcACPm-Fw、EcACPm-Rv[根据GenBank中参考序列NC_000913 (1151615..1151851 nt)设计],采用引物重叠延伸法[21]从大肠杆菌DH5基因组中扩增其酰基载体蛋白基因ACP并使其编码的第37位丝氨酸残基突变为甘氨酸残基。ACP的PCR片段纯化后通过Xho Ⅰ酶切,然后分别插入到载体pET(JcAPX1)[14]、pET(GmRCA2) 和pET(EcMetA)上目标基因编码区后面的Xho Ⅰ位点,构建成其大肠杆菌融合表达载体pET(JcAPX1-ACP)、pET(GmRCA2-ACP)和pET(EcMetA-ACP),重组克隆分别用目标基因的上游引物和ACP下游引物EcACP-3Xh通过菌落PCR鉴定。最后,利用载体pET32a(+)下游引物Tt7Dw-Rv对这些基因融合进行测序验证。
1.2.2 大肠杆菌诱导表达和蛋白质电泳将表达载体通过化学法转化大肠杆菌BL21(DE3)。按1:100比例转接单克隆菌在37℃的过夜培养物,继续于37℃培养至OD600为0.6,然后加入终浓度为0.5mmol/L的IPTG,30℃诱导培养8h。离心收集14ml诱导菌的菌体,用4ml PBS缓冲液(pH 7.4) 重悬后进行超声破菌。取16L破菌液于12 000r/min离心5min,转移全部上清作为样品S,沉淀用16μl PBS缓冲液重悬后作为样品P,同时取16μl破菌液作为总蛋白质样品T。此外,将200μl诱导前菌液离心后的菌体用16μl PBS缓冲液重悬,作为未诱导样品(UI)。所有样品都加4μl 5×蛋白质上样缓冲液,混匀后煮沸5min,然后用12% SDS-PAGE进行电泳分析[22]。
1.2.3 重组表达蛋白质样品的温度梯度处理和SDS-PAGE分析取200μl破菌液于12 000r/min离心5min;然后分别取16μl上清于几个薄壁PCR管中,用Eppendorf梯度PCR仪模拟温度梯度,根据不同目标蛋白均匀选择几个温度点,处理30min;接着将每个样品于12 000r/min离心5min,转移全部上清作为样品S(标号S1~Sn),沉淀用16μl预冷的PBS缓冲液(pH7.4) 重悬后作为样品P(标号P1~Pn)。最后,往各个样品加4μl 5×蛋白质上样缓冲液并混匀,煮沸5min后用12% SDS-PAGE进行电泳分析[22]。
1.2.4 APX酶活性分析重组蛋白JcAPX1及其融合蛋白JcAPX1-ACP的温度梯度处理及其分相样品(S、P)制备同上。用12%非变性PAGE胶进行电泳分离后,参照Mittler和Zilinskas[23]的方法进行APX胶活性染色。另外,参照Chen和Asada[24]的方法进行APX酶活性的分光光度法测定,然后将未处理样品的酶活性标准化为100%,并以此为参照计算出所有温度处理过样品的相对酶活性。
1.2.5 生物软件应用和统计分析引物设计、核酸和蛋白质的序列和特性分析采用Invitrogen公司的Vector NT suite 11.5软件。使用Bio-Rad凝胶成像和分析软件Quantity One对SDS-PAGE胶上目的蛋白条带进行灰度定量分析,得到其扣除背景的灰度值,以此估算蛋白质量;然后,根据同一重组蛋白在S、P中的含量来计算其可溶性[= S/(S+P)×100 %]。另外,在不同温度处理条件下,通过比较重组蛋白的可溶性变化来评判它的热稳定性。数据处理和统计作图使用Microsoft Excel。
2 结果 2.1 靶基因克隆及其大肠杆菌表达载体构建通过RT-PCR,本工作从大豆幼苗叶片中成功分离到大豆Rubisco活化酶2基因GmRCA2,其PCR片段大小约为1.15kb,与预期一致(图 1a)。纯化后通过其引物上酶切位点Nde Ⅰ和Xho Ⅰ克隆到载体pET32a(+)上,构建了其大肠杆菌表达载体pET(GmRCA2),其阳性重组克隆通过菌落PCR得到鉴定(图 1b)。进一步的测序结果表明GmRCA2基因编码区与其GenBank中参考序列NM_001253316几乎完全一致,只有3个同义突变。
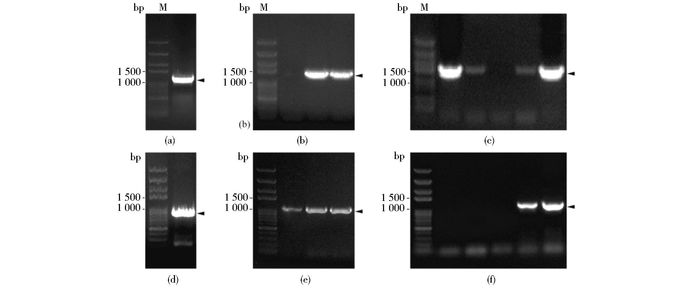
|
| 图 1 靶基因克隆及其大肠杆菌表达载体的构建 Figure 1 Cloning of the target genes and construction of their E. coli expression vectors PCR amplification of the target genes GmRCA2 (a), EcMetA (d) and colony PCR identification of the expression vectors pET(GmRCA2) (b), pET(EcMetA) (e) as well as the fusion expression vectors pET(GmRCA2-ACP) (c), pET(EcMetA-ACP) (f). Arrows indicate the target PCR bands. M: DNA marker |
另外,本工作还直接通过基因组PCR从大肠杆菌中扩增得到MetA酶基因EcMetA,大小约为0.95kb,与预期相符(图 1d)。其PCR片段纯化后同样通过酶切位点Nde Ⅰ和Xho Ⅰ克隆到载体pET32a(+)上,构建了其大肠杆菌表达载体pET(EcMetA)并通过菌落PCR得到鉴定(图 1e)。进一步的测序结果表明EcMetA基因编码区与其GenBank中参考序列NC_000913 (4214280..4215209nt)完全相同。
随后,我们采用引物重叠延伸法从大肠杆菌基因组中扩增并突变其酰基载体蛋白基因ACP(其编码的第37位丝氨酸残基变为甘氨酸残基)。ACP片段再通过Xho Ⅰ酶切位点分别插入到载体pET(GmRCA2) 和pET(EcMetA)上目标基因编码区后面,得到相应融合基因的大肠杆菌表达载体pET(GmRCA2-ACP)和pET(EcMetA-ACP),并通过菌落PCR鉴定(图 1c、f)。同样,将ACP片段插入到pET(JcAPX1) 中也获得了其融合表达载体pET(JcAPX1-ACP)(结果未显示)。使用载体下游引物Tt7Dw-Rv对这三个融合表达载体进行定向测序,结果表明ACP序列(包括其突变点,231bp)及其与目标基因的融合与预期完全一致,未造成阅读框架移码。
通过比较大肠杆菌ACP、靶蛋白及其融合蛋白的一些特性,如大小(aa)、分子质量(MW)、在pH7.0的净电荷、等电点(pI)等(表 2),可以看出大肠杆菌ACP是一个超酸性小分子蛋白质,作为融合标签并未使其融合靶蛋白(JcAPX1-ACP、GmRCA2-ACP、EcMetA-ACP)的分子质量增大许多,却能大大提高它们的酸性(在pH7.0的净负电荷及其百分比增加、等电点降低)。
| Name | Size (aa) | MW (kDa) | Net charge at pH7.0 | Percentage of net charge (%) | pⅠ |
| ACP | 77 | 8.48 | -15 | 19.48 | 3.97 |
| JcAPX1 | 258 | 28.56 | -10 | 3.88 | 5.76 |
| JcAPX1-ACP | 337 | 37.27 | -26 | 7.72 | 4.91 |
| GmRCA2 | 394 | 44.14 | -8 | 2.03 | 5.60 |
| GmRCA2-ACP | 473 | 52.84 | -24 | 5.07 | 4.85 |
| MetA | 317 | 36.79 | -17 | 5.36 | 5.36 |
| MetA-ACP | 396 | 45.49 | -33 | 8.33 | 4.77 |
2.2 融合ACP可提高大肠杆菌重组靶蛋白的可溶性
将所构建的表达载体转化大肠杆菌BL21(DE3),并用IPTG在30℃进行诱导表达。每个表达菌通过超声裂解后,取样并分成总蛋白质(T)、上清(S)、沉淀(P)三个组分进行SDS-PAGE电泳分析。结果表明,三个重组靶蛋白JcAPX1、GmRCA2、EcMetA都有相当一部分是以不溶的沉淀形式(图 2a、d、g)存在,但其可溶性能被C端融合的ACP极大地增强,其重组融合蛋白JcAPX1-ACP、GmRCA2-ACP、EcMetA-ACP几乎全部可溶、位于上清中(图 2b、e、h)。进一步用Quantity One软件对凝胶上靶蛋白条带进行灰度定量,并以此估算重组蛋白的可溶性,结果也清楚表明ACP作为融合标签能显著促进靶蛋白在大肠杆菌中的可溶性表达(图 2c、f、i)。
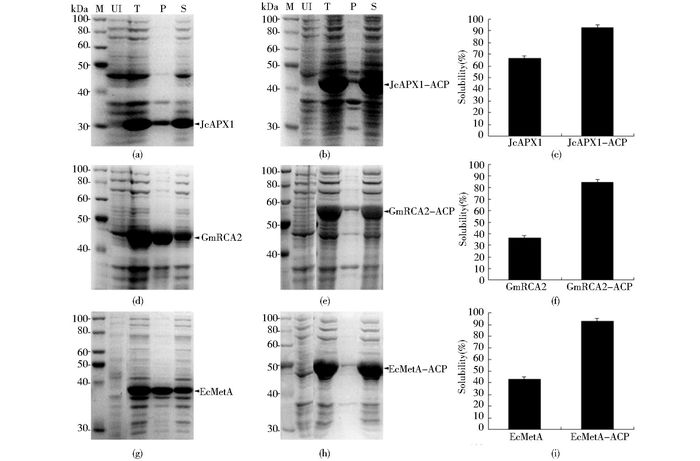
|
| 图 2 融合ACP可促进靶蛋白在大肠杆菌中的可溶性表达 Figure 2 ACP fusion enhances the soluble expression of the target proteins in E. coli Solubility comparison by SDS-PAGE analysis for the recombinant target proteins and their fusion forms, i.e. JcAPX1 (a) vs. JcAPX1-ACP (b), GmRCA2 (d) vs. GmRCA2-ACP (e), EcMetA (g) vs. EcMetA-ACP (h), and by protein band densitometric measurement for JcAPX1 vs. JcAPX1-ACP (c), GmRCA2 vs. GmRCA2-ACP (f), EcMetA vs. EcMetA-ACP (ⅰ), respectively. Arrows indicate the recombinant proteins M: protein molecular weight marker; UI: Cell lysate of the uninduced bacteria; T: Cell lysate of the induced bacteria; P: The pellet fraction of 'T'; S: The soluble fraction of 'T' |
由于本工作中的重组靶蛋白在大肠杆菌中都获得了高水平的表达,而且与细菌内部蛋白在SDS-PAGE胶上几无重叠(图 2),因此无需纯化直接用于热稳定性分析。重组蛋白样品在梯度PCR仪上几个合适的温度点处理30min后,每个经离心分为上清(S)和沉淀(P)两个组分并用于SDS-PAGE电泳分析。然后,进一步通过凝胶上靶蛋白条带的灰度定量,估算出每个重组蛋白样品经温度处理后的可溶性,并比较其随温度的变化。
由图 3a、b可以看出,重组JcAPX1蛋白在37℃处理后就有约30%变为不可溶的沉淀,而且其可溶性随着处理温度的升高而逐步下降,到接近48℃时几乎全部不可溶。相比较,JcAPX1-ACP融合蛋白的可溶性在37℃处理后变化很小,而且随处理温度升高而下降的趋势也较缓慢,到接近48℃时仍有约70%还保持在可溶状态。
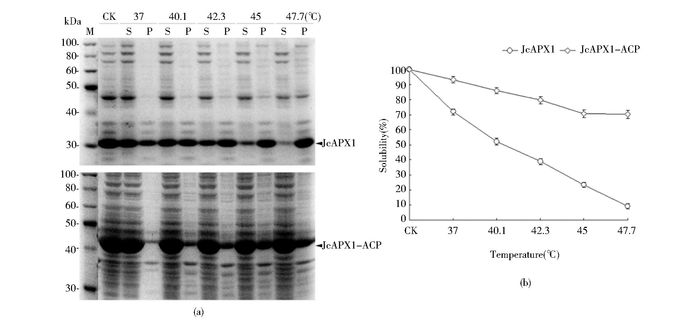
|
| 图 3 融合ACP可提高靶蛋白JcAPX1的热稳定性 Figure 3 ACP fusion improves the thermostability of the target protein JcAPX1 Comparison of the heat-induced solubility changes of the recombinant JcAPX1 protein and its fusion form JcAPX1-ACP, analyzed by SDS-PAGE (a) and protein band densitometric measurement (b). Arrows indicate the recombinant proteins M: Protein molecular weight marker; CK: Untreated sample; S, P: The soluble, pellet fraction of each heat-treated sample, respectively |
类似地,由图 4a、b可以看出,重组GmRCA2蛋白在近40℃处理后就有约40%变为不可溶的沉淀,而且其可溶性随着处理温度的升高而下降,到接近50℃时只剩下约30%可溶。相比较,GmRCA2-ACP融合蛋白的可溶性在近40℃处理后变化还不显著(高达80%),而且随处理温度升高而下降的趋势也十分缓慢,到接近50℃时仍有约75%还保持在可溶状态。这两种形式的GmRCA2蛋白在前面两个低温度处理点(近30℃和35℃)的可溶性变化基本一致。
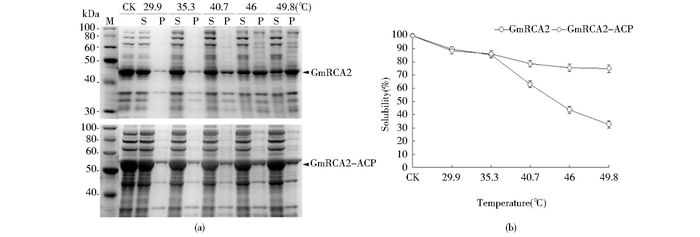
|
| 图 4 融合ACP可增强靶蛋白GmRCA2的热稳定性 Figure 4 ACP fusion improves the thermostability of the target protein GmRCA2 Comparison of the heat-induced solubility changes of the recombinant GmRCA2 protein and its fusion form GmRCA2-ACP, analyzed by SDS-PAGE (a) and protein band densitometric measurement (b). Arrows indicate the recombinant proteins M: Protein molecular weight marker; CK: Untreated sample; S, P: The soluble, pellet fraction of each heat-treated sample, respectively |
同样,对重组EcMetA及其融合蛋白EcMetA-ACP的热处理分析结果(图 5a、b)发现,EcMetA蛋白在近25℃的温度点就变得不稳定(约有20%丧失可溶性),到近30℃时其可溶性就急剧下降到约55%,而且这种快速下降趋势持续到近40℃(近35℃时略超过20%,近40℃时约为10%)。相比较,EcMetA-ACP融合蛋白的可溶性除在近25℃的温度点上略有(约10%)下降外,在后面的高温度处理点几乎没有明显变化,在近45℃时仍旧有高达90%还处于可溶状态。
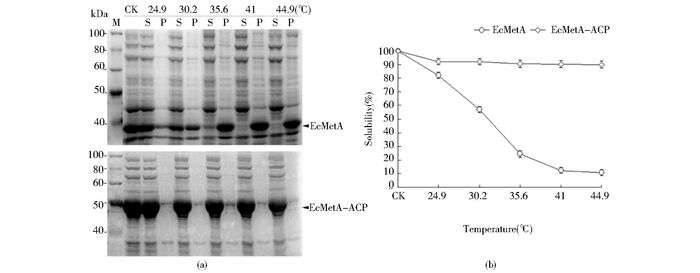
|
| 图 5 融合ACP可增强靶蛋白EcMetA的热稳定性 Figure 5 ACP fusion improves the thermostability of the target protein EcMetA Comparison of the heat-induced solubility changes of the recombinant EcMetA protein and its fusion form EcMetA-ACP, analyzed by SDS-PAGE (a) and protein band densitometric measurement (b). Arrows indicate the recombinant proteins M: Protein molecular weight marker; CK: Untreated sample; S, P: The soluble, pellet fraction of each heat-treated sample, respectively |
综合前面结果可以看出,融合ACP能够显著提高三个靶蛋白JcAPX1、GmRCA2、EcMetA的热稳定性,其融合蛋白形式在较高温度下仍能保持相当高的可溶性。
2.4 融合ACP可提高重组JcAPX1酶活的耐热性我们以JcAPX1为代表分析了ACP融合对高温下酶蛋白活性的影响。重组JcAPX1和其融合蛋白JcAPX1-ACP的温度处理及其分相样品(S、P)制备同上述相应的热稳定性分析实验。通过APX胶活性染色(图 6a)发现,重组JcAPX1酶活性在37℃温度处理点就已下降,到45℃还有部分保持,但在接近48℃就全部消失。相比较,融合蛋白JcAPX1-ACP的酶活性在所有低于48℃的温度处理点上基本没有太大变化(甚至略有上升),只是到了近50℃时才明显下降。而且,所有沉淀样品(P)均没有胶活性染色条带出现,说明沉淀中的JcAPX1和其融合酶蛋白JcAPX1-ACP是真正失活。当进一步通过更加灵敏的分光光度法测定上清样品(S)中的APX酶活性时(图 6b),同样发现融合蛋白JcAPX1-ACP的酶活耐热性要显著好于非融合形式的JcAPX1。在所有低于45℃的温度处理点上,JcAPX1及其融合蛋白JcAPX1-ACP的酶活性均没有下降,反倒与对照(CK,未经温度处理)相比有一定程度的上升;但到了近48℃时,JcAPX1酶活性就急剧下降至约60%,而JcAPX1-ACP酶活性虽表现出下降趋势但仍超出对照少许;而到了近50℃时,JcAPX1酶活性就基本完全丧失,JcAPX1-ACP酶活性仍能保持在80%左右;最后到53℃时,两者均完全失活。归纳起来,这些结果清楚表明融合ACP可有效促使JcAPX1酶活免遭热失活,使其耐热性至少提高了2℃。
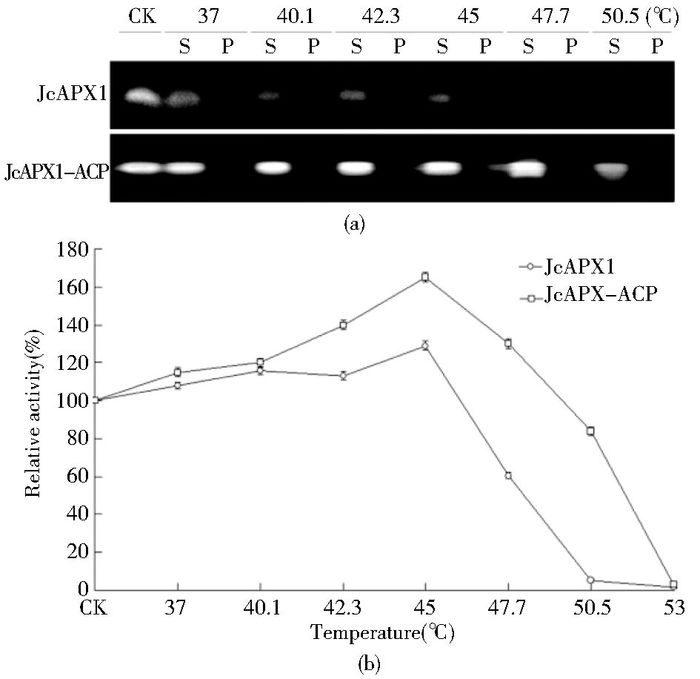
|
| 图 6 融合ACP可提高JcAPX1酶活的耐热性 Figure 6 ACP fusion improves the heat tolerance of JcAPX1 enzymatic activity Comparison of the heat-induced changes in enzymatic activity of the recombinant JcAPX1 protein and its fusion form JcAPX1-ACP, analyzed by in gel activity staining (a) and spectrometric assay (b) CK: Untreated sample; S, P: The soluble, pellet fraction of each heat-treated sample, respectively |
目前,基于融合基因表达策略以提高蛋白质可溶性和热稳定性已成为大肠杆菌重组蛋白高效生产、功能应用和长期保存的重要手段,而有效的融合标签便是其中的关键[5-8, 12-16]。在现已验证过的增溶标签和热稳定标签中,有不少具有分子质量小、超酸性和/或细菌内源性等特点[8, 14-16]。
大肠杆菌酰基载体蛋白(ACP)是一个高度酸性的小分子单肽链(由77个氨基酸组成,pH 7.0条件下净电荷为-15,见表 2),具备了酸性蛋白融合标签的几个关键特性。本工作将它与三个热不稳定靶蛋白JcAPX1、GmRCA2、EcMetA进行基因融合并使其在大肠杆菌中重组表达,发现大肠杆菌ACP作为融合标签能显著增强这些重组靶蛋白的可溶性(图 2)和热稳定性(图 3~图 5),并能有效保护JcAPX1酶活免遭热失活,使其耐热性提高了至少2℃(图 6)。大肠杆菌ACP标签的增溶作用与我们先前报道的其他超酸性蛋白标签的效果[8-9]一致,而它的热稳定作用和/或热保护作用也与我们最近验证的超酸性蛋白标签的功能[14, 16]符合。因此,大肠杆菌ACP可以成为增溶和热稳定双功能融合标签类型中新的一员,如同msyB和yjgD [8, 14],在大肠杆菌重组表达体系中应该具有潜在的应用前景。
蛋白质的可溶性和热稳定性密切相关[12],在某种角度上后者是前者在高温下变化的反映。超酸性蛋白融合标签的增溶作用可能主要取决于其赋予靶蛋白的强负电荷排斥作用,也可能与其本身的分子伴侣活性相关[8-9]。同样,超酸性标签的这种作用和活性也使得其融合蛋白在一定高温范围内不易聚集形成沉淀,从而表现出较高的热稳定性以及对靶蛋白活性的热保护作用。大肠杆菌ACP的高酸性可以使其三个热不稳定靶蛋白发生酸化,形成较酸性的融合蛋白JcAPX1-ACP、GmRCA2-ACP、EcMetA-ACP(表 2),从而提高它们的可溶性和热稳定性。
在本工作中,我们还将大肠杆菌ACP第37位的丝氨酸残基突变成甘氨酸残基,使它不能与其辅基(磷酸泛酰巯基乙胺)相连从而不能携带脂酰基。这样,“游离”形式的ACP作为融合标签发挥作用时可以防止疏水性脂酰基的干扰。
4 结论验证了大肠杆菌酰基载体蛋白(ACP)可以作为一个超酸性蛋白融合标签,能够显著提高大肠杆菌重组蛋白的可溶性和热稳定性,并能对靶蛋白活性提供一定的热保护作用。
| [1] |
Terpe K. Overview of bacterial expression systems for heterologous protein production: from molecular and biochemical fundamentals to commercial systems. Appl Microbiol Biotechnol, 2006, 72(2): 211-222. DOI:10.1007/s00253-006-0465-8 |
| [2] |
Cabrita L D, Bottomley S P. Protein expression and refolding -a practical guide to getting the most out of inclusion bodies. Biotechnol Annu Rev, 2004, 10(4): 31-50. |
| [3] |
Vasina J A, Baneyx F. Expression of aggregation-prone recombinant proteins at low temperatures: a comparative study of the Escherichia coli cspA and tac promoter systems. Protein Expr Purif, 1997, 9(2): 211-218. DOI:10.1006/prep.1996.0678 |
| [4] |
Miroux B, Walker J E. Over-production of proteins in Escherichia coli: mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels. J Mol Biol, 1996, 260(3): 289-298. DOI:10.1006/jmbi.1996.0399 |
| [5] |
Esposito D, Chatterjee D K. Enhancement of soluble protein expression through the use of fusion tags. Curr Opin Biotechnol, 2006, 17(4): 353-358. DOI:10.1016/j.copbio.2006.06.003 |
| [6] |
Kapust R B, Waugh D S. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein Sci, 1999, 8(8): 1668-1674. DOI:10.1110/(ISSN)1469-896X |
| [7] |
LaVallie E R, Lu Z, Diblasio-Smith E A, et al. Thioredoxin as a fusion partner for production of soluble recombinant proteins in Escherichia coli. Methods Enzymol, 2000, 326: 322-340. DOI:10.1016/S0076-6879(00)26063-1 |
| [8] |
Zou Z, Cao L, Zhou P, et al. Hyper-acidic protein fusion partners improve solubility and assist correct folding of recombinant proteins expressed in Escherichia coli. J Biotechnol, 2008, 135(4): 333-339. DOI:10.1016/j.jbiotec.2008.05.007 |
| [9] |
Zou Z, Fan Y, Zhang C. Preventing protein aggregation by its hyper-acidic fusion cognates in Escherichia coli. Protein Expr Purif, 2011, 80(1): 138-144. DOI:10.1016/j.pep.2011.06.004 |
| [10] |
Yu H, Huang H. Engineering proteins for thermostability through rigidifying flexible sites. Biotechnol Adv, 2014, 32(2): 308-315. DOI:10.1016/j.biotechadv.2013.10.012 |
| [11] |
Wijma H J, Floor R J, Janssen D B. Structure-and sequence-analysis inspired engineering of proteins for enhanced thermostability. Curr Opin Struct Biol, 2013, 23(4): 588-594. DOI:10.1016/j.sbi.2013.04.008 |
| [12] |
Huang H, Liu J, de Marco A. Induced fit of passenger proteins fused to Archaea maltose binding proteins. Biochem Biophys Res Commun, 2006, 344(1): 25-29. DOI:10.1016/j.bbrc.2006.03.151 |
| [13] |
Luke J M, Carnes A E, Sun P, et al. Thermostable tag (TST) protein expression system: engineering thermotolerant recombinant proteins and vaccines. J Biotechnol, 2011, 151(3): 242-250. DOI:10.1016/j.jbiotec.2010.12.011 |
| [14] |
Zhang M, Gong M, Yang Y, et al. Improvement on the thermal stability and activity of plant cytosolic ascorbate peroxidase 1 by tailing hyper-acidic fusion partners. Biotechnol Lett, 2015, 37(4): 891-898. DOI:10.1007/s10529-014-1754-4 |
| [15] |
Park S M, Jung H Y, Chung K C, et al. Stress-induced aggregation profiles of GST-alpha-synuclein fusion proteins: role of the C-terminal acidic tail of alpha-synuclein in protein thermosolubility and stability. Biochemistry, 2002, 41(12): 4137-4146. DOI:10.1021/bi015961k |
| [16] |
Zhang M, Li X, Yang Y, et al. An acidified thermostabilizing mini-peptide derived from the carboxyl extension of the larger isoform of the plant Rubisco activase. J Biotechnol, 2015, 212: 116-124. DOI:10.1016/j.jbiotec.2015.08.021 |
| [17] |
Chan D I, Vogel H J. Current understanding of fatty acid biosynthesis and the acyl carrier protein. Biochem J, 2010, 430(1): 1-19. DOI:10.1042/BJ20100462 |
| [18] |
Panchuk I I, Volkov R A, Sch? ffl F. Heat stress-and heat shock transcription factor-dependent expression and activity of ascorbate peroxidase in Arabidopsis. Plant Physiol, 2002, 129(2): 838-853. DOI:10.1104/pp.001362 |
| [19] |
Salvucci M E, Osteryoung K W, Crafts-Brandner S J, et al. Exceptional sensitivity of Rubisco activase to thermal denaturation in vitro and in vivo. Plant Physiol, 2001, 127(3): 1053-1064. DOI:10.1104/pp.010357 |
| [20] |
Gur E, Biran D, Gazit E, et al. In vivo aggregation of a single enzyme limits growth of Escherichia coli at elevated temperatures. Mol Microbiol, 2002, 46(5): 1391-1397. DOI:10.1046/j.1365-2958.2002.03257.x |
| [21] |
Horton R M, Hunt H D, Ho S N, et al. Engineering hybrid genes without the use of restriction enzymes: gene splicing by overlap extension. Gene, 1989, 77(1): 61-68. DOI:10.1016/0378-1119(89)90359-4 |
| [22] |
Sambrook J F, Russell D W. Molecular Cloning: A Laboratory Manual, 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001.
|
| [23] |
Mittler R, Zilinskas A. Detection of ascorbate peroxidase activity in native gels by inhibition of the ascorbate dependent reduction of nitroblue tetrazolium. Anal Biochem, 1993, 212(2): 540-546. DOI:10.1006/abio.1993.1366 |
| [24] |
Chen G X, Asada K. Ascorbate peroxidase in tea leaves: occurrence of two isozymes and the differences in their enzymatic and molecular properties. Plant Cell Physiol, 1989, 30(7): 987-998. |
 2017, Vol. 37
2017, Vol. 37




