文章信息
- 杨建伟, 薛正莲, 朱昊, 杨蒙, 王洲.
- YANG Jian-wei, XUE Zheng-lian, ZHU Hao, YANG Meng, WANG Zhou.
- ARTP辐照对磷脂酶A1重组质粒的诱变效应
- Study on the Mutagenic Effect of Phospholipase A1 Recombinant Plasmid by ARTP
- 中国生物工程杂志, 2017, 37(6): 78-85
- China Biotechnology, 2017, 37(6): 78-85
- http://dx.doi.org/DOI:10.13523/j.cb.20170612
-
文章历史
- 收稿日期: 2016-12-02
- 修回日期: 2017-03-17
常压室温等离子体(ARTP)作为一种新型的诱变技术,可以快速诱变各类微生物,已成为获取优势菌株的最有效的一种方法[1-2]。ARTP利用等离子体射流改变微生物遗传特性,可直接改变核苷酸结构或造成DNA双链或单链断裂,诱发细胞启动应急修复机制,从而导致核苷酸序列的改变[3-5]。ARTP也可以在细胞表面发生作用,通过间接影响胞内遗传物质而引起代谢途径的改变,因此利用ARTP诱变所得突变性状能在胞内稳定遗传[6-7]。
磷脂酶A1(phospholipase A1,PLA1) 是一类能催化磷脂Sn-1位上脂肪酸水解,生成游离脂肪酸和溶血性磷脂的酶类[8-9]。目前,磷脂酶A1的应用越来越广泛,尤其是在油脂脱胶行业[10]。随着人们对磷脂酶A1需求量的增加,利用微生物发酵生产磷脂酶A1引起了人们的关注。由于工程菌发酵具有目的性强、产量高、易纯化等一系列的优点,利用工程菌生产磷脂酶A1的研究必将更加深入[11]。
质粒是存在于细胞内与染色体相互独立的遗传单位,它是一种能自主复制的共价闭合环状双链DNA分子[12]。在基因工程中,质粒常被用作为运载体[13]。最近十年来,由于分子生物学实验方法的迅速发展,极大地促进了对质粒的研究。目前,运用各种诱变技术对质粒进行诱变研究已较为广泛[14-15],为了进一步提高诱变效率、使诱变目的性增强,已报道有利用ARTP对工程菌进行诱变来提高产量的[16],而利用ARTP对质粒直接诱变的确极为少见。因此,本研究为进一步揭示ARTP作用于离体质粒DNA的生物学效应及为生物诱变育种提供实验依据和技术参考。
1 材料与方法 1.1 材料质粒pET28a-plaB(携带磷脂酶A1及辅助蛋白S基因,7.1 kb),BP28工程菌(携带pET28a-plaB质粒)、宿主菌BL21(本实验室保藏),ARTP诱变仪本实验室购置,质粒提取试剂盒、琼脂糖均购自上海生工公司,其它试剂均购自国药。
LB培养基:酵母粉5 g,胰蛋白胨10 g,氯化钠10 g,蒸馏水1000 ml,调pH到7.0。
PLB固体培养基:LB培养基90 ml,10 %卵磷脂10 ml,0.01 %溴甲酚紫3 ml,1 mol/L CaCl2 2.5 ml,琼脂粉2 g。
以上培养基均在121 ℃,灭菌20 min,培养基中的卵磷脂、氯化钙和溴甲酚紫需分开灭菌后混合使用。
自诱导培养基:蛋白胨10 g,葡萄糖0.8 g,乳糖5 g,磷酸氢二钠0.025 mol/L,磷酸二氢钾0.025 mol/L,硫酸镁1 mmol,甘氨酸7.5 g,1 000 ml蒸馏水,115 ℃灭菌15 min。
8 %卵磷脂配制:卵磷脂8 g、CaCl2 0.222 g、水100 ml、乳化器乳化30 min。
10 %卵磷脂配制:卵磷脂10 g、水100 ml、乳化器乳化30 min。
柠檬酸-磷酸氢二钠缓冲液(pH 3.0、pH 4.0、pH 5.0)
PB缓冲液(pH 6.0、pH 7.0、pH 8.0)
甘氨酸-氢氧化钠缓冲液(pH 9.0、pH 10.0)
1.2 方法 1.2.1 DNA制备按常规方法将工程菌BP28(携带目的质粒pET28a)接种到含100 μg/ml卡那霉素的LB液体培养基中,过夜培养12~16 h,按照质粒提取试剂盒步骤制备质粒样品。紫外可见光分光光度计测定其浓度及纯度,质粒DNA浓度(μg/ml)=OD260nm×50×30(稀释率)[17]。2 μl质粒样品与1 μl上样缓冲液混合,1%琼脂糖凝胶电泳检测,凝胶成像仪拍照。
1.2.2 ARTP诱变将质粒样品稀释到50μg/ml,取18个已灭菌的PCR管盖,在每个PCR管盖上滴加稀释好的质粒样品20μl,将其放入ARTP诱变仪中诱变0s、30s、60s、90s、120s、150s,每组设3个平行,诱变参数为400 W,10 slpm。
1.2.3 质粒结构检测取诱变后的质粒10 μl与2 μl上样缓冲液混合,1%琼脂糖凝胶电泳检测,凝胶成像仪拍照观察。
1.2.4 BL21感受态制备将过夜活化的BL21菌液以2%比例接种于100 ml LB液体培养基中,37 ℃、200 r/min震荡培养至OD600nm=0.5左右;冰浴10 min,4 100r/min离心10 min,弃上清;加入30 ml预冷的0.05 mol/L CaCl2重悬细胞,冰浴10 min,4 100r/min离心10 min,弃上清;最后全部菌液用4 ml(0.1 mol/L CaCl2:30%甘油=1:1) 重悬后分装至Dof管中,每支Dof管200 μl,-70度保存。
1.2.5 转化取制备好的感受态细胞,冰上解冻后加入5 μl诱变后的质粒,温和混匀后冰浴30 min,42℃热激90s,立即冰浴15 min,加入800 μl LB液体培养基37 ℃、150 r/min恢复培养1 h。离心30s,弃上清液900 μl,剩余上清液与沉淀混匀后涂布于含100 μg/ml卡那霉素的PLB平板中。37℃培养48h,计算转化率及突变率。
相对转化率=(实验组菌落数/对照组菌落数)×100%。
突变率=(突变数/总菌落数)×100%。
正突变率=(诱变菌株的圈径比大于出发菌株的圈径比的个数/总菌落数)×100%。
1.2.6 最优诱变时间验证对分析出的最优诱变时间进行重复实验,挑取圈径比较高的菌株,活化后按1%接种量接入自诱导培养基中,37 ℃、200 r/min培养6 h,测定其酶活。选取酶活最高的菌株与原始菌株磷脂酶A1基因测序比对、分析。磷脂酶A1酶活测定方法参照国标GBT 23535-2009,酶活定义为:1g固体酶粉(或1ml液体酶),在一定温度和pH条件下,1 min水解底物产生1μmol的可滴定的脂肪酸,即为1个酶活单位,U/g或U/ml。酶活测定方法:.取A(对照组)、B(实验组)、C(实验组) 3个100 ml烧杯,分别加入4 ml 8%大豆卵磷脂和5 ml pH 6.0 PB缓冲液,混匀,40℃预热5 min;向对照组中加入15 ml乙醇,混匀;向每组中加入1 ml粗酶液,40℃反应15 min;向实验组加入15 ml乙醇混匀终止反应。0.05 mol/L NaOH滴定反应液至pH=10.3,记录所用NaOH体积,代入公式计算酶活。
酶活计算公式为:X=(V-V0)×C×50×n/(0.05×t)
其中:X为样品的酶活力,U/ml;V为滴定样品时消耗的NaOH标准溶液体积,ml;V0为滴定空白时消耗的NaOH标准溶液体积,ml;c为NaOH标准溶液的浓度,mol/L;50~0.05 mol/L NaOH标准溶液1.00 ml相当于脂肪酸50 μmol;n为酶液样品的稀释倍数;t为测定酶活时的反应时间。
1.2.7 磷脂酶A1野生酶与突变酶酶学性质比对在磷脂酶A1酶活测定的标准方法(GBT 23535-2009) 上,分别设定pH及温度梯度,测定酶活,将其转化为相对酶活力,对比其最适的pH及温度。
1.2.8 磷脂酶A1野生酶与突变酶蛋白结构比对利用蛋白结构在线预测软件Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page, cgi?id=index)对高酶活菌株12及对照菌株CK磷脂酶A1基因序列进行蛋白空间结构预测、比对。其空间结构预测模板为与其相似度99.7 %的脂肪酶d3tgla。
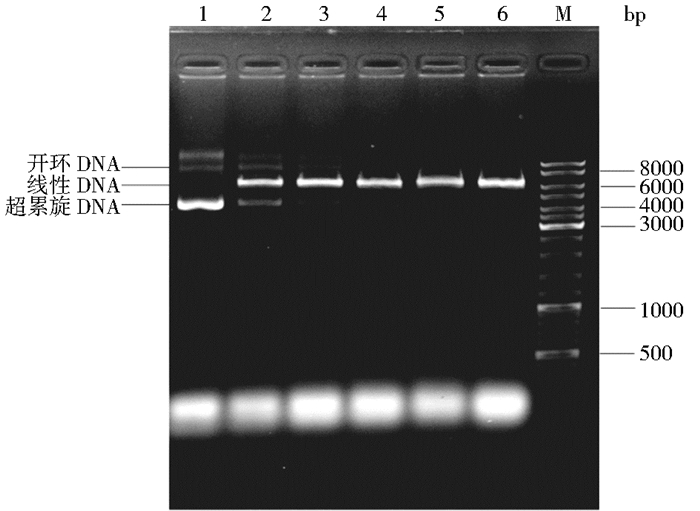
2 结果与讨论 2.1 ARTP对质粒的损伤效应质粒在受到外力作用下,其结构会发生改变甚至损伤。先前研究表明,质粒在受到激光作用下,低剂量时超螺旋结构解开形成开环结构,高剂量时单链或双链断裂形成线性结构,Li等[19]利用ARTP对质粒pP-GFP诱变效应进行了研究,探究了不同诱变时间、诱变剂量、诱变功率及诱变距离对质粒结构的影响,通过琼脂糖凝胶电泳检测发现,在诱变强度较低的情况下,质粒超螺旋与开环结构条带变淡,线性结构条带变亮,随着诱变强度的增加,质粒超螺旋、开环及线性结构条带均变淡直至消失。由于质粒三种构象利用琼脂糖凝胶电泳就可观察,因此,诱变后的质粒可通过凝胶电泳反映其损伤程度。取诱变后的质粒10 μl与2 μl上样缓冲液混合,1 %琼脂糖,120 V恒压30 min。其结果如图 1。由图 1可知,诱变时间越长,超螺旋结构越少,到120s时几乎不可见,诱变30s后开环结构条带也逐渐变淡,随着诱变时间的延长,其线性结构条带越亮。
|
| 图 1 诱变质粒结构检测 Figure 1 Mutation plasmid structure detection M: DL10 000 DNA Mark 1~6: Mutation time is 0, 30, 60, 90, 120, 150s |
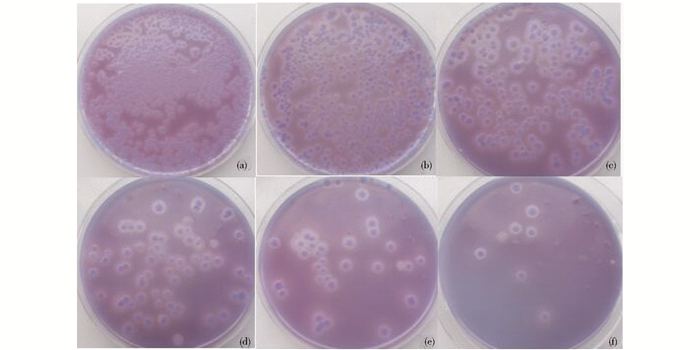
质粒构象发生改变时,其转化活性也会受到影响,而且线性质粒在转化到宿主菌中后无法正常复制而使得宿主菌无法生长。因此,结合转化率可进一步揭示ARTP对离体质粒的损伤效应。将转化后菌株涂布到PLB平板中(图 2),37 ℃培养48 h后计算转化率(表 1)。从表 1可知,诱变时间与转化率成反比,说明质粒受损伤程度增加,结合图 2分析可知,质粒超螺旋结构在0~90s内逐渐转变为线性结构,开环结构在30s后逐渐转变为线性结构,150s时,转化率极低,可见质粒大部分断裂为线性。
|
| 图 2 转化子PLB平板生长情况 Figure 2 Growth of the transformants on PLB plate (a)~(f) Mutation time is 0, 30, 60, 90, 120, 150s |
2.2 ARTP对靶基因磷脂酶A1的诱变效应
将转化后菌株涂布到PLB平板上,菌株分泌磷脂酶降解底物卵磷脂产生透明圈(图 2),利用圈径比判断磷脂酶A1基因是否发生突变并计算各诱变时间突变率(图 3)。分析图 3可知,0~90s突变率和正突变率成线性增长,90s后变化较小,趋于稳定。结合转化率数据,0~90s转化率变化较大,下降较快。综合3组数据分析,在保证转化率不在较低水平,正突变率较高且利于后期正突变菌株的筛选,最佳诱变时间为60s。
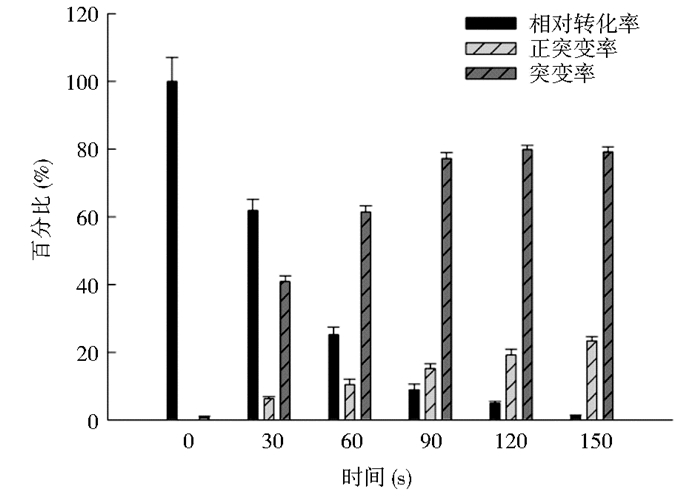
|
| 图 3 ARTP诱变时间对突变率影响 Figure 3 The effect of mutation rate by the ARTP mutation time |
以60s作为最佳诱变时间,重复诱变实验,挑选圈径比较高的转化子测定其酶活,结果如表 2所示。在选择的17株圈径比较大的突变菌株中,12号菌株的磷脂酶A1酶活较高,达12.8 U/ml,较出发菌株提高2.67倍。
在获得一株酶活较高突变菌株的基础上,本文分别从酶催化pH和温度二个方面对酶的催化特性进行分析。首先,对酶反应的最适pH进行了测定,结果如图 4所示。出发菌株的酶最适pH在5~7范围内,在pH 6.0条件下酶活最高,而突变菌株酶催化最适pH在5.0,相对于出发菌株有一定酸性偏移。接着,对酶的最适反应温度进行了测定,突变菌株与出发菌株结果一致,均在45 ℃条件下达到最大酶活(图 5)。
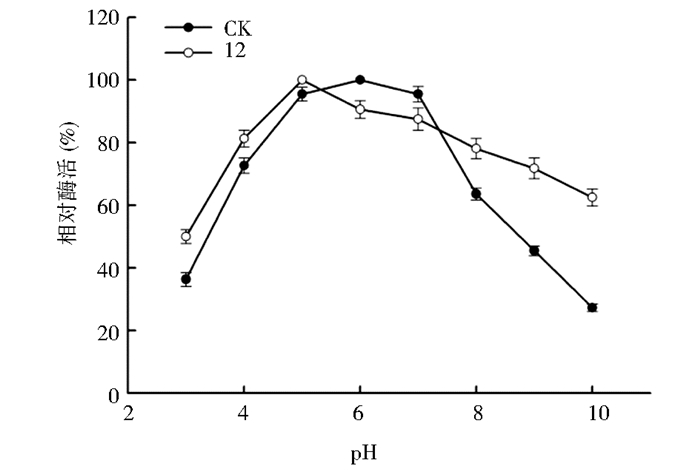
|
| 图 4 不同pH下CK与12号菌株的相对酶活 Figure 4 Relative activity of CK and strain 12 under different pH |
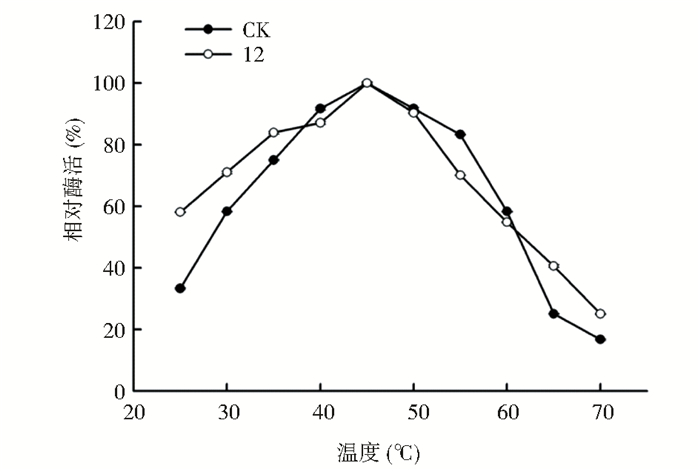
|
| 图 5 不同温度下CK与12号菌株的相对酶活 Figure 5 Relative activity of CK and strain 12 at different temperatures |
在对突变菌株酶催化特性分析基础上,我们对其酶的蛋白序列结构进行分析。磷脂酶A1编码基因涉及两个部分重叠的开放式阅读框,即plaA和plaS,分别编码磷脂酶A1蛋白PlaA及其辅助蛋白PlaS。首先,通过对突变菌株12和原始菌株CK中磷脂酶A1合成相关基因的测序比对发现,与原始序列相比,碱基突变率为0.74 %,碱基及蛋白突变见表 3。对表 3数据分析可知,突变碱基大都集中在A与C,突变后碱基大都集中在T与G,且突变结果大都为A→G和C→T,可能揭示着ARTP作用下A与C突变概率更大。
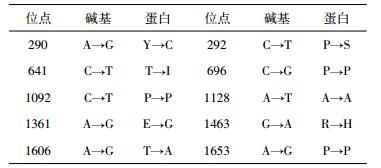
|
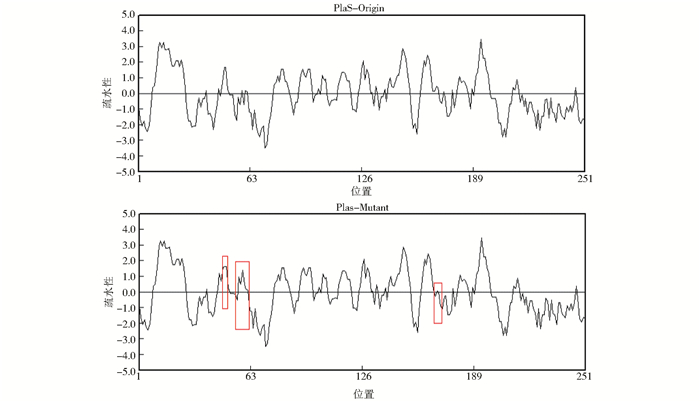
在分析氨基酸突变的基础上,我们对氨基酸序列的疏水性进行分析,结果如图 6, 7所示。由图 6可知,在突变菌株中,蛋白的疏水性发生改变,主要表现在,磷脂酶A1蛋白中,94~100位氨基酸区域由亲水到疏水的变化,在211~215氨基酸区域表现氨基酸疏水性增强。磷脂酶辅助蛋白中,则表现出43~50位氨基酸区域和167~172氨基酸区域疏水性降低,以及55~60位氨基酸疏水性增强的趋势(图 7)。氨基酸疏水性的变化,一方面对蛋白的跨膜产生影响,另一方面,对酶与底物的结合具有一定的作用。在本研究中,磷脂酶是一类脂肪酶,其作用底物主要为油脂类化合物,那么磷脂酶蛋白结构中,氨基酸疏水性的增强,可能对酶与底物的结合性产生影响,从而表现出酶活增加的特性。

|
| 图 6 磷脂酶A1蛋白疏水性对比分析 Figure 6 The hydrophobicity analysis of phospholipase A1 |
|
| 图 7 辅助蛋白疏水性分析 Figure 7 The hydrophobicity analysis of accessory protein |
在对蛋白质疏水性分析基础上,我们对出发菌株和突变菌株的磷脂酶A1蛋白结构进行模拟预测和分析,结果如图 8所示。突变酶与野生酶相比,其α螺旋由43 %减少为42 %,β链由9%增加为11 %。参照与其同源的脂肪酶分析,脂肪酶活性中心保守序列为Gly-X1-Ser-X2-Gly,而在磷脂酶A1第193~197位同样存在该保守序列,推测磷脂酶A1与脂肪酶有着相似的催化机理,其活性中心被多个α螺旋包裹,此时处于无活性构象,当酶与底物接触时,α螺旋被打开,暴露活性位点,促进酶与底物结合。图 8a中97、98、228位氨基酸的突变导致了其α螺旋的缺失(图 8b),促进了底物与活性位点的结合。

|
| 图 8 PLA1蛋白质空间结构 Figure 8 The spatial structure of PLA1 Protein (a) Spatial structure of wild enzyme (b) Spatial structure of mutant enzyme |
目前,ARTP在基因工程诱变育种领域应用极其广泛。与其它诱变方法相比,ARTP展示出了更多优势,如何建华等[20]运用ARTP诱变筛选出了3株生长速度提高了17%~57%的草菇优良菌,并运用RAPD技术扩增出了16个差异条带,证明了ARTP对核酸序列突变的多样性。Dong等[21]利用ARTP对方雷伯菌进行诱变,获得了1株高产1, 3丙二醇的突变株,测定1, 3丙二醇合成过程中关键酶:甘油脱氢酶、甘油脱水酶及1, 3丙二醇氧化还原酶酶活力发现,各酶活力均有显著提升。Lu等[22]对产气肠杆菌进行ARTP诱变,获得了每摩尔葡萄糖的氢气产量提高了2.64 %的菌株,并对氢气合成途径分析发现,乳酸、乙醇、乙酸、琥珀酸产量上调,2, 3-丁二醇产量下调,对其进一步研究发现,氢气产量的提高主要因为NADH氢气通量的提高。表明ARTP能够引起遗传物质和代谢途径的变化。
本研究以离体质粒为研究对象,ARTP为技术手段,揭示了ARTP对离体质粒损伤及诱变效应。在较短处理时间范围内,质粒损伤表现为,随着处理时间的延长,碱基间发生断裂,超螺旋与开环结构转变为线性结构。伴随着质粒损伤程度的增加,其转化活性和突变频率也相应地降低和增高。其中,0~90s范围内呈线性变化,之后变化较为平稳,可见,90s范围内ARTP对质粒诱变损伤较大。
以磷脂酶A1基因作为靶标基因,酶活变化为参考依据,对酶活差异较大菌株磷脂酶A1基因测序比对发现了一个可能的结果,ARTP对质粒上碱基A、C诱变效果更为显著,其确切的结论还需进一步研究。对最佳诱变时间进行回复验证,筛选到了一株较原始菌株提升了167 %的高酶活菌株,ARTP可以作为一种高效的诱变手段来提升菌种性能。
ARTP诱变离体质粒获得高产菌株,为ARTP在诱变育种领域提供了一个新的思路,也为后续更精准的诱变对象PCR产物的诱变提供了参考依据。
| [1] | Zhang X, Zhang X F, Li H P, et al. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool. Applied Microbiology and Biotechnology, 2014, 98(12) : 5387–5396. DOI:10.1007/s00253-014-5755-y |
| [2] | Wang L Y, Huang Z L, Li G, et al. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma. Journal of Applied Microbiology, 2010, 108(3) : 851–858. DOI:10.1111/jam.2010.108.issue-3 |
| [3] | Li H P, Wang Z B, Ge N, et al. Studies on the physical characteristics of the radio-frequency atmospheric-pressure glow discharge plasmas for the genome mutation of Methylosinus trichosporium. IEEE Transactions on Plasma Science, 2012, 40(11) : 2853–2860. DOI:10.1109/TPS.2012.2213274 |
| [4] | Zhang X, Zhang C, Zhou Q Q, et al. Quantitative evaluation of DNA damage and mutation rate by atmospheric and room-temperature plasma (ARTP) and conventional mutagenesis. Applied Microbiology and Biotechnology, 2015, 99(13) : 5639–5646. DOI:10.1007/s00253-015-6678-y |
| [5] | Wang L Y, Li G, Zhao H X, et al. A new method for microbial breeding by atmospheric-pressure, non-equilibrium discharge plasma. Journal of Biotechnology, 2008, 136(4) : S295–S296. |
| [6] | Wang X, Lu M, Wang S, et al. The atmospheric and room temperature plasma (ARTP) method on the dextranase activity and structure. International Journal of Biological Macro Molecules, 2014, 70(8) : 284–291. |
| [7] | Fang M, Jin L, Zhang C, et al. Rapid mutation of Spirulina platensis by a new mutagenesis system of atmospheric and room temperature plasmas (ARTP) and generation of a mutant library with diverse phenotypes. PLoS One, 2013, 8(10) : e77046. DOI:10.1371/journal.pone.0077046 |
| [8] |
苏燕南, 薛正莲, 陈涛, 等.
粘质沙雷氏菌PL-06磷脂酶A1基因大肠杆菌优化表达. 中国生物工程杂志, 2013, 33(7) : 36–42.
Su Y N, Xue Z L, Chen T, et al. The optimized phospholipase A1 gene expression of Serratia marcescens PL-06 in E.coli. China Biotechnology, 2013, 33(7) : 36–42. |
| [9] | Alaoui M E, Soulère L, Noiriel A, et al. A continuous spectrophotometric assay that distinguishes between phospholipase A1 and A2 activities. Journal of Lipid Research, 2016, 57(10) : 1589–1597. |
| [10] | Ranjan Moharana T. Selective enrichment of omega-3 fatty acids in oils by phospholipase A1. PLoS One, 2016, 11(3) : e0151370. DOI:10.1371/journal.pone.0151370 |
| [11] | Bakholdina S I, Tischenko N M, Sidorin E V, et al. Recombinant phospholipase A1 of the outer membrane of Psychrotrophic yersinia pseudotuberculosis:expression, purification, and characterization. Biochemistry, 2016, 81(1) : 47–57. |
| [12] |
吴桂梅.
柱式法和磁珠法提取大肠杆菌中质粒. 生物技术世界, 2015, 26(11) : 26–27.
Wu G M. Pillar method and magnetic beads method to extract plasmid from E. coli. Biotech World, 2015, 26(11) : 26–27. |
| [13] |
刘成君, 黄庆, 赵莲.
大肠杆菌-枯草杆菌穿梭质粒载体pSUGV4的构建. 四川大学学报(自然科学版), 2001, 38(2) : 243–246.
Liu C J, Huang Q, Zhao L. Construction of a Escherichia coli-Bacillus subtilis shuttle vector pSUGV4. Journal of Sichuan University (Natural Science Edition), 2001, 38(2) : 243–246. |
| [14] |
谢晖.
紫外照射对大肠埃希氏菌质粒DNA影响的研究. 青海民族大学学报(教育科学版), 2010, 30(5) : 48–51.
Xie H. The influence on Escherichia coli plasmid DNA which caused by SOS repaired system combined with mltraviolet irradiation mutation. Journal of Qinghai Junior Teachers College, 2010, 30(5) : 48–51. |
| [15] |
李莉, 杨剑波, 李俊, 等.
离子束辐照对pUC18质粒DNA结构和功能影响的初步研究. 安徽农业科学, 1994, 04 : 300–304.
Li L, Yang J H, Li J, et al. Research on damage of ion beam irradiated pUC18 plasmid DNA. Journal of AnHui Agricultural Sciences, 1994, 04 : 300–304. |
| [16] |
陈璇, 刘松, 冯岳, 等.
常压室温等离子诱变选育L-天冬酰胺酶高产重组菌. 食品与生物技术学报, 2016, 35(5) : 485–491.
Chen X, Liu S, Feng Y, et al. Screening of high L-asparaginase activity mutants of recombinant bacteria. Journal of Food Science and Biotechnology, 2016, 35(5) : 485–491. |
| [17] |
周国雁, 郭凤根, 张应华, 等.
一种经济高效的用Silica提取纯化质粒DNA的方法. 生物技术通讯, 2007, 18(5) : 800–802.
Zhou G Y, Guo F G, Zhang Y H, et al. A rapid and high efficiency method for plasmid DNA extraction and purification using silica. Letters in Biotechnology, 2007, 18(5) : 800–802. |
| [18] | Li X, Jin H, Wu Z, et al. An automated process to extract plasmid DNA by alkaline lysis. Applied Microbiology and Biotechnology, 2007, 75(5) : 1217–1223. DOI:10.1007/s00253-007-0925-9 |
| [19] | Li G, Li H P, Wang L Y, et al. Genetic effects of radio frequency, atmospheric-pressure glow discharges with helium. Applied Physics Letters, 2008, 92(22) : 221504. DOI:10.1063/1.2938692 |
| [20] |
何建华, 蒋玮, 吕贝贝, 等.
ARTP诱变筛选草菇优良菌株及RAPD分析. 核农学报, 2014, 28(11) : 1950–1955.
DOI:10.11869/j.issn.100-8551.2014.11.1950 |
| [21] | Dong X Y, Xiu Z L, Hou Y M, et al. Enhanced production of 1, 3-propanediol in Klebsiella pneumoniae induced by dielectric barrier discharge plasma in atmospheric air. IEEE Transactions on Plasma Science, 2009, 37(6) : 920–926. DOI:10.1109/TPS.2009.2017749 |
| [22] | Lu Y, Wang L, Ma K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma (ARTP). Biochemical Engineering Journal, 2011, 55(1) : 17–22. DOI:10.1016/j.bej.2011.02.020 |
 2017, Vol. 37
2017, Vol. 37