文章信息
- 巨晓芝, 袁倩倩, 马春玲, 肖冬光, 马红武.
- JU Xiao-zhi, YUAN Qian-qian, MA Chun-ling, XIAO Dong-guang, MA Hong-wu.
- 体外苏氨酸循环固碳途径的构建
- In vitro Construction of the Threonine Cycle Pathway for Carbon Fixation
- 中国生物工程杂志, 2017, 37(6): 56-62
- China Biotechnology, 2017, 37(6): 56-62
- http://dx.doi.org/DOI:10.13523/j.cb.20170609
-
文章历史
- 收稿日期: 2017-01-10
- 修回日期: 2017-02-27
2. 中国科学院系统微生物工程重点实验室 中国科学院天津工业生物技术研究所 天津 300308;
3. 天津大学化工学院 天津 300072
2. Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
3. College of Chemical Engineering, Tianjin University, Tianjin 300072, China
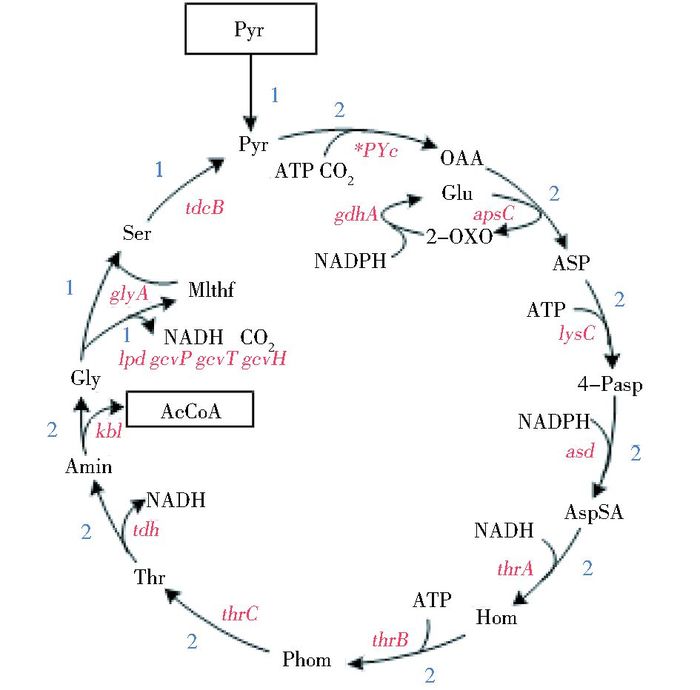
乙酰CoA是微生物代谢过程中重要的中间代谢物,是许多有价值生化产品如丙酮、异丙醇、法尼烯和聚β-羟基丁酸(PHB)等的前体物质[1-6]。传统代谢途径中乙酰CoA是通过丙酮酸一步脱羧合成的,反应方程为:Pyruvate + CoA + NADP+⇒ Acetyl-CoA + CO2 + NAD,由方程可以看出每合成一分子乙酰CoA就会损失一分子CO2,丙酮酸到乙酰CoA的碳摩尔得率只有0.667。为了寻找能够提高乙酰CoA得率的新途径,Lin等[7]对大肠杆菌模型iJO1366进行通量平衡分析[8],发现了一条固碳新途径(图 1),该途径中苏氨酸是重要的中间代谢物,因此他们将该途径命名为苏氨酸循环途径。图 1中苏氨酸循环途径由丙酮酸到乙酰CoA的总反应方程为:Pyruvate + CO2 + CoA + 3 NADPH + 6 ATP⇒2 Acetyl-CoA + 3 NADP + 6 ADP。每分子丙酮酸可以通过固定一分子CO2生成两分子乙酰CoA,丙酮酸到乙酰CoA的碳摩尔得率达到了1.33。Lin等[1]在体内构建了该途径并用于生产PHB。由于体内代谢网络复杂的代谢调控和反馈抑制等因素,很难确定该途径是否真正可行,因此本研究利用体外验证的方法,将苏氨酸循环固碳途径的酶及辅酶进行纯化,在合适的缓冲液,合适的温度条件下,对苏氨酸循环固碳途径进行体外验证。
|
| 图 1 从丙酮酸出发的苏氨酸循环固碳途径 Figure 1 Threonine cycle pathway for carbon fixation from Pyr Pyr: Pyruvate; OAA: Oxaloacetate; Asp: Aspartate; 4-Pasp: Aspartyl-4-phosphate; AspSA: Aspartate semialdehyde; Hom: Homoserine; Phom: Homoserine phosphate; Thr: Threonine; Amin: 2-amino-3-ketobutyrate; Gly: Glycine; Ser: Serine; MLTHF: Methylene-methyltetrahydrofolate; Glu: glutamate; 2-OXO: 2-oxoglutarate |
反应及测定酶活时所用的底物丙酮酸,草酰乙酸,谷氨酸钠,天冬氨酸,甘氨酸,苏氨酸,高丝氨酸,ATP,ADP,NADH,NADPH,NAD+,NADP+,异丙基硫代半乳糖苷(IPTG),生物素等购自北京索莱宝科技有限公司;乙酰CoA,CoA,磷酸吡哆醛(PLP),黄素腺嘌呤二核苷酸(FAD),四氢叶酸,磷酸烯醇式丙酮酸(PEP),丙酮酸激酶(PK),乳酸脱氢酶(LDH)等购自Sigma公司(USA);磷酸二氢钠,邻苯二甲醛(OPA),色谱级甲醛,色谱级乙腈,色谱级异丙醇等购于Agilent公司(USA);Bradford试剂盒,DNA Marker等购于GENE RAY公司(Shanghai, China);Prime STAR mix、限制性内切酶、T4 DNA连接酶、Protein Marker等购于New England Biolabs公司。
V-1600可见分光光度计购自上海森信实验仪器有限公司;Tecan infinite M200 PRO多功能微孔板检测仪购自Tecan公司;1260 Infinity LC高效液相色谱分析仪(high performance liquid chromatography, HPLC)购自Agilent公司;高压细胞破碎仪(JN-3000plus)购于广州聚能生物科技有限公司;冷冻大容量离心机(Sorvall Evolution RC)购自Thermo Fisher公司,USA;蛋白纯化仪AKTA10-2由瑞典GE公司生产。
1.2 方法 1.2.1 质粒的构建应用Primer premier 5.0软件设计引物,进行片段扩增。将扩增好的片段进行双酶切后,以pET28a作为载体,以E. coli BL21(DE3) 为宿主,进行途径蛋白的表达纯化,基因来源及引物见表 1。
 |
1.2.2 苏氨酸循环固碳途径蛋白的表达与纯化
将活化的目的菌株置于LB培养基(50 μg/ml Kanamycin)中,在37℃摇床中进行培养,待OD600到0.6~0.8时,IPTG诱导(终浓度为0.5 mmol/L),诱导温度保持在16℃,诱导时间为16~20 h。
将诱导完的菌液在4℃,5 000r/min离心10min,弃上清,收集菌体。收集的菌体用buffer A(150mmol/L Tris-HCl, 150mmol/L NaCl和20 mmol/L咪唑, pH 7.5) 悬浮,用高压均质机破碎细胞,形成了蛋白和细胞碎片混合液,用4℃,10 000 r/min离心30 min,取上清,进行蛋白的进一步纯化。
将上清置于亲和凝胶Ni2+柱上,将buffer A和buffer B(150 mmol/L Tris-HCl, 150 mmol/L NaCl、500 mmol/L咪唑, pH 7.5) 配置成不同浓度的咪唑(50 mmol/L, 100 mmol/L, 150 mmol/L, 200 mmol/L,250 mmol/L,500 mmol/L),然后分别用不同浓度的咪唑进行洗脱,洗脱液用不同的收集管收集。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)验证,透析浓缩,收集目的蛋白,将收集的目的蛋白置于-80℃,备用。
1.2.3 酶浓度及酶活性的测定利用蛋白浓度试剂盒Bradford法测量蛋白浓度。
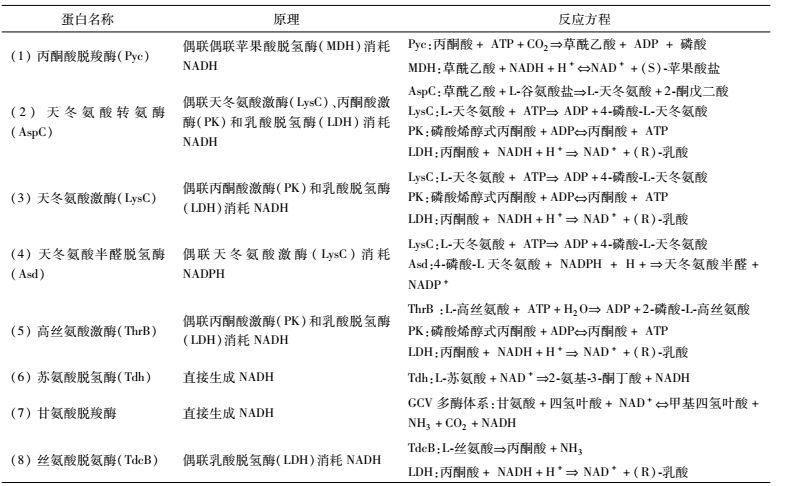
酶活的测定主要是通过偶联丙酮酸激酶(PK)和乳酸脱氢酶(LDH),通过动态检测NADH或者NADPH的消耗或者生成在OD340时的变化,计算得到比酶活[9-10]。所有的反应都是在37℃下进行反应(50 mmol/L Bis-Tris, 25 mmol/L Tricine和6 mmol/L MgCl2,pH 7.5)。先将除酶以外的底物,辅因子,偶联的酶(PK和LDH),缓冲液加入96孔板中,将其在37℃下孵育2min后,将酶加入,在OD340下检测NADH或者NADPH的动态变化。苏氨酸循环固碳途径中各蛋白比酶活的测定原理及反应方程见表 2。
 |
1.2.4 反应体系的建立
反应体系为200μl,包括5mmol/L丙酮酸,10mmol/L NADPH,10mmol/L ATP,10mmol/L NAD+,20mmol/L谷氨酸,10mmol/L HCO3-,10mmol/L CoA,2mmol/L四氢叶酸,0.1mmol/L PLP,0.1mmol/L FAD,丙酮酸羧化酶、天冬氨酸转氨酶、天冬氨酸激酶、天冬氨酸半醛脱氢酶、高丝氨酸激酶、苏氨酸脱氢酶、甘氨酸脱氨酶和丝氨酸脱氨酶各加入0.5U/ml,高丝氨酸脱氢酶,苏氨酸合成酶,2-氨基-3-酮丁酸辅酶A连接酶和丝氨酸羟甲基转移酶加过量。反应的buffer为50 mmol/L Bis-Tris,25 mmol/L Tricine和6 mmol/L MgCl2,pH 7.5,反应温度为37℃。
1.2.5 HPLC的检测方法氨基酸的HPLC检测方法:色谱柱为ZORBAX Eclipse AAA(4.6 mmol/L×150 mmol/L, Agilent, USA),柱温为40℃,流动相A为40 mmol/L Na2HPO4 (pH =7.8),流动相B为甲醇:乙腈:水=45%:45%:10%(v/v/v),流速为2 ml/min,紫外检测波长为380nm。
乙酰CoA的HPLC检测方法:色谱柱为ZORBAX Eclipse Plus C18(4.6 mmol/L×250 mmol/L, Agilent, USA),柱温为40℃,流动相A为0.2 mol/L Na2HPO4(pH=5),流动相B为100%乙腈,恒定流速为0.3 ml/min,紫外检测波长为245nm。
2 结果与讨论 2.1 苏氨酸循环固碳途径蛋白的表达纯化苏氨酸循环途径中除丙酮酸羧化酶来源于Rhizobium etli[11],其余的酶均来源于E. coli MG1655。E. coli MG1655中能表达丝氨酸脱氨酶的基因包括sdaA、sdaB、tdcG和tdcB [12], 根据依赖的辅因子的类型可以分为两类:1.PLP依赖型(tdcB);2.Fe-S离子簇依赖型(sdaA、sdaB和tdcG [13-14]。PLP依赖型的丝氨酸脱氨酶是多功能酶,对丝氨酸和苏氨酸都可以进行脱氨作用,而依赖Fe-S离子簇的丝氨酸脱氢酶只对底物丝氨酸起作用[15],但是由于Fe-S离子簇对氧极其敏感,空气中的氧就会使丝氨酸脱氨酶失活。体外研究需要将酶从生物体内提取纯化, 不可避免地会有空气的摄入,因此在体外进行苏氨酸循环固碳的验证时选择了PLP依赖型的丝氨酸脱氨酶。将表达纯化的目的蛋白100 ℃变性10 min后,SDS-PAGE结果如图 2所示。

|
| 图 2 目的蛋白SDS-PAGE图谱分析 Figure 2 The SDS-PAGE analysis of target genes M: Protein marker; 1: Pyruvate carboxylase-120kDa; 2: Aspartate aminotransferase-43kDa; 3: Glutamate dehydrogenase-48kDa; 4: Aspartate kinase-48kDa; 5: Aspartate semialdehyde dehydrogenase-40kDa; 6: Homoserine dehydrogenase-89kDa; 7: Homoserine kinase-33kDa; 8: Threonine synthase-48kDa; 9: Threonine dehydrogenase-35kDa; 10: 2-amino-3-ketobutyrate CoA ligase-85kDa; 11: Lipoamide dehydrogenase-56kDa; 12: P-protein-93.3kDa; 13: T-protein-43kDa; 14: H-protein-14kDa; 15: Serine hydroxymethyltransferase-46kDa; 16: Serine deaminase-39kDa |
由图 2得出,蛋白条带正确,基本没有杂带,可以用于后续实验。
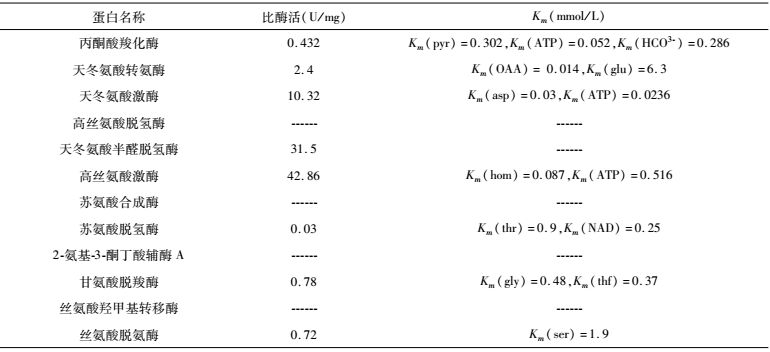
2.2 苏氨酸循环固碳途径蛋白的比酶活及Km值测定结果苏氨酸循环固碳途径蛋白比酶活和Km的测定结果,见表 3。高丝氨酸脱氢酶,苏氨酸合成酶,2-氨基-3-酮丁酸辅酶A连接酶,丝氨酸羟甲基转移酶,因底物购买不到,不能测定比酶活和Km值。
 |
2.3 苏氨酸循环固碳途径的体外验证
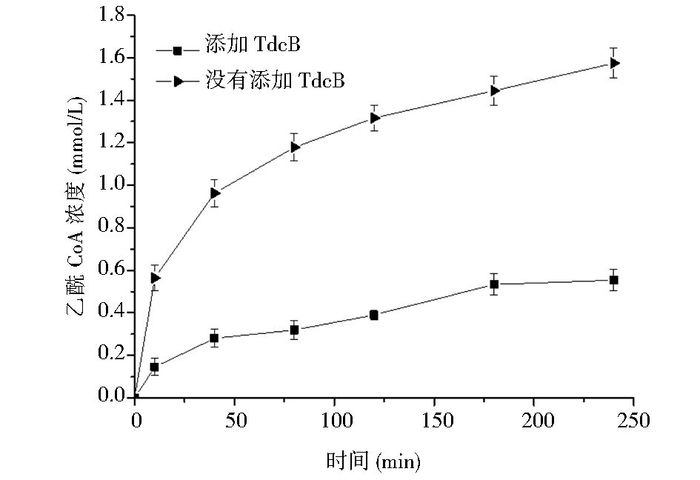
模型计算得到1摩尔丙酮酸固定一个CO2经过苏氨酸循环固碳途径可以生成2摩尔乙酰CoA,体外验证苏氨酸循环固碳途径是以丙酮酸为底物,加入途径中纯化的酶各0.5 U/ml,不能测得比酶活的高丝氨酸脱氢酶,苏氨酸合成酶,2-氨基-3-酮丁酸辅酶A连接酶,丝氨酸羟甲基转移酶加过量,200 μl体系,37℃下反应。为了在体外清楚明确地验证苏氨酸循环固碳途径,需要寻找合适的方法进行分析。最直接的验证方法就是测定途径所有中间代谢物的碳摩尔数,如果其和大于初始加入底物的碳摩尔数则表明通过该途径固定了CO2。但苏氨酸循环固碳途径中的很多中间代谢物无法准确定量测定,因此不能根据这种方法进行苏氨酸循环途径的体外固碳验证。苏氨酸循环固碳途径中乙酰CoA为关键目的代谢物,需要寻找能证明途径循环的关键酶。如图 3,以5 mmol/L的丙酮酸为底物,加入苏氨酸循环固碳途径中除丝氨酸脱氨酶以外的其他酶,可以生成1.5 mmol/L的乙酰CoA,若加入苏氨酸循环途径中的所有酶,仅有0.5 mmol/L的乙酰CoA生成。原因可能是在苏氨酸循环固碳途径中,苏氨酸为中间代谢物,被丝氨酸脱氨酶利用,生成2-酮丁酸。为了减少丝氨酸脱氨酶对中间代谢物苏氨酸的利用,可以采用分段加入丝氨酸脱氨酶的方法,目的是先积累丝氨酸,再加入丝氨酸脱氨酶使丝氨酸转化为丙酮酸,再次进入循环,因此,我们可以采用一种简化的分段加入丝氨酸脱氨酶的方法进行验证,通过加入丝氨酸脱氨酶前后乙酰CoA浓度的变化在体外分析苏氨酸循环固碳途径。
|
| 图 3 丝氨酸脱氨酶(TdcB)对苏氨酸循环固碳途径中合成的乙酰CoA浓度的影响 Figure 3 Serine deaminase (TdcB) to the influence of the concentration of the synthesis of acetyl CoA in the threonine cycle carbon fixation "Cube" means adding all enzymes including TdcB in the threonine cycle carbon fixation pathway, "triangles" means adding enzymes other than TdcB in the threonine cycle carbon fixation pathway |
分段加酶的方法分为两步,第一步加入苏氨酸循环固碳途径中除丝氨酸脱氨酶之外的酶,测定乙酰CoA和丝氨酸的量,第二步为当乙酰CoA和丝氨酸的量达到反应平衡时,加入丝氨酸脱氨酶,测定乙酰CoA的量。如图 4a,反应开始加入苏氨酸循环固碳途径中除丝氨酸脱氨酶之外的其他酶,240 min时,生成的乙酰CoA达到平衡,加入丝氨酸脱氨酶,120 min后,丝氨酸的浓度在减少,乙酰CoA的浓度没有增加。理论上丝氨酸的浓度减少说明了有丙酮酸的生成,因此乙酰CoA的浓度也会有所增加,但是实验结果表明并没有乙酰CoA的生成,可能是因为加入的丝氨酸脱氨酶与苏氨酸脱氢酶竞争性地利用了中间代谢物苏氨酸,生成了不能合成乙酰CoA的2-酮丁酸。

|
| 图 4 加入丝氨酸脱氨酶前后,丝氨酸和乙酰CoA随时间变化的曲线 Figure 4 Before and after the addition of serine deaminase, the serine and acetyl-CoA curves were recorded (a) 0~240min, add in addition to the serine deaminase enzymes in the reaction system, 240min, add 0.5U/ml serine deaminase, "square" shows cocentration of acetyl CoA, "triangle" shows cocentration of serine (b) 0~240min, add in addition to the serine deaminase enzymes in the reaction system, 240min, adding 0.5U/ml serine deaminase and 0.5U/ml threonine dehydrogenase"square" shows cocentration of acetyl CoA, "triangle" shows cocentration of serine."arrow" shows the time of adding the serine deaminase |
为了解决苏氨酸被丝氨酸脱氨酶利用的问题,需要提高苏氨酸脱氢酶对苏氨酸的利用,减少丝氨酸脱氨酶对苏氨酸的利用,我们通过提高苏氨酸循环固碳途径中加入的苏氨酸脱氢酶的酶浓度,即在240 min时,在加入0.5 U/ml丝氨酸脱氨酶的同时再补加0.5 U/ml的苏氨酸脱氢酶。如图 4b,120 min后,乙酰CoA的浓度增加了约0.2 mmol/L,通过提高苏氨酸脱氢酶的浓度,更多的苏氨酸被苏氨酸脱氢酶利用,生成了乙酰CoA,0.2 mmol/L的乙酰CoA是在加入丝氨酸脱氨酶之后,生成的丙酮酸再次进入循环产生的,因此,乙酰CoA浓度的增加可以推断体外苏氨酸循环途径实现了固碳。
3 结论本研究在体外构建了苏氨酸循环途径,由于中间代谢物无法全部准确测量,无法直接验证,因此需要寻找简化的方法进行分析。苏氨酸循环固碳途径中乙酰CoA为关键目的代谢物,可以通过直接测定乙酰CoA进行分析验证,但需要寻找能证明途径循环的关键酶。丝氨酸脱氨酶既可以利用丝氨酸又可以利用苏氨酸,如果开始的反应体系中加入丝氨酸脱氨酶,丝氨酸脱氨酶会利用部分苏氨酸,影响体外打通苏氨酸循环固碳途径。为了减少丝氨酸脱氨酶对苏氨酸的利用,采用了分段加入丝氨酸脱氨酶的方法,先加入途径中除丝氨酸脱氨酶之外的所有酶,再加入丝氨酸脱氨酶,将丝氨酸转化为丙酮酸,再次进入循环。根据丝氨酸脱氨酶加入前后丝氨酸和关键目的产物乙酰CoA的浓度变化,可以得出结论,苏氨酸循环途径在体外是可以打通的。
| [1] | Earle Swim H, Lester O Krampitz. Acetic acid oxidation by Escherichia coli:evidence for the occurrence of a tricarboxylic acid cycle. Journal of Bacteriology, 1954, 67(4) : 419–425. |
| [2] | Trainer M A, Charles T C. The role of PHB metabolism in the symbiosis of rhizobia with legumes. ApplMicrobial Biotechnology, 2006, 71(4) : 377–386. |
| [3] | Priyanka Sharma, Bijender Kumar Bajaj. Production and characterization of poly-3-hydroxybutyrate fromBacillus cereus PS 10. International Journal of Biological Macromolecules, 2015 : 241–248. |
| [4] | Hanai T. Engineered synthetic pathway for isopropanol production in Escherichia coli. Appled and Environmental Microbiology, 2007 : 7814–7818. |
| [5] | Sabrina Hoffmeister, Marzena Gerdom. Acetone production with metabolically engineered strains of Acetobacterium woodii. Metabolic Engineering, 2016, 36(2016) : 37–47. |
| [6] | Antje May, Ralf-J rg Fischer. A modified pathway for the production of acetone in Escherichia coli. Metabolic Engineering, 2013, 15(2013) : 218–225. |
| [7] | Lin Zhenquan, Yan Zhang, Qianqian Yuan, et al. Metabolic engineering of Escherichia coli for poly (3-hydroxybutyrate) production via threonine bypass. Microb Cell Factary, 2015, 14 : 185. DOI:10.1186/s12934-015-0369-3 |
| [8] | Orth J D, Conrad T M, Na J, et al. comprehensive genome-scale reconstruction of E.coli metabolism-2011. Mol Syst Biol, 2011, 7 : 535. |
| [9] | Szczesiul M, Wampler D E. Regulation of a metabolic system in vitro:synthesis of threonine from aspartic acid. Biochemistry, 1976, 15 : 2236–2244. DOI:10.1021/bi00655a033 |
| [10] | Christophe Chassagnole, Badr Raiss, Eric Quentin, et al. Integrated study of threonine-pathway enzyme kinetics in Escherichia coli. Biochemical Journal, 2001, 356 : 415–423. DOI:10.1042/bj3560415 |
| [11] | Tonya N Zeczycki, Ann L Menefee, Sarawut Jitrapakdee, et al. Activation and inhibition of pyruvate carboxylase from Rhizobium etli. Biochemistry, 2011, 50(45) : 9694–9707. DOI:10.1021/bi201276r |
| [12] | Burman J D, Harris R L, Hauton K A, et al. The iron-sulfur cluster in the L-serine dehydratase TdcG from Escherichia coli is required for enzyme activity. FEBS Lett, 2004, 576 : 442–444. DOI:10.1016/j.febslet.2004.09.058 |
| [13] | Xiao Zhang, Elaine Newman. Deficiency in L-serine deaminase results in abnormal growth and cell division of Escherichia coli K-12. Molecular Microbiology, 2008, 69(4) : 870–881. |
| [14] | Robert M Cicchillo, Melissa A Baker, Eric J Schnitzer, et al. Escherichia coli L -serine deaminase requires a 4Fe-4S Cluster in catalysis. Biochemistry and Molecular Biology, 2004 : 32418–32425. |
| [15] | Grabowski R, Hofmeister A E, Buckel W. Bacterial L-serine dehydratases:a new family of enzymes containing iron-sulfur clusters. Trends Biochem Sci, 1993, 18(8) : 297–300. DOI:10.1016/0968-0004(93)90040-T |
 2017, Vol. 37
2017, Vol. 37




