文章信息
- 张玉富, 王建文, 李松涛, 朱张亮, 路福平, 毛淑红, 秦慧民.
- ZHANG Yu-fu, WANG Jian-wen, LI Song-tao, ZHU Zhang-liang, LU Fu-ping, MAO Shu-hong, QIN Hui-min.
- 来源于红球菌胆固醇氧化酶ChOG的异源表达、纯化及催化反应结构分析
- The Expression, Purification and Structural Analysis of Cholesterol Oxidase ChOG
- 中国生物工程杂志, 2017, 37(6): 43-49
- China Biotechnology, 2017, 37(6): 43-49
- http://dx.doi.org/DOI:10.13523/j.cb.20170607
-
文章历史
- 收稿日期: 2016-12-16
- 修回日期: 2017-02-11
2. 天津科技大学工业发酵微生物教育部重点实验室 天津 300457;
3. 工业酶国家工程实验室 天津 300457
2. Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education, Tianjin 300457, China;
3. National Engineering Laboratory for Industrial Enzymes, Tianjin 300457, China
胆固醇,主要分布在人脑和神经组织中,它是生成胆酸及类固醇激素的前体物质,也是细胞膜的组成成分。人血浆中胆固醇水平过高会引起多种疾病和并发症,危害人类健康[1]。而胆固醇氧化酶是胆固醇降解的第一步反应,且产物胆甾-4-烯-3-酮是一些固醇类激素药物的前体,具有治疗心血管疾病和抗肥胖等功效[2]。胆固醇氧化酶能将胆固醇氧化生成胆甾-4-烯-3-酮同时生成H2O2,也可以作用于含有3β-羟基的甾体类化合物[3]。胆固醇氧化酶主要应用于临床检测血清中胆固醇的浓度[4],去除食品中胆固醇[5],以及作为一种防治鳞翅目害虫的生物农药[6]。
胆固醇氧化酶来源很广泛,是一类依赖于黄素腺嘌呤二核苷酸(FAD)的氧化酶,其FAD结合的方式分为结合和非共价结合两种方式[7]。研究者已经获得了非共价结合酶ChOA的晶体结构[8-9],该酶分为FAD结合域和底物结合域,由于蛋白链总在含有辅基和底物结合区域来回蜿蜒折叠,所以在拓扑结构上其仍然是属于单域蛋白。来源于Streptomyces胆固醇氧化酶的活性位点是由His447、Glu361和Asn485组成的氢键网构成。其空间结构包括了2个结构域:与FAD结合的介于α螺旋之间中心的β折叠,与甾体环结合的巨大β片层[10]。Asn485的构象使得ND2原子与FAD的C4形成很强的氢键。胆固醇氧化酶(PDB ID:1I19) 氧化半反应中,氧通道可能是从底物结合区域延伸到FAD的水通道,其中活性位点的精氨酸和谷氨酸残基通过构象变化,控制氧气是否进入此通道,接收FAD传递的氢质子[11]。Kojima等[12]对胆固醇氧化酶的氧结合位点进行定点突变,V191A的脱氢/氧化活性比为150%,比野生型提高了400倍。研究胆固醇氧化酶的结构、活性、稳定性、动力学等特性,对其工业化应用具有指导意义[13]。目前人们对胆固醇氧化酶的催化机制进行了一定程度的研究,但对于Rhodococcus来源的胆固醇氧化酶的催化机制研究还未见报道。本文对来源于红球菌Rhodococcus ruber的胆固醇氧化酶ChOG进行了异源表达、分离纯化、酶催化机理以及生物信息学分析,为胆固醇氧化酶的应用奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 试剂实验使用常规试剂为国药集团化学试剂有限公司和上海生工生物工程股份有限公司生产。胆固醇及胆甾-4-烯-3-酮标准品购自Sigma公司。酵母提取物及胰蛋白胨为OXOID公司生产。Prime STAR Max及DpnⅠ购自TaKaRa。Ni-NTA Surperflow及Disposable Column购自德国QIAGEN公司,10kDa超滤管购自Millipore公司。质粒小提试剂盒购自美国OMEGA公司,BCA蛋白浓度试剂盒购自北京Solarbio科技有限公司。
1.1.2 菌株、质粒大肠杆菌BL21(DE3),Rosetta(DE3),pET-28a(+)质粒为本实验室保藏;ChOG(苏州金唯智公司全基因合成)。
1.2 方法 1.2.1 ChOG的诱导表达及产物鉴定将重组基因ChOG-pET28a质粒(限制性内切酶为NdeⅠ和EcoR Ⅰ),转化入BL21(DE3),Rosetta(DE3),挑单克隆转化子过夜培养作为种子液,按1%的接种量转接至100 ml LB液体培养基中,37 ℃ 200 r/min振荡培养,当OD600达到0.6~0.8,加入IPTG使其终浓度为0.1 mmol/L,25 ℃下培养,同时投入0.1%(质量分数)胆固醇底物,过夜培养后取1ml菌液,使用乙酸乙酯萃取产物,进行TLC法初步分析鉴定产物。将剩余菌液离心,收集菌体,使用PBS缓冲液清洗2次,加入适量破碎缓冲液,超声破碎细胞后进行离心取上清和少量沉淀进行SDS-PAGE分析目标蛋白的表达。
1.2.2 ChOG诱导条件的优化按照上述方法进行培养ChOG-pET28a-BL21(DE3),ChOG-pET28a-Rosetta(DE3),加入终浓度为0.05、0.1、0.5 mmol/L的IPTG,分别在16 ℃、25 ℃培养16 h,37 ℃培养4 h,离心收集菌体,超声破碎后高速离心取上清液,进行SDS-PAGE,使用Quantity One采集凝胶图像,用Image Lab软件做灰度分析,研究不同诱导条件下蛋白表达量的变化。使用BCA试剂盒测定上清液总蛋白的浓度,计算不同表达宿主、诱导条件下的ChOG表达量差异。
1.2.3 ChOG蛋白纯化异源表达的蛋白ChOG在N端含有His标签,采用亲和层析法(Ni-NTA Surperflow树脂)初步纯化蛋白。按上述最优诱导条件培养1 L菌液,离心收集菌体,加入适量破碎缓冲液,超声破碎,40 000 g 4 ℃离心30 min,取上清液与提前平衡的Ni-NTA Surperflow结合1 h,使用洗杂缓冲液,洗脱20个柱体积,洗脱杂质蛋白,用10个柱体积洗脱缓冲液溶出目标蛋白ChOG。用10kDa超滤管浓缩蛋白,并使用PBS缓冲液置换Tris-HCl缓冲液,BCA法测定纯化后蛋白的浓度。
1.2.4 ChOG活性分析及产物鉴定酶活力检测方法参考季文明等[14]的方法。溶液A(4-氨基-安替比林1 mmol/L,苯酚6 mmol/L,辣根过氧化物酶7 000 U/L,PBS缓冲液);溶液B(0.8%胆固醇,4.3% Triton X-100,异丙醇)。
将3 ml溶液A和150 μl溶液B混合,30 ℃保温3 min后加入50 μl适量浓度酶液,准确反应5 min,置于沸水终止反应。500 nm测定光吸收值OD500,根据酶活定义及H2O2的标准曲线计算酶活。
酶活定义:30 ℃,PBS缓冲液pH 7.5,每分钟催化胆固醇生成1 μmol H2O2所需要的酶量,定义为一个酶活力单位(U)。
将反应液置于不同温度下,测定酶活,得到酶最适反应温度。配制不同pH的溶液A,在最适温度下,测定酶活,得到酶最适反应pH。
将上述酶反应液加入适量乙酸乙酯,萃取产物胆甾-4-烯-3-酮,加入适量色谱甲醇溶解后使用0.22 μm滤膜过滤制得样品。液相测定条件为Agilent 1200,色谱柱为DiKMA C18色谱柱(250 mm×4.6 mm,5 μm),进样量10 μl,流动相为甲醇,流速0.6 ml/min,柱温30 ℃,紫外检测器,检测波长为240 nm。
1.2.5 ChOG基因序列的生物信息学分析应用DNAMAN翻译,得到ChOG的氨基酸序列,预测了其分子量及等电点等信息。通过NCBI(http://www.ncbi.nlm.nih.gov/)BLAST进行蛋白质相似性检索;蛋白空间结构采用SWISS-MODEL(http://www.swissmodel.expasy.org/)预测蛋白结构(模板PDB ID:1I19,氨基酸序列相似度70%)。
1.2.6 通过定点突变的方法研究关键氨基酸残基的作用根据胆固醇氧化酶基因ChOG和拟突变的氨基酸位点设计引物(表 1)。以ChOG-pET28a为模板,设计引物并使用Prime STAR Max进行PCR扩增得到含有目的基因的载体。PCR扩增条件为:98 ℃ 30 s;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 7 min,30个循环;72 ℃ 5 min。PCR扩增产物经DpnⅠ酶处理后,转化大肠杆菌JM109,卡那霉素抗性平板筛选转化子,经测序鉴定对应位点是否成功突变。对测序成功的突变体,转化到大肠杆菌BL21(DE3),按照1.2.2诱导表达,分离纯化突变体蛋白,检测其酶活力。
2 结果与讨论 2.1 不同诱导条件的ChOG蛋白表达量差异分析
根据DNAMAN预测结果显示,ChOG的分子量约为59.19 kDa,其等电点约为5.41。BCA法测定上清液总蛋白浓度,通过Image lab灰度分析SDS-PAGE电泳图,结果发现(图 1)两种大肠杆菌BL21(DE3)、Rosetta(DE3) 均在16 ℃,IPTG浓度为0.1 mmol/L时,破碎上清中目标蛋白的浓度最大,分别为0.49 mg/ml、0.16 mg/ml。重组质粒ChOG-pET28a在BL21(DE3) 表达量与Rosetta(DE3) 相比较高。高温高浓度IPTG诱导条件下表达的目标蛋白浓度相对较低,可能是由于高温高浓度的诱导剂会使目标蛋白肽链合成速度快,导致形成较多折叠错误的蛋白质,其疏水基团暴露在蛋白结构外表,从而使蛋白溶解度很低[15-16]。

|
| 图 1 在BL21(DE3) 和Rosetta(DE3) 中ChOG表达量分析 Figure 1 Expression and induction conditions of ChOG in BL21(DE3) and Rosetta(DE3) strains (a) Supernatant of ChOG expressed in BL21(DE3) (b) Supernatant of ChOG expressed in Rosetta(DE3) M: Marker; 1~9: 16 ℃, 0.05 mmol/L IPTG; 16 ℃, 0.1 mmol/L IPTG; 16 ℃, 0.5 mmol/L IPTG; 25 ℃, 0.05 mmol/L IPTG; 25 ℃, 0.1 mmol/L IPTG; 25 ℃, 0.5 mmol/L IPTG; 37 ℃, 0.05 mmol/L IPTG; 37 ℃, 0.1 mmol/L IPTG; 37 ℃, 0.5 mmol/L IPTG (c) The concentration of soluble ChOG in different induction conditions 1~3: 16 ℃ 0.05, 0.1, 0.5 mmol/L IPTG; 4~6: 25 ℃ 0.05, 0.1, 0.5 mmol/L IPTG; 7~9: 37 ℃ 0.05, 0.1, 0.5 mmol/L IPTG |
经过不断探索,发现50 mmol/L咪唑洗脱缓冲液洗脱杂质蛋白时,会将少量目标蛋白洗脱,今后实验方案中需要降低其咪唑浓度洗脱杂质蛋白。溶出缓冲液中咪唑浓度为400 mmol/L时,将Ni-NTA Surperflow上结合的目标蛋白洗脱下来。如图 2所示,经过亲和层析后,得到较为纯净的蛋白。SDS-PAGE电泳条带介于45与66.2 kDa之间,与理论值59.19 kDa相符。纯化后的蛋白洗脱液经超滤管进行浓缩,使用BCA法测得所得蛋白溶液浓度为0.44 mg/ml。

|
| 图 2 纯化ChOG SDS-PAGE Figure 2 SDS-PAGE of purified ChOG M: Marker; 1~9: Whole cell liquor before inducing; whole cell liquor induced at 0.1 mmol/L IPTG; supernatant; precipitant; flowthrough; washing buffer; resin before elution; elution buffer; resin after elution |
在ChOG酶活反应体系中加入不同浓度H2O2,反应5 min,沸水浴终止反应,测得OD500,得到OD500与H2O2浓度的线性方程:y=0.2x R2=0.9994
其中x为反应液500 nm的光吸收OD500,y为H2O2的浓度(μmol/ml),R2为相关系数。
根据OD500与H2O2浓度的线性方程及酶活力定义计算得到亲和层析纯化后ChOG的比酶活。
比酶活(U/mg)=0.2·OD500·f·V/(T·m)
OD500为反应液500 nm的光吸收值,f为稀释倍数,V反应液体积(ml),T反应时间(min),m为ChOG的质量(mg)。
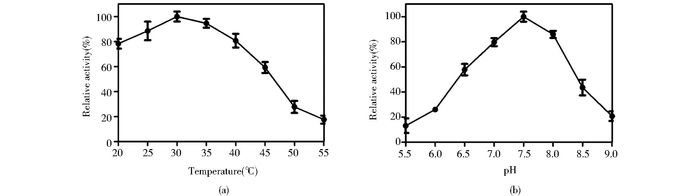
酶的催化活性受温度的影响较大。一方面,提高温度可以增加酶促反应速度,另一方面,随着温度升高,酶蛋白逐渐变性而失活。酶的最适反应温度是这两种影响的综合结果。以1 mmol/L胆固醇为底物,不同温度下测定胆固醇氧化酶ChOG相对酶活,结果如图 3a所示。ChOG的最适反应温度为30℃。且随着温度升高,酶活力开始下降。在20~45 ℃间ChOG可以保持60%以上的相对酶活。在30 ℃下测定了不同pH值对胆固醇氧化酶ChOG的相对酶活影响,结果如图 3b所示。ChOG的最适反应pH为7.5,并且在pH 6.5~8.0之间可保持60%以上的相对酶活。pH可能通过影响底物与酶活性基团的解离影响酶的活力,低于或高于最适pH,酶均不能发挥其最佳催化能力。酶最适反应条件较为温和。在最适反应条件下,ChOG的比酶活为8.0 U/mg。目前已经报道的胆固醇氧化酶的活力为0.5~7 U/mg[17],因此ChOG与胆固醇氧化酶家族相比,具有相对较高的催化活性。通过双倒数法,测得ChOG的Km为202.3 μmol/L。
|
| 图 3 温度(a)和pH(b)对ChOG酶活性的影响 Figure 3 Effect of temperature (a) and pH (b) on ChOG activity |
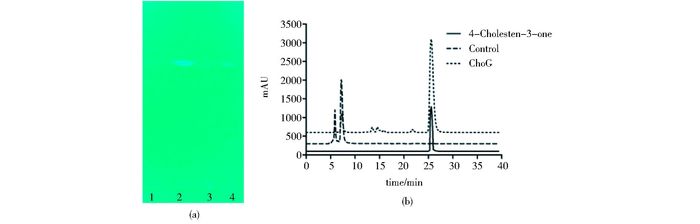
胆甾-4-烯-3-酮在紫外光(254 nm)下可以显色,通过TLC检测发酵菌液的样品,发现转化了ChOG-pET28a的大肠杆菌发酵液萃取有机相在胆甾-4-烯-3-酮标品相应位置有显色,而转有pET28a的大肠杆菌发酵液萃取有机相在相应位置没有显色,可以初步判断ChOG在大肠杆菌表达且具有催化胆固醇氧化的功能。
通过HPLC检测酶催化产物,发现标品胆甾-4-烯-3-酮在保留时间25.63min有吸收峰,而ChOG酶反应在相同时间也检测到吸收峰,证明异源表达纯化的ChOG具有氧化胆固醇生成胆甾-4-烯-3-酮的能力(图 4)。
|
| 图 4 TLC(a)及HPLC(b)产物分析 Figure 4 Product analysis with (a) TLC and (b) HPLC ChOG-pET28a-BL21(DE3) strain was cultured and induced at 16 ℃, 0.1 mmol/L IPTG (a) 1~4: Cholesterol; 4-Cholesten-3-one; Control (pET28a); ChOG product (b) HPLC analysis |
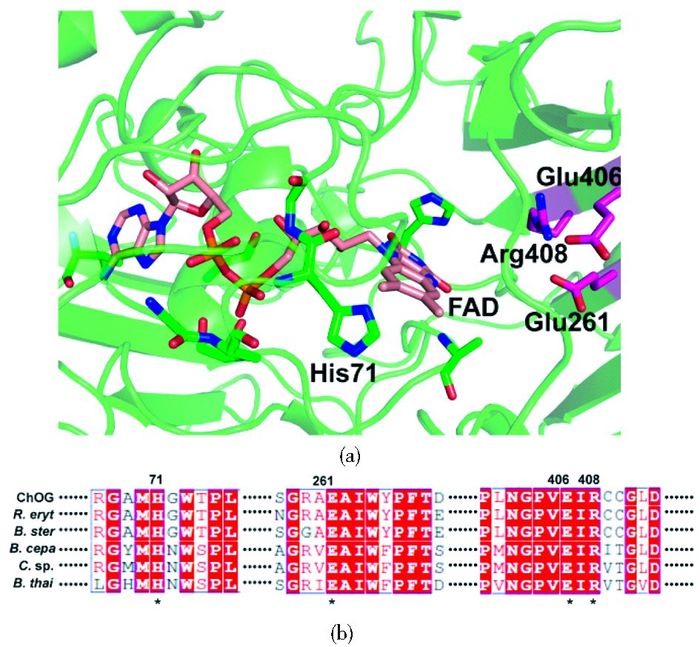
不同来源的胆固醇氧化酶由于序列上存在较大差异,因此蛋白质结构之间也存在差异。通过检索蛋白质数据库(PDB),ChOG与B. Sterolicum来源胆固醇氧化酶BCO在氨基酸序列比对中具有较高的相似度。利用SWISS-MODEL(http://swissmodel.expasy.org)进行同源建模。胆固醇氧化酶ChOG具有典型的罗斯曼折叠模式结构,该结构包括两个相邻的βαβ单位组成的超二级结构。ChOG的结构由两个结构域组成,即辅因子FAD结合区域和底物结合区域(图 5)。FAD位于一个四股β-折叠片层中β3和β4围成的口袋中。FAD磷酸基团的O原子与蛋白质loop区的氨基酸残基的N原子形成氢键。His71侧链与辅因子FAD形成共价结合。FAD与ChOG氨基酸通过共价相互作用结合,成为共价结合型胆固醇氧化酶的基本特征[18-19]。Lim等[18]通过结构与动力学研究,分析了B. sterolicum来源胆固醇氧化酶BCO中His121的重要作用。发现H121A保持了与野生型相似的催化活性,但其氧化还原电位降低了100 mV。结构研究发现突变体引起了FAD异咯嗪环的极性空间结构的改变。ChOG中His71与BCO的His121在空间位置上完全相同,且H71A对酶催化活性影响较小,所以推测His71与FAD共价结合,稳定蛋白质的空间结构。另外,ChOG拥有一个底物结合区域,底物结合区有足够大的空间可以容纳胆固醇。胆固醇结合位点是由隔离了蛋白外界环境的大量loop包围形成的疏水"口袋"组成,这个区域表现出更高的柔性(图 5)。据参考文献[8]报道胆固醇底物进入疏水口袋,相关loop会在空间结构上进行调整,从而促进生物催化反应能顺利进行。
|
| 图 5 ChOG的模拟三维结构(a)和胆固醇氧化酶序列比对(b) Figure 5 Simulated 3D structure of ChOG (a) and sequence alignments of cholesterol oxidases (b) FAD was colored as salmon stick. The catalytic residues were showed as magenta sticks; These sequence include Burkholderia cepacia (B. cepa, BAB63263.1), Burkholderia thailandensis E264 (B. thai, ABC36409.1), Brevibacterium sterolicum (B. ster, PDB: 1I19), Chromobacterium sp. DS-1 (C. sp., BAG70948.1), Rhodococcus erythropolis (R. eryt, ABW74861.1) |
胆固醇氧化酶ChOG的催化反应需要满足以下条件:首先,胆固醇与辅因子FAD在底物结合域内的定位,使胆固醇底物C3的质子氢传递到异咯嗪的N5位置;第二,两个催化步骤需要侧链的官能团:(1) 需要亲核碱在氧化过程接受C3的氢质子;(2) 需要亲核碱在异构化反应过程中进行质子传递。最后,在氧化半反应中与分子氧反应生成过氧化氢。
胆固醇氧化酶ChOG催化底物包括:(1) 还原半反应,即使甾环上的3-羟基脱氢,将两个氧化还原当量转移到氧化态的黄素辅因子(E-Flox)而成为还原态(E-FlredH),Glu406为亲核碱夺取底物胆固醇C3羟基的质子,Arg408在Glu406相互作用范围之内,起到协同脱氢作用;(2) 氧化半反应,即还原态的辅因子FAD与氧分子反应,生成氧化态的FAD和过氧化氢,Glu261和Glu406参与了胆固醇C3-OH脱氢及质子传递过程,协同作用与氧分子进行氧化半反应;(3) 异构化,即被氧化的甾环上的双键从Δ5~6移到Δ4~5,Glu406促使异构化反应进行,并生成最终产物胆甾-4-烯-3-酮。
Vrielink等[7, 9]对FAD共价结合型胆固醇氧化酶进行了研究阐明催化残基的重要作用,Coulombe等[11]通过对胆固醇氧化酶BCO氧气进入活性中心通道的结构学基础研究,阐明Glu475在氧化过程中起到亲核碱和异构化作用。质子氢从底物C3传递到FAD-N5,活性中心的Arg477与底物胆固醇氧化酶C3羟基形成了氢键,稳定FAD的嘧啶环结构。氧化过程中失去的质子传递到Glu311。通过ChOG与胆固醇氧化酶家族氨基酸序列和B. ster来源BCO三维结构比对结果发现:Glu261、Glu406、Arg408三个催化残基在胆固醇氧化酶家族中高度保守,GhoG突变体E261A、E406A、R408A几乎丧失酶催化活性,因此推测其在胆固醇催化反应过程中起到至关重要的作用。

|
| 图 6 ChOG突变体的纯化SDS-PAGE电泳(a)和ChOG突变体的酶活力测定(b) Figure 6 The purification of ChOG mutants(a) and activity analysis of ChOG mutants (b) M: Marker; 1~4:H71A; E406A; R408A; E261A |
本文以来源于红球菌的胆固醇氧化酶ChOG为研究对象,实现了ChOG的异源可溶性表达,ChOG具有催化胆固醇生成胆甾-4-烯-3-酮的活性。通过Ni亲和层析得到纯净的ChOG,并测定了其酶学性质及动力学参数。对ChOG进行三维建模,通过序列比对及定点突变验证,Glu261、Glu406、Arg408是ChOG酶催化反应的保守位点。同时本研究为胆固醇氧化酶ChOG的工业化应用提供了重要的理论依据。
| [1] | Zhang H, Liu R, Zheng J. Selective determination of cholesterol based on cholesterol oxidase-alkaline phosphatase bienzyme electrode. Analyst, 2012, 137(22) : 5363–5367. DOI:10.1039/c2an36075f |
| [2] | Uhia I, Galan B, Morales V, et al. Initial step in the catabolism of cholesterol by Mycobacterium smegmatis mc2155. Env Microbiol Rep, 2011, 13(4) : 943–959. DOI:10.1111/emi.2011.13.issue-4 |
| [3] | Doukyu N, Nihei S. Cholesterol oxidases with high catalytic activity from Pseudomonas aeruginosa:Screening, molecular genetic analysis, expression and characterization. J Biosci Bioeng, 2015, 120(1) : 24–30. DOI:10.1016/j.jbiosc.2014.12.003 |
| [4] | Doukyu N. Characteristics and biotechnological applications of microbial cholesterol oxidases. Appl Microbiol Biot, 2009, 83(5) : 825–837. DOI:10.1007/s00253-009-2059-8 |
| [5] | Mathieu J, Wang F, Segatori L, et al. Increased resistance to oxysterol cytotoxicity in fibroblasts transfected with a lysosomally targeted Chromobacterium oxidase. Biotechnology Bioeng, 2012, 109(9) : 2409–2415. DOI:10.1002/bit.24506 |
| [6] | Pollegioni L. Cholesterol oxidase:A model flavoprotein oxidase and a biotechnological tool. FEBS J, 2009, 276(23) : 6825–6825. DOI:10.1111/j.1742-4658.2009.07376.x |
| [7] | Vrielink A, Ghisla S. Cholesterol oxidase:biochemistry and structural features. FEBS J, 2009, 276(23) : 6826–6843. DOI:10.1111/j.1742-4658.2009.07377.x |
| [8] | Yue Q K, Kass I J, Sampson N S, et al. Crystal structure determination of cholesterol oxidase from Streptomyces and structural characterization of key active site mutants. Biochemistry-US, 1999, 38(14) : 4277–4286. DOI:10.1021/bi982497j |
| [9] | Vrielink A, Lloyd L F, Blow D M. Crystal-structure of cholesterol oxidase from Brevibacterium sterolicum refined at 1.8-? resolution. J Mol Biol, 1991, 219(3) : 533–554. DOI:10.1016/0022-2836(91)90192-9 |
| [10] | Lario I P, Sampson N, Vrielink A. Sub-atomic resolution crystal structure of cholesterol oxidase:What atomic resolution crystallography reveals about enzyme mechanism and the role of FAD cofactor in redox activity. J Mol Biol, 2003, 326(5) : 1635–1650. DOI:10.1016/S0022-2836(03)00054-8 |
| [11] | Coulombe R, Yue K Q, Ghisla S, et al. Oxygen access to the active site of cholesterol oxidase through a narrow channel is gated by an Arg-Glu pair. J Biol Chem, 2001, 276(32) : 30435–30441. DOI:10.1074/jbc.M104103200 |
| [12] | Kojima K, Kobayashi T, Tsugawa W, et al. Mutational analysis of the oxygen-binding site of cholesterol oxidase and its impact on dye-mediated dehydrogenase activity. J Mol Catal B-Enzym, 2013, 88(88) : 41–46. |
| [13] | Moradpour Z, Ghasemianl A. Protein engineering of microbial cholesterol oxidases:a molecular approach toward development of new enzymes with new properties. Appl Microbiol Biotechnol, 2016, 100(10) : 4323–4336. DOI:10.1007/s00253-016-7497-5 |
| [14] |
季文明, 陈毅力, 张和春.
比色法测定胆固醇氧化酶酶活. 无锡轻工大学学报, 2000, 5(19) : 251–254.
Ji W M, Chen Y L, Zhang H C, et al. Assay of cholesterol oxidase activity by colorimetry. Journal of Wuxi University of Light Industry, 2000, 5(19) : 251–254. |
| [15] | Hoffmann F, van den Heuvel J, Zidek N, et al. Minimizing inclusion body formation during recombinant protein production in Escherichia coli at bench and pilot plant scale. Enzyme Microb Tech, 2004, 34(3-4) : 235–241. DOI:10.1016/j.enzmictec.2003.10.011 |
| [16] | Carrio M M, Villaverde A. Constrution and deconstrution of bacterial inclusion bodies. J Biotechnol, 2002, 96(1) : 3–12. DOI:10.1016/S0168-1656(02)00032-9 |
| [17] | Volonte F, Pollegioni L, Molla G, et al. Production of recombinant cholesterol oxidase containing covalently bound FAD in Escherichia coli. BMC Biotechnol, 2010, 10(1) : 1–10. DOI:10.1186/1472-6750-10-1 |
| [18] | Lim L, Molla G, Guinn N, et al. Structural and kinetic analyses of the H121A mutant of cholesterol oxidase. Biochem J, 2006, 400(1) : 13–22. DOI:10.1042/BJ20060664 |
| [19] | Motteran L, Pilone M S, Molla G, et al. Cholesterol oxidase from Brevibacterium sterolicum -The relationship between covalent flavinylation and redox properties. J Biol Chem, 2001, 276(21) : 18024–1803. DOI:10.1074/jbc.M010953200 |
 2017, Vol. 37
2017, Vol. 37





