文章信息
- 徐安健, 李艳萌, 李斯文, 乌姗娜, 张蓓, 黄坚.
- XU An-jian, LI Yan-meng, WU Shan-na, LI Si-wen, ZHANG Bei, HUANG Jian.
- 人组氨酸磷酸酶蛋白PHPT1的细胞定位及其对细胞层状伪足形成的影响
- The Location of GFP Fused PHPT1 and Its Effect on Lamellipodia Formation
- 中国生物工程杂志, 2017, 37(6): 17-21
- China Biotechnology, 2017, 37(6): 17-21
- http://dx.doi.org/DOI:10.13523/j.cb.20170603
-
文章历史
- 收稿日期: 2016-12-22
- 修回日期: 2017-01-16
2. 首都医科大学附属北京友谊医院 临床检验中心 北京 100875
2. Clinical Laboratory Center, Beijing Friendship Hospital, Beijing 100875, China
人组氨酸磷酸酶蛋白PHPT1(也称为PHP14) 是在脊椎动物中发现的第一个蛋白组氨酸磷酸酶[1-2]。目前,对它的生物学功能还知之甚少。除发现其具有组氨酸磷酸酶功能外,其可能还具有信号传导的功能,并在肿瘤中发挥作用[3-5]。
PHPT1能与多种胞内分子相互作用,如ATP循环裂解酶和G蛋白的β亚基,以及HSP90а[6-8],从而发挥其部分生理生化功能。从这些与其相互作用的分子定位信息中,我们虽然能得出一些PHPT1的部分亚细胞定位信息,但其具体的亚细胞定位目前还未见报道。
我们前期的研究已经采用免疫组化的方法,对PHPT1在肺癌肿瘤组织中的分布情况进行了描述[9],但由于免疫组化方法分辨率不高,并不能细致观察PHPT1的准确亚细胞定位。为了进一步了解PHPT1在细胞中的定位情况,从而为更全面地阐明其在细胞中的功能提供参考信息,本研究通过分子生物学的手段,构建了PHPT1的C端GFP真核表达载体,转染人子宫颈癌细胞HeLa,并采用激光共聚焦显微镜观察,明确了PHPT1的亚细胞定位。此外,本研究还进一步深入探讨了PHPT1的细胞定位与细胞层状伪足形成以及细胞运动的关系。
1 材料与方法 1.1 试剂与材料大肠杆菌DH5α和人子宫颈癌细胞HeLa由本实验室保存; pEGFP-N2质粒购自Pharmarcia公司;LipofectamineTM 2000购自美国Invitrogen公司;Pyrobest TM DNA聚合酶、DNA聚合酶、DNA限制性内切酶、T4 DNA连接酶和DL2000分子量Marker购自TaKaRa公司; 质粒提取试剂盒、DNA凝胶回收试剂盒购自Omega公司; CK-666、氨苄青霉素购自Sigma公司; 其它常规试剂均为进口或国产分析纯级。
1.2 方法 1.2.1 PHPT1全长编码基因的PCR扩增根据Genbank数据库中PHPT1蛋白的mRNA序列,在其编码序列的两端分别设计用于构建pEGFP-N2-PHPT1真核表达载体的特异性引物,其序列如下:
pEGFP-N2-PHPT1:
正义引物:5′-TTACTCGAGATGGCGGTGGCGGACCT-3′(划线部分为Xho Ⅰ酶切位点)
反义引物:5′-ATCGGTACCGGTAGCCGTCGTTAGC-3′(划线部分为KpnⅠ酶切位点)
引物序列由上海英俊生物技术有限公司合成。以子宫颈癌细胞HeLa cDNA为模板,PCR扩增PHPT1的基因编码序列,反应条件如下:94℃预变性5min;94℃ 30s,58℃退火30 s,72℃延伸30s,循环30次;在72℃再延伸7min。扩增产物在1%的琼脂糖凝胶上分离目的基因,用B型小量DNA片段快速凝胶回收试剂盒进行回收。
1.2.2 pEGFP-N2-PHPT1真核表达载体的构建分别将回收所得的PCR产物与pEGFP-N2载体用Xho Ⅰ和KpnⅠ内切酶在37℃酶切5h。酶切完毕经电泳分离后进行回收。调整酶切完全并纯化回收的片段与载体的浓度,用T4连接酶在16℃连接过夜(12h~16h)。将连接产物转化大肠杆菌DH5α。挑取抗氨苄青霉素阳性克隆,一部分进行菌落PCR,另一部分提取质粒,并使用双酶切进行鉴定分析。选取含目标片段的单克隆菌落递交上海英俊生物技术公司进行测序鉴定。
1.2.3 细胞培养、转染和激光共聚焦扫描显微镜观察在六孔板中每孔接种2×105个/ml的人子宫颈癌细胞HeLa细胞,并在37℃ 5%二氧化碳培养箱中培养18~24 h,使细胞达到对数生长期,达到70%~80%的细胞密度。将6孔板内的含10%胎牛血清的DMEM培养基更换为无血清DMEM培养基,并分别用4μg已测序验证的pEGFP-N2-PHPT1真核表达载体用LipofectamineTM 2000真核转染试剂转染,然后继续培养4~6 h。在将细胞培养液换成新的含10%胎牛血清的DMEM培养基后,放入二氧化碳培养箱中培养24h。随后用pH7.4的PBS洗涤细胞,3.7%多聚甲醛固定20min,0.2%的Triton X-100通透5 min,用DAPI于室温下避光标记8min后封片,用激光共聚焦扫描显微镜观察。
1.2.4 活细胞成像用pEGFP-N2-PHPT1真核表达载体转染HeLa细胞24h后,将细胞接种到显微镜培养皿中。然后将细胞过夜培养。加入CK-666后每1min获取一次图像。
1.2.5 划痕修复实验La细胞种6孔板(1× 106 cell/well),37 ℃,5% CO2培养24 h至细胞达100%汇合度;用黄色枪头划痕,无血清培养基冲洗两遍去除漂起的细胞,并换上新鲜的含血清培养基,拍照记为0 h;继续培养,并在不同时间点拍照。
2 结果 2.1 PHPT1全长编码基因的PCR扩增以HeLa细胞的cDNA为模板,用pEGFP-N2的PHPT1扩增引物,PCR扩增分别用于pEGFP-N2-PHPT1真核表达载体构建的全长PHPT1,分别成功获得了长度为378bp的目的片段(图 1)。
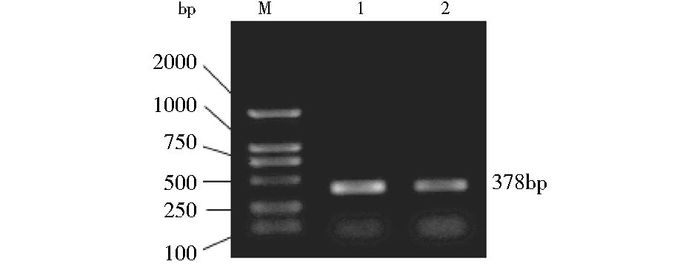
|
| 图 1 PHPT1全长编码基因的PCR扩增 Figure 1 The full length of PHPT1 by PCR amplification M: DNA ladder 2000; 1, 2: PCR product of PHPT1 for pEGFP-N2 |
构建pEGFP-N2-PHPT1真核表达载体,并得到阳性大肠杆菌DH5α菌落后,挑取部分菌落,分别用pEGFP-N2的PHPT1扩增引物进行菌落PCR,初步鉴定其中是否含有成功构建的pEGFP-N2-PHPT1真核表达载体。结果如图 2,在阳性大肠杆菌DH5α菌落中,成功扩增出PHPT1片段。

|
| 图 2 pEGFP-N2-PHPT1真核表达载体的菌落PCR鉴定和酶切鉴定 Figure 2 Colony PCR identification and restriction enzyme identification of pEGFP-N2-PHPT1 vectors M: DNA ladder 2000; 1: Empty vector; 2, 3: Colony PCR identification for pEGFP-N2-PHPT1 vector; 4, 5: Restriction enzyme identification of pEGFP-N2-PHPT1 vector |
分别将阳性大肠杆菌DH5α菌落中提取的pEGFP-N2-PHPT1真核表达载体用XhoⅠ和KpnⅠ酶切,得到了378bp的条带(图 2),与预期吻合。将克隆成功的融合质粒递交上海英俊生物科技有限公司进行序列测定,测序结果与人PHPT1的ORF序列完全一致(结果未列出)。
2.3 PHPT1的细胞内定位将pEGFP-N2-PHPT1真核表达载体用LipofectamineTM 2000真核转染试剂转染HeLa细胞,并观察C端融合GFP的PHPT1蛋白在细胞中的表达情况(图 3)。

|
| 图 3 C端融合GFP的PHPT1在HeLa细胞中的定位 Figure 3 The location of GFP-N-PHP and GFP-C-PHPT1 fusion protein in HeLa cells Green: PHP14, Red: F-actin, Blue: DAPI Scale bar 20 μm (up panel) and 40 μm (low panel) |
从图 3可以看出,融合GFP的PHPT1蛋白显示出细胞核和细胞质内的定位表达。更特异地,其还定位于细胞的层状伪足的前沿(图 3中箭头所指)。
2.4 定位于层状伪足的PHPT1与细胞层状伪足形成密切相关为了进一步研究PHPT1与细胞层状伪足形成的关系,我们使用抑制细胞层状伪足生成的抑制剂CK-666处理细胞,并采用激光共聚焦显微镜实时观察了PHPT1的定位改变。结果如图 4中所示,在没有使用抑制剂CK-666的时候,PHPT1可正常定位于细胞层状伪足的前沿,但随着CK-666的加入,PHPT1在细胞层状伪足前沿的定位受到了抑制,其GFP荧光强度逐渐消失,到20min时,基本消失不见。表明随着细胞层状伪足受到抑制,PHPT1在细胞层状伪足的定位受到了极大的影响,推测PHPT1可能与细胞层状伪足形成密切相关。

|
| 图 4 PHPT1与细胞层状伪足形成密切相关 Figure 4 The relationship of PHPT1 and lamellipodia Green: PHPT1; Up panel, Select time points shown the localization of PHP14 gradually disappeared at the leading edge after CK-666 treatment; Low panel, the fluorescence intensity analysis. Arrow, the fluorescence intensity analysis of PHPT1 in lamellipodia. Scale bar 40 μm |
基于以上实验,我们已初步确认PHP14通过影响细胞层状伪足形成,与细胞运动存在着密切的关系。接下来,我们进一步通过划痕修复实验,检测了过表达PHP14的HeLa细胞体外运动能力的改变情况。如图 5所示,在HeLa细胞中过表达PHP14后,虽然在第4小时并没有明显促进HeLa细胞的运动能力,在从第8h开始,过表达PHP14的HeLa细胞的运动能力明显增强,在第24h时,过表达PHP14的HeLa细胞几乎完全覆盖了整个划痕区域,而未过表达PHP14的HeLa细胞仍存在明显的划痕区域。这更清楚直接地说明了PHP14对细胞运动的调节作用,而这一作用可能是通过影响细胞层状伪足形成而实现的。
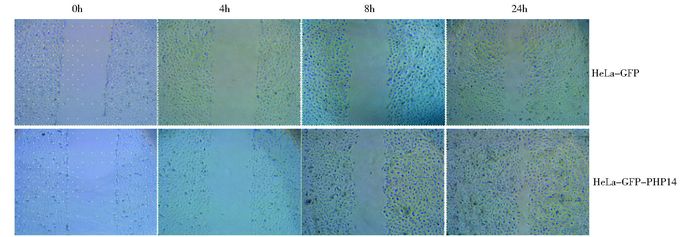
|
| 图 5 过表达PHP14可促进HeLa细胞的体外运动能力 Figure 5 PHP14 over-expression promoted the cell mobility of HeLa cells A wound healing assay was also performed to compare cell mobility between HeLa-GFP and HeLa-GFP-PHP14 cells. Closure of the wound was almost complete in HeLa-GFP-PHP14cells within 24 h of incubation, but the wound still existed in HeLa-GFP cells |
组氨酸磷酸酶蛋白PHPT1是真核细胞中发现的第一个具有组氨酸磷酸酶功能的蛋白[1-2]。随着研究的深入,对其生理生化功能已有部分了解。但对于其在细胞中的亚细胞定位,目前还未见报道。
通过PHPT1的相互作用蛋白ATP循环裂解酶和G蛋白的β亚基,以及HSP90а的细胞内定位情况,我们可以部分推断,PHPT1可能在细胞质和膜系统中存在定位。在对肺癌组织中PHPT1免疫组织化学染色时我们发现,PHPT1不仅存在于细胞质中,而且在细胞核中也有分布[9]。但由于免疫组化方法分辨率不高,未能对PHPT1在胞内的亚细胞定位进行更深入的研究。但鉴于PHPT1在细胞中的重要作用,特别是在肿瘤的发生和发展中的重要作用,有必要对其在细胞内的亚细胞定位进行更精细的研究。
为此,本研究构建了PHPT1的GFP融合真核表达载体,以通过分子生物学的手段对PHPT1的亚细胞定位进行了深入的研究。通过分辨率更高的激光共聚焦影像学分析发现,PHPT1不仅具有细胞质和细胞核的亚细胞定位,其还可定位于细胞的层状伪足前沿。我们以前的研究发现,PHPT1可以影响细胞的运动和迁移能力,但其具体机制还不明确[5]。通过本文的研究,我们直观地观察到了其与细胞运动的密切关系。因为细胞层状伪足作为细胞运动的一种重要结构,对细胞的运动包括肿瘤细胞的转移等生物学功能有着重要的影响。因此,我们推测,PHPT1在细胞层状伪足前沿的定位可能与细胞层状伪足的形成有着密切的联系。
接下来,我们通过活细胞实时观察,探讨了PHPT1与细胞层状伪足之间的关系。通过细胞层状伪足抑制剂CK-666抑制细胞层状伪足,再同时实时观察PHPT1的定位情况。令人惊奇的是随着细胞层状伪足受到抑制,PHPT1在细胞层状伪足前沿的荧光强度逐渐降低,在20min左右,已基本消失。表明PHPT1的确与细胞层状伪足的形成密切相关,而这也可能是PHPT1调控细胞运动迁移的可能机制之一。
通过对PHPT1的细胞内定位分析研究,使我们对PHPT1有了更深入的了解,这对我们阐明PHPT1在细胞,甚至肿瘤中的功能或作用机制提供了帮助。
致谢 感谢北京优秀人才培养项目(2016000021469G227);北京友谊医院院启动项目(yyqdkt201516) 对本研究的资助。| [1] | Pia E K, Pettersson G, Bo E K, et al. Identification and characterization of a mammalian 14-kDa phosphohistidine phosphatase. Eur J Biochem, 2002, 269(20) : 5016–5023. DOI:10.1046/j.1432-1033.2002.03206.x |
| [2] | Klumpp S, Hermesmeier J, Selke D, et al. Protein histidine phosphatase:a novel enzyme with potency for neuronal signaling. J Cereb Blood Flow Metab, 2002, 22(12) : 1420–1424. DOI:10.1097/01.wcb.0000045041.03034.99 |
| [3] | Ma R, Kanders E, Sundh U B, et al. Mutational study of human phosphohistidine phosphatase:effect on enzymatic activity. Biochem Biophys Res Commun, 2005, 337(3) : 887–891. DOI:10.1016/j.bbrc.2005.09.134 |
| [4] | Steeg P, Palmieri D, Ouatas T, et al. Histidine kinases and histidine phosphorylated proteins in mammalian cell biology, signal transduction and cancer. Cancer Lett, 2003, 190(1) : 1–12. DOI:10.1016/S0304-3835(02)00499-8 |
| [5] | Xu A J, Hao J, Zhang Z, et al. 14-kDa phosphohistidine phosphatase and its role in human lung cancer cell. Lung Cancer, 2010, 67(1) : 48–56. DOI:10.1016/j.lungcan.2009.03.005 |
| [6] | Klumpp S, Bechmann G, Maurer A, et al. ATP-citrate lyase as a substrate of protein histidine phosphatase in vertebrates. Biochem Biophys Res Commun, 2003, 306(1) : 110–115. DOI:10.1016/S0006-291X(03)00920-3 |
| [7] | Maurer A, Wieland T, Meissl F, et al. The b-subunit of G proteins is a substrate of proteinhistidine phosphatase. Biochem Biophys Res Commun, 2005, 334(4) : 1115–1120. DOI:10.1016/j.bbrc.2005.06.200 |
| [8] |
徐安健, 蒋单懿, 黄凌云, 等.
人组氨酸磷酸酶PHP14的原核表达及其与Hsp90的体外互作研究. 中国生物工程杂志, 2010, 30(7) : 7–11.
Xu A J, Jiang S Y, Huang L Y, et al. Prokaryotic expression, purification of human 14-kDa phosphohistidine phosphatase and its interaction with HSP90 in vitro. China Biotechnology, 2010, 30(7) : 7–11. |
| [9] | Xu A J, Xia X H, Gu J C, et al. Clinical significance of PHPT1 in lung cancer. Chinese Medical Journal, 2010, 123(22) : 3247–3251. |
 2017, Vol. 37
2017, Vol. 37




