文章信息
- 袁雅红, 赵珊珊, 王小莉, 腾智平, 李东升, 曾毅.
- YUAN Ya-hong, ZHAO Shan-shan, WANG Xiao-li, TENG Zhi-ping, LI Dong-sheng, ZENG Yi.
- HIV-1 Tat蛋白抑制骨髓间充质干细胞的造血支持功能
- HIV-1 Tat Protein Inhibits the Hematopoiesis Support Function of Bone Marrow Mesenchymal Stem Cells
- 中国生物工程杂志, 2017, 37(6): 1-8
- China Biotechnology, 2017, 37(6): 1-8
- http://dx.doi.org/DOI:10.13523/j.cb.20170601
-
文章历史
- 收稿日期: 2016-12-26
- 修回日期: 2017-01-18
2. 湖北医药学院附属太和医院胚胎干细胞研究湖北省重点实验室 十堰 442000;
3. 中国预防医学科学院病毒所 北京 100052
2. Hubei Key Laboratory of Embryonic Stem Cell Research, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China;
3. Institute of Virology, Chinese Academy of Preventive Medicine, Beijing 100052, China
人类免疫缺陷病毒1型(HIV-1) 主要攻击人体免疫系统中CD4+T淋巴细胞,大量破坏该细胞,使人体丧失免疫功能。然而,临床病例报道表明,HIV-1感染的个体不仅仅CD4+T淋巴细胞严重受损,晚期阶段的HIV感染者80%以上都存在血细胞减少方面的血液学异常现象,包括贫血、嗜中性白血球减少症或血小板减少症等[1-2]。究其原因,HIV-1感染导致的血细胞减少是多因素的,可能与HIV-1直接影响造血系统有关或与感染后所出现伴随症状及治疗手段均有关系,如炎症、感染、营养不良、恶性肿瘤及药物副作用等[3]。然而,HIV-1对骨髓中造血干细胞赖以生存的造血微环境的影响仍不十分清楚。近年来的研究表明,骨髓造血微环境中的重要组成部分间充质干细胞(mesenchymal stem cell, MSC)的多方面的生物学特性受到HIV-1蛋白Tat及Nef等的影响,HIV蛋白能与MSC表面受体结合,促进MSC老化[4],抑制其成骨分化并促进其成脂分化[5]。而骨髓间充质干细胞(bone marrow mesenchymal stem cell, BMSC)在维持机体正常造血过程中发挥着不可或缺的作用,它是造血干细胞(hematopoietic stem cell, HSC)的“土壤”,它通过分泌一系列造血支持因子促进HSC的自我更新、增殖和分化[6-7]。Tat蛋白是HIV-1病毒编码的7个重要调控蛋白之一,在激活和促进病毒复制中起重要作用,它可以由骨髓中被感染的细胞分泌到细胞外。由此,我们提出问题,HIV-1Tat蛋白既然能影响BMSC的基本生物学特性,那么对其造血支持功能是否有影响。基于此,本研究利用HIV-1 Tat蛋白作用于BMSC,对蛋白处理后的BMSC的造血支持功能展开初步的研究,以期更进一步地揭示HIV-1感染者血液系统疾病的致病原因。
1 材料与方法 1.1 材料α-MEM培养基,IMDM培养基,胎牛血清(FBS)均购自美国Hyclone公司;人淋巴细胞分离液购自天津灏洋生物制品科技有限公司;BMSC成骨及成脂分化鉴定试剂盒购于美国Cyagen公司;CD34+ HSC磁珠分选试剂盒购于德国Miltenyi公司;抗人mAb CD34-FITC (fluorescein isothiocyanate)、CD45-PE (phycoerythrin)、CD44-FITC、CD73-PE、CD29-PE、CD106-PE购自BD Biosciences公司;SCF、TPO、IL-6、Flt3及bFGF细胞因子购于R & D公司;HIV-1 Tat全长蛋白购于Abcam公司;丝裂霉素购于Sigma公司;甲基纤维素人造血干/祖细胞半固体培养基购于Stem Cell Technologies公司;GM-CSF及IL-6 Elisa试剂盒购于上海吉泰生物公司。
1.2 方法 1.2.1 BMSC分离、培养及鉴定骨髓来源为创伤骨折需取髂骨植骨的志愿者,排除血液系统疾病,经医院伦理委员会批准并征得患者知情签字同意。术中用含有1 ml肝素(100U/ml)的10ml注射器从患者髂骨中抽取骨髓5 ~10 ml。将骨髓用PBS1:3稀释后,用人淋巴细胞分离液进行密度梯度离心,获得单个核细胞,用BMSC完全培养基(α-MEM培养基含10%FBS及4ng/ml bFGF)重悬,并调整细胞密度为2×106/ml, 接种入培养瓶静置培养,5天后第1次换液,待贴壁细胞达到80%融合时进行传代。传至3代进行鉴定,将BMSC标记抗人mAb CD34-FITC、CD45-PE、CD44-FITC、CD73-PE、CD29-PE及CD106-PE后,用流式细胞仪进行检测;将BMSC按试剂盒说明进行成脂及成骨诱导分化并进行鉴定。
1.2.2 免疫磁珠分选脐带血HSC脐带血采自健康足月妊娠产妇,经医院伦理委员会批准并征得患者知情签字同意。CD34+脐带血HSC磁珠分选严格按照试剂盒说明进行操作,简言之,将脐血用密度梯度离心法获得单个核细胞,离心洗涤去除血小板后计数,先标记FcR-blocking,4℃避光孵育5min,再标记CD34磁珠,4℃避光孵育30 min,离心洗涤后过柱分选。将分选获得的造血干细胞标记CD34-PE, 流式细胞仪检测纯度。
1.2.3 BMSC与HSC分组共培养将BMSC在培养过程中分两组进行处理,一组用正常BMSC完全培养基培养(BMSCCon),另一组在完全培养基中添加100ng/ml的HIV Tat蛋白(BMSCTat)。两组细胞均培养20天后在培养液中添加10μg/ml丝裂霉素处理1.5h,PBS洗涤3遍,胰蛋白酶消化收集后冻存以备用作HSC的滋养层。两组细胞使用前在24孔板中每孔先铺被1% gelatin, 在37℃培养箱中放置30min后,将剩余gelatin吸走,之后每孔分别接种BMSC 2×104个,BMSCCon和BMSCTat各6个孔。将新鲜分离的CD34+HSC分6组进行培养,每组3个孔,每孔6×104个,基础培养基为IMDM含10%FBS, 其中3组在基础培养基中添加造血生长因子(Growth factor, GF)SCF 50ng/ml、TPO 25ng/ml、IL-6 20ng/ml和FLT3 50ng/ml。6组分别为:BMSCCon+HSC+GF;BMSCCon+HSC;BMSCTat+HSC+GF;BMSCTat+HSC;HSC+GF;HSC。分组培养10天时,倒置显微镜下拍照观察悬浮细胞密度,将各孔悬浮细胞轻轻吹吸收集后分别计数。
1.2.4 集落形成分析将上述分组培养10天后收集的造血细胞分别用甲基纤维素人造血干/祖细胞半固体培养基诱导分化产生不同谱系的造血集落形成单位,该培养基中含有SCF、G-CSF、GM-CSF、IL3、IL6及EPO多种细胞因子。即将6组造血细胞分别用该培养基重悬,充分吹打均匀,接种入24孔板中,每组3个复孔,每孔1 000个细胞。14天后,倒置显微镜下观察集落形成单位的种类和形态,记录≥50个细胞组成的集落形成单位的数量。
1.2.5 RT-PCR检测将BMSCCon及用HIV-1 Tat蛋白处理20天后的BMSCTat用胰酶消化后各取1×106细胞提取总RNA再逆转录成cDNA,RT-PCR检测BMSCTat及BMSCCon造血相关因子表达的差异。各基因引物序列为:M-CSF上游:5′-GTCTGCACTCCCAAACCC-3′,下游:5′-CCTGTCGCTCGTTGCCTA-3′;IL-6上游:5′-CACACAGACAGCCACTCACC-3′,下游:5′-TTTTCACCAGGCAAGTCTCC-3′;IL-7上游:5′-ATTGAACCTGCAGACCAAGC-3′,下游:5′-CCGCCCATAGTCACTCCC-3′;GM-CSF上游:5′-TCTGCTTGTCATCCCCTT-3′,下游:5′-CCATTCTTCTGCCATGCC-3′;FLT3L上游:5′-GAGCCCAACAACCTATCTCC-3′,下游:5′-AAGCCTTGCATCTTGGACCC-3′;LIF上游:5′-ATCTACAAGAGCCCTGACCAC-3′,下游:5′-CTGAATGCCAAGTGACCTCC-3。
1.2.6 ELISA检测将BMSCCon及BMSCTat各1×105分别接种入六孔板中,均用含10%FBS的α-MEM进行培养,不添加Tat蛋白或任何其他细胞因子。48h后收集培养上清,按ElISA检测试剂盒说明书检测培养上清中造血相关因子GM-CSF及IL-6的浓度。
1.2.7 统计学分析采用SPSS13.0统计软件进行t检验,数据用均数±x表示,P<0.05有统计学意义。
2 结果 2.1 BMSC鉴定将传至第3代的BMSC标记MSC鉴定常用的一组抗体[8],流式检测进行免疫表型鉴定,结果显示,BMSC不表达造血细胞抗原CD34和CD45,而CD44、CD73和CD105表达阳性(图 1a)。为了确定BMSC的干细胞特性,对其分化鉴定,用成脂及成骨分化培养液诱导后,油红O染色显示胞浆中充满红色的油滴(图 1b),碱性磷酸酶染色显示大部分细胞呈阳性反应,细胞被染成深蓝色区域(图 1c),表明BMSC能向脂肪细胞和成骨细胞分化。
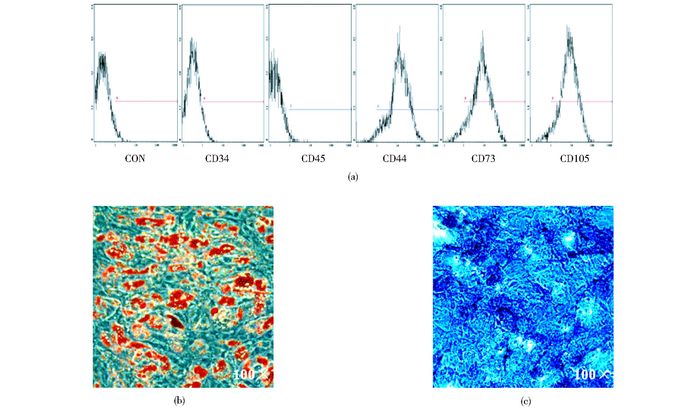
|
| 图 1 BMSC的鉴定 Figure 1 Identification of BMSC (a) Immune phenotype were detected by flow cytometry (b) Adipogenic differentiation were detected by Oil red O staining (c) Osteogenesis differentiation were detected by ALP |
流式检测所分选获得的造血干细胞CD34的表达达到95.5%(图 2),表明我们所获得的造血干细胞纯度高,可以用于后续的实验。
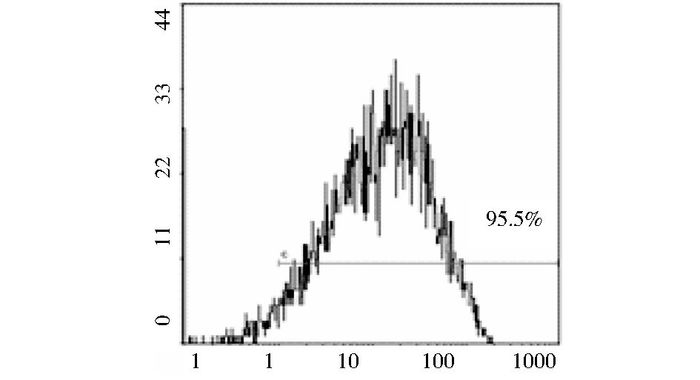
|
| 图 2 HSC纯度检测 Figure 2 Purity of HSC were detected |
分6组培养10天时,倒置显微镜下观察,未添加细胞因子的HSC单独培养组(HSC)细胞数量很少,细胞形态不完整,有较多碎片,添加因子的HSC单独培养组(HSC+GF)细胞大小均匀、细胞膜完整、折光好;未添加因子的BMSCTat和HSC共培养组(BMSCTat+HSC)的细胞数量虽略多于HSC组,但明显少于BMSCCon和HSC共培养组(BMSCCon+HSC); 添加因子的BMSCTat和HSC共培养组(BMSCTat+HSC+GF)与HSC+GF相比细胞密度略有增高,但明显低于添加因子的BMSCCon和HSC共培养组(BMSCCon+HSC+GF) (图 3a)。细胞计数结果表明,无论是在添加细胞因子和不含细胞因子的情况下,以BMSCCon为滋养层培养的造血细胞的数量均明显多于以BMSCTat为滋养层的(图 3b)。
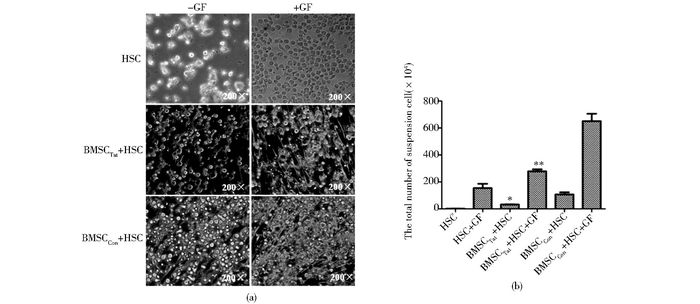
|
| 图 3 BMSC和HSC共培养 Figure 3 HSC were co-cultured with BMSC (a) The density of hematopoietic cell was observed under microscope (b) The numbers of hematopoietic cell in all groups were compared |
经甲基纤维素人造血干/祖细胞半固体培养基诱导14天后,显微镜下观察可以看到明显的集落,包括粒系集落形成单位(CFU-G)、单核巨噬系集落形成单位(CFU-M)和粒-巨噬系集落形成单位(CFU-GM)、红系集落形成单位(CFU-E)、红系爆式集落形成单位(BFU-E)和粒红单巨核集落形成单位(CFU-GEMM)(图 4a)。显微镜下计数每组集落形成单位的总数,结果显示,HSC组几乎未见到有克隆形成单位,在添加细胞因子和不含细胞因子的情况下,以BMSCCon为滋养层培养的造血细胞的集落形成单位的总数均明显多于以BMSCTat为滋养层的(图 4b)。
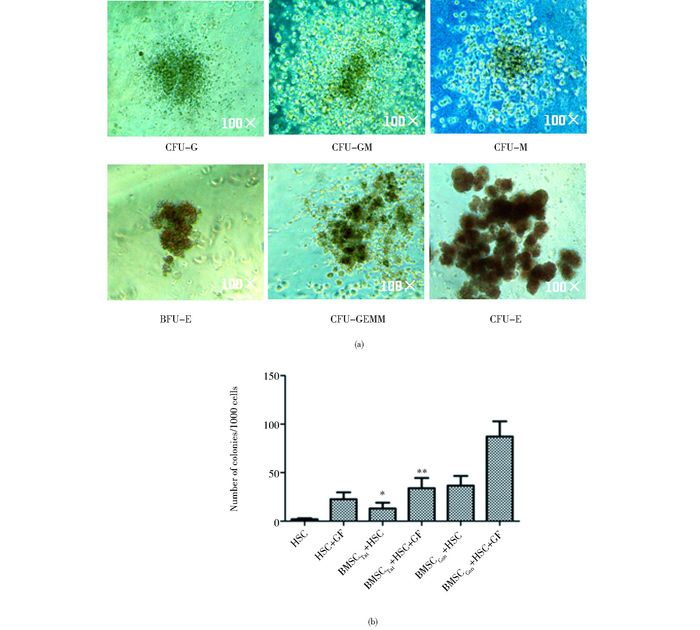
|
| 图 4 各组造血集落形成情况 Figure 4 The situation of hematopoietic colony formation in all groups (a) The hematopoietic colony morphology (b) The total number of hematopoietic colony in all groups were compared |
RT-PCR检测BMSCCon和BMSCTat一系列造血相关因子mRNA的表达水平发现:BMSCCon的FLT3LG、M-CSF、IL-6、IL-7及LIF mRNA的表达均明显强于BMSCTat(图 5a),利用灰度分析计算目的基因和β-actin的比值显示,BMSCCon的FLT3LG、M-CSF、IL-6及IL-7的比值均明显大于BMSCTat, 而LIF的mRNA表达二者没有统计学意义上的差异(图 5b)。ELISA检测BMSCCon和BMSCTat培养48h后的上清液中的GM-CSF和IL-6的浓度发现:BMSCCon上清液中GM-CSF和IL-6的浓度均明显高于BMSCTat上清液,分别为33.3和4.8倍(图 5c)。
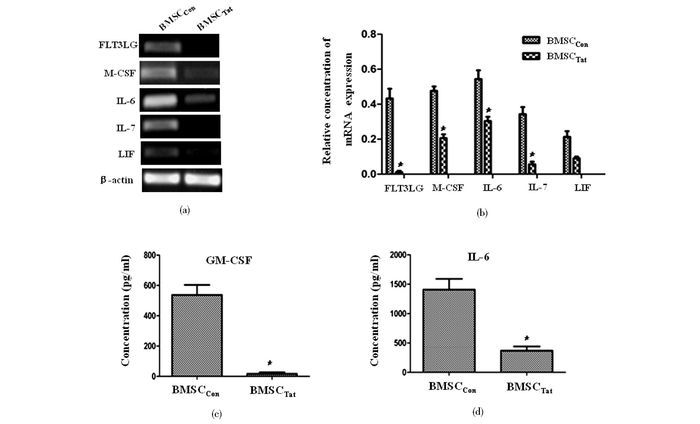
|
| 图 5 BMSC的造血相关因子mRNA及蛋白表达水平 Figure 5 mRNA and protein expression of hematopoietic growth factor in BMSC (a) Electrophoregram of hematopoietic growth factor mRNA expression detected by RT-PCR (b) Relative concentration of mRNA expression were compared in all groups (c) GM-CSF and IL-6 concentration in BMSC condition medium detected by ELISA |
HIV-1靶向CD4+T淋巴细胞,使CD4+T细胞数量下降,最终摧毁机体免疫系统,与此同时,一些HIV-1感染者还伴随着其他所有造血谱系细胞的减少,包括贫血、嗜中性白血球减少症及血小板减少症,表明HIV-1感染者体内存在造血损伤[9]。虽然,HIV-1感染患者造血抑制可能由一些继发性并发症导致,例如抗病毒药物治疗的副作用、免疫系统破坏导致的恶性肿瘤及机会性感染(巨细胞病毒和弓形虫感染),但是HIV-1本身对造血系统也有破坏作用。对大多数HIV-1感染者而言,CD34+HSC并不是HIV-1的靶细胞,但研究表明,在HIV-1感染患者的少数个体中检测到CD34+HSC的某个亚群表达CD4,而成为HIV-1的靶细胞[10]。另外,HIV-1蛋白(包括表面的包膜糖蛋白)异常激活炎症通路相关因子TNF-α和IL-1,从而影响骨髓微环境,因此对HSC产生间接的负面效应[11]。早在1997年,Bahner等[12]就报道HIV-1病毒在骨髓基质细胞的复制,是导致造血细胞减少的原因之一,报道中所研究的基质细胞是异质细胞群体,其中包括成纤维细胞、内皮细胞、脂肪细胞、巨噬细胞、破骨细胞和网状细胞。而在该研究中并未涉及BMSC,而BMSC在骨髓中存在,其最重要、最经典且研究得最多的便是其造血支持功能,它是HSC的“土壤”,对维持HSC的生长和功能活性都具有不可或缺的重要作用。研究表明,HIV患者的骨髓中造血祖细胞(HPC)可以储存HIV-1病毒[13],可以释放HIV-1蛋白或病毒粒子对周围细胞产生损伤效应,例如凋亡、氧化应激、线粒体功能障碍或者自噬改变[14-15]。而靠近HPC的MSC成为直接的靶细胞。一些HIV-1蛋白如gp120, Gag, Tat和Rev在体外能影响MSC的成骨分化和活性[16-18]。那么,BMSC的造血支持功能是否也受到了HIV蛋白的影响,本研究检测了HIV-1 Tat蛋白作用后的BMSC的体外造血支持功能,以期进一步揭示HIV-1感染者出现造血损伤现象的机制。
本研究从骨髓中原代分离培养BMSC,从形态,表面标志及分化能力三个方面进行鉴定后,表明我们成功获得BMSC。之后在BMSC完全培养基中添加HIV-1 Tat蛋白作用20天,与此同时将未添加Tat蛋白的对照组BMSC同步培养20天。以BMSCTat及BMSCCon为滋养层培养HSC, 结果显示,造血因子、BMSCCon及BMSCTat对HSC的体外生长均具有支持作用,造血因子和BMSC还具有协同作用,但是无论在培养基中是否添加造血支持因子,BMSCTat滋养层维持HSC生长扩增的能力均明显弱于BMSCCon。不仅如此,在这两种滋养层上体外生长的HSC其分化能力也存在差异,在BMSCTat上培养10天的HSC在体外分化生成造血集落的总数明显少于在BMSCCon上培养的HSC。由此可以推测,在HIV-1 Tat蛋白的长期作用下,与健康的BMSC相比,BMSCTat的造血支持能力受到损伤,而这种不健康的BMSC所支持的HSC其功能活性也不能充分发挥,导致各个谱系造血细胞生成的减少。而RT-PCR及ELISA检测也表明,BMSCTat的造血相关因子的基因和蛋白表达强度也明显受到抑制。研究表明,MSC细胞上存在Tat蛋白受体KDR和整合素αVβ3[17].,Tat蛋白通过其受体影响MSC的成脂分化[19]。那么,在本研究中,Tat蛋白是否也是通过这两个受体影响了BMSC的造血支持功能,有怎样的信号通路在其中起到作用,还有待我们更进一步地深入研究。
同种异体造血干细胞移植(HSCT)是一种已经确定的临床用于治疗严重恶性或非恶性血液系统疾病的治疗手段。而由于MSC具有造血支持功能,在临床前的动物实验和临床试验中,MSC常常用作HSCT的辅助细胞,通过不同的方式与HSC共同移植促进HSCT的疗效[20]。而近年来,HSCT不仅仅用于血液系统疾病的治疗,自2009年同时患有艾滋病和白血病的“柏林病人”通过移植CCR5 △32/△32缺失的造血干细胞将两种疾病同时治愈后[21],将HSC进行基因改造后移植治疗艾滋病人的研究成为HIV研究领域的热点[22]。然而,HIV-1感染患者无论是否接受造血干细胞移植,即便是单纯为了控制造血细胞数量的减少,都需要良好的造血微环境,而结合前面的报道和本研究的实验结果可知,HIV-1感染患者的骨髓造血微环境受到了破坏,那么,从这个角度而言,健康的MSC对于HIV-1的辅助治疗具有新的重要的意义。因此,本研究不仅进一步揭示了HIV-1感染者造血损伤的又一可能原因,也为MSC应用于HIV-1的辅助治疗提供了一定的依据,将为HIV-1治疗研究领域提供新的思路。
| [1] | Zon L I, Groopman J E. Hematologic manifestations of the human immune deficiency virus (HIV). Seminars in Hematology, 1988, 25(3) : 208–218. |
| [2] | Scadden D T, Zon L I, Groopman J E. Pathophysiology and management of HIV-associated hematologic disorders. Blood, 1989, 74(5) : 1455–1463. |
| [3] | Redig A J, Berliner N. Pathogenesis and clinical implications of HIV-related anemia in 2013. Hematology Am Soc Hematol Educ Program, 2013, 2013 : 377–381. |
| [4] | Beaupere C, Garcia M, Larghero J, et al. The HIV proteins Tat and Nef promote human bone marrow mesenchymal stem cell senescence and alter osteoblastic differentiation. Aging Cell, 2015, 14(4) : 543–546. |
| [5] | Gibellini D, Miserocchi A, Tazzari P L, et al. Analysis of the Effects of HIV-1 Tat on the Survival and Differentiation of Vessel Wall-Derived Mesenchymal Stem Cells. Journal of Cellular Biochemistry, 2012, 113(4) : 1132–1141. DOI:10.1002/jcb.23446 |
| [6] | Ludwig A, Saffrich R, Eckstein V, et al. Functional potentials of human hematopoietic progenitor cells are maintained by mesenchymal stromal cells and not impaired by plerixafor. Cytotherapy, 2014, 16(1) : 111–121. DOI:10.1016/j.jcyt.2013.07.007 |
| [7] | Pelagiadis I, Stiakaki E, Choulaki C, et al. The role of children's bone marrow mesenchymal stromal cells in the ex vivo expansion of autologous and allogeneic hematopoietic stem cells. Cell Biology International, 2015, 39(10) : 1099–1110. DOI:10.1002/cbin.v39.10 |
| [8] | Freida D, Lecourt S, Cras A, et al. Human bone marrow mesenchymal stem cells regulate biased DNA segregation in response to cell adhesion asymmetry. Cell Rep, 2013, 5(3) : 601–610. DOI:10.1016/j.celrep.2013.09.019 |
| [9] | Davis B R, Zauli G. Effect of human immunodeficiency virus infection on haematopoiesis. Baillieres Clin Haematol, 1995, 8(1) : 113–130. DOI:10.1016/S0950-3536(05)80234-3 |
| [10] | Sebastian N T, Collins K L. Targeting HIV latency:resting memory T cells, hematopoietic progenitor cells and future directions. Expert Review of Anti-Infective Therapy, 2014, 12(10) : 1187–1201. DOI:10.1586/14787210.2014.956094 |
| [11] | Kuller L H, Tracy R, Belloso W, et al. Inflammatory and coagulation biomarkers and mortality in patients with HIV infection. PLoS Medicine, 2008, 5(10) : e203. DOI:10.1371/journal.pmed.0050203 |
| [12] | Bahner I, Kearns K, Coutinho S, et al. Infection of human marrow stroma by human immunodeficiency virus-1(HIV-1) is both required and sufficient for HIV-1-induced hematopoietic suppression in vitro:demonstration by gene modification of primary human stroma. Blood, 1997, 90(5) : 1787–1798. |
| [13] | Mcnamara L A, Onafuwa-nuga A, Sebastian N T, et al. CD133+ hematopoietic progenitor cells harbor HIV genomes in a subset of optimally treated people with long-term viral suppression. J Infect Dis, 2013, 207(12) : 1807–1816. DOI:10.1093/infdis/jit118 |
| [14] | Kyei G B, Dinkins C, Davis A S, et al. Autophagy pathway intersects with HIV-1 biosynthesis and regulates viral yields in macrophages. J Cell Biol, 2009, 186(2) : 255–268. DOI:10.1083/jcb.200903070 |
| [15] | Raymond A D, Campbell-sims T C, Khan M, et al. HIV Type 1 Nef is released from infected cells in CD45(+) microvesicles and is present in the plasma of HIV-infected individuals. AIDS Res Hum Retroviruses, 2011, 27(2) : 167–178. DOI:10.1089/aid.2009.0170 |
| [16] | Cotter E J, Malizia A P, Chew N, et al. HIV proteins regulate bone marker secretion and transcription factor activity in cultured human osteoblasts with consequent potential implications for osteoblast function and development. AIDS Res Hum Retroviruses, 2007, 23(12) : 1521–1530. DOI:10.1089/aid.2007.0112 |
| [17] | Cotter E J, Chew N, Powderly W G, et al. HIV type 1 alters mesenchymal stem cell differentiation potential and cell phenotype ex vivo. AIDS Res Hum Retroviruses, 2011, 27(2) : 187–199. DOI:10.1089/aid.2010.0114 |
| [18] | Gibellini D, De Crignis E, Ponti C, et al. HIV-1 Tat protein enhances RANKL/M-CSF-mediated osteoclast differentiation. Biochem Biophys Res Commun, 2010, 401(3) : 429–434. DOI:10.1016/j.bbrc.2010.09.071 |
| [19] | Gibellini D, Miserocchi A, Tazzari P L, et al. Analysis of the Effects of HIV-1 Tat on the Survival and Differentiation of Vessel Wall-Derived Mesenchymal Stem Cells. J Cell Biochem, 2012, 113(4) : 1132–1141. DOI:10.1002/jcb.23446 |
| [20] | Kallekleiv M, Larun L, Bruserud O, et al. Co-transplantation of multipotent mesenchymal stromal cells in allogeneic hematopoietic stem cell transplantation:A systematic review and meta-analysis. Cytotherapy, 2016, 18(2) : 172–185. DOI:10.1016/j.jcyt.2015.11.010 |
| [21] | Hutter G, Nowak D, Mossner M, et al. Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation. N Engl J Med, 2009, 360(7) : 692–698. DOI:10.1056/NEJMoa0802905 |
| [22] | Younan P, Kowalski J, Kiem H P, et al. Genetic modification of hematopoietic stem cells as a therapy for HIV/AIDS. Viruses, 2013, 5(12) : 2946–2962. DOI:10.3390/v5122946 |
 2017, Vol. 37
2017, Vol. 37




