文章信息
- 刘立平, 张纯, 殷爽, 王祺, 张耀, 余蓉, 刘永东, 苏志国.
- LIU Li-ping, ZHANG Chun, YIN Shuang, WANG Qi, ZHANG Yao, YU Rong, LIU Yong-dong, SU Zhi-guo.
- 白蛋白结合肽-多柔比星耦合物的设计、制备、表征及初步评价
- Design, Preparation, Characterization and Preliminary Evaluation of an Albumin Binding Peptide-Doxorubicin Conjugate
- 中国生物工程杂志, 2017, 37(4): 68-75
- China Biotechnology, 2017, 37(4): 68-75
- http://dx.doi.org/DOI:10.13523/j.cb.20170409
-
文章历史
- 收稿日期: 2016-11-04
- 修回日期: 2016-11-22
2. 中国科学院过程工程研究所 生化工程国家重点实验室 北京 100190
2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
多柔比星作为DNA嵌入剂,是目前被认为最有效的抗癌/肿瘤的小分子化学药物之一。多柔比星与DNA作用结合后,可干扰其正常合成并最终抑制细胞生长,在临床上广泛用于乳腺癌、卵巢癌、白血病、淋巴癌、胃癌、肺癌以及其他多种实体肿瘤的治疗[1]。然而其严重的毒副作用如骨髓抑制、心脏毒性以及消化道损伤等限制了其在临床癌症疾病治疗中的进一步发展,并且这些毒副作用严重程度与使用剂量相关且具有累计效应[2],如充血性心脏衰竭的单次临界剂量为550 mg/m2。研究显示多柔比星在人体血液中的表观半衰期极为短暂,静脉注射后大部分的药物迅速分布于组织器官中,如心脏、骨髓、肺和肾脏等[3]。多柔比星在组织器官的富集分布是导致其系列毒副作用的主要原因之一。
多柔比星-马来酰亚胺衍生物 (DOXO-EMCH) 可与内源性白蛋白共价结合,从而改善多柔比星在体内的组织分布、延长其在循环血液中的代谢半衰期。DOXO-EMCH进入血液后,其衍生的马来酰亚胺基团与血清白蛋白Cys34的游离巯基通过迈克尔加成反应共价结合,依赖于白蛋白自身的长效机制实现多柔比星的长效[4-5]。DOXO-EMCH在体内的半衰期显著延长,且最大耐受剂量相对于多柔比星提高了数倍[6],然而其临床Ⅲ期试验结果并未达到满意的治疗效应。基于现有文献报道分析,其原因可能是因为:(1) DOXO-EMCH进入血液后除了与白蛋白Cys34结合之外,还能够与血液中的还原型谷胱甘肽 (GSH) 以及游离的半胱氨酸和其他含有游离半胱氨酸的蛋白结合;(2) DOXO-EMCH与白蛋白Cys34的耦合反应需要一定时间才能完成,而在耦合之前的游离DOXO-EMCH可能以类似于多柔比星代谢的形式迅速分布于组织器官;这两方面的原因导致DOXO-EMCH不能完全转化为白蛋白-多柔比星复合物,最终导致临床试验未能达到预期的效应。
基于上述分析,本研究设计制备了一种基于革兰氏阳性菌体表面蛋白来源的重组白蛋白结合肽,其分子量约6 kDa。重组白蛋白结合肽通过大肠杆菌体系实现可溶性高表达,并通过两步层析纯化方法获得纯度高于95%的重组合肽。重组白蛋白结合肽与人血清白蛋白在数分钟内完成结合,具有极高的亲和力[7]。我们将DOXO-EMCH与重组白蛋白结合肽在体外完成耦联反应,制备获得重组白蛋白结合肽-多柔比星耦合物,并表征了其结构 (图 1),以及初步评价了耦合物的药学性质。
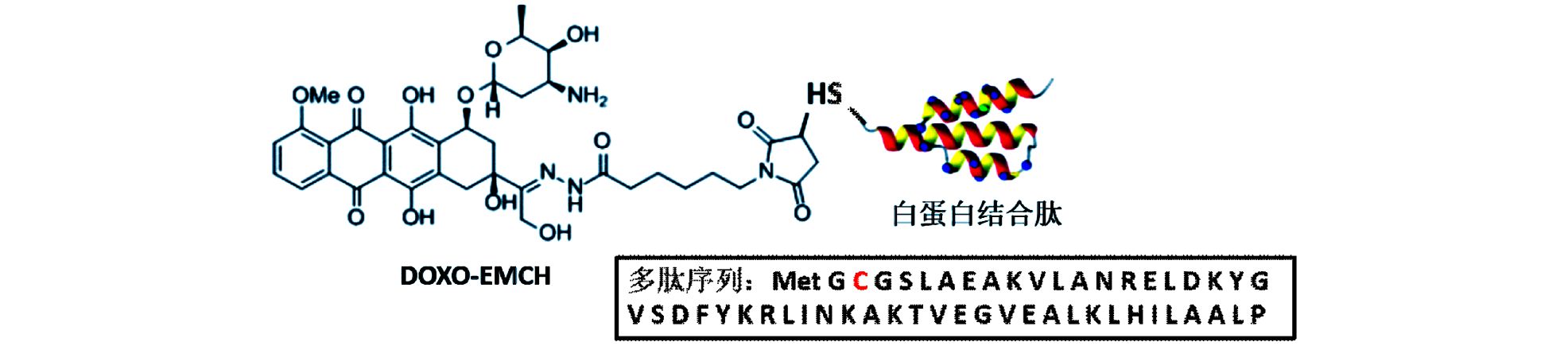
|
| 图 1 白蛋白结合肽-多柔比星耦合物的结构图 Figure 1 Structure of albumin binding peptide-doxorubicin conjugate |
目的基因序列合成以及质粒构建由上海生工公司完成,将含有目的基因序列的pET-30a (+) 质粒转入到大肠杆菌E. coli BL21(DE3) 宿主菌种。
1.1.2 试剂层析介质CM Sepharose FF、制备型Superdex 75介质购自GE Healthcare公司 (美国),多柔比星和DOXO-EMCH均购自北京乐博生物有限公司 (MCE,美国),其他试剂均为国产分析纯。
1.1.3 设备KTA purifier层析系统 (GE Healthcare,美国);紫外-可见分光光度计 (GE Healthcare,美国); SuperdexTM peptide高效凝胶过滤柱 (GE Healthcare,美国); 圆二色光谱仪 (JASCO,日本);荧光分光光度计 (Hitachi,日本)。
1.1.4 实验动物SD大鼠和BALB/c裸鼠小鼠均由中国科学院过程工程研究所生化工程国家重点实验室SPF级实验动物室提供、饲养,所有实验操作符合国家实验动物相关规定。
1.2 方法 1.2.1 重组白蛋白结合肽大肠杆菌的发酵低温保存的重组白蛋白结合肽菌种,经过夜活化后按1:50的接种比例转入到含有500 ml LB培养基的2.0 L培养瓶中 (含100 mg/L浓度的卡那霉素),继续在37 ℃,200 r/min摇床中培养至OD600 nm长至2.0左右,将500 ml的菌液导入至含有15 L培养基的BioFlo-415发酵罐中。培养基成分为每升培养基中含有20 g蛋白胨,10 g酵母浸膏,20 g氯化钠,以及5 g甘油和100mg卡那霉素。设置发酵罐参数初始为350 r/min搅拌速度,15 L/min空气通入量,37 ℃恒温,pH控制在6.8~6.9范围内。期间定期测定发酵液OD600 nm检测细菌生长情况。待菌液浓度OD600 nm达到5.0~6.0之间时,终浓度为0.5 mmol/L IPTG加入发酵罐中,诱导目的蛋白合成。诱导时间为4h,诱导开始后以5.0 ml/min的流速补加补料培养基1.0 L以补充发酵液养分 (补料培养基含10%蛋白胨,10%氯化钠,5%酵母浸膏,5%甘油)。诱导结束后,菌液4 000 r/min离心,称重,保存于-70 ℃。
1.2.2 重组白蛋白结合肽的纯化制备发酵菌体使用缓冲液 (20 mmol/L PB,1 mmol/L EDTA,pH6.0) 按20%菌体浓度的比例重悬,使用APV-2000高压均质匀浆机进行菌体破碎,破碎压力为800~900 bar,重悬菌液循环三次,然后10 000 r/min离心30 min,收集上清液,冷藏备用。
CM-Sepharose色谱纯化:自装CM-Sepharose FF层析柱 (XK16×100 mm) 以buffer A (20 mmol/L PB, pH 6.0) 充分平衡,再取菌体破碎上清液,以buffer A稀释3倍降低电导后上样。上样完毕后用buffer A继续淋洗5 CV,然后以25% buffer B (20 mmol/L PB, 1mol/L NaCl, pH6.0) 阶跃洗脱目的蛋白,流速均为5 ml/min。
Superdex 75色谱纯化:Superdex 75预装柱 (XK26×600 mm) 以buffer C (20 mmol/L PB, 0.1 mol/L Na2SO4,pH 7.0) 充分平衡,阳离子层析洗脱蛋白直接上样,上样量为10 ml。然后继续以buffer C洗脱,收集目标蛋白峰,流速均为3 ml/min。
1.2.3 重组白蛋白结合肽对人血清白蛋白的结合能力评价将纯化获得的多肽与人血清白蛋白按1:0, 1:1, 1:2, 和1:3摩尔浓度比例混合10min,注意应保持各组混合液中白蛋白结合肽的浓度一致。之后使用高效凝胶过滤色谱 (Superdex 75 HR分析柱) 以同等上样量分析各组多肽的结合效率。
1.2.4 重组白蛋白结合肽-多柔比星耦合物的合成条件筛选重组白蛋白结合肽分子中的游离半胱氨酸可与多柔比星的马来酰亚胺衍生物 (DOXO-EMCH) 中的马来酰亚胺基团发生迈克尔加成反应。为提高该化学反应耦联修饰率,我们对溶剂有机相组分 (DMF,DMSO) 及比例 (30%,35%,40%) 进行了优化。耦联反应2h后,使用G-25脱盐柱去除未反应的DOXO-EMCH,并通过Lowry法定量蛋白的摩尔浓度,通过480 nm的吸光值定量耦联物中的多柔比星的摩尔量,计算耦联效率[8]。
1.2.5 圆二色光谱分析将多肽-多柔比星耦合物与多肽分别置换至50 mmol/L PB,pH 7.0的缓冲液中,测定蛋白浓度并将最终浓度稀释至0.5 mg/ml,然后将样品载入0.1 cm光径的样品杯中,使用J-810圆二色光谱仪 (JASCO, 日本) 扫描260~190 nm波段的信号,扫描波长间隔为1.0 nm,扫描重复次数为5次,样品扫描速度为1 200 nm/min。以空白缓冲液信号作为参考校正。
1.2.6 荧光光谱分析将多肽-多柔比星耦合物、多肽及DOXO-EMCH的浓度分别稀释至0.2 mg/ml,然后将样品载入1.0 cm光径的石英样品杯中,使用荧光分光光度计 (Hitachi, 日本),设置荧光激发波长为480 nm,扫描500~650 nm波长范围内的荧光发射信号,扫描波长间隔为1.0 nm,扫描重复次数为5次,数据按5次平均值处理。
1.2.7 A549细胞毒力实验将A549细胞以1×104/孔的密度接种至96孔板,接种体积为100 μl。将细胞于5% CO2培养箱中37 ℃孵育过夜,待其贴壁。然后分别加入0.01~70μmol/L DOX当量的DOX、DOXO-EMCH及多肽-多柔比星耦合物,继续培养60 h。作用结束后,去除药物,PBS洗涤各孔细胞3次,然后再向各孔补足100 μl新鲜培养基,并加入10 μl CCK8试剂孵育2 h。最后用酶标仪测定各孔细胞在450 nm的吸收值,绘制细胞存活曲线,并采用GraphPad Prism v5.0软件计算各药物的IC50值。每组药物均设置三个复孔。
1.2.8 大鼠体内的药代动力学评价将多柔比星、多柔比星马来酰亚胺衍生物以及耦合物按5 mg/kg的多柔比星当量通过SD大鼠尾静脉进行注射,给药后分别在既定的时间点 (10 min, 20 min, 30 min, 1 h, 2 h, 4 h, 8 h, 12 h, 24 h, 36 h, 48 h) 通过大鼠眼眶静脉采集血液,离心获得血清,保存于-70 ℃至待测。血清多柔比星浓度是通过荧光酶标仪测得,设置多柔比星的荧光激发波长λex=480 nm,荧光发射检测波长λem=580 nm。通过多柔比星荧光发射标准浓度曲线计算血清实际多柔比星当量浓度,数据参数通过DAS 2.0软件分析获得。
1.2.9 荷瘤小鼠体内药效学评价选用4周龄的雄性BALB/c裸鼠,将A549细胞以1×106/ml的密度接种至其右前肢腋下,待肿瘤体积达到100~150 mm3时,随机将肿瘤裸鼠分为4组,每组6只。分别将生理盐水、多柔比星、多柔比星马来酰亚胺衍生物以及耦合物按3 mg/kg的多柔比星当量进行皮下注射给药,给药间隔为4天/次,共给药4次。每两天测定各组裸鼠的肿瘤尺寸,并计算肿瘤体积,公式为:体积=(长×宽2) / 2。
1.2.10 蛋白质浓度测定测定方法参照Lowry法[8]。
2 结果与分析 2.1 重组白蛋白结合肽的大肠杆菌发酵与表达鉴定其发酵过程和菌体生长曲线如图 2,通过15 L发酵液发酵后,最终获得近300 g的湿菌体。破菌后离心上清液和沉淀分别电泳鉴定,结果显示目的蛋白几乎全部以可溶的形式表达。表达量通过BandScan软件分析粗略估算约占上清液总蛋白量的15%,换算为发酵液表达量则为每升最终发酵液中含目标蛋白约200mg。

|
| 图 2 重组白蛋白结合肽的菌体生长曲线 Figure 2 Bacterial growth curve of albumin-binding domain |
通过两步骤组合色谱层析实验,可获得重组白蛋白结合肽,经电泳分析,其纯度高于95%,且在Superdex Peptide高效凝胶层析中显示为单峰,进一步验证了其高纯度。此外,两步骤蛋白的总收率约为42.6%(图 3)。
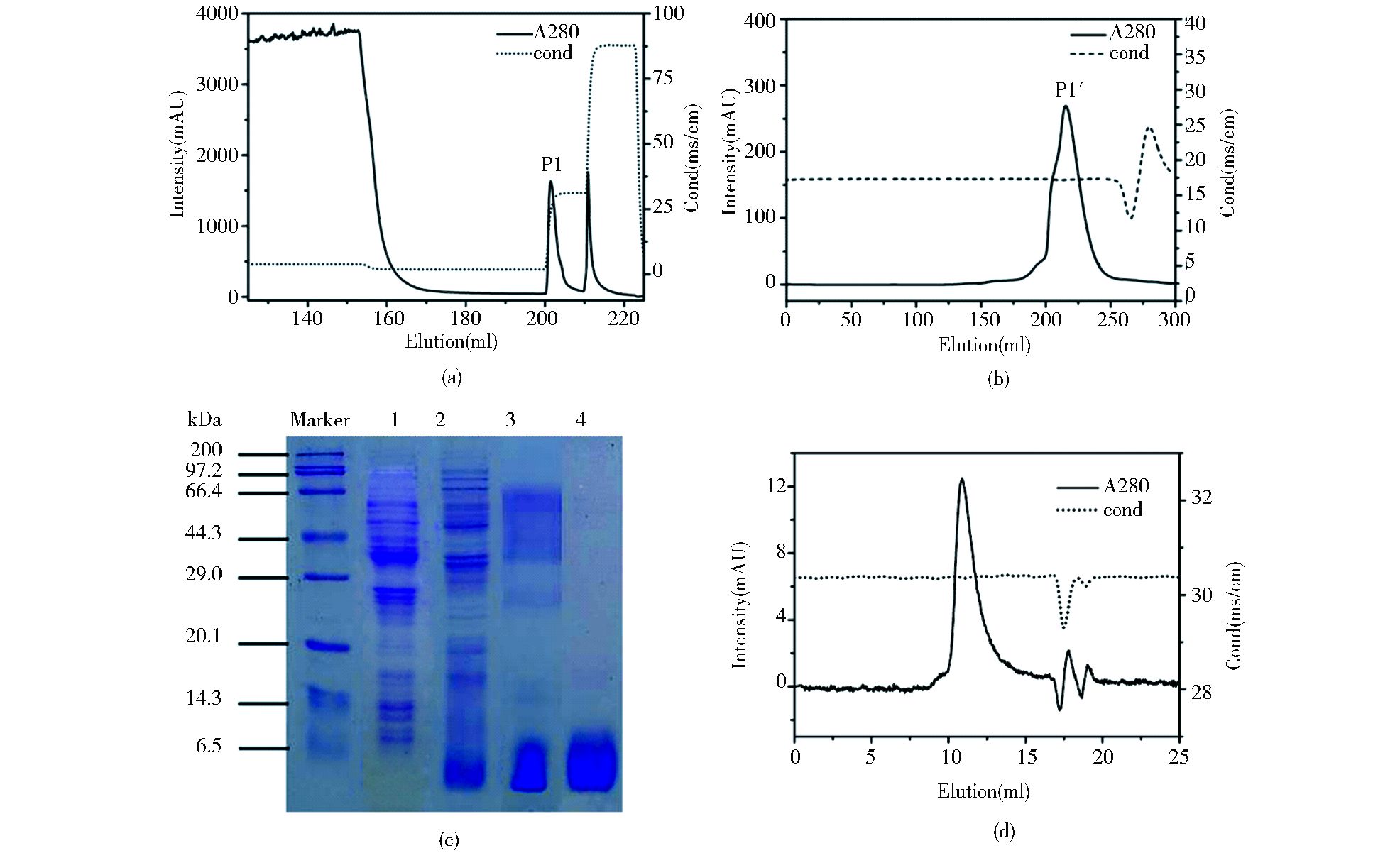
|
| 图 3 重组白蛋白结合肽的分离纯化层析及纯度鉴定 Figure 3 Chromatographic profile of the purification of the albumin-binding domain peptide (a) CM-Sepharose FF (b) Superdex 75 (c)12% SDS-PAGE analysis of eluted peaks (d) Superdex Peptide HR gel filtration 1: Bacterial protein before induction; 2: Disrupted bacteria supernatant; 3:Peak1 after CM purification; 4: Peak1' after CM purification |
高效凝胶过滤结果显示重组白蛋白结合肽与人血清白蛋白具有极高的亲和力,在摩尔比为1:2(重组肽/HSA) 的情况下重组白蛋白结合肽几乎被完全结合,并且这种结合作用在数分钟内即可完成 (图 4)。
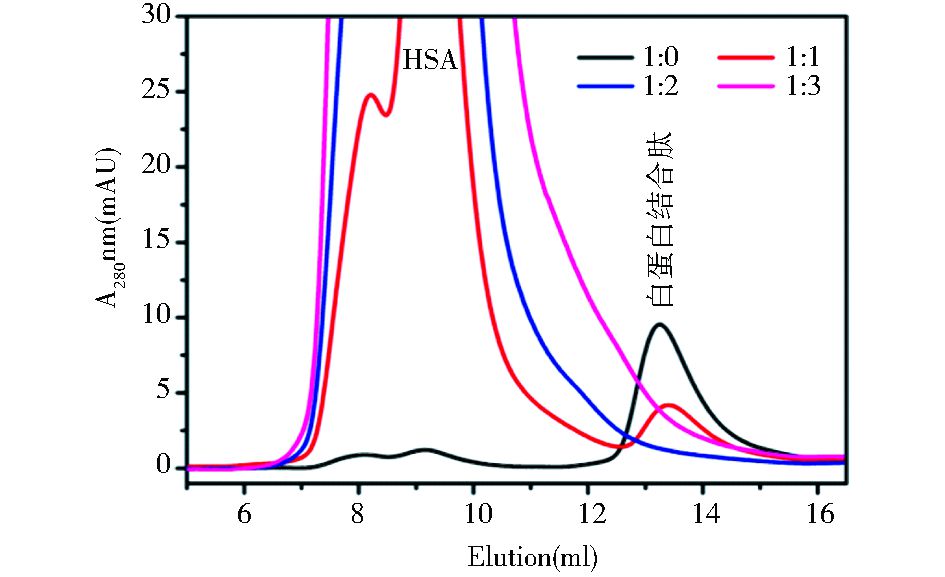
|
| 图 4 白蛋白结合肽与人血清白蛋白的体外结合 Figure 4 Binding of the albumin-binding domain peptide to human serum albumin in vitro |
不同耦联反应条件下的耦联修饰率结果如表 1所示。多柔比星衍生物DOXO-EMCH分子的溶解度是制约耦合物收率至关重要的因素。在pH 9.0及摩尔比1:6条件的基础上,我们尝试了在有机溶剂-水混合体系中修饰的策略,筛选了两种有机试剂使用比例。结果表明,DMF更有利于耦联反应的进行,且随有机相比例的提升,耦联效率可大为改善。但当有机相比例超出40%时,蛋白因不稳定而发生沉淀。因此,最终确定耦联反应的最佳条件组合为pH 9.0、摩尔比1:6、40% DMF、反应2 h,在此条件下,耦联率可达73.59%及以上。
| 30% | 35% | 40% | >40% | |
| DMSO | 50.12% | 51.07% | 52.46% | 蛋白沉淀 |
| DMF | 60.84% | 67.06% | 73.59% | 蛋白沉淀 |
2.5 长效肽-多柔比星耦合物的圆二色光谱分析
圆二色光谱分析结果显示重组白蛋白结合肽的二级结构主要以α-螺旋结构为主,与文献报道基本一致。圆二色结构分析显示重组白蛋白结合肽与DOXO-EMCH耦联后,其二级结构几乎不发生变化,表明药物耦联对重组白蛋白结合肽的结构不产生显著性影响 (图 5)。

|
| 图 5 多肽-多柔比星耦合物的圆二色图谱 Figure 5 Circular dichroism spectrum of the peptide-DOXO conjugate |
分离获得的耦合物,在480 nm激发波长下,荧光发射扫描测定550 nm和588 nm处有最大荧光发射波长,与多柔比星衍生物自身的荧光性质相符合,表明多柔比星衍生物成功耦联于重组白蛋白结合肽上 (图 6)。
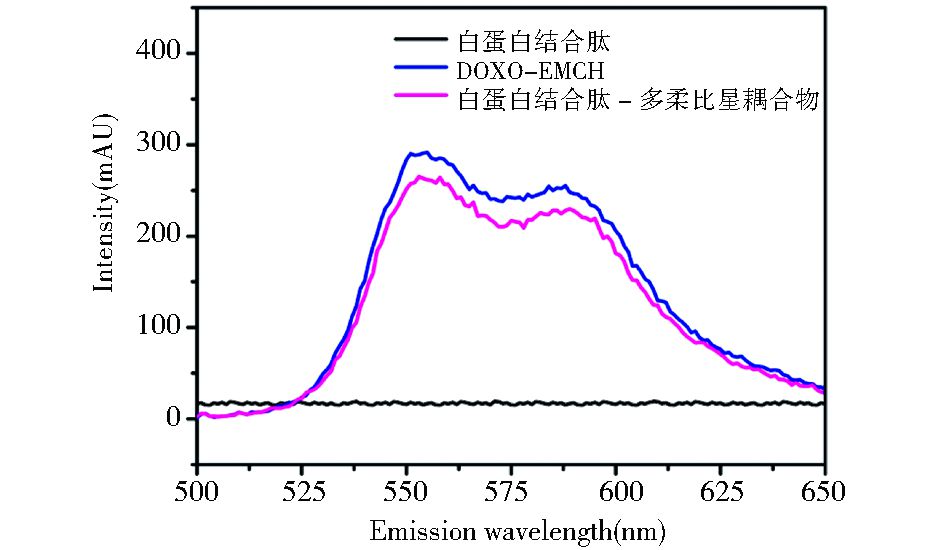
|
| 图 6 多肽-多柔比星耦合物的荧光光谱 Figure 6 Fluorescence spectrum of the peptide-DOXO conjugate |
A549细胞活性实验结果显示多柔比星和DOXO-EMCH的IC50浓度相近,约0.3 μmol/L,而重组白蛋白结合肽-多柔比星耦合物的IC50浓度约为13 μmol/L (图 7)。

|
| 图 7 多肽-多柔比星耦合物的细胞存活率测定 Figure 7 Proliferation inhibitory effect of the conjugate on A549 tumor cells |
大鼠药代动力学实验结果显示 (图 8及表 2),多柔比星在血液中的浓度迅速减低,而DOXO-EMCH相对于多柔比星有所延长。而重组白蛋白结合肽-多柔比星耦合物显示出显著延长的血液浓度衰减半衰期,相对于多柔比星和DOXO-EMCH分别延长了5.6倍和3.8倍。线下面积 (AUC) 积分显示重组白蛋白结合肽-多柔比星耦合物相对于多柔比星和DOXO-EMCH,分别延长了180.9倍和55.8倍。
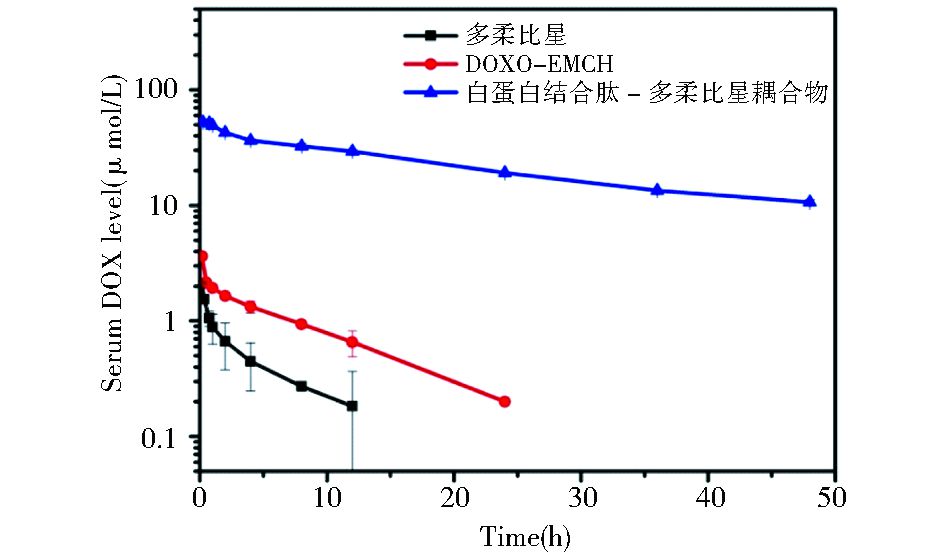
|
| 图 8 雄性SD大鼠体内药代动力学 Figure 8 Pharmacokinetics of the conjugate in SD male rats |
| 药物组别 | T1/2β(h) | AUC(mg/L·h) | Cl(L/h/kg) | Vc(L/kg) | MRT(h) |
| 多柔比星 | 4.4 | 3.3 | 1.2 | 3.1 | 3.8 |
| DOXO-EMCH | 6.5 | 10.7 | 0.4 | 1.3 | 6.1 |
| 白蛋白结合肽-多柔比星耦合物 | 24.8 | 596.9 | 0.006 | 0.17 | 17.9 |
2.9 药效学分析
药效学实验结果显示所有实验荷瘤小鼠肿瘤体积都在增加。相对于生理盐水对照组,在3.0 mg/kg多柔比星当量的给药剂量、每周约两次给药的情况下,所有小鼠的肿瘤体积生长速度都得到了不同程度的抑制。其中耦合物组小鼠的肿瘤增长速度最为缓慢。多柔比星组、DOXO-EMCH组及白蛋白结合肽-多柔比星耦合物组的抑瘤率分别为24.28%, 25.67%及47.09%(图 9),表明耦联白蛋白结合肽后,多柔比星的肿瘤抑制作用得到明显增强。此外数据显示实验期间小鼠的体重都在一定程度上有所下降,下降幅度大小顺序为生理盐水组 < 重组白蛋白结合肽-多柔比星耦合物组 < DOXO-EMCH组 < 多柔比星组,表明相对于多柔比星及DOXO-EMCH药物分子,耦合物的毒性减弱。

|
| 图 9 体内肿瘤生长抑制曲线图 Figure 9 In vivo tumor inhibitory effect on A549 tumor-bearing mice |
大多数小分子药物用于抗肿瘤治疗时,毒副作用过强、耐受性差和血液清除半衰期短是其在临床使用中的最大不足。目前,基于白蛋白载体的长效机制被广泛用于小分子药物的长效设计[9-11],即设计前药分子,使其静脉给药后快速并专一性地与内源白蛋白Cys34结合,从而使半衰期有效延长。然而即使采用当前最常使用的、对Cys-SH反应活性及特异性最强的马来酰亚胺作为衍生基团,同样难以取得理想的治疗效应。其可能的原因之一为这些前药分子不能够及时有效地与循环白蛋白耦合形成复合物。
本研究通过大肠杆菌表达了高亲和力重组白蛋白结合肽 (N-末端引入了便于药物耦联的半胱氨酸),并建立了无亲和标签 (tag-free) 的纯化工艺。其结构与文献报道相近[7, 12],且能够与人血清白蛋白快速结合。与常规的前药分子不同,该重组短肽无需与白蛋白分子的Cys34共价结合,而是通过其C端的α螺旋结构与白蛋白结构域Ⅱ高亲和力结合,避免了共价耦合反应效率低的问题。然后本研究以DOXO-EMCH作为载体药物,通过其马来酰亚胺基团与白蛋白结合肽进行耦联,成功制备获得了重组白蛋白结合肽-多柔比星耦合物。
细胞活性实验结果显示耦合物的毒力相对于多柔比星或DOXO-EMCH都有一定程度的下降,这可能是因为在细胞与药物共培养过程中,分子量较小的多柔比星和DOXO-EMCH通过被动扩散的形式更为直接地、高效地进入细胞内并发生作用,而耦合物进入细胞相对较为缓慢[13]。药代动力学结果显示重组白蛋白结合肽显著改善多柔比星在血液中浓度的衰减速度。这是因为耦合物进入血液后迅速与白蛋白发生亲和作用,“粘附”于白蛋白之上,通过白蛋白的长效机制[14]实现耦合物或多柔比星自身的长效。相对于DOXO-EMCH在循环系统中与白蛋白发生化学耦联反应时可能出现被GSH、游离Cys以及其它含有游离半胱氨酸的蛋白的竞争,重组白蛋白结合肽-多柔比星耦合物对白蛋白的亲和作用具有更高的效率和特异性,最终体现为更强的抑制荷瘤小鼠生长的作用效力。因此,本研究有望为小分子药物设计基于白蛋白的长效机制提供新的长效设计思路。
致谢 感谢教育部博士点基金 (NO. 120120181110036),生化工程国家重点实验室开放基金 (NO. 2014KF-05)、北京市自然科学基金 (NO. 2162041)、和国家自然科学基金 (NO. 21576267) 的资助。| [1] | 刘一, 边原, 叶云. 阿霉素抗肿瘤作用的研究进展. 泸州医学院学报, 2008, 31(1) : 101–103. Liu Y, Bian Y, Ye Y. Research progress on the anti-tumor effect of adriamycin. Journal of Luzhou Medical College, 2008, 31(1) : 101–103. |
| [2] | Rahman A M, Yusuf S W, Ewer M S. Anthracycline-induced cardiotoxicity and the cardiac-sparing effect of liposomal formulation. International Journal of Nanomedicine, 2007, 2(4) : 567–583. |
| [3] | Stefano G D, Kratz F, Lanza M, et al. Doxorubicin coupled to lactosaminated human albumin remains confined within mouse liver cells after the intracellular release from the carrier. Digestive and Liver Disease, 2003, 35(6) : 428–433. DOI:10.1016/S1590-8658(03)00212-3 |
| [4] | Graeser R, Esser N, Unger H, et al. INNO-206, the (6-maleimidocaproyl hydrazone derivative of doxorubicin), shows superior antitumor efficacy compared to doxorubicin in different tumor xenograft models and in an orthotopic pancreas carcinoma model. Investigational New Drugs, 2010, 28(1) : 14–19. DOI:10.1007/s10637-008-9208-2 |
| [5] | 张建军, 高缘, 孙婉瑾. 白蛋白作为药物载体的研究. 化学进展, 2011, 23(8) : 1747–1754. Zhang J J, Gao Y, Sun W J. Research of albumin as a drug carrier. Progress in Chemistry, 2011, 23(8) : 1747–1754. |
| [6] | Kratz F. DOXO-EMCH (INNO-206):the first albumin-binding prodrug of doxorubicin to enter clinical trials. Expert Opinion on Investigational Drugs, 2007, 16(6) : 855–866. DOI:10.1517/13543784.16.6.855 |
| [7] | Jonsson A, Dogan J, Herne N, et al. Engineering of a femtomolar affinity binding protein to human serum albumin. Protein Engineering Design & Selection, 2008, 21(8) : 515–527. |
| [8] | 殷爽, 冯翠, 张纯, 等. 转铁蛋白-PEG-睫状神经营养因子的制备及其生物活性评价. 中国生物工程杂志, 2016, 36(4) : 43–49. Yin S, Feng C, Zhang C, et al. Preparation and biological activity evaluation of transferrin-PEG-ciliary neurotrophic factor. China Biotechnology, 2016, 36(4) : 43–49. |
| [9] | Nilvebrant J, Hober S. The albumin-binding domain as a scaffold for protein engineering. Computational and Structural Biotechnology Journal, 2013, 6(6) : 1–8. |
| [10] | Kontermann R E. Strategies for extended serum half-life of protein therapeutics. Current Opinion in Biotechnology, 2011, 22(6) : 868–876. DOI:10.1016/j.copbio.2011.06.012 |
| [11] | 李荣, 胡维新. 血清白蛋白的生物学特性研究进展. 生命科学, 2013, 25(10) : 1022–1026. Li R, Hu W X. Research progress on the biological characteristics of serum albumin. Chinese Bulletin of Life Sciences, 2013, 25(10) : 1022–1026. |
| [12] | Johansson M U, Frick I M, Nilsson H, et al. Structure, specificity, and mode of interaction for bacterial albumin-binding modules. Journal of Biological Chemistry, 2002, 277(10) : 8114–8120. DOI:10.1074/jbc.M109943200 |
| [13] | Sheng Y, Xu J, You Y, et al. Acid-sensitive peptide-conjugated doxorubicin mediates the lysosomal pathway of apoptosis and reverses drug resistance in breast cancer. Molecular Pharmaceutics, 2015, 12(7) : 2217–2228. DOI:10.1021/mp500386y |
| [14] | Kratz F. A clinical update of using albumin as a drug vehicle——A commentary. Journal of Controlled Release, 2014, 190 : 331–336. DOI:10.1016/j.jconrel.2014.03.013 |
 2017, Vol. 37
2017, Vol. 37




