文章信息
- 程可利, 刘晓, 李素霞.
- CHENG Ke-li, LIU Xiao, LI Su-xia.
- 对SDS稳定的V8(V125T) 蛋白酶突变体的高效表达及性质研究
- Study on High-level Expression and Characterization of a V125T V8 Protease Mutant with Tolerance to SDS
- 中国生物工程杂志, 2017, 37(4): 56-67
- China Biotechnology, 2017, 37(4): 56-67
- http://dx.doi.org/DOI:10.13523/j.cb.20170408
-
文章历史
- 收稿日期: 2016-11-17
- 修回日期: 2016-12-22
2. 上海雅心生物技术有限公司 上海 201108
2. Shanghai Yaxin Biotechnology Co., Ltd, Shanghai 201108, China
谷氨酰内切酶 (glutamyl endoproteinase,EC 3. 4.21.19) 属于丝氨酸蛋白酶,类胰凝乳蛋白水解酶亚家族,能水解多肽链中谷氨酸和 (或) 天冬氨酸残基的α羧基形成的肽键[1]。该酶最早从金黄色葡萄球菌V8株系的培养基中分离得到,因此也被称为金黄色葡萄球菌V8蛋白酶、V8蛋白酶、Glu V8、Glu-C或SspA[2-3]。后来从链霉菌和放线菌[4]、芽孢杆菌[5-6]、葡萄球菌属[7-9]中分别获得了与V8蛋白酶具有高度同源性的谷氨酰内切酶。最近几年,国内外陆续有重组V8蛋白酶的报道。Yabuta等[10]将成熟的V8蛋白酶构建成一种“三明治式”的融合蛋白,在大肠杆菌中得到了不溶的包涵体,通过变复性获得V8蛋白酶,但得率较低。为了获得可溶性表达的V8蛋白酶,Ono等[11], Nemoto等[12]分别将与GluV8同源的GluSE和GluSW蛋白酶的前肽与成熟V8蛋白酶进行融合表达时,抑制了自降解,成功获得了可溶性表达的V8蛋白酶。在国内,朱蓓霖等[13]将地衣芽孢杆菌V8蛋白酶在大肠杆菌中表达获得了不溶性的包涵体,复性后收率很低。李礼等[14]、段树燕等[15]分别将来源于沃氏葡萄球菌、金黄色葡萄球菌的V8蛋白酶在大肠杆菌中实现了可溶性表达并进行了性质研究。
V8蛋白酶主要用于功能性短肽制备、肽图分析、临床检测、蛋白组学分析[16-18]等。对于天然的蛋白,非变性条件下,有些Glu, Asp残基位于分子内部,从而使得V8蛋白酶的酶切不能覆盖到所有的位点。如果能够得到一种对变性剂耐受的V8蛋白酶,在该变性条件下,蛋白肽链去折叠,经V8蛋白酶酶切,可获得覆盖率高的肽谱图。为获得对变性剂稳定的V8蛋白酶,Yabuta等[19-21]的研究报道了其成熟酶N端的第44, 71, 147位氨基酸的突变体,发现三个位点任一位点的单突变都会提高其在5 mol/L尿素中的稳定性,且将三个位点同时进行突变时,其稳定性最高。对V8蛋白酶的氨基酸序列和空间结构的研究报道了两个氨基酸序列[22-23],二者的差异在于氨基酸序列的第125位氨基酸由缬氨酸 (V) 突变为苏氨酸 (T)[23],我们通过结构模拟发现这一位点的突变导致了较大的空间结构的差异,第16~20位,107~112位由原helix变成了loop结构 (如图 1所示,突变位点用蓝色标示,有氨基酸标注且为红色的部位为二级结构改变处)。但对于这一突变体的性质目前并未有研究报道。本研究获得了这两种V8蛋白酶,分别称为重组V8蛋白酶和V8(V125T) 突变体,在大肠杆菌中获得了可溶性表达并通过补料分批发酵首次实现了50 L发酵,通过亲和层析和离子交换层析获得了纯度较高的酶,对其性质和对变性剂的耐受性进行了比较研究,发现该突变体对SDS有很好的耐受性,并对其耐受性的原因进行了分析。研究结果对于V8蛋白酶突变体研究及其应用具有实际意义。
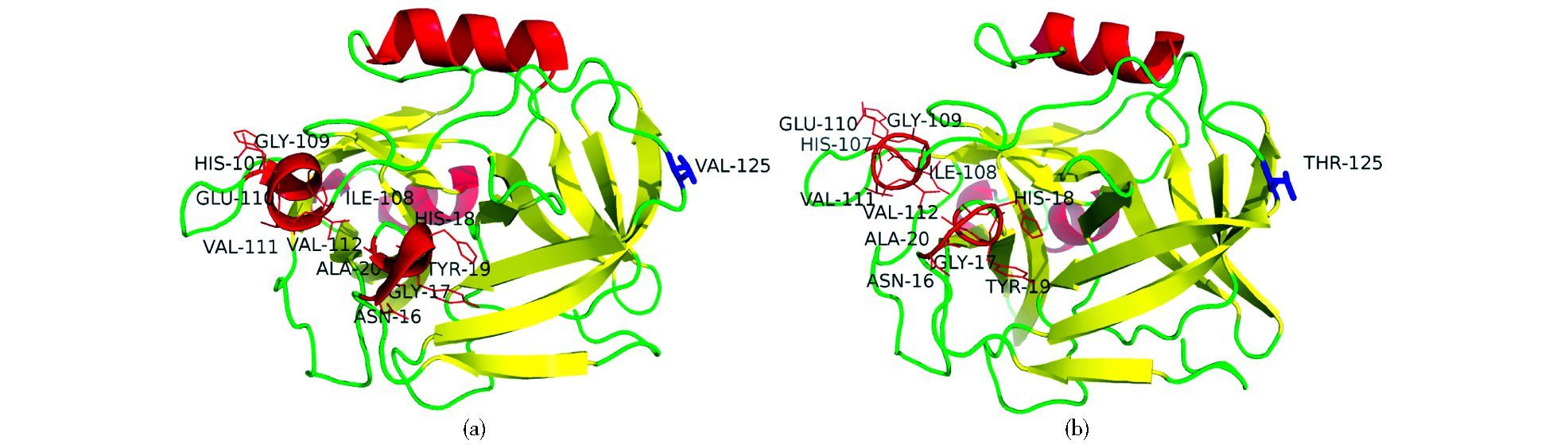
|
| 图 1 V8蛋白酶三维结构分析 Figure 1 Three-dimensional structure of V8 proteinases (a) Three-dimensional structure of recombinant V8 proteinase (PDB ID:1wcz) (b) Three-dimensional structure of V8(V125T) mutant |
质粒pGEX-4T-3购自GE公司;大肠杆菌BL21(DE3)、DH5α菌种均由本实验室保存;蛋白胨和酵母提取物均购自BD公司;BCA蛋白浓度试剂盒购自北京鼎国昌盛生物技术有限责任公司;蛋白Marker、基因合成由上海捷瑞生物工程有限公司提供;Z-Phe-Leu-Glu-pNA,上海吉尔生化有限公司合成;重组肠激酶购自上海雅心生物技术有限公司;其他试剂均为国产分析纯或化学纯。
1.2 仪器台式高速冷冻离心机 (TL-18M),(上海市离心机械研究所);酶标仪 (Bio-Rad);紫外可见分光光度计 (北京普析通用仪器有限公司);50 L发酵罐 (上海国强生化工程装备公司);高压匀浆破碎仪 (德国APV公司);WD-9413B凝胶成像分析仪 (北京六一生物科技有限公司)。
1.3 重组质粒构建V8蛋白酶的目的基因按照Uniprot (P0C1U8)(PDB ID:1wcz) 中来源于Staphylococcus aureus的成熟酶的氨基酸序列 (V1-Q220) 进行大肠杆菌密码子优化,合成到pGEX-4T-3质粒 (委托基因公司合成),通过定点突变技术将第125位的Val (V) 突变为Thr (T),构建到pGEX-4T-3质粒上。
1.4 目的蛋白的表达鉴定将含目的基因的pGEX-4T-3质粒转化到大肠杆菌BL21(DE3) 中,涂布于含100 μg/ml的氨苄抗性LB固体培养基 (0.1%蛋白胨,0.1%NaCl,0.05%酵母粉,1.5%琼脂粉) 上,37 ℃培养过夜。挑取单菌落到30ml含100μg/ml氨苄抗性LB培养基 (0.1%蛋白胨,0.1%NaCl,0.05%酵母粉) 中,37 ℃,200 r/min摇床培养6~8 h,当OD600达到0.6~0.8时,加入0.5 mmol/L IPTG (异丙基-β-D-硫代半乳糖苷,Isopropyl β-D-1-thiogalactopyranoside) 诱导,继续培养4 h。3 000 r/min离心20 min,弃上清,收取菌体,用50 mmol/L Tris-HCl pH 8.0悬浮,冰浴条件下,超声破碎 (功率:250 W超声时间:5 s间隔时间:5 s,15 min)。取诱导前、诱导后、破碎后上清、破碎后沉淀样品进行SDS-PAGE凝胶电泳分析。
1.5 V8(V125T) 突变体的50 L发酵将甘油菌按0.1%接种到400 ml种子培养基 (酵母粉5 g/L,KH2PO4 2 g/L,K2HPO4 4 g/L,Na2HPO4 7 g/L,氨苄青霉素100 mg/L) 中,37 ℃ 200 r/min摇床培养8~10 h,菌浓OD600约1.5,将摇瓶中的种子培养液全部接种于50 L发酵罐中,含有35 L的灭菌基础培养基 (酵母粉5 g/L,甘油1 ml/L,KH2PO4 2 g/L,K2HPO4 4 g/L,Na2HPO4 7 g/L,消泡0.3 ml/L,CaCl2 0.024 g/L,MgSO4 1 g/L,氨苄100 mg/L,微量元素0.2ml/L) 中。控制溶氧在10%~30%,50%氨水调节pH7.0。发酵约5~6 h,基础培养基中碳源耗尽,当溶氧和pH均回升,采用指数流加的方式补料 (酵母粉30 g/L, 甘油400 ml/L),37 ℃持续发酵7~8 h,当OD600达到30时,加入IPTG进行诱导,37 ℃诱导3 h发酵结束。离心收集菌体,用50 mmol/L Tris-HCl pH 8.0按质量比1:20悬浮菌体,高压均质机进行破碎。离心收集上清。
1.6 目的蛋白的纯化 1.6.1 GST亲和纯化将Glutathione Beads装入合适的层析柱,用5倍柱体积的结合Buffer (PBS, pH 7.4) 进行平衡,将破碎后上清液经0.22 μm的滤膜进行过滤加到平衡好的Glutathione Beads中,用10~15倍柱体积的洗杂Buffer (PBS, pH 7.4) 进行清洗,去除非特异性吸附的杂蛋白。使用5~10倍柱体积的洗脱Buffer (50 mmol/L Tris-HCl, 10 mmol/L还原型谷胱甘肽,pH 8.0) 进行洗脱,收集洗脱液,即为含GST标签的融合蛋白组分。
1.6.2 V8(V125T) 突变体的激活及标签蛋白的去除将经过GST亲和纯化后得到的含GST标签的融合蛋白在25 mmol/L Tris-HCl pH 8.0缓冲液中透析,BCA法测定透析后的蛋白浓度,根据肠激酶的酶活性单位定义 (1 U定义为在25 ℃,12~16 h之内,将0.5 mg保存于25 mmol/L Tris-HCl pH 8.0缓冲液中的融合蛋白切割95%所需的酶量) 加入适量的肠激酶,25 ℃酶切过夜。将酶切后的蛋白液按上述GST纯化的步骤进行第二次亲和纯化,此时被肠激酶酶切的GST标签被亲和柱吸附,收集上样流穿液即为已经被激活的V8(V125T) 蛋白酶。
1.6.3 DEAE-FF阴离子交换层析将激活的V8(V125T) 蛋白酶用1 mol/L HAc调pH 5.0后,25 mmol/L NaAc-HAc pH 5.0缓冲液透析,透析后液体上平衡后的DEAE-FF阴离子交换柱,0~400 mmol/L NaCl梯度洗脱,分管收集洗脱液。对洗脱液进行SDS-PAGE凝胶电泳分析,并进行活性测定。合并活性较高的收集液,对25 mmol/L NaAC-HAC pH 5.0缓冲液透析,透析后样品-20 ℃保存,待用。
1.7 对重组V8蛋白酶及V8(V125T) 突变体性质的研究本研究对纯化后的酶液进行性质分析, 对重组V8蛋白酶及V8(V125T) 突变体的性质进行对比分析。
1.7.1 酶活测定方法以Z-Phe-Leu-Glu-pNA为测活底物,用DMSO溶解并配置成120 mmol/L的底物溶液,100 mmol/L Tris-HCl pH8.0为测活缓冲液,按照测活体系:2.82 ml测活缓冲液+ 100 μl底物溶液+ 80 μl酶溶液,混匀,25 ℃,405nm下测定光吸收A值的变化,调整酶液浓度,使吸光度的变化值△A450在5min内呈线性。按照以下公式计算酶活。酶活U定义为:每分钟催化底物Z-Phe-Leu-Glu-pNA释放1μmol pNA所需的酶量为一个酶活单位U。计算公式如下:
V8蛋白酶活力单位 (Z-Phe-Leu-Glu-pNA单位/ml)=△A405/t×F×df
F=(tv)×103/(ε·L·sv)
其中:t:反应时间min;tv:反应液总体积ml;sv:加入酶液体积ml;df:稀释倍数;L为比色皿的光径,本测活体系中L=1cm,pNA的摩尔吸光系数ε=9650L/(mol·cm)。
1.7.2 最适pH和pH稳定性最适pH:将底物溶于pH 3.0~11.0的缓冲液中,分别测定相同浓度的重组V8蛋白酶及V8(V125T) 突变体的活性,结果表示为测定值占最高酶活的百分比。缓冲液依次为100 mmol/L NaAc-HAc (pH 3.0~6.0),100 mmol/L Tris-HCl (pH 7.0~8.0),100 mmol/L Gly-NaOH (pH 9.0~11.0)。所有缓冲液均于25 ℃配制。
pH稳定性:取纯化好的相同浓度的重组V8蛋白酶及V8(V125T) 突变体,分别在pH 3.0~11.0缓冲液中稀释10倍,于25 ℃下温育12 h,取样测定酶活,以水浴前酶液的初始活性作为100%,计算活性残余率。
1.7.3 最适温度及温度稳定性最适温度:将底物分别置于4 ℃、16 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃水浴中温育30 min,然后加入适量的重组V8蛋白酶及V8(V125T) 突变体纯酶液,记录A405,将底物与酶的混合液放入上述不同温度下反应5 min,立即测定A405,计算酶活,以最高酶活为100%,计算其余温度下酶活占最高酶活的百分比,做出相对酶活随温度变化曲线图。
温度稳定性:取相同浓度重组V8蛋白酶及V8(V125T) 突变体纯酶液,分别置于4 ℃、16 ℃、25 ℃、30℃、35 ℃、40 ℃、45 ℃、50 ℃水浴中温育12 h,分别在第1, 2, 4, 6, 8, 12 h按常规方法测定酶活性,以水浴前酶液的初始活性作为100%计算残余率。
1.7.4 金属离子及EDTA对酶活性的影响在重组V8蛋白酶及V8(V125T) 突变体纯酶溶液中分别加入终浓度为1 mmol/L的Ca2+, Mg2+, Mn2+, Cu2+, Ni2+, Co2+, Ba2+, Zn2+, Fe3+,终浓度分别为1 mmol/L、20 mmol/L和50 mmol/L的EDTA,25 ℃水浴保温2 h,测定其活性,以初始酶活性为100%,计算酶活残余率。
1.7.5 尿素中的稳定性及不同浓度尿素对酶活性的影响将重组V8蛋白酶及V8(V125T) 突变体纯酶液加入到终浓度分别为2 mol/L、5 mol/L及8 mol/L的尿素中,25 ℃温浴2 h,测定其活性,以初始酶活性为100%,计算酶活残余率,此结果为重组V8蛋白酶及V8(V125T) 突变体蛋白酶在尿素中的稳定性。
分别配置含2 mol/L、5 mol/L及8 mol/L尿素的100 mmol/L Tris-HCl pH8.0的测活缓冲液,测定重组V8蛋白酶及V8(V125T) 突变体蛋白酶活性,以不含尿素的缓冲液条件下所测活性为100%,计算酶活残余率。
1.7.6 SDS中的稳定性及不同浓度SDS对酶活性的影响将配置好的10%SDS溶液加入到重组V8蛋白酶及V8(V125T) 突变体纯酶液中,使其终浓度为0.1%、0.5%、1%,25 ℃下温浴12 h,在第1, 2, 4, 6, 8, 12 h测定酶活,以水浴前酶液的初始活性作为100%计算残余率,以此做为酶在SDS中的稳定性。配制含0.1%、0.5%、1%SDS的100 mmol/L Tris-HCl pH8.0的测活缓冲液,测定重组V8蛋白酶及V8(V125T) 突变体蛋白酶活性,以不含SDS的缓冲液条件下所测活性为100%,计算酶活残余率,以此作为SDS对酶活性的影响。
1.7.7 Km值与Vmax的测定配制终浓度为0.05 mmol/L,0.1 mmol/L,0.125 mmol/L,0.2 mmol/L,0.4 mmol/L,1 mmol/L的底物溶液,加入适量的重组V8蛋白酶及V8(V125T) 突变体纯酶液,测活。按经典的Lineweaver-Burk双倒数作图法,以1/[S]为横坐标,1/v为纵坐标作图,通过线性拟合得到一条直线,其中横轴截距为-1/Km,纵轴截距为1/Vmax。
2 结果分析 2.1 目的蛋白的表达鉴定结果见图 2a。融合蛋白大小约为50 kDa,根据超声破碎后结果 (图 2a泳道3, 4) 融合蛋白主要存在于在细胞破碎后的上清液中,为可溶性表达。
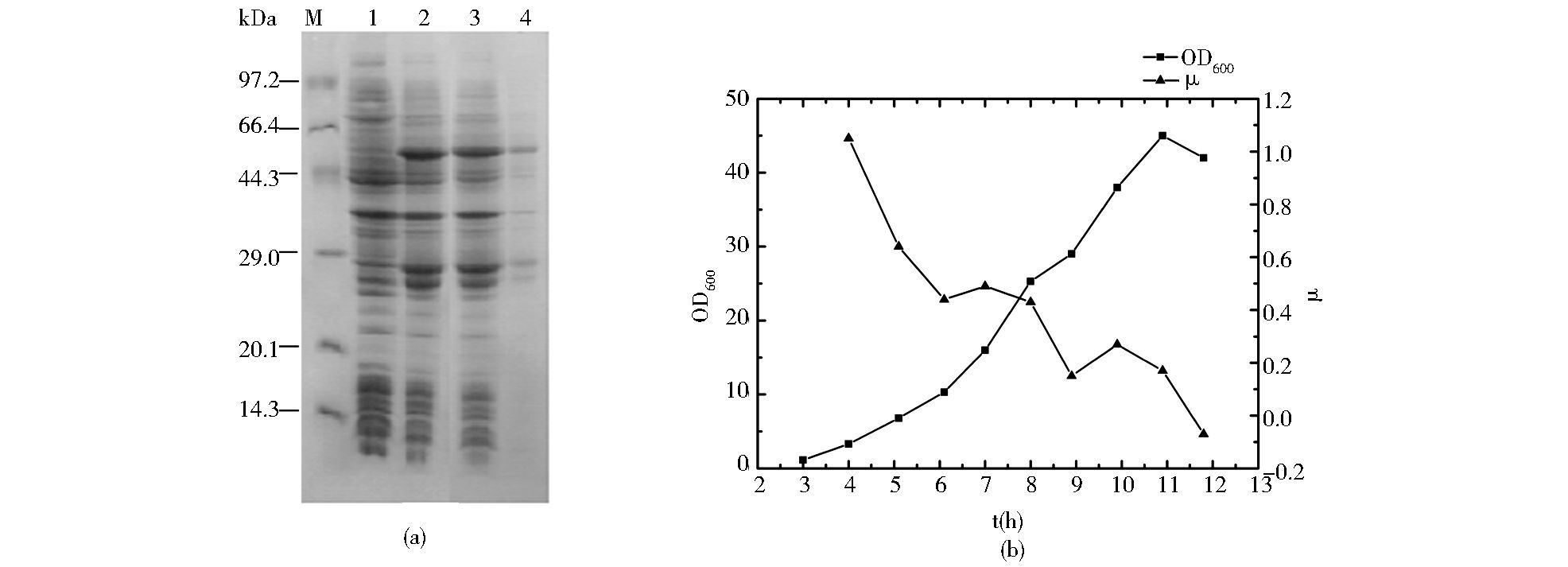
|
| 图 2 V8(V125T) 突变体表达的SDS-PAGE电泳分析和发酵过程记录 Figure 2 The SDS-PAGE analysis of the expression of V8(V125T) mutation and the records of fermentation (a) The SDS-PAGE analysis of the expression of V8(V125T) mutation M:Protein marker; 1: Before induction; 2: After induction with IPTG; 3: Supernatant after ultrasonic disruption; 4: Sediment (b) The trend chart of cell concentration OD600 and cell growth rate μ during the fermentation |
发酵过程中OD600与比生长速率μ记录如图 2b所示。菌种接入发酵罐经短暂的适应期后便开始进入对数生长期,OD600逐渐增大,由于培养基中营养物质的逐渐消耗,μ逐渐下降,发酵6 h时基础培养基中碳源耗尽,pH、溶氧回升,流加补料培养基补充碳源,通过脉冲流加补料的方式控制比生长速率μ,诱导前控制在0.4/h左右,诱导后的比生长速率控制在0.2/h。诱导3 h后放罐,得到的菌体湿重为50 g/L,通过WD-9413B凝胶成像分析软件进行灰度扫描分析,目的蛋白占总蛋白的33%。诱导过程中,每隔1 h取样做蛋白电泳 (图 3a),诱导1 h时,目的蛋白已经有表达,3 h时表达量达到最大。对菌体进行破碎,目的蛋白主要存在于破碎后细胞上清中,为可溶性表达 (结果如图 3b)。
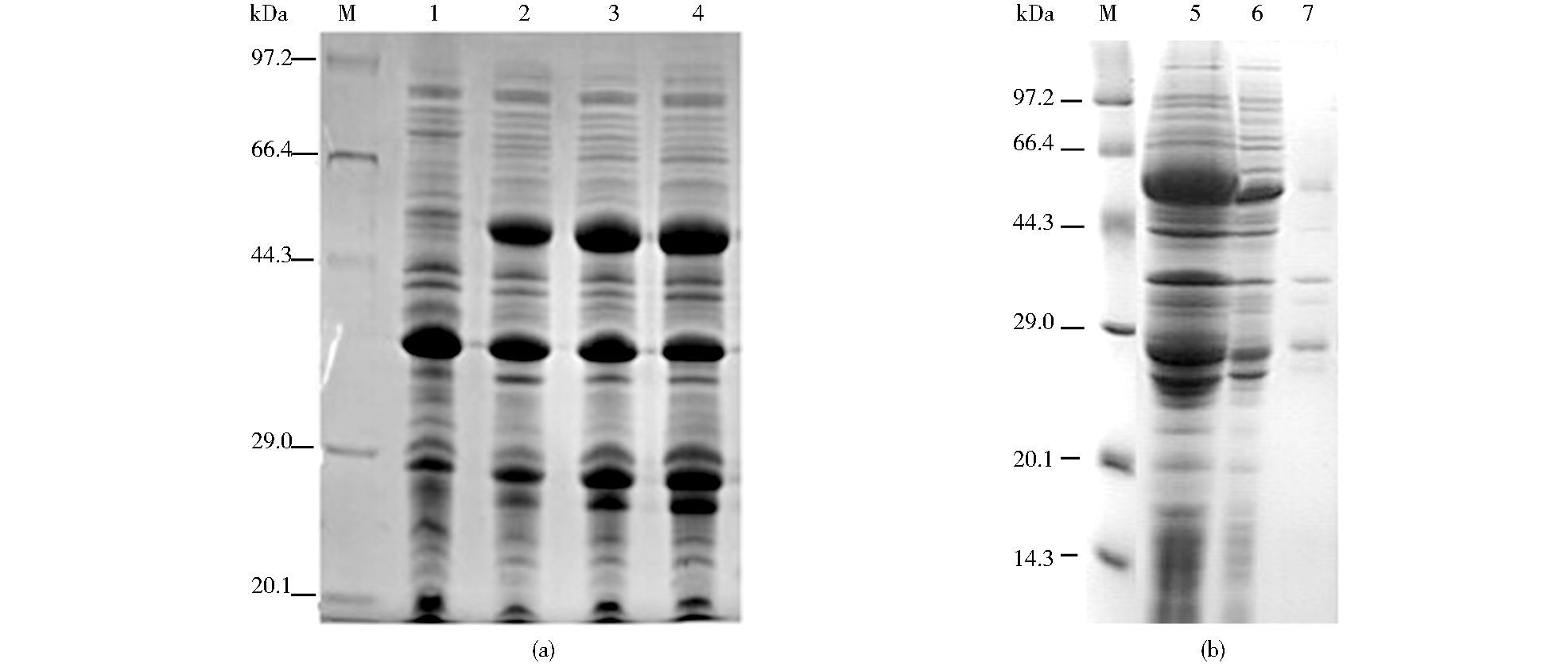
|
| 图 3 V8(V125T) 突变体发酵过程中表达鉴定 Figure 3 Expression and identification of V8(V125T) mutant during the fermentation (a) SDS-PAGE analysis of the target protein during the fermentation M:Protein marker; 1: Before induction; 2~4:After induction 1 h, 2h and 3h, respectively (b) SDS-PAGE analysis of bacterial fragmentation after the fermentation M: Protein marker; 5: Whole cell; 6: Supernatant of the cell lysate; 7: Sediment |
目的蛋白主要存在于破碎后细胞上清中,上清液经GST亲和层析柱纯化,SDS-PAGE电泳分析结果见图 4a,从而可知经一步GST亲和纯化后,可得到较纯的分子量为50 kDa的目的融合蛋白,但同时有24 kDa左右的条带出现。图 4b所示为经肠激酶激活后及第二次GST亲和纯化的条带。经肠激酶处理后,原融合蛋白条带消失,酶切后得到重组V8(V125T) 蛋白酶、GST融合标签和少量杂条带。
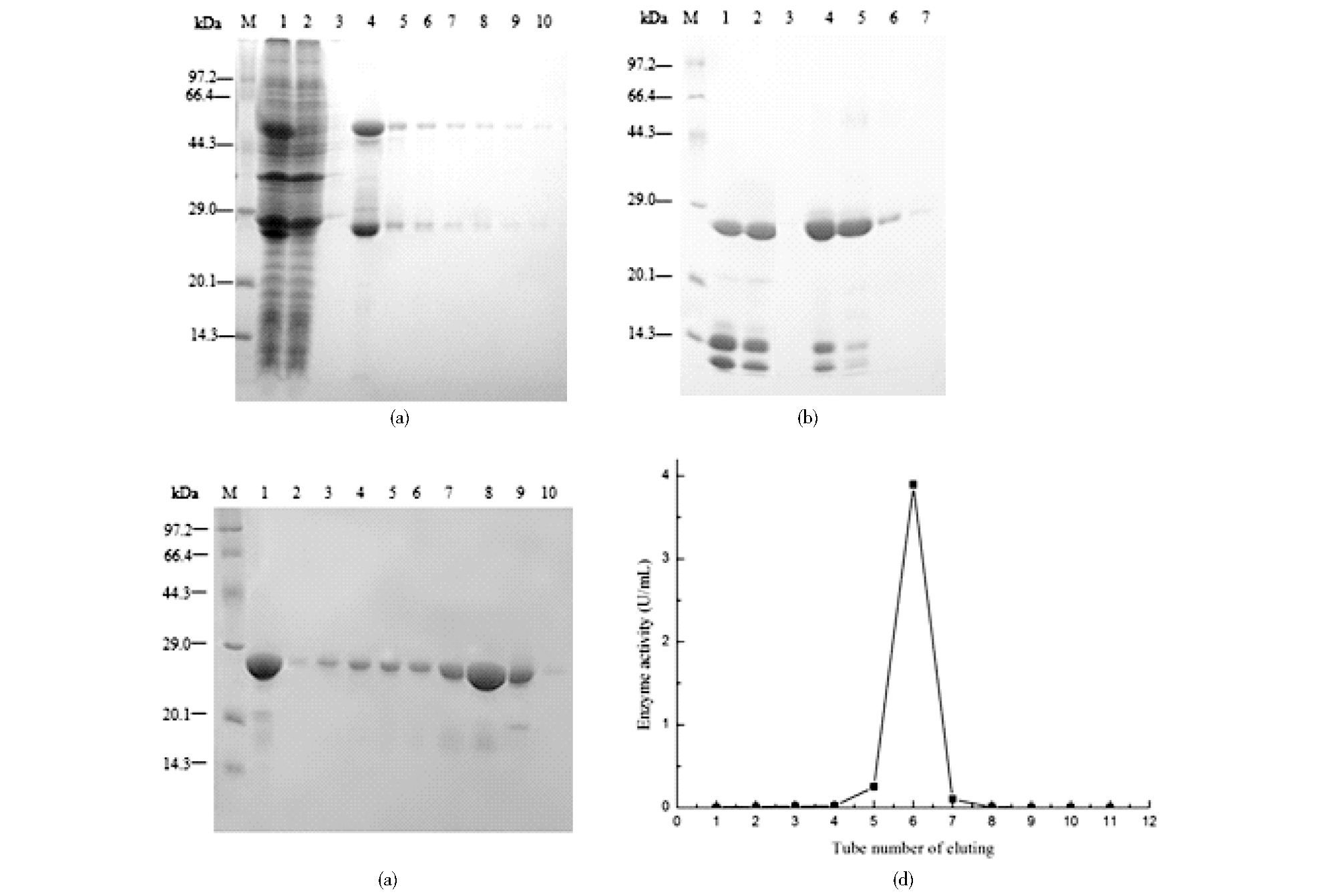
|
| 图 4 V8(V125T) 突变体的纯化 Figure 4 The purification of V8(V125T) mutation (a) The SDS-PAGE analysis of recombinant V8(V125T) by GST affinity purified M: Protein marker; 1: The loading sample (supernatant of the cell lysate); 2: The flow out part; 3: Balance part; 4~10: Eluting parts; (b) SDS-PAGE analysis on the solution activated by enterokinase and further purified by GST affinity of recombinant V8 M: Protein marker; 1: Activated by EK; 2: Flow-out; 3: Balance part; 4~7: Eluting parts (c) SDS-PAGE analysis of the recombinant V8(V125T) purified by anion-exchange chromatography DEAE-FF M: Protein marker; 1:Laoding sample; 2~10: Eluting (d) Elution curve |
为了除去GST标签,再次采用GST亲和凝胶进行纯化 (图 4b),GST标签蛋白与凝胶结合,激活后的V8(V125T) 蛋白酶流穿,如图 4b(泳道2) 中所示。泳道4~7主要是没有酶活性的洗脱的GST融合蛋白,二者分子量相近。均为24 kDa左右,流穿液中酶活性为4.77 U/ml。
为进一步除去杂蛋白,得到纯的V8(V125T) 蛋白酶,采用DEAE-FF阴离子交换柱进行纯化,洗脱曲线见图 4d,图 4c中泳道8(图 4d中洗脱第6管) 的活性最高,为17.51 U/ml。活性回收率为97.9%,纯化倍数为5.5(表 1)。第二次GST亲和纯化除去了被肠激酶切割后的GST,再经亲和纯化后使得V8(V125T) 的比活性有所增加。
| Process | Enzyme activity (U/ml) | Volume (ml) | Total Activity (Units) | Protein Concentration (mg/ml) | Specificity activity (U/mg pro) | Recovery (%) | Purification folds |
| Activated by EK | 4.77 | 30 | 143.10 | 1.95 | 2.45 | 100 | |
| GST affinity purification | 4.59 | 31 | 142.29 | 1.04 | 4.41 | 99.4 | 1.80 |
| DEAE-FF purification | 17.51 | 8 | 140.08 | 1.30 | 13.47 | 97.9 | 5.50 |
2.4 酶学性质的测定 2.4.1 最适pH和pH稳定性
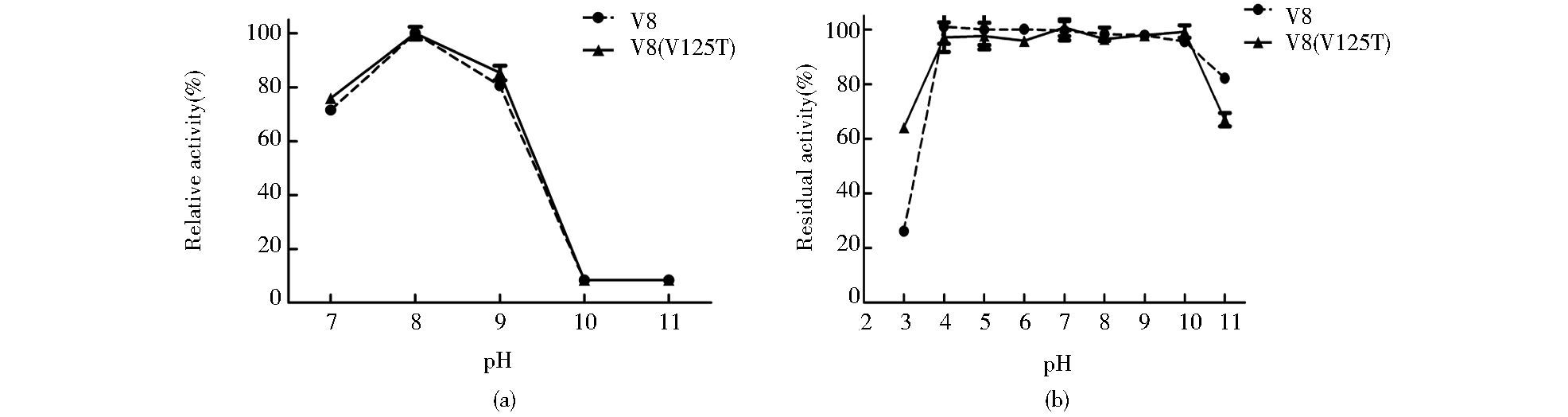
在最适pH实验中,测活底物在pH3.0~6.0的缓冲液中不能溶解,出现明显的浑浊,在pH7.0~11.0的条件下,底物能够溶解,且重组V8与V8(V125T) 蛋白酶均表现出催化活性。其中pH8.0条件下催化效率最高,为最适pH,以该条件下所测得的酶活为100%,计算pH7.0~11.0之间各条件下的酶活残余率,作图如图 5a。pH10.0,11.0条件下催化效率不到20%。而V8蛋白酶突变前后最适pH相同。
|
| 图 5 V8蛋白酶的最适pH和pH稳定性 Figure 5 Optimum pH and effect of pH on the stability of V8 proteases (a) Optimum pH of recombinant V8 and V8(V125T) mutant (b) Effect of pH on the stability of recombinant V8 and V8(V125T) mutant |
将蛋白酶液在25 ℃不同pH缓冲液中温浴12 h后,以初始原酶液的活性为100%,计算pH缓冲液中的酶活残余率,结果如图 5b。V8与V8(V125T) 蛋白酶在pH4.0~10.0之间活性均能保持95%以上,V8在pH4.0~6.0之间的稳定性高于V8(V125T),V8(V125T) 在pH7.0条件下最为稳定,活性可以保持100%。在pH3.0条件下,V8活性仅为原活性的25%,V8(V125T) 活性下降到60%;pH为11.0时,V8、V8(V125T) 的酶活残余率分别为80%和60%。由此可以看出V8(V125T) 提高了其在pH3.0条件下的稳定性,但却降低了在pH11.0条件下的稳定性。
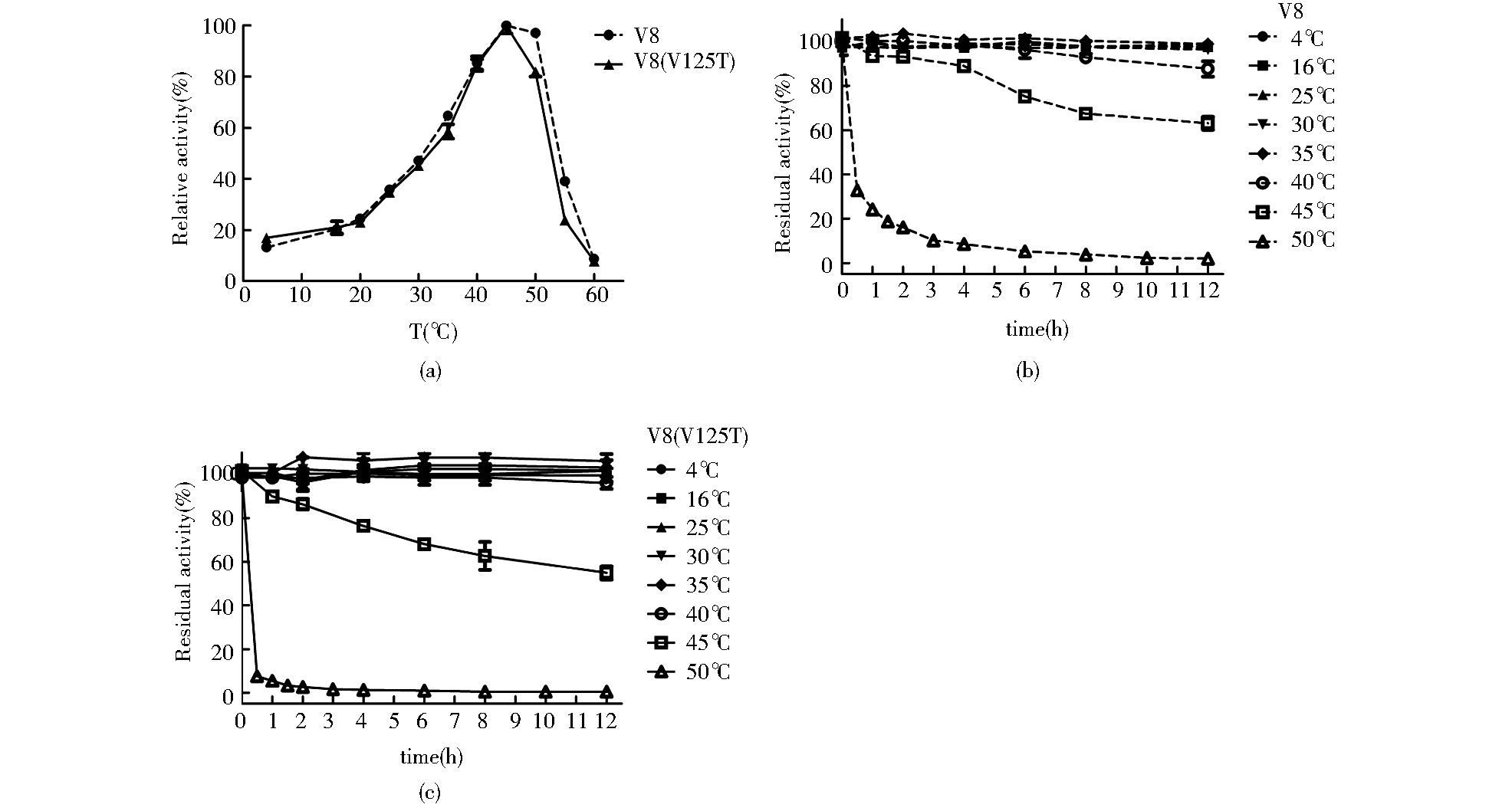
2.4.2 最适温度和温度稳定性最适温度的测定结果如图 6a所示,当温度为45 ℃时,V8和V8(V125T) 蛋白酶的催化效率最高,因此该温度为最适反应温度。
|
| 图 6 V8蛋白酶的最适温度和温度稳定性 Figure 6 Optimum temperature and effect of temperature on the stability of V8 proteases (a) Optimum temperature of V8 and V8(V125T) proteinases (b) Effect of temperature on the stability of recombinant V8 (c) Effect of temperature on the stability of V8(V125T) mutant |
温度稳定性的结果如图 6b, 图 6c所示。重组V8与V8(V125T) 蛋白酶均在4~35℃保温12 h酶活无损失;在40 ℃保温12h,重组V8和V8(V125T) 蛋白酶活性保持分别为90%、96%。45 ℃保温12 h,酶活残余率分别为62%、55%;50 ℃条件下酶失活很快,V8蛋白酶30 min活性下降到30%,1.5 h下降到20%,3 h下降到10%,之后活性一直下降,V8(V125T) 在50 ℃条件下,10 min活性下降到21%,20 min下降到10%以下。
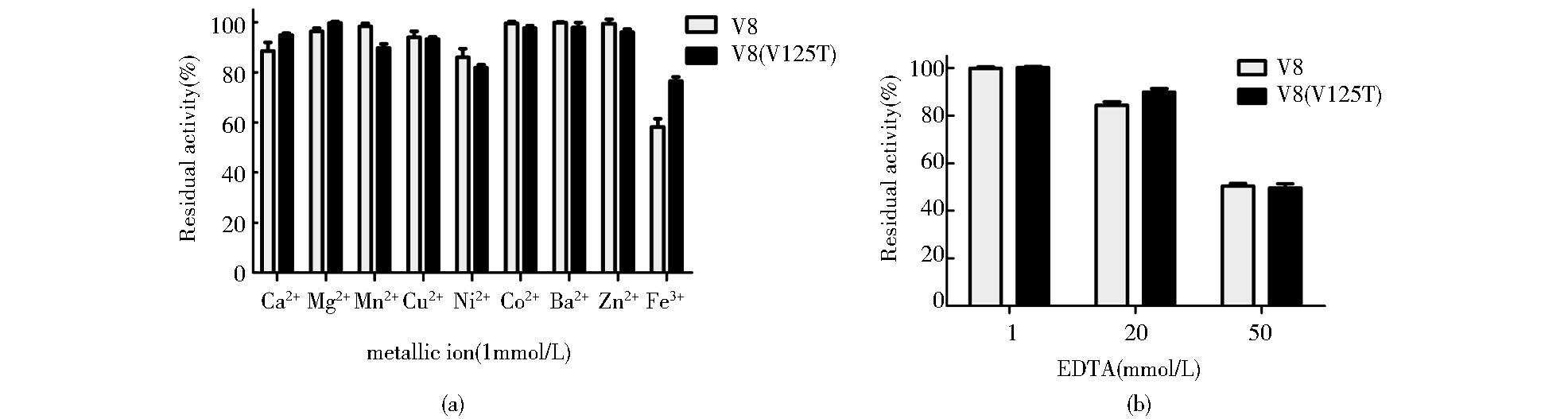
2.4.3 金属离子及EDTA对酶活性的影响1 mmol/L的金属离子对酶活性的影响结果如图 7a所示。除了V8(V125T) 提高了V8对1 mmol/L Fe3+的耐受性,使酶活保持从60%升高到74%。其它离子对二者的影响基本一致。如:Mg2+, Co2+,Ba2+, Zn2+对重组V8与V8(V125T) 蛋白酶影响较小;Ca2+,Mn2+和Cu2+均使两种蛋白酶活性降低为原来的90%左右;Ni2+使两种蛋白酶降低为原活性的80%左右;EDTA对V8和V8(V125T) 蛋白酶酶活性的影响基本一致,结果如图 7b所示,当EDTA浓度为1 mmol/L时,对酶活性无影响;当EDTA的浓度升高到20 mmol/L时,V8,V8(V125T) 酶活分别降低到原来的84%,89%;当EDTA的浓度的升高到50 mmol/L时,酶活性均降低为原活性的50%。
|
| 图 7 金属离子及EDTA对酶活影响 Figure 7 The effect of metal ions and EDTA on enzyme activity (a) The effect of 1 mmol/L metal ions on enzyme activity (25℃, 2 h) (b) The effect of 1 mmol/L, 20 mmol/L, 50 mmol/L EDTA on enzyme activity (25℃, 2 h) |
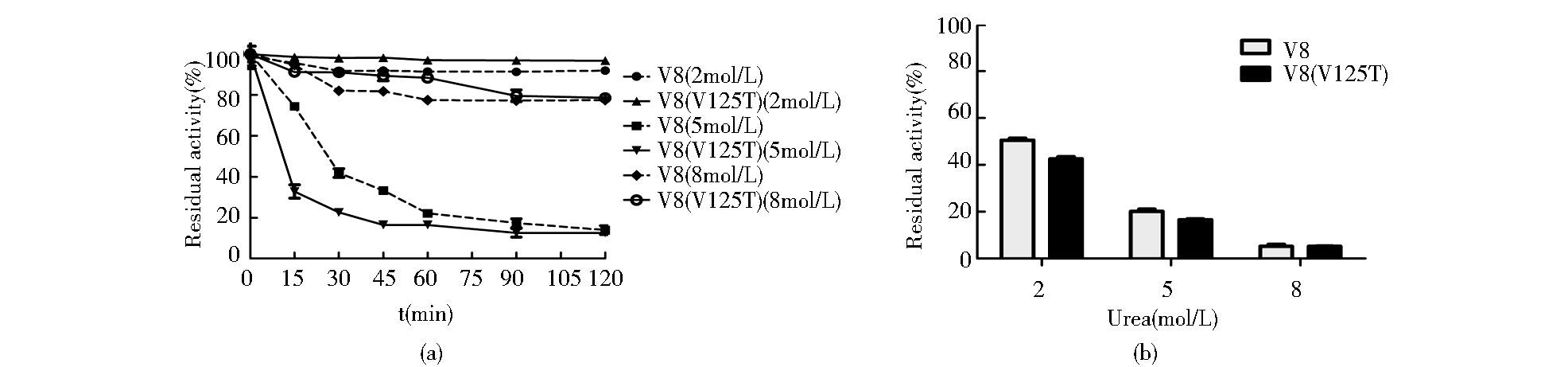
25℃条件下,将不同浓度的尿素与酶进行孵育,2 h测其活性,以初始活性为100%,酶活残余率的变化如图 8a。当尿素浓度为2 mol/L,在2 h内对重组V8与V8(V125T) 突变体的活性影响不大;当尿素浓度为5 mol/L时,25 ℃温浴15 min,V8和V8(V125T) 活性分别降到初始酶活的74%和32%;且随时间的增加,酶活继续下降,2 h活性降低为初始酶活的13%和12%;当尿素浓度为8 mol/L时,V8和V8(V125T) 在2 h内均能保持80%的活性,比5 mol/L尿素存在的情况下还要稳定。分析其可能原因为:尿素破坏氢键,使蛋白结构疏松而发生变性,在5 mol/L和8 mol/L尿素中,V8和V8(V125T) 不能维持正确的构象而变性,且在8 mol/L尿素中变性更为彻底,而这种疏松的结构更有利于其在测活缓冲液中迅速恢复正确构象即复性,使得蛋白酶的酶活残余率较高。为验证这一假设,我们测定了V8和V8(V125T) 蛋白酶在含有尿素的底物缓冲液中的酶活,与不存在尿素的情况相比,在2 mol/L尿素中,V8和V8(V125T) 蛋白酶的酶活性分别降低为50%和43%;5 mol/L尿素时,活性降低到20%和18%,当尿素浓度增加到8mol/L时,酶反应降低到原催化效率的5%(图 8b)。随测活缓冲液中尿素浓度的升高,催化效率较低,结合图 8a说明尿素的存在会抑制酶的反应,2 mol/L尿素引起V8和V8(V125T) 构象的改变较小,蛋白酶在该条件下较稳定,5 mol/L和8 mol/L尿素引起蛋白酶构象的变化,其中在8 mol/L尿素中的变性可逆。
|
| 图 8 V8蛋白酶在尿素中的稳定性及尿素对酶活性的影响 Figure 8 The stability of V8 proteases in urea and the effect of urea on enzyme activity (a) The stability of recombinant V8 and V8(V125T) mutant in 2 mol/L, 5 mol/L, 8 mol/L urea (25℃, 2 h) (b) Effect of 2 mol/L, 5 mol/L, 8 mol/L urea on enzymatic activity of recombinant V8 and V8(V125T) mutant |
不同浓度SDS对重组V8蛋白酶, V8 (V125T) 突变体的影响如图 9a。在0.1%SDS温浴12 h V8, V8 (V125T) 活性仍保持在90%以上;在0.5%SDS中,4 h内V8, V8 (V125T) 能维持90%以上的活性,温浴12 h,V8能保持70%的活性,V8 (V125T) 能维持80%的活性;当SDS的浓度为1%时,温浴1 h V8活性为初始活性的80%,V8 (V125T) 活性维持在90%以上,随时间的增加,两者的酶活残余率逐渐降低,温浴12 h V8, V8 (V125T) 活性下降为初始酶活的42%, 64%。由图 9a,V8(V125T) 对0.5%,1%SDS的稳定性要高于V8。图 9b为测活体系中含有0.1%,0.5%和1% SDS时对反应的影响,可以看出,不同浓度的SDS对两者的影响基本相同,但是突变体的稳定性高于野生型。

|
| 图 9 V8蛋白酶在SDS中的稳定性及SDS对反应的影响 Figure 9 The stability of V8 proteases in SDS and the effect of SDS on enzyme activity (a) The changes of residual activity of recombinant V8 and V8(V125T) mutant with 0.1%, 0.5%, 1% SDS in 12 h (b) Effect of 0.1%, 0.5%, 1% SDS on enzymatic activity in the reaction buffer |
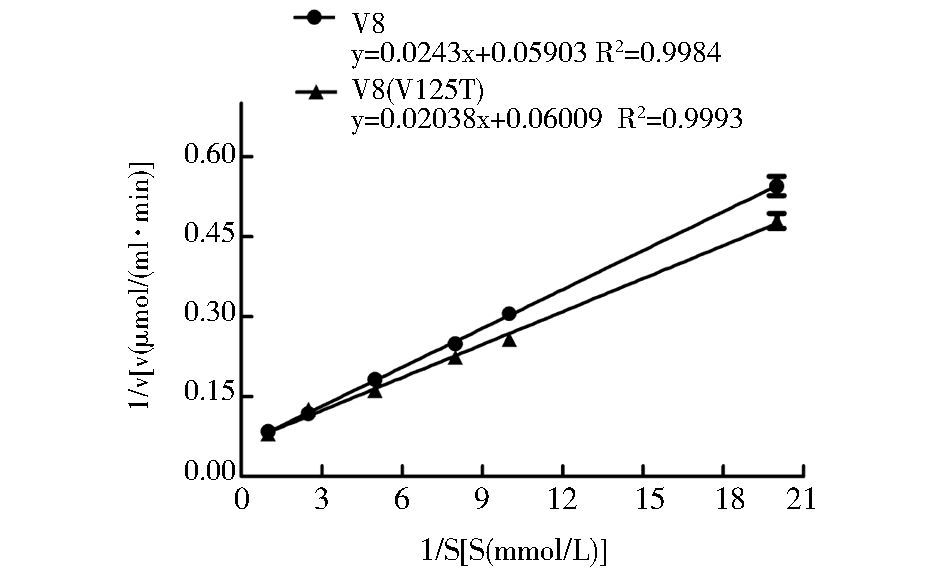
分别以1/[S],1/v为横、纵坐标作图,根据Lineweaver-Burk双倒数作图法,结果如图 10所示,对V8和V8(V125T) 进行分析,得到方程分别为y=0.0243x+0.05903 R2=0.9984、y=0.02038x+0.06009 (R2=0.9993),其中横轴截距为-1/Km,纵轴截距为1/Vmax,即V8蛋白酶的Km为0.412 mmol/L,Vmax为16.941μmol/(ml·min)。V8(V125T) 蛋白酶的Km为0.339 mmol/L,Vmax为16.642 μmol/min。较低的Km值说明了V8(V125T) 比V8对底物有更好的底物亲和力。
|
| 图 10 重组V8蛋白酶, V8(V125T) 突变体的Km,Vmax测定 Figure 10 Determination of Km and Vmax of recombinant V8 and V8(V125T) mutant |
本研究利用基因重组的方法将重组V8(V125T) 蛋白酶以含有GST标签的融合形式实现了可溶性表达。目前,国内外已有研究表明利用GST标签为融合蛋白成功地表达出了人β防御素[24]、降血压活性肽[25]、重组人α干扰素[26]等,其中,人β防御素-4[24]能够在37 ℃条件下高水平表达,通过10 L的发酵其可溶目的蛋白占总蛋白的33.6%;降血压活性肽[25]在30 ℃条件下的发酵中实现了可溶性表达,目标蛋白达到总蛋白的35%。本研究通过GST融合蛋白的方式,首次成功实现了V8蛋白酶突变体GST-V8(V125T) 融合蛋白在大肠杆菌中的可溶性表达。控制溶氧在10%~30%,利用50%氨水调节pH,使pH维持在7.0。采用指数流加的方式补料,在37 ℃条件下成功进行了50 L发酵实现了V8(V125T) 突变体的高效表达,可获得菌体湿重为50 g/L,可溶性融合蛋白占细胞总蛋白的33%。
采用GST亲和纯化及阴离子交换层析对目的蛋白进行纯化,酶活回收率为97.9%,纯化倍数为5.5。对V8(V125T) 突变体进行酶学性质测定,该酶的最适pH为8.0,在pH4.0~10.0之间较稳定,与重组V8蛋白酶相比提高了在pH3.0条件下的稳定性;最适反应温度在45 ℃,在4~35 ℃有较好的温度稳定性,与野生型V8蛋白酶[2-3]及重组V8蛋白酶的性质相似。以Z-Phe-Leu-Glu-pNA为底物,测得Km为0.339 mmol/L,与已有报道的重组野生型V8蛋白酶Km为0.36 mmol/L[20]相似,比重组V8蛋白酶对底物有更好的亲和力。1 mmol/L EDTA对酶活性影响不大,金属离子对酶均有不同程度的影响。1 mmol/L Fe3+对酶影响较大;2 mol/L尿素对酶活基本无影响,在5 mol/L尿素中孵育30 min,活性降低到20%,与野生型V8蛋白酶在5 mol/L尿素中20 min活性降到不足原活性的10%[20]相比,该重组V8蛋白酶提高了在5 mol/L尿素中的稳定性,但已有报道V8蛋白酶其成熟酶K147R突变体[21]能在5 mol/L尿素存在的条件下孵育30 min酶活残余率仍能保持50%。与重组V8蛋白酶相比该突变对尿素稳定性并没有很明显的提高。
本研究结果表明重组V8(V125T) 蛋白酶突变体显示了对SDS的高耐受性,与重组V8蛋白酶相比,该突变体提高了在0.5%和1%SDS中的稳定性,尤其是在1% SDS中的稳定性。三维结构的比较见图 1。经过对二者的结构分析,发现V8蛋白酶第16~20氨基酸残基 (NGHYA)、107~112(HIGEVV) 氨基酸残基分别形成的两段helix结构,位于蛋白质分子的表面,含有Y, G不易形成helix结构的氨基酸残基,当第125位氨基酸由原疏水性的Val突变为Thr时,这两段位于蛋白质表面的helix变为loop结构。SDS作为一种变性剂,其疏水性结构能够插入到蛋白质疏水内部,影响蛋白酶的活性中心,而第125位由V突变为T,提高了蛋白的亲水性,从而更好地保护了位于蛋白内部的疏水结构,对其三级结构起到了部分的保护作用,因此会提高蛋白对SDS的稳定性。
本研究报道了一种对SDS的高耐受性的V8蛋白酶突变体,并对其进行了50 L发酵,获得了高效可溶性表达,并通过纯化得到了纯度较高、活性较稳定的酶,为该酶的应用提供了一种选择。
致谢 感谢华东理工大学生物反应器工程国家重点实验室对本研究提供的基金支持!| [1] | Mil'Gotina E I, Voyushina T L, Chestukhina G G. Glutamyl endopeptidases:structure, function, and practical application. Russian Journal of Bioorganic Chemistry, 2003, 29(6) : 511–522. DOI:10.1023/B:RUBI.0000008891.51576.d0 |
| [2] | Drapeau G R, Boily Y, Houmard J. Purification and properties of an extracellular protease of Staphylococcus aureus. Journal of Biological Chemistry, 1972, 247(20) : 6720–6726. |
| [3] | Houmard J, Drapeau G R. Staphylococcal protease:a proteolytic enzyme specific for glutamyl bonds. Proceedings of the National Academy of Sciences, 1973, 69(12) : 3506–3509. |
| [4] | Svendsen I, Jensen M R, Breddam K. The primary structure of the glutamic acid-specific protease of Streptomyces griseus. Febs Letters, 1991, 292(1-2) : 165–167. DOI:10.1016/0014-5793(91)80859-2 |
| [5] | Balaban N P, Mardanova A M, Sharipova M R, et al. Isolation and characterization of glutamyl endopeptidase 2 from Bacillus intermedius, 3-19. Biochemistry Biokhimiia, 2003, 68(11) : 1217–1224. DOI:10.1023/B:BIRY.0000009136.09167.b6 |
| [6] | Gasanov E V, Demidyuk I V, Shubin A V, et al. Hetero-and auto-activation of recombinant glutamyl endopeptidase from Bacillus intermedius. Protein Engineering Design & Selection, 2008, 21(11) : 653–658. |
| [7] | Yoshikawa K, Tsuzuki H, Fujiwara T, et al. Purification, characterization and gene cloning of a novel glutamic acid-specific endopeptidase from Staphylococcus aureus, ATCC 12600. Biochimica et Biophysica Acta, 1992, 1121(1) : 221–228. |
| [8] | Ohara-Nemoto Y, Ikeda Y, Kobayashi M, et al. Characterization and molecular cloning of a glutamyl endopeptidase from Staphylococcus epidermidis. Microbial Pathogenesis, 2002, 33(33) : 33–41. |
| [9] | Park J W, Park J E, Park J K, et al. Purification and biochemical characterization of a novel glutamyl endopeptidase secreted by a clinical isolate of Staphylococcus aureus. International Journal of Molecular Medicine, 2011, 27(5) : 637–645. |
| [10] | Yabuta M, Ochi N, Ohsuye K. Hyperproduction of a recombinant fusion protein of Staphylococcus aureus, V8 protease in Escherichia coli, and its processing by OmpT protease to release an active V8 protease derivative. Applied Microbiology and Biotechnology, 1995, 44(1) : 118–125. |
| [11] | Ono T, Nemoto T K, Yu S, et al. An Escherichia coli, expression system for glutamyl endopeptidases optimized by complete suppression of autodegradation. Analytical Biochemistry, 2008, 381(1) : 74–80. DOI:10.1016/j.ab.2008.06.022 |
| [12] | Nemoto T K, Ohara-Nemoto Y, Ono T, et al. Characterization of the glutamyl endopeptidase from Staphylococcus aureus, expressed in Escherichia coli. Febs Journal, 2008, 275(3) : 573–587. DOI:10.1111/j.1742-4658.2007.06224.x |
| [13] | 朱蓓霖, 周杰, 汪正华, 等. 地衣芽孢杆菌谷氨酰内切酶的克隆表达与性质研究. 中国生物工程杂志, 2013, 33(3) : 105–110. Zhu B L, Zhou J, Wang Z H, et al. Cloning and characterization of Bacillus licheniformis glutamys endopetptidase. China Biotechnology, 2013, 33(3) : 105–110. |
| [14] | 李礼, 吴亮, 陈盛霞, 等. 谷氨酰内切酶的原核表达及生物化学特性分析. 临床检验杂志, 2012, 30(4) : 274–277. Li L, Wu L, Chen S X, et al. Prokaryotic expression and biochemical characteristics of glutamyl endopeptidase. Chinese Journal of Clinical Laboratory Science, 2012, 30(4) : 274–277. |
| [15] | 段树燕, 郭怀祖, 李晶, 等. 重组GluV8的克隆表达、纯化及酶学性质研究. 中国生物工程杂志, 2014, 34(4) : 36–40. Duan S Y, Guo H Z, Li J, et al. Cloning, expression, purification, and characterization of recombinant GluV8. China Biotechnology, 2014, 34(4) : 36–40. |
| [16] | 李礼, 姜旭淦. 谷氨酰内切酶的催化特性研究与应用进展. 江苏大学学报 (医学版), 2012, 22(1) : 83–85. Li L, Jiang X G. Advances in research and application of catalytic properties of glutamyl endopeptidase. Journal of Jiangsu University (Medicine Education), 2012, 22(1) : 83–85. |
| [17] | Mil'Gotina E I, Voyushina T L, Chestukhina G G. Glutamyl endopeptidases:structure, function, and practical application. Russian Journal of Bioorganic Chemistry, 2003, 29(6) : 511–522. DOI:10.1023/B:RUBI.0000008891.51576.d0 |
| [18] | Petr P, Marie T, Zdenka K. Immobilized endoproteinase Glu-C to magnetic bead cellulose as a tool in proteomic analysis. Journal of Separation Science, 2013, 36(12) : 2043–2048. DOI:10.1002/jssc.201300118 |
| [19] | Yabuta M, Ohsuye K. Mutant Staphylococcus aureus V8 proteases.EP, 96303939, 1.1996-12-04. |
| [20] | Yabuta M, Ohsuye K. Increase in urea-resistance of recombinant V8 protease by combining mutations, and its application in the releasing of a peptide hormone from a fusion protein. Journal of Fermentation and Bioengineering, 1995, 80(5) : 467–472. DOI:10.1016/0922-338X(96)80921-4 |
| [21] | Yabuta M, Onai-Miura S, Ohsuye K. Isolation and characterization of urea-resistant Staphylococcus aureus, V8 protease derivatives. Journal of Fermentation & Bioengineering, 1995, 80(3) : 237–243. |
| [22] | Carmona C, Gray G L. Nucleotide sequence of the serine protease gene of Staphylococcus aureus, strain V8. Nucleic Acids Research, 1987, 15(16) : 6757–6757. DOI:10.1093/nar/15.16.6757 |
| [23] | Prasad L, Leduc Y, Hayakawa K, et al. The structure of a universally employed enzyme:V8 protease from Staphylococcus aureus. Acta Crystallographica Section D, 2004, 60(2) : 256–259. DOI:10.1107/S090744490302599X |
| [24] | 王芳. 重组大肠杆菌高效生产可溶性的人β防御素. 杭州: 浙江大学, 2004. Wang F. Efficient production of soluble human beta-defensin in recombinant E.coli systems.Hangzhou:Zhejiang University, 2004. |
| [25] | 饶胜其. 降血压活性肽的筛选及其前体多肽的设计、克隆表达与活性鉴定. 无锡: 江南大学, 2011. Rao S Q.Screening of antihypertensive peptide and design, cloning, expression and activity identification of its precursor polypeptide.Wuxi:Jiangnan University, 2011. |
| [26] | Fathallah M D, Rabhi-Essafi I. Method for the production of high-level soluble human recombinant interferon alpha in E. coli and vectors useful for such a production.US, 07290712, 4. 2008-12-10. |
 2017, Vol. 37
2017, Vol. 37




