文章信息
- 白欣艳, 温丽敏, 王玉晶, 王海龙, 解军, 郭睿.
- BAI Xin-yan, WEN Li-min, WANG Yu-jing, WANG Hai-long, XIE Jun, GUO Rui.
- ANKRD49通过上调Bcl-xL的表达抑制UV诱导GC-1细胞的凋亡
- ANKRD49 Inhibits UV-induced Apoptosis of GC-1 Cells by Up-regulating Bcl-xL
- 中国生物工程杂志, 2017, 37(4): 40-47
- China Biotechnology, 2017, 37(4): 40-47
- http://dx.doi.org/DOI:10.13523/j.cb.20170406
-
文章历史
- 收稿日期: 2016-10-25
- 修回日期: 2016-11-21
2. 山西医科大学寄生虫学教研室 太原 030001
2. Department of Parasitology, Shanxi Medical University, Taiyuan 030001, China
Ankyrin repeat domain 49 (ANKRD49) 是具有4个ankyrin重复序列结构域的蛋白质,而ankyrin重复序列结构域通过介导蛋白质与蛋白质的相互作用广泛参与转录调控、细胞周期、细胞凋亡、细胞骨架完整性、细胞机械感受和内吞作用等细胞生命活动过程[1]。Hsu等[2]利用RNA芯片技术发现ANKRD49在非侵袭性非小细胞肺癌细胞中高表达,在侵袭性肺癌细胞中低表达;另有Christensen等[3]曾报道ANKRD49基因在抑郁症大鼠模型的大脑外侧缰核区呈低水平表达。但截至目前ANKRD49确切的生物学功能尚未引起广大研究者的关注,也未见有相关研究结果发表。
课题组前期研究发现ANKRD49在小鼠睾丸组织高表达,进而成功构建了稳定过表达ANKRD49的GC-1细胞模型,进一步研究表明该基因可以通过促进细胞自噬来提高GC-1细胞的生存能力[4]。自噬和凋亡在细胞的生存和死亡中可以相互促进或相互拮抗,虽然二者在代谢途径和形态学方面有着显著的区别,但它们的信号通路却有着千丝万缕的联系[5]。ANKRD49是否也参与了GC-1细胞凋亡过程呢?为了继续探讨ANKRD49在睾丸组织表达的意义,本研究利用稳定过表达ANKRD49的GC-1细胞模型初步检测该基因对GC-1细胞凋亡的影响及其可能机制。
1 材料与方法 1.1 材料与试剂BALB/c雄性小鼠,8周龄,体重20~25 g,均由山西医科大学实验动物中心提供,合格证号为:SCXK (晋)2009-0001;质粒PMSCVpuro购自Clontech公司;限制性内切酶Bgl Ⅱ和Xho Ⅰ购自TaKaRa公司;Trizol Reagent、UltraSYBR Two Step RT-qPCR Kit试剂盒购自北京康为世纪生物科技有限公司;Lipofectamine 2000 Transfection Reagent购自Invitrogen公司;嘌呤霉素购自SIGMA公司;GC-1细胞株由中国协和医科大学基础医学研究所王琳芳教授课题组惠赠;稳定过表达ANKRD49的GC-1细胞 (GC-1/ANKRD49-flag) 及转染空载体的GC-1细胞 (GC-1/NC) 由本实验室建立并保存;线粒体膜电位试剂盒、细胞凋亡-Hoechst染色试剂盒购自碧云天公司;兔抗ANKRD49多克隆抗体购自Abcam公司;小鼠抗Flag单克隆抗体、兔抗PARP单克隆抗体、兔抗Cleaved-Caspase-3单克隆抗体、兔抗Bcl-xL单克隆抗体及兔抗Bax多克隆抗体均购自Cell Signaling Technology公司;小鼠抗GAPDH单克隆抗体及辣根过氧化物酶标记的山羊抗小鼠、山羊抗兔IgG购自北京中杉金桥有限公司。其它试剂均为国产分析纯。
1.2 ANKRD49过表达质粒的构建以及稳定转染细胞系的建立通过NCBI数据库检索,获取ANKRD49编码区域序列并设计引物,上游为5′-GGAAGATCTGCCACCATGGAAAAAGAAAAAGGAAATGATG-3′, 下游为5′-CCGCTCGAGTTACTTGTCATCGTCGTCCTTGTAGTCAGACTGAGGTGAAGAATTTGTAC-3′,划线部分为Flag-tag序列。利用Trizol试剂提取8周龄成年雄性小鼠睾丸组织总RNA,定量后取4 μl进行逆转录,以合成的cDNA为模板进行PCR扩增。在Bgl Ⅱ和Xho Ⅰ位点通过分子克隆技术将PCR扩增产物与PMSCVpuro质粒连接构建真核表达重组质粒,送中美泰和测序,对DNA测序结果进行Blast比对,插入片段序列与Genbank中ANKRD49编码序列一致,即成功构建了ANKRD49过表达重组质粒。然后分别将2.5 μg重组质粒PMSCVpuro-ANKRD49-flag和PMSCVpuro在Lipofectamine 2000介导下转染GC-1细胞,置于培养箱中继续培养,48 h后加嘌呤霉素 (2 μg/ml) 开始筛选,约经过3周加压筛选后获得阳性克隆,即为稳定转染细胞系。
1.3 实时荧光定量PCR (qRT-PCR) 和Western blotting检测稳定转染GC-1细胞系ANKRD49的表达根据ANKRD49基因的ORF序列设计实时荧光定量PCR引物,上游为5′-ACACCTGATTCCCACTGG-3′,下游为5′-GCACTGTAGCAAGCCGAT-3′,小鼠GAPDH内参基因上游引物为5′-TGAGTACGTCGTGGAGTCCA-3′,下游为5′-TAGACTCCACGACATACTCA-3′。用Trizol试剂提取各组细胞总RNA并反转录成单链cDNA,以此为模板,运用UltraSYBR Two Step RT-qPCR Kit试剂盒进行扩增反应,利用2-ΔΔCT法计算目的基因的相对表达量。同时用RIPA裂解液于冰上裂解各组细胞提取总蛋白,取30 μg样品经12% SDS-PAGE凝胶电泳分离,转移至PVDF膜上,5%的脱脂奶粉封闭1 h后,分别以小鼠抗GAPDH单克隆抗体 (1:1 000)、小鼠抗Flag单克隆抗体 (1:1 000) 及兔抗ANKRD49多克隆抗体 (1:1 000) 为一抗4 ℃孵育过夜,以山羊抗小鼠HRP-IgG (1:5 000) 及山羊抗兔HRP-IgG (1:5 000) 为二抗,室温孵育1 h,经ECL化学发光液显色,用BIO-RAD凝胶成像仪分析结果。
1.4 流式细胞术检测细胞凋亡实验分为3组:pMSCVpuro-ANKRD49-flag稳定转染组、pMSCVpuro空载体转染组和未转染裸细胞组。3组细胞均接种于6孔板中,24 h后将各组细胞培养基弃掉,用40 J/m2 UV (波长254 nm) 刺激细胞2 min,然后加入新鲜培养基,在培养箱中继续孵育6 h。用不含EDTA的胰酶将细胞消化成单细胞悬液,1 000r/min离心4 min收集细胞,PBS洗两次,离心后弃上清,加入150 μl Binding buffer重悬细胞,然后加入10 μl AnnexinV-FITC和碘化丙啶 (PI) 双染抗体,混匀后避光染色20 min,各管再加入200 μl Binding buffer,流式细胞仪检测细胞凋亡率,实验重复3次。
1.5 流式细胞术检测细胞线粒体膜电位将各组细胞接种于6孔板中,24 h后将各组细胞培养基移去,采用相同的UV条件刺激细胞,然后按照1.4中描述的方法和步骤离心、收集细胞,重悬于0.5 ml细胞培养液中,加入0.5 ml JC-1染色工作液,充分混匀,37℃孵育20 min。孵育结束后,1 000r/min离心4 min收集各组细胞,弃掉上清,JC-1染色缓冲液 (1×) 洗涤细胞2次,最终用100 μl的JC-1染色缓冲液重悬细胞,并加入200 μl Binding buffer,流式细胞仪检测各组细胞的线粒体膜电位变化,实验重复3次。
1.6 Hoechst-33258染色检测细胞凋亡情况将GC-1细胞 (分组同上) 接种于铺有盖玻片的6孔板中,24 h后将各组细胞培养基移去,采用相同的UV条件刺激各组细胞,在培养箱中继续培养6 h后吸尽培养液,加入0.5 ml固定液,固定10 min,PBS洗2次,加入0.5 ml Hoechst染色液,染色5 min后弃去染色液,PBS洗2次,滴加抗荧光猝灭封片液于载玻片上,盖玻片细胞面充分接触封片液,荧光显微镜下观察各组细胞的细胞核变化情况,随机选取视野并计数细胞总数以及核浓缩的细胞数,每组计数5个视野,最后计算凋亡百分比。凋亡百分比=核浓缩细胞数/细胞总数×100%,实验重复3次。
1.7 Western blotting检测细胞凋亡相关蛋白采用相同的UV条件刺激各组细胞后,用RIPA裂解液于冰上裂解并提取总蛋白,取30 μg样品分别经12%和10% SDS-PAGE凝胶电泳分离,转移至PVDF膜上,5%脱脂奶粉封闭1 h后,分别以鼠抗GAPDH单克隆抗体 (1:1 000)、兔抗PARP单克隆抗体 (1:1 000)、兔抗Cleaved-Caspase-3单克隆抗体 (1:1 000)、兔抗Bcl-xL单克隆抗体 (1:1 000) 及兔抗Bax单克隆抗体 (1:1 000) 为一抗4 ℃孵育过夜,次日经TBST洗涤后分别以山羊抗鼠HRP-IgG (1:5 000) 和山羊抗兔HRP-IgG (1:5 000) 为二抗,室温孵育1 h,经ECL化学发光液显色,用BIO-RAD凝胶成像仪分析结果。
1.8 统计学分析实验数据以均数±标准差 (Mean±SD) 表示,组间比较采用单因素方差分析,采用GraphPadPrism5.0统计软件进行分析,以P<0.05表示差异具有显著性。
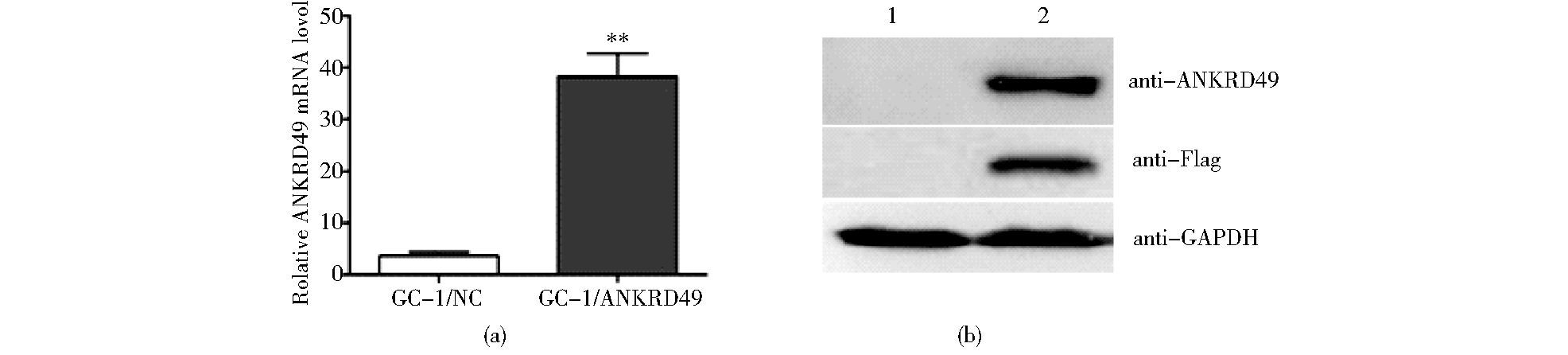
2 结果 2.1 qRT-PCR和Western blotting检测稳定转染GC-1细胞中ANKRD49的表达qRT-PCR检测结果显示,稳定转染PMSCVpuro-ANKRD49-flag的GC-1细胞和转染PMSCVpuro空载体的GC-1细胞均有ANKRD49 mRNA表达,但过表达组ANKRD49 mRNA的表达水平显著高于转染空载体组,差异具有统计学意义 (P<0.01,图 1a)。分别以小鼠抗Flag单克隆抗体和兔抗ANKRD49多克隆抗体为一抗进行Western blotting检测,结果显示稳定转染PMSCVpuro-ANKRD49-flag的GC-1细胞均有相应的蛋白表达,而转染空载体组未见表达 (图 1b)。根据图 1结果可判定ANKRD49稳定过表达细胞模型建立成功。
|
| 图 1 qRT-PCR和Western blotting检测PMSCVpuro-ANKRD49-flag在GC-1细胞中的表达 Figure 1 Expression of PMSCVpuro-ANKRD49-flag in GC-1 cells by qPR-PCR and Western blotting analysis (a) The mRNA expression level of ANKRD49 in GC-1 stable cells by qRT-PCR analysis (b) Protein expression level of ANKRD49 in GC-1 stable cells by Western blotting analysis 1:GC-1/NC; 2:GC-1/ANKRD49-flag ** P < 0.01 compared to GC-1/NC group |
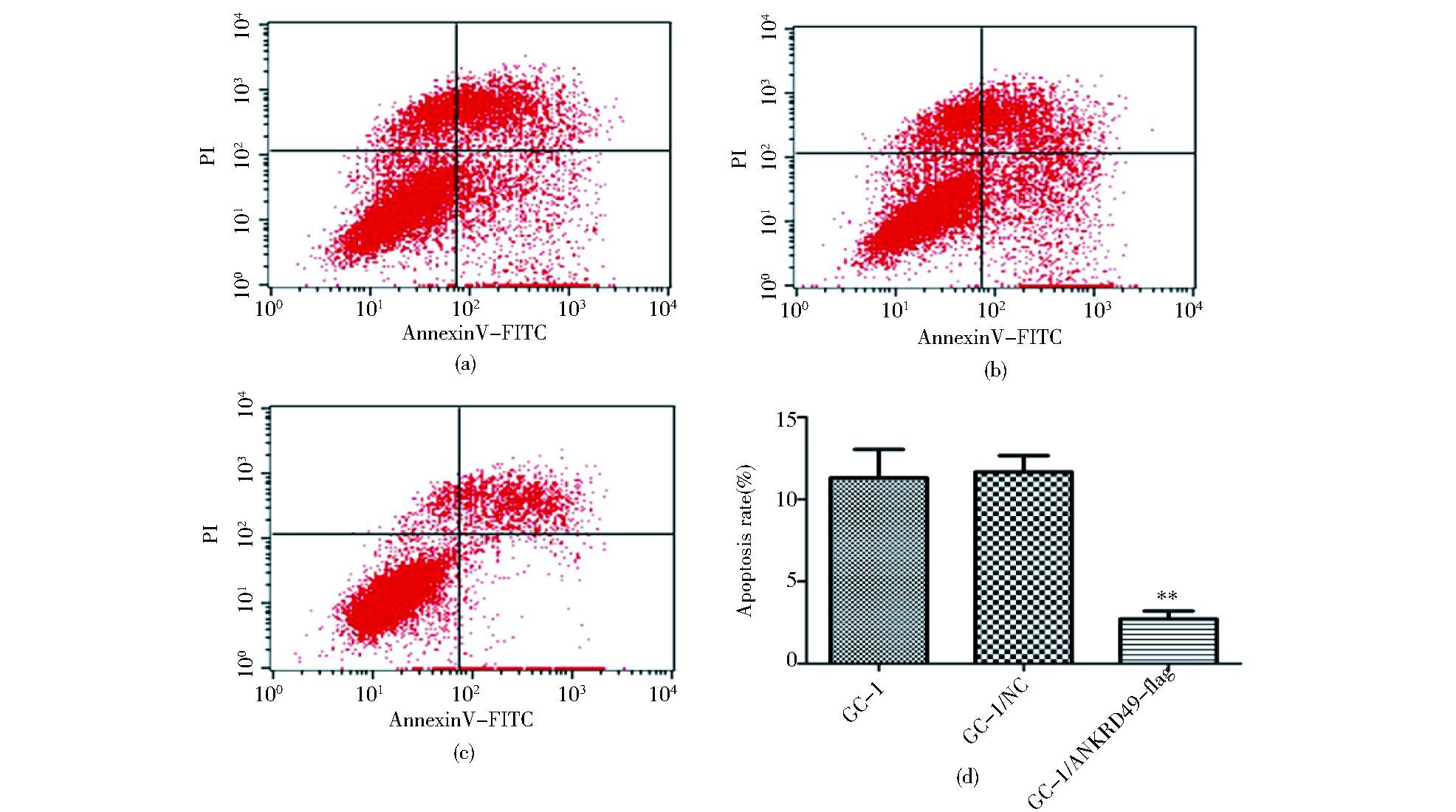
流式细胞术结果显示过表达ANKRD49组细胞的早期凋亡率为2.71%±0.50%,明显低于空质粒组11.66%±1.01%和裸细胞组11.31%±1.74%,差异具有统计学意义 (P<0.01,图 2)。
|
| 图 2 流式细胞术检测各组细胞凋亡情况 Figure 2 The apoptosis rate of GC-1 cells was detected by flow cytometry (a) GC-1 (b) GC-1/NC (c) GC-1/ANKRD49-flag (d) The schematic of apoptosis rate of GC-1 cells in three groups ** P < 0.01 compared to GC-1 group and GC-1/NC group |
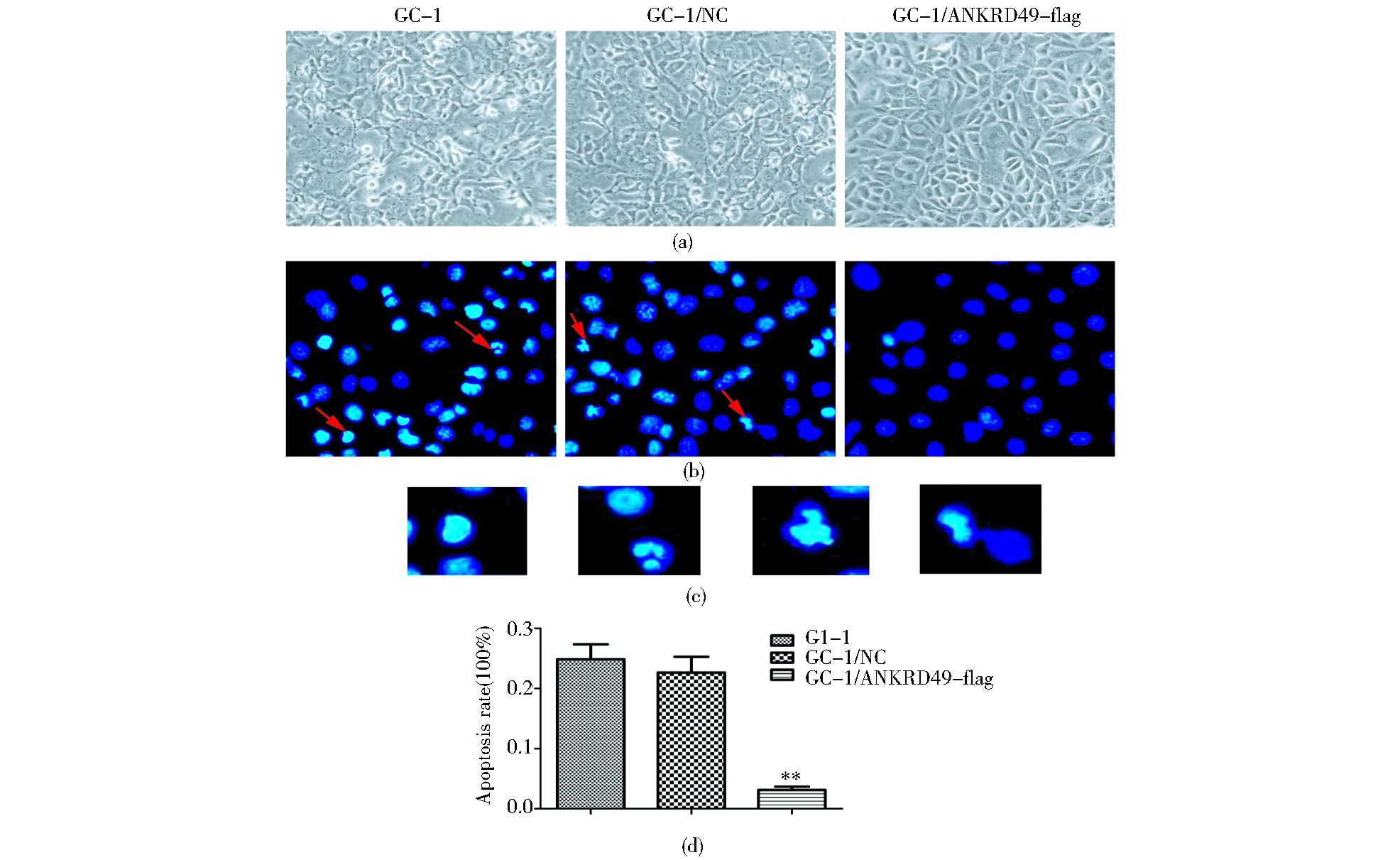
倒置显微镜观察UV照射后3组细胞的形态变化,镜下可见,过表达ANKRD49组细胞贴壁生长旺盛,细胞间连接相对紧密,包膜较清晰,胞质饱满,而空质粒组和裸细胞组细胞间隙增宽,细胞膜皱缩,胞质减少,部分细胞失去贴壁性而漂浮起来 (图 3a)。进一步Hoechst染色可见凋亡细胞的细胞核呈波纹状或皱缩状态,并可见细胞核因浓缩致密而呈强蓝色荧光染色 (图 3b和3c)。经计算,过表达ANKRD49组细胞的凋亡百分比为 (0.03±0.01)×100%,明显低于空质粒组 (0.23±0.05)×100%和裸细胞组 (0.25±0.04)×100%,差异具有统计学意义 (图 3d,P<0.01)。
|
| 图 3 Hoechst33258染色检测各组细胞凋亡 Figure 3 The apoptosis rate of GC-1 cells with hoechst33258 staining (a) Morphological changes of GC-1 cells were observed by inverted microscope (b) The apoptosis of GC-1 cells by Hoechst33258 staining (×200) (c) The apoptosis of GC-1 cells by Hoechst33258 staining (×400) (d) The schematic of apoptosis rate of GC-1 cells in three groups ** P < 0.01 compared to GC-1 group and GC-1/NC group |
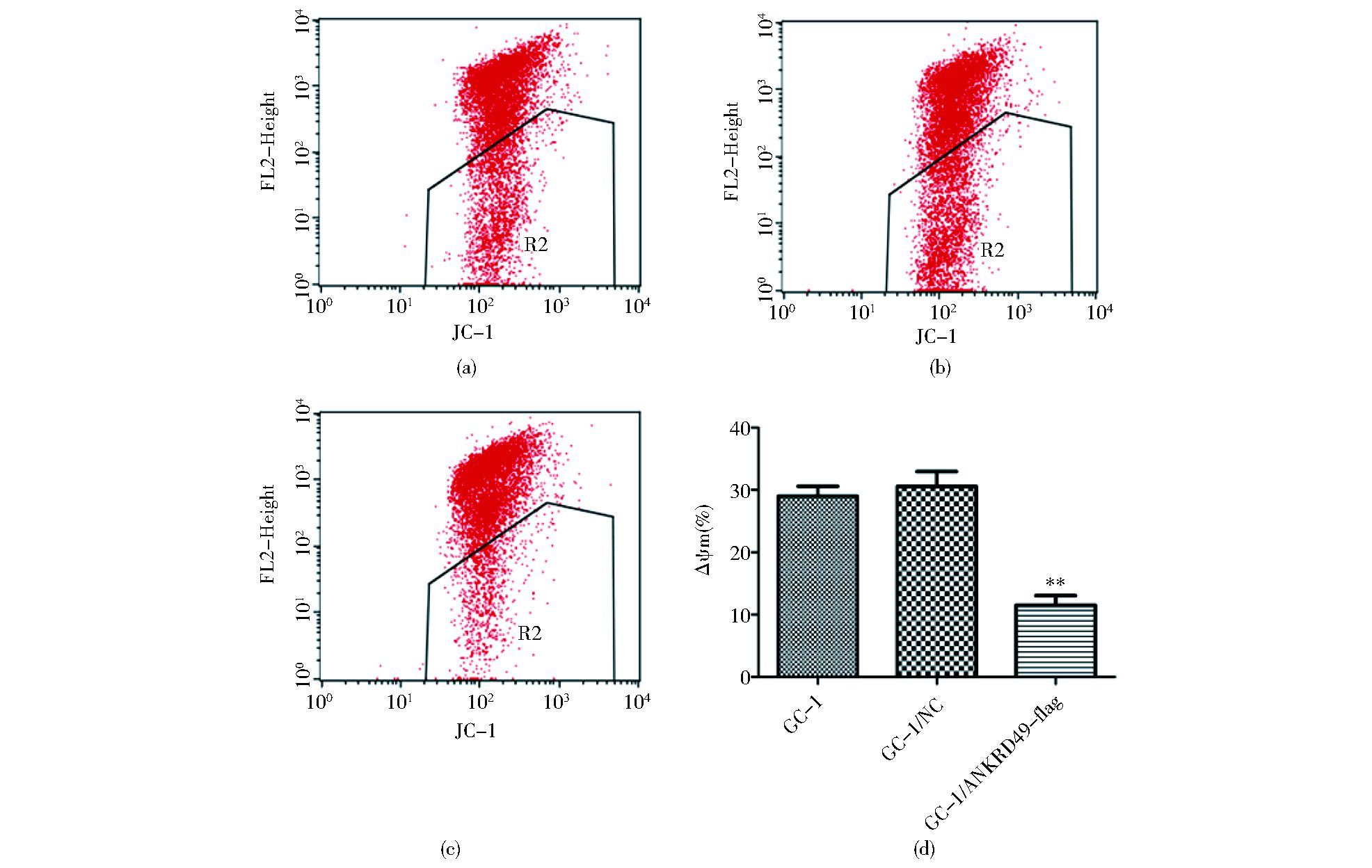
进一步利用流式细胞术检测各组细胞线粒体膜电位的变化,结果显示过表达ANKRD49组细胞的线粒体膜电位下降了11.51%±1.53%,明显低于空质粒组和裸细胞组 (30.54%±2.42%和28.99%±1.61%),且差异具有统计学意义 (P<0.01,图 4)。
|
| 图 4 流式细胞术检测各组线粒体膜电位的变化 Figure 4 The mitochondrial membrane potential of GC-1 cells was detected by flow cytometry (a) GC-1 (b) GC-1/NC (c) GC-1/ANKRD49-flag (d) The schematic of mitochondrial membrane potential of GC-1 cells in three groups ** P < 0.01 compared to GC-1 group and GC-1/NC group |
Western blotting结果显示,与空质粒组和裸细胞组相比,过表达ANKRD49组GC-1细胞中Cleaved-Caspase-3的表达水平显著降低 (图 5),PARP的剪切带85kDa的蛋白条带显著减弱 (图 6)。经图像分析和统计学比较,均具有显著性差异 (P<0.01)。
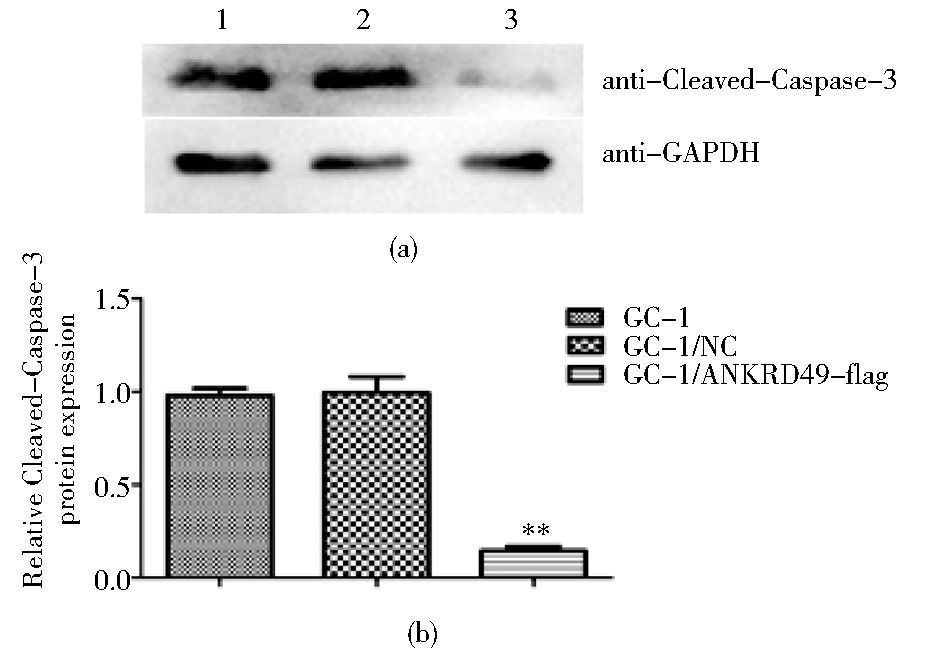
|
| 图 5 Western blotting检测Cleaved-Caspase-3在各组细胞中的表达 Figure 5 The expression of Cleaved-Caspase-3 in GC-1 cells was detected by Western blotting (a) 1: GC-1; 2: GC-1/NC; 3: GC-1/ANKRD49-flag (b) The schematic of relative expression of Cleaved-Caspase3 of GC-1 cells in three groups ** P < 0.01 compared to GC-1 group and GC-1/NC group |
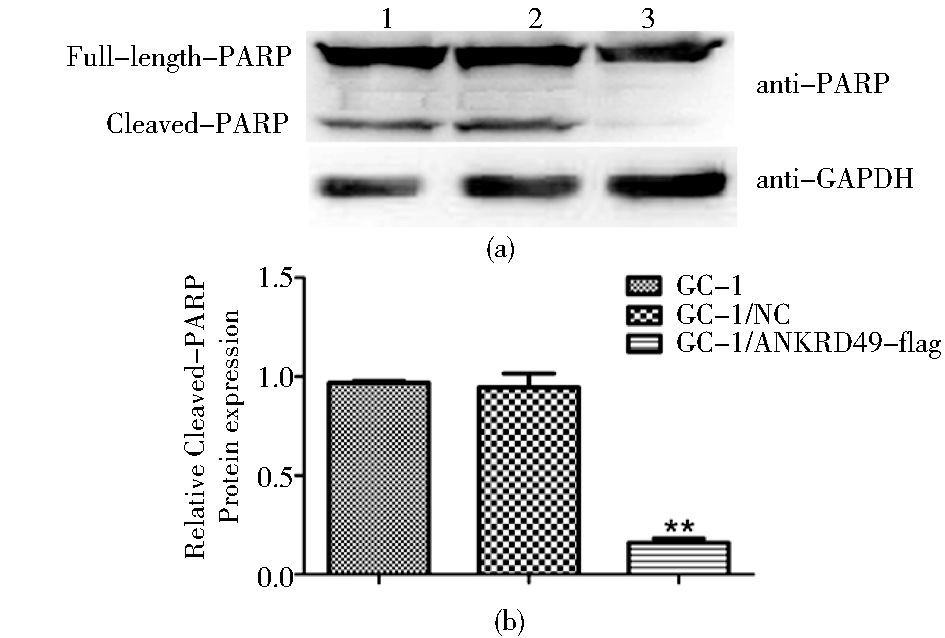
|
| 图 6 Western blotting检测PARP在各组细胞中的表达 Figure 6 The expression of PARP in GC-1 cells was detected by Western blotting (a) 1: GC-1; 2: GC-1/NC; 3: GC-1/ANKRD49-flag (b) The schematic of relative expression of Cleaved-PARP of GC-1 cells in three groups ** P < 0.01 compared to GC-1group and GC-1/NC group |
为进一步研究ANKRD49参与GC-1细胞凋亡的可能机制,通过Western blotting检测了UV诱导各组细胞内Bcl-xL和Bax的变化。结果显示,与空质粒组和裸细胞组相比,过表达ANKRD49组的GC-1细胞内Bcl-xL蛋白的表达水平显著高于其它两组 (P<0.05,图 7),而Bax蛋白的表达则无显著差异 (图 8)。
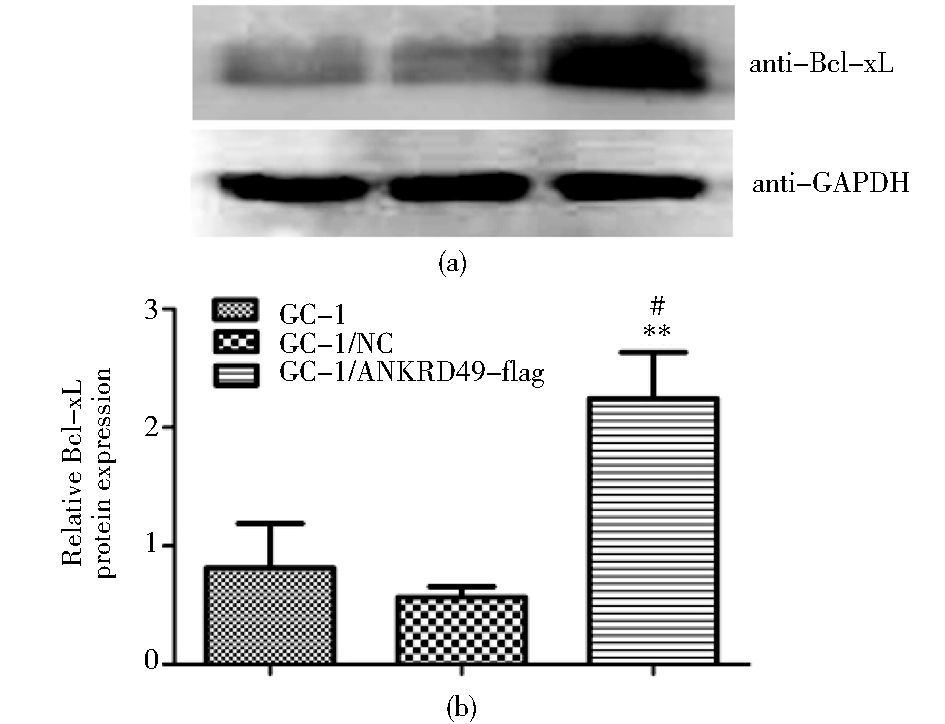
|
| 图 7 Western blotting检测Bcl-xL在各组细胞中的表达 Figure 7 The expression of Bcl-xL in GC-1 cells was detected by Western blotting (a) 1: GC-1; 2: GC-1/NC; 3: GC-1/ANKRD49-flag (b) The schematic of relative expression of Bcl-xL of GC-1 cells in three groups # P < 0.05 compared to GC-1 group ** P < 0.01 compared to GC-1/NC group |
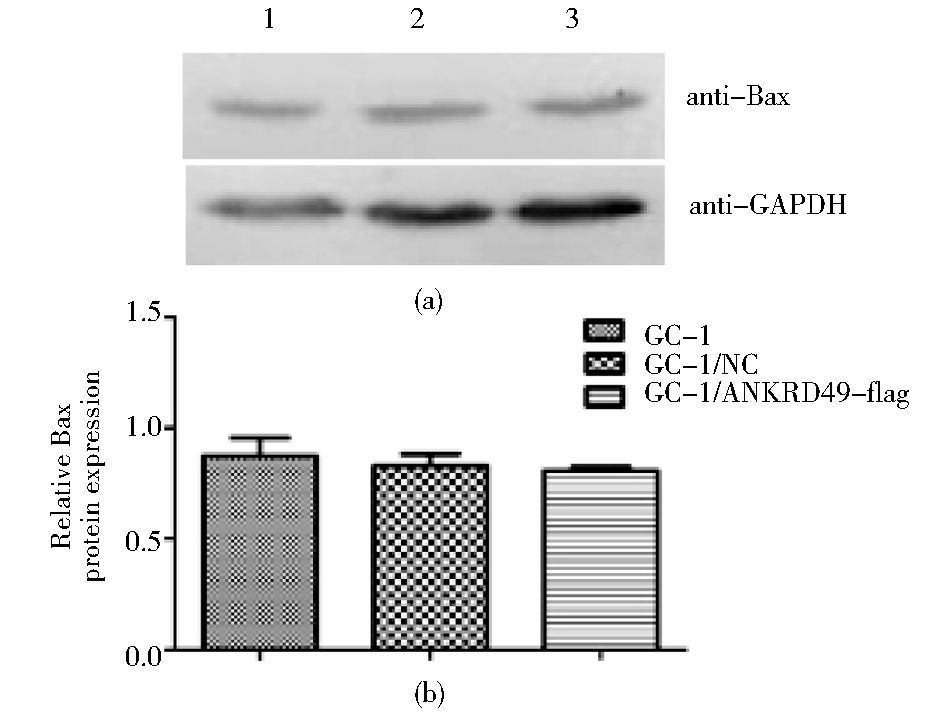
|
| 图 8 Western blotting检测Bax在各组细胞中的表达 Figure 8 The expression of Bax in GC-1 cells was detected by Western blottiong (a) 1: GC-1; 2: GC-1/NC; 3: GC-1/ANKRD49-flag (b) The schematic of relative expression of Bax of GC-1 cells in three groups |
细胞凋亡是在基因调控下发生的细胞不可逆的死亡过程,是维持体内细胞数量动态平衡、生物体内环境稳定的重要机制。生殖生物学研究者们早已发现细胞凋亡在精子发生过程中也扮演着十分重要的角色,研究表明成年动物大约75%的精原细胞会发生凋亡,处于减数分裂期的精母细胞甚至已经分化的精子细胞也可能发生凋亡[6]。这些凋亡常常是清除损伤生精细胞的必要手段,以保证精子生成的数量和质量[7]。但生精细胞凋亡过度,又会造成睾丸内生精障碍[8-9],严重者常常导致男性不育发生。
课题组前期研究发现ANKRD49在小鼠睾丸组织中高表达,但其意义不明。本文利用稳定过表达ANKRD49的GC-1细胞模型检测了该基因与细胞凋亡的关系。首先利用流式细胞术进行AnnexinV-FITC/PI双染及线粒体膜电位检测,从检测结果明显看到过表达ANKRD49的GC-1细胞凋亡发生率和线粒体膜电位下降幅度均低于空质粒组和裸细胞组。继而应用Hoechst33258染色从形态学角度再次观察到过表达ANKRD49的GC-1细胞出现核浓缩情况较对照组明显减少,可以初步判断过表达ANKRD49与细胞凋亡减少有关。Caspase-3活化和PARP的切割常常被认为是细胞早期凋亡发生的标志事件[10]。利用Western blotting证实在过表达ANKRD49的GC-1细胞中Cleaved-PARP和Cleaved-Caspase-3蛋白的表达水平显著低于对照组,这一结果表明过表达ANKRD49能够使GC-1细胞凋亡受到抑制。
众所周知,Bcl-2基因家族是调控细胞凋亡的重要基因,同样也是生精细胞凋亡过程的主要调节因素[11-12],该家族可分为促凋亡基因Bax、Bcl-XS等和抑制凋亡基因Bcl-2、Bcl-xL等。当细胞凋亡激活基因被抑制或凋亡抑制基因被激活,则细胞凋亡受到抑制。许多实验证明,Bcl-xL以及Bax广泛参与生精细胞凋亡的调节,如在维生素D缺乏引起幼年小鼠生精细胞凋亡的研究中,发现Bcl-xL表达显著下调[13],而在研究姜黄素减弱大鼠睾丸组织凋亡的论文中,作者发现Bcl-xL的表达显著上调[14]。也有研究发现Bax基因敲除小鼠的生精细胞凋亡率明显下降[15]。由此可见,充分认识Bcl-xL和Bax的表达变化对于了解生精细胞凋亡及其可能机制具有重要意义。进一步应用Western blotting检测了凋亡抑制蛋白Bcl-xL和凋亡促进蛋白Bax的表达情况,发现过表达ANKRD49的GC-1细胞内Bcl-xL蛋白表达水平明显高于对照组,而Bax蛋白的表达未见明显变化。因此推测:ANKRD49抑制GC-1细胞发生凋亡可能与Bcl-xL蛋白大量表达有关。有研究表明Bcl-xL基因启动子区存在转录因子NF-κB的特异结合位点,可以接受NF-κB的调节,从而启动基因的转录,进一步参与细胞凋亡的抑制过程[16]。课题组前期已经证实ANKRD49可以通过NF-κB信号通路促进血清饥饿诱导的GC-1发生自噬,提示ANKRD49在精原细胞内能够激活NF-κB信号通路[4]。因此,ANKRD49有可能通过NF-κB信号通路上调Bcl-xL基因表达,从而发挥抑制GC-1细胞凋亡的作用。但这一过程的确切分子机理仍需加以实验验证。基因过表达技术和基因抑制是研究基因功能的常用策略,也是目前基因治疗的常用方法,而基因抑制对基因功能的研究更具有说服力。前期课题组运用RNA干扰技术研究了ANKRD49基因抑制情况下对血清饥饿诱导GC-1细胞自噬的影响,发现ANKRD49基因抑制后,血清饥饿诱导的GC-1细胞自噬减弱[4]。本实验验证了ANKRD49过表达可以抑制UV诱导的GC-1凋亡,但ANKRD49基因抑制后对UV诱导GC-1细胞凋亡的影响还未做研究,我们会在后续的实验中采用RNA干扰技术进一步研究ANKRD49的确切生物功能,从而为人类诊断和治疗由睾丸基因异常引起的男性不育提供科学依据。
| [1] | Tee J M, Peppelenbosch M P. Anchoring skeletal muscle development and disease:the role of ankyrin repeat domain containing proteins in muscle phsiolgy. Critical Reviews in Biochemistry and Molecular Biology, 2010, 45(4) : 318–330. DOI:10.3109/10409238.2010.488217 |
| [2] | Hsu Y C, Yuan S, Chen H Y, et al. A four-gene signature from NCI-60 cell line for survival prediction in non-small cell lung Cancer. Clin Cancer Res, 2009, 15(23) : 7309–7315. DOI:10.1158/1078-0432.CCR-09-1572 |
| [3] | Christensen T, Jensen L, Bouzinova E V, et al. Molecular profiling of the lateral habenula in a rat model of depression. PLoS One, 2013, 8(12) : e80666. DOI:10.1371/journal.pone.0080666 |
| [4] | Wang H L, Fan S S, Pang M, et al. The ankyrin repeat domain 49(ANKRD49) augments autophagy of serum-starved GC-1 cells through the NF-kB pathway. PLoS One, 2015, 10(6) : e0128551. DOI:10.1371/journal.pone.0128551 |
| [5] | Oral O, Akkoc Y, Bayraktar O, et al. Physiological and pathological significance of the molecular cross-talk between autophagy and apoptosis. Histol Histopathol, 2016, 31(5) : 479–498. |
| [6] | Aitken R J, Findlay J K, Hutt K J, et al. Apoptosis in the germ line. Reproduction, 2011, 141(2) : 139–150. DOI:10.1530/REP-10-0232 |
| [7] | Shukla K K, Mahdi A A, Rajender S. Apoptosis, spermatogenesis and male infertility. Front Biosci (Elite Ed), 2012, 4 : 746–754. |
| [8] | Xu Y R, Dong H S, Yang W X. Regulators in the apoptotic pathway during spermatogenesis:Killers or Guards Gene, 2016, 582(2):97-111. |
| [9] | Ghasemzadeh J, Talebi A R, Khalili M A, et al. Sperm parameters, protamine deficiency, and apoptosis in total globozoospermia. Iran J Reprod Med, 2015, 13(8) : 495–502. |
| [10] | Agarwal A, Mahfouz R Z, Sharma R K, et al. Potential biological role of poly (ADP-ribose) polymerase (PARP) in male gametes. Reprod Biol Endocrinol, 2009, 7 : 143. DOI:10.1186/1477-7827-7-143 |
| [11] | Fotios Dimitriadis, Chara Tsiampali, Chaliasos N, et al. The Sertoli cell as the orchestra conductor of spermatogenesis:spermatogenic cells dance to the tune of testosterone. Hormones (Athens), 2015, 14(4) : 479–503. |
| [12] | Print C G, Loveland K L. Germ cell suicide:new insights into apoptosis during spermatogenesis. BioEssays, 2000, 22(5) : 423–430. DOI:10.1002/(SICI)1521-1878(200005)22:5<>1.0.CO;2-C |
| [13] | Sun W, Chen L, Zhang W, et al. Active vitamin D deficiency mediated by extracellular calcium and phosphorus results in male infertility in young mice. Am J Physiol Endocrinol Metab, 2015, 308(1) : 51–62. DOI:10.1152/ajpendo.00076.2014 |
| [14] | Mu Y, Yan W J, Yin T L, et al. Curcumin ameliorates highfat dietinduced spermatogenesis dysfunction. Mol Med Rep, 2016, 14(4) : 3588–3594. |
| [15] | Xu G, Vogel K S, McMahan C A, et al. BAX and tumor suppressor TRP53 are important in regulating mutagenesis in spermatogenic cells in mice. Biol Reprod, 2010, 83(6) : 979–987. DOI:10.1095/biolreprod.110.085415 |
| [16] | Chen C, Edelstein L C, Gélinas C. The RelNF-kappaB family directly activates expression of the apoptosis inhibitor Bcl-x (L). Mol Cell Biol, 2000, 20(8) : 2687–2695. DOI:10.1128/MCB.20.8.2687-2695.2000 |
 2017, Vol. 37
2017, Vol. 37




