文章信息
- 刘晓骅, 吉彩霞, 徐丽, 董超群, 罗进勇.
- LIU Xiao-hua, JI Cai-xia, XU Li, DONG Chao-qun, LUO Jin-yong.
- Hmox1促进BMP9诱导C3H10T1/2细胞向成骨分化
- Hmox1 Can Promote BMP9-induced Osteogenesis in C3H10 T1/2
- 中国生物工程杂志, 2017, 37(4): 33-39
- China Biotechnology, 2017, 37(4): 33-39
- http://dx.doi.org/DOI:10.13523/j.cb.20170405
-
文章历史
- 收稿日期: 2016-09-13
- 修回日期: 2016-10-28
间充质干细胞是一种具有多向分化能力的干细胞,它可以向成骨,成脂,成软骨,成肌等各向分化[1-3],并且因其具有来源广泛、易分离、易培养、免疫原性低的特点,是组织工程中最受青睐的种子细胞。骨形态发生蛋白 (bone morphogenetic proteins, BMPs) 是转化生长因子 (transforming growth factor, TGF-β) 超家族中的一员,它是一种外分泌蛋白,在胚胎的发育,神经系统完善以及出生后骨形成过程中起着重要作用[4-5]。BMP2,BMP4,BMP6,BMP7均具有促进间充质干细胞向成骨分化的作用,其中,人重组BMP2、BMP7蛋白已经应用于临床治疗[6-7]。课题组前期研究发现,在这些具有促成骨作用的BMP中,BMP9作用最强[8]。BMP9有望成为临床上更有效的促成骨治疗因子,因此需要深入研究BMP9的促成骨机制从而为BMP9应用于临床提供可靠的支持。
血红素加氧酶 (hemeoxygenase,HO) 系统是一个微粒体酶系统,在人和哺乳动物体内广泛存在,参与整个生长发育过程和多种生理病理过程,是血红素降解起始酶和限速酶。HO有两种类型:诱导型 (HO-1),组成型 (HO-2)。HO作用于血红素得到产物CO、Fe和胆绿素。胆绿素在体内立即被胆绿素还原酶还原成胆红素, 而铁离子诱导铁蛋白的合成[9]。HO-1可以在多种刺激因素下 (亚铁血红素,组织内氧过多,内毒素) 反应增高,具有抗凋亡,抗氧化应激作用[10]。在骨折愈合过程中,低氧诱导因子 (hypoxia-inducible factor, HIF-1) 和血管内皮细胞生长因子 (VEGF)、HO-1参与调控破骨细胞生成和骨再吸收;HO-1也能促进成骨细胞分化[11-12],但HO-1在BMP9诱导成骨分化的过程中的作用尚不清楚。因此,本研究主要探讨在BMP9诱导下,HO-1在间充质干细胞分化过程中发挥的作用。
1 材料与方法 1.1 材料Hmox1基因模板,腺病毒穿梭质粒PAdTrace-TO4(卡那抗性),大肠埃希菌DH10B,BJ5183感受态 (含有缺失E1和E3区的野生型腺病毒骨架质粒pAdEasy1的BJ5183感受态),腺病毒Ad-BMP9、Ad-GFP和Ad-RFP,人胚肾HEK293细胞,小鼠胚胎成纤维细胞C3H10T1/2(本实验室保存)。
1.2 试剂高保真酶PrimerSTAR购于TaKaRa公司,胶回收试剂盒、质粒抽提试剂盒购于Omega公司,限制性内切酶BamH Ⅰ、Hind Ⅲ、Pme Ⅰ、Pac Ⅰ购于New England Biolab公司,DNA连接酶和脂质体转染试剂盒Lipofectamine 2 000购于Invitrogen公司,高糖型DMEM培养基购于HyClone公司,胎牛血清购于Gibico公司,一抗β-Actin购于天津三箭生物技术有限公司,一抗Hmox1购于ABcam公司,二抗辣根过氧化物酶标记的羊抗兔/鼠IgG购于北京中衫金桥公司,Trizol、普通PCR、SYBR试剂与逆转录PCR试剂盒均购于TaKaRa公司,Hmox1激动剂COPP、ALP染色试剂盒、茜素红、维生素C、β-磷酸甘油购自Sigma公司。
1.3 引物设计引物设计见表 1。
| Primer | Sequence | |
| GAPDH | Forward Primer | GGCTGCCCAGAACATCAT |
| Reverse Primer | CGGACACATTGGGGGTAG | |
| Hmox1 clone | Forward Primer | cgcGGATCCACCATGGAGCGTCCACAGCCC |
| Reverse Primer | cccAAGCTTTTACATGGCATAAATTCCCACTGC | |
| Hmox1 screening | Forward Primer | GCTGTTTAGTGAACCGTCAGATCG |
| Reverse Primer | CCTGAGAGGTCACCCAGGTA | |
| Hmox1 | Forward Primer | CACGCATATACCCGCTACCT |
| Reverse Primer | CCAGAGTGTTCATTCGAGCA |
1.4 质粒构建和细胞实验 1.4.1 穿梭质粒pAdTrace-TO4-Hmox1构建
首先PCR扩增出目的片段 (PCR反应体系50μl:PrimerSTAR buffer 10μl、PrimerSTAR 0.5μl、2.5mol/L dNTP 4μl、目的片段上下游引物各1μl、Hmox1质粒模板1μl、ddH2O 32.5μl;反应条件:95℃预变性3min,92℃变性30s,55℃退火30s,72℃延伸60s,循环30次,72℃延伸5min),用BamH Ⅰ、Hind Ⅲ分别双酶切纯化回收的目的片段和穿梭质粒pAdTrace-TO4,T4连接酶连接后铺板 (含卡那霉素100mg/L),12h后PCR筛选阳性克隆菌 (反应体系10μl:筛选引物各1μl、10×PCR buffer 1μl、2.5mol/L dNTP 3μl、rTaq 0.2μl、DMSO 0.6μl、ddH2O 3.2μl),阳性克隆菌扩增后提取的质粒送公司测序进行鉴定。
1.4.2 重组质粒构建和腺病毒包装Pme Ⅰ酶切pAdTrace-TO4-Hmox1使其线性化,纯化后电转入含Adeasy-1骨架质粒的BJ5183感受态中进行重组,取适量涂布于LB琼脂平板 (卡那霉素100mg/L),Pac Ⅰ酶切鉴定正确的重组质粒再次转化DH10B感受态扩增,最后Pac Ⅰ酶切重组质粒,经Lipofectamine 2 000介导转染人胚肾HEK 293细胞进行包装,一周左右大部分细胞变圆,30%细胞脱落,收集细胞反复冻融3次得到腺病毒,重复扩增直到病毒滴度增高。
1.4.3 细胞培养C3H10T1/2、HEK 293细胞株在37℃,5% CO2的环境下,用含10%胎牛血清与100U/ml青霉素和100μg/ml的链霉素的DMEM高糖培养基进行培养。
1.4.4 条件培养基的制备接种结肠癌细胞HCT116于100mm×20mm培养皿中,待细胞融合率达到60%~70%,Ad-BMP9感染结肠癌细胞HCT116(控制24h病毒感染率50%左右),4~6h后换无血清无抗生素DMEM培养基继续培养,分别于24h、48h离心收集上清备用,上清中含较高浓度BMP9蛋白。
1.4.5 Q-PCRC3H10 T1/2做处理后,于72h提取细胞RNA,逆转录为cDNA后Q-PCR (SYBR酶) 检测相关目的基因表达。
1.4.6 Western blotC3H10T1/2做处理后,于72h用蛋白裂解液裂解细胞提取细胞总蛋白,SDS-PAGE凝胶电泳分离,PVDF膜上进行湿转,37℃用BSA封闭2h,一抗 (Hmox1抗体1:1 000,β-actin抗体1:1 000) 在4℃封闭过夜,洗膜3次,辣根过氧化物酶标记二抗 (1:5 000)37℃孵育1h,再次洗膜3次,按照ECL试剂盒配置显色液发光成像。
1.4.7 碱性磷酸酶染色及活性测定将C3H10T1/2细胞以30%融合度铺在24孔板里,病毒或药物处理24h后加入BMP9条件培养基,于第5天按照说明书进行碱性磷酸酶染色及活性测定。
1.4.8 钙盐沉积实验将C3H10 T1/2细胞以30%融合度铺在24孔板里,病毒处理24h后加入成骨诱导培养基 (含DMEM,10%胎牛血清,1%青/链霉素,10mmol/L β磷酸甘油及50mg/ml维生素C) 和BMP9条件培养基,在第14天进行茜素红染色:弃去培养基,PBS洗2次,0.05%戊二醛固定10min,去离子水洗2次,0.04%茜素红200μl每孔染色至出现红色物质,弃去染液并用去离子水洗涤3次。扫描并于显微镜下照相留存。
1.5 统计学分析计量资料以均数±标准差 (x±s) 表示,组间比较采用单因素方差分析,用SPSS 17.0进行统计学处理。
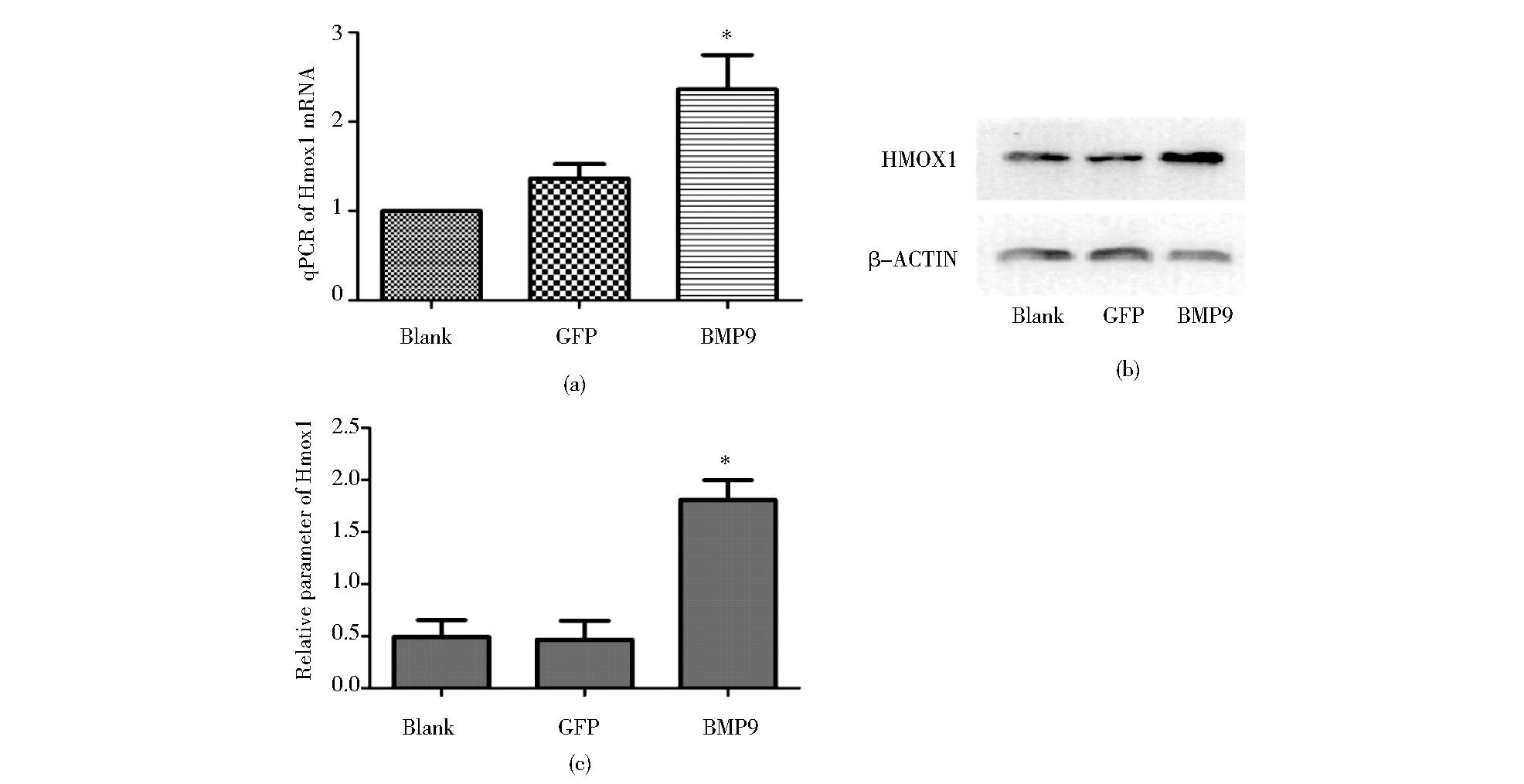
2 结果 2.1 BMP9对C3H10T1/2细胞内源性Hmox1表达的影响Ad-GFP和Ad-BMP9分别感染C3H10T1/2细胞72h后,RT-PCR和Western blot检测到Hmox1的mRNA和蛋白水平增加 (图 1a,图 1b)。
|
| 图 1 C3H10T1/2细胞中BMP9对内源性Hmox1表达的影响 Figure 1 Effects of BMP9 on gene and protein level of Hmox1 in C3H10T1/2 (a) The mRNA level of Hmox1 after Ad-BMP9 infection for 72h (b) and (c) The protein level of Hmox1 after Ad-BMP9 infection for 72h; * P < 0.5 vs.GFP group |
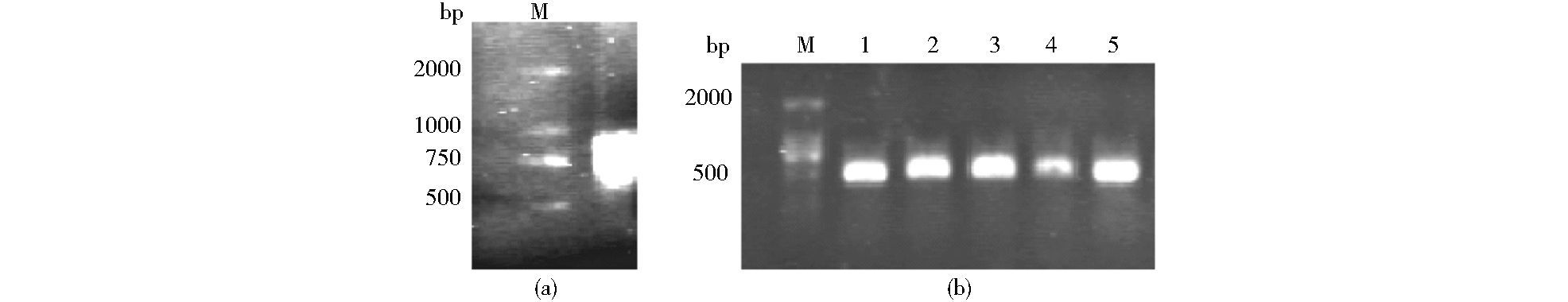
PCR方法扩增Hmox1基因编码序列 (870bp),凝胶电泳检测条带位置 (图 2a),与酶切处理的TO4质粒连接后转入DH10B感受态,菌落PCR筛选结果 (图 2b),选1、2号送公司做测序鉴定,测序结果正确。
|
| 图 2 Hmox1重组腺病毒穿梭质粒构建 Figure 2 Construction of shuttle plasmids of Hmox1 recombinant adenovirus (a) PCR product of target fragments (b) Colony PCR M:Marker |
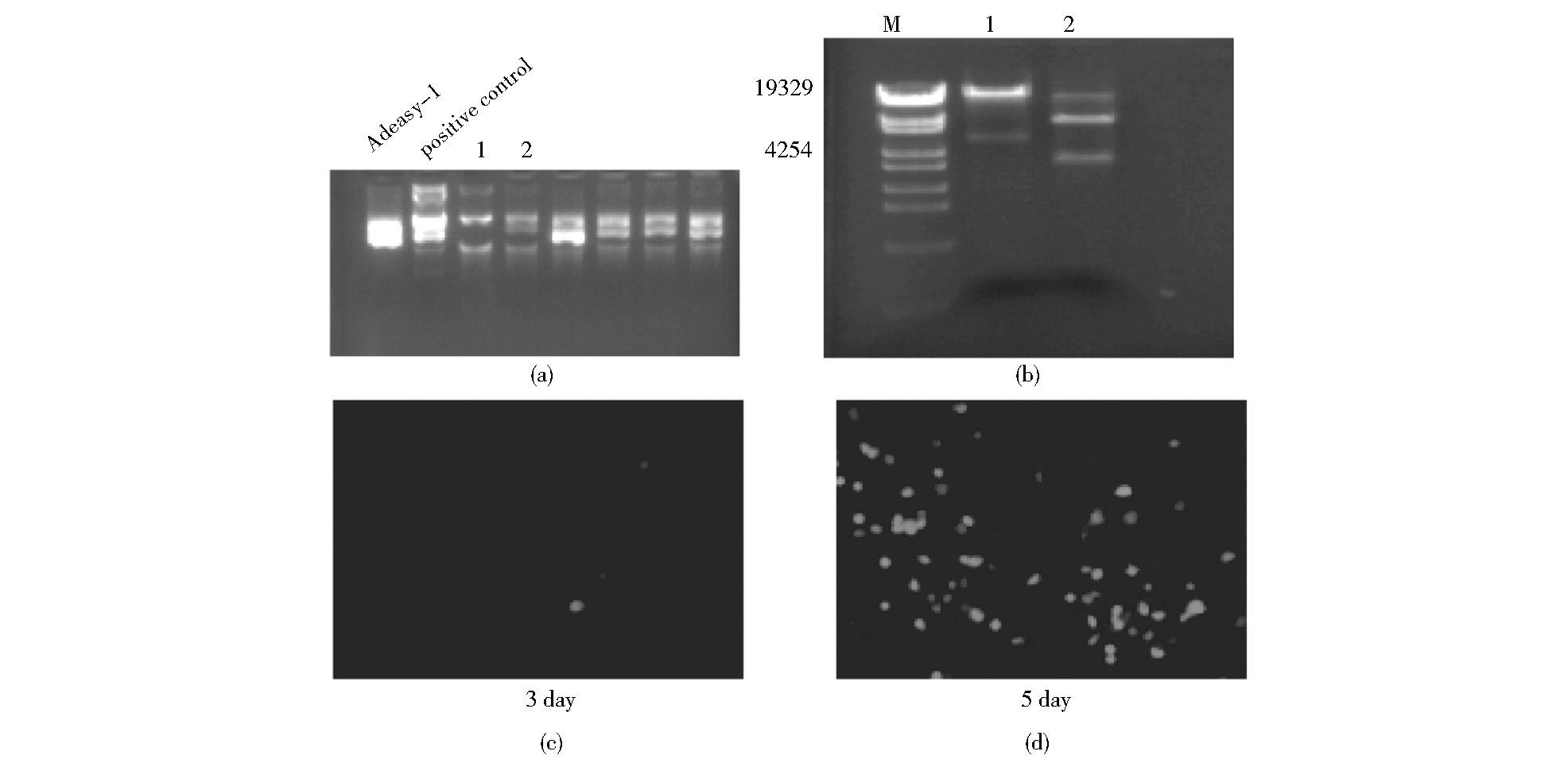
测序成功的穿梭质粒Pme Ⅰ线性化后转入BJ5183(含Adeasy-1骨架质粒) 同源重组,重组后的阳性质粒 (1, 2) 比Ad-easy质粒大 (图 3a);选1、2号质粒做Pac Ⅰ酶切鉴定 (图 3b);Pac Ⅰ酶切鉴定成功的1号质粒后经lipofectamine 2 000导入HEK 293细胞,第3天出现红色荧光 (图 3c), 第5天红色荧光越来越多 (图 3d),说明病毒包装成功。
|
| 图 3 Hmox1腺病毒穿梭质粒和骨架质粒的同源重组及包装 Figure 3 Homologous recombinant and packaging of Hmox1 adenovirus (a) Test of recombinant plasmids (b) Identification of plasmids after enzyme digestion (c, d) Fluorescence imaging of 293 cells during the process of adenovirus packaging M: Marker |
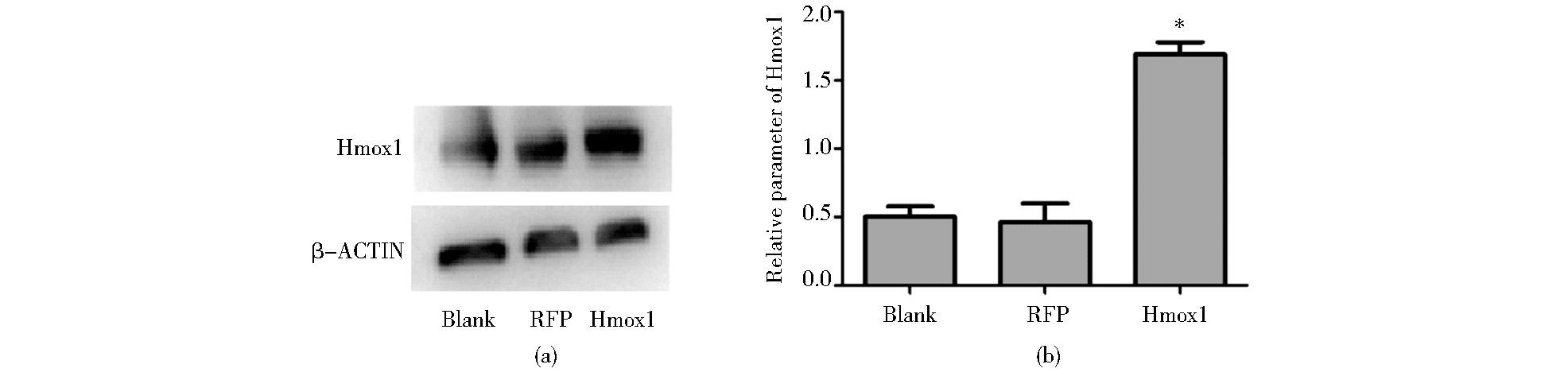
Ad-Hmox1感染C3H10T1/2细胞,72h后提取蛋白,经Western blot检测发现Hmox1蛋白的表达增加 (图 4)。
|
| 图 4 重组腺病毒有效性验证 Figure 4 Test the validation of adenovirus C3H10T1/2 cells were infected with Ad-RFP or Ad-Hmox1, then extracted proteins after 72h. β-ACTIN was used as internal control. * P < 0.05 vs. RFP group |
用Ad-Hmox1或Hmox1激动剂COPP处理BMP9诱导的C3H10T1/2细胞,在第5天检测碱性磷酸酶ALP活性及染色。结果显示,Ad-Hmox1处理组和RFP处理组相比ALP活性一样,Ad-Hmox1和BMP9共同处理组ALP染色和活性与BMP9组相比明显增高 (图 5a、5c),BMP9和COPP共同处理组也比BMP9组的ALP染色和活性更强 (图 5b、5d)。说明用Hmox1处理对ALP活性没有影响,Hmox1可以明显促进BMP9诱导下ALP活性。
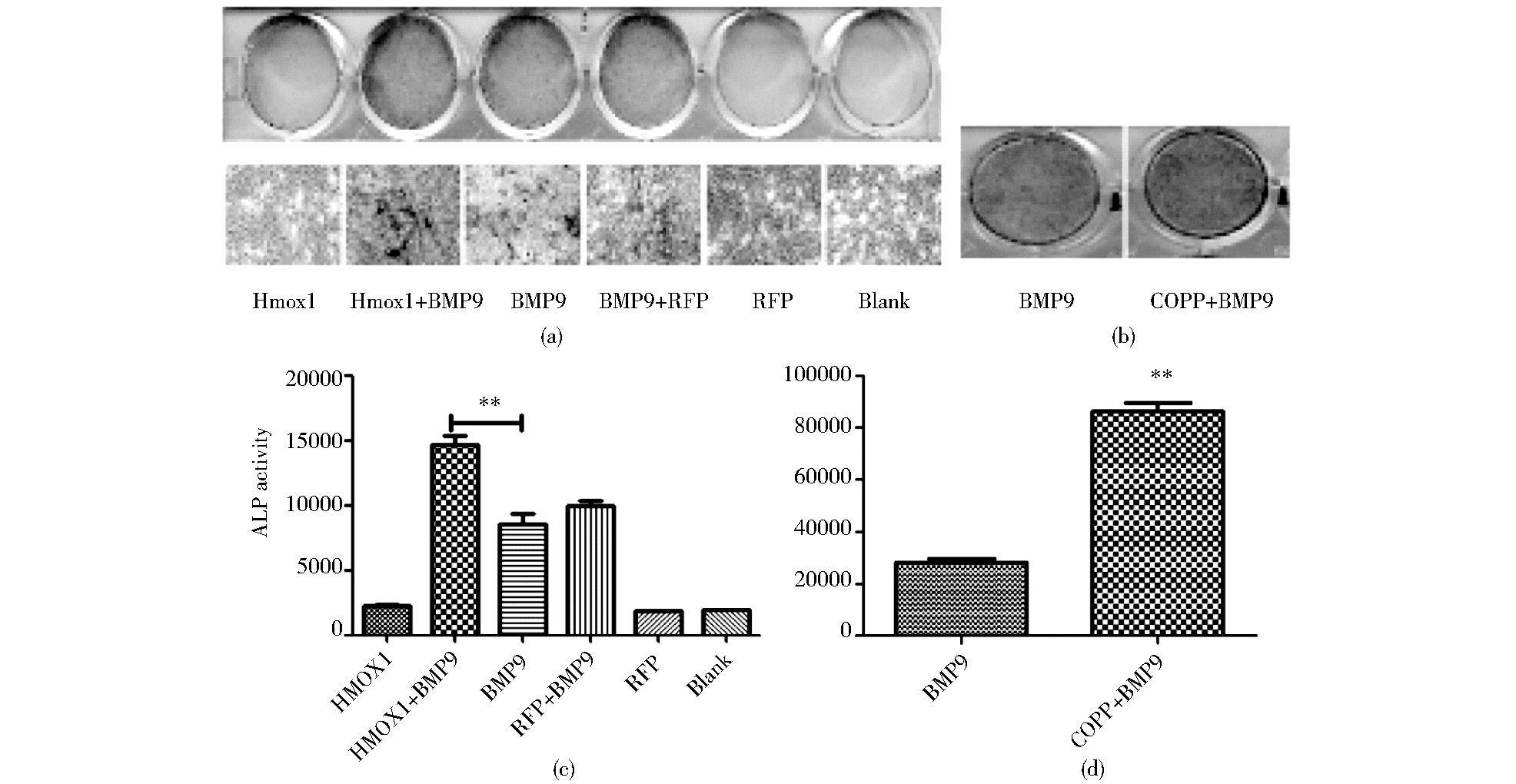
|
| 图 5 Hmox1对BMP9诱导下C3H10 T1/2细胞早期成骨分化的影响 Figure 5 Effects of Hmox1 on BMP9-induced early osteogenic differentiation (a) and (b) ALP staining at 5 day; (c) and (d) ALP quantitative assay at 5 day (b) ** P < 0.01 vs. BMP9 group |
Ad-Hmox1处理BMP9诱导的C3H10T1/2细胞,在第14天茜素红染色检测钙盐结节。结果显示Hmox1能明显促进BMP9诱导下钙盐结节的形成 (图 6)。
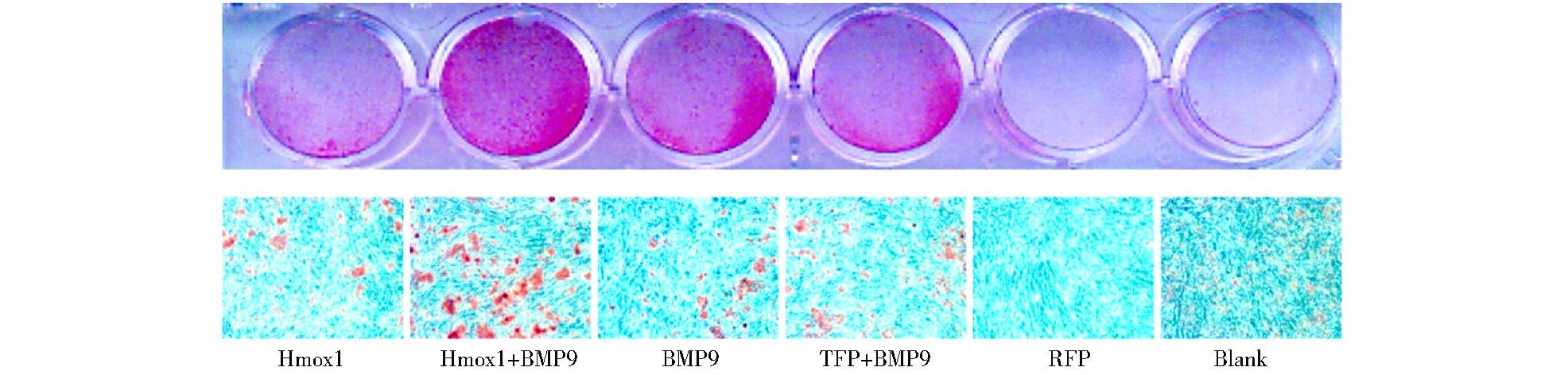
|
| 图 6 茜素红染色 Figure 6 Calcium deposition was determined by Alizarin Red S staining assay at day 14 |
Ad-Hmox1与BMP9共同处理C3H10T1/2细胞,提取3天的蛋白,Western blot检测COL1A1蛋白水平。结果显示两者联合作用可以明显增加COL1A1的蛋白表达 (图 7)。
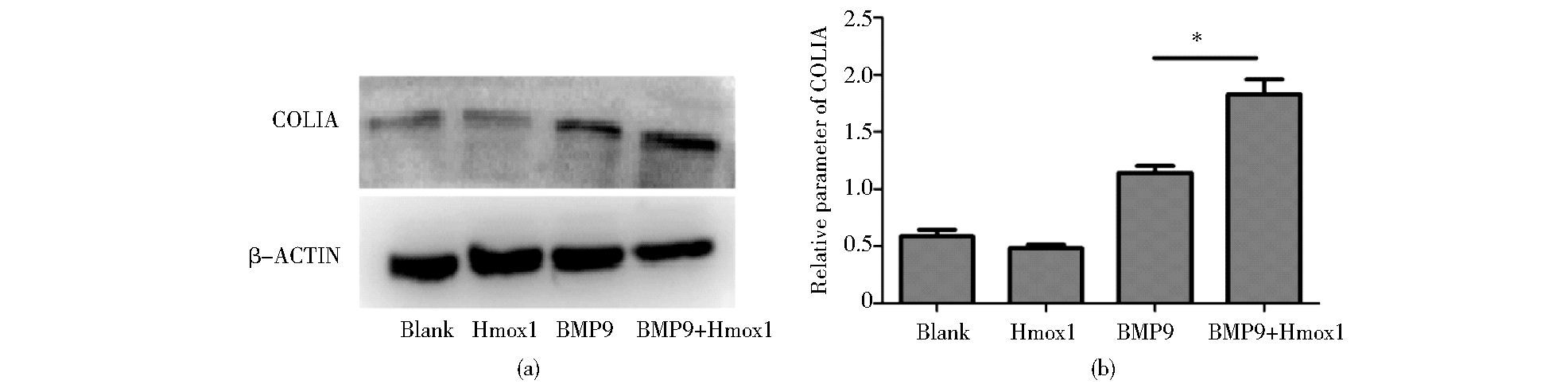
|
| 图 7 Western blot检测COL1A1表达 Figure 7 Detection of COL1A1 by Western blot at day 3 |
课题组前期研究发现,BMP9可以直接或间接与多种转录因子相互作用,来促进间充质干细胞向成骨分化,如RUNX2[13]。
Hmox1是一种热休克蛋白,作为重要的抗炎、抗氧化因子刺激因子在各种生理或病理情况下发挥作用[14-15],Hmox1表达下调促进破骨形成,引起骨量减少[16, 11]。近几年研究报道Hmox1对成骨的作用,Ignazio等发现hMSCs在成骨诱导培养基作用下,Hmox1表达在第7天有降低,在第14、21天升高,COPP激动剂引起Hmox1的高表达可以明显促进MSCs的成骨分化,但是具体机制尚不清楚[12]。成骨细胞分泌的VEGF通过上调Hmox1促进骨髓基质细胞的成骨分化[17]。BMP9作用下间充质干细胞向成骨分化过程中,Hmox1扮演的角色是未知的,因此在本课题中,首先探讨BMP9作用下间充质干细胞向成骨分化过程Hmox1内源性表达变化,检测到Hmox1的mRNA和蛋白水平都明显增加,说明Hmox1的表达在BMP9诱导下间充质干细胞的成骨分化过程有作用。
但BMP9诱导间充质干细胞中Hmox1的表达变化在成骨分化过程起着怎样的作用以及具体机制尚不清楚,因此,本课题采用Ad-easy系统构建了表达红色荧光的过表达Hmox1的重组腺病毒,用Ad-Hmox1处理C3H10 T1/2细胞检测成骨早期指标ALP和晚期指标钙盐沉积的变化。结果表明,过表达Hmox1可以促进BMP9诱导下C3H10 T1/2细胞的成骨分化。
本研究利用腺病毒Ad-easy系统将携有红色荧光标签的穿梭质粒和含腺病毒E1、E3缺失区域的骨架质粒pAd-easy1同源重组,在293细胞中进行包装,成功构建出过表达Hmox1的腺病毒,并证实Hmox1可增强BMP9诱导下间充质干细胞的成骨分化。下一步将深入研究Hmox1对BMP9诱导下间充质干细胞成骨分化涉及的信号通路 (如Smad信号以及WNT,MAPK信号) 的影响,此外,后期还应从体内实验水平验证Hmox1对BMP9诱导C3H10T1/2细胞成骨分化的促进作用。临床上疾病或外伤导致的大面积骨不连,骨缺损都伴随着局部炎症反应,而Hmox1作为重要的抗炎、抗氧化因子在BMP9刺激下表达增高并且高表达Hmox1可以促进BMP9诱导下间充质干细胞的成骨分化,为BMP9应用于临床治疗提供了理论支持。
| [1] | Ferrari G, Cusella-De Angelis G, Coletta M, et al. Muscle regeneration by bone marrow-derived myogenic progenitors. Science (New York, N.Y.), 1998, 279(5356) : 1528–1530. DOI:10.1126/science.279.5356.1528 |
| [2] | Mackay A M, Beck S C, Murphy J M, et al. Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow. Tissue Engineering, 1998, 4(4) : 415–428. DOI:10.1089/ten.1998.4.415 |
| [3] | Pittenger M F, Mackay A M, Beck S C, et al. Multilineage potential of adult human mesenchymal stem cells. Science, 1999, 284(5411) : 143–147. DOI:10.1126/science.284.5411.143 |
| [4] | Dudley A T, Lyons K M, Robertson E J. A requirement for bone morphogenetic protein-7 during development of the mammalian kidney and eye. Genes Dev, 1995, 9(22) : 2795–2807. DOI:10.1101/gad.9.22.2795 |
| [5] | Chen D, Zhao M, Mundy G R. Bone morphogenetic proteins. Growth Factors (Chur, Switzerland), 2004, 22(4) : 233–241. DOI:10.1080/08977190412331279890 |
| [6] | Valentin-Opran A, Wozney J, Csimma C, et al. Clinical evaluation of recombinant human bone morphogenetic protein-2. Clin Orthop Relat Res, 2002, 395 : 110–120. DOI:10.1097/00003086-200202000-00011 |
| [7] | Ristiniemi J, Flinkkila T, Hyvonen P, et al. RhBMP-7 accelerates the healing in distal tibial fractures treated by external fixation. J Bone Joint Surg Br, 2007, 89(2) : 265–272. |
| [8] | Luu H H, Song W X, Luo X, et al. Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells. Journal of Orthopaedic Research, 2007, 25(5) : 665–677. DOI:10.1002/(ISSN)1554-527X |
| [9] | Ryter S W, Alam J, Choi A M. Heme oxygenase-1/carbon monoxide:from basic science to therapeutic applications. Physiological Reviews, 2006, 86(2) : 583–650. DOI:10.1152/physrev.00011.2005 |
| [10] | Komatsu D E, Hadjiargyrou M. Activation of the transcription factor HIF-1 and its target genes, VEGF, HO-1, iNOS, during fracture repair. Bone, 2004, 34(4) : 680–688. DOI:10.1016/j.bone.2003.12.024 |
| [11] | 赵艳芳, 宋涛, 刘跃亮, 等. RUNX2对BMP9诱导的间充质干细胞C3H10T1/2成骨分化的影响. 中国生物工程杂志, 2013, 33(2) : 21–26. Zhao Y F, Song T, Liu Y L, et al. Effects of RUNX2 on BMP9-induced osteogenic differentiation of C3H10T1/2 mesenchymal stem cells. China Biotechnology, 2013, 33(2) : 21–26. |
| [12] | Kapturczak M H, Wasserfall C, Brusko T, et al. Heme oxygenase-1 modulates early inflammatory responses:evidence from the heme oxygenase-1-deficient mouse. Am J Pathol, 2004, 165 : 1045–1053. DOI:10.1016/S0002-9440(10)63365-2 |
| [13] | Takahashi T, Morita K, Akagi R, et al. Heme oxygenase-1:a novel therapeutic target in oxidative tissue injuries. Curr Med Chem, 2004, 11(12) : 1545–1561. DOI:10.2174/0929867043365080 |
| [14] | Ke K, Safder M A, Sul O J, et al. Hemeoxygenase-1 maintains bone mass via attenuating a redox imbalance in osteoclast. Mol Cell Endocrinol, 2015, 409 : 11–20. DOI:10.1016/j.mce.2015.03.022 |
| [15] | Sakamoto H, Sakai E, Fumimoto R, et al. Deltamethrin inhibits osteoclast differentiation via regulation of heme oxygenase-1 and NFATc1. Toxicol In Vitro, 2012, 26(6) : 817–822. DOI:10.1016/j.tiv.2012.05.005 |
| [16] | Barbagallo I, Vanella A, Peterson S J, et al. Overexpression of heme oxygenase-1 increases human osteoblast stem cell differentiation. J Bone Miner Metab, 2010, 28(3) : 276–288. DOI:10.1007/s00774-009-0134-y |
| [17] | Zhang L F, Qi J, Zuo G, et al. Osteoblast-secreted factors promote proliferation and osteogenic differentiation of bone marrow stromal cells via VEGF/Heme-oxygenase-1 pathway. PLoS One, 2014, 9(6) : e99946. DOI:10.1371/journal.pone.0099946 |
 2017, Vol. 37
2017, Vol. 37




