文章信息
- 冯雪军, 龙琼, 唐增华, 黄惟巍, 刘存宝, 杨旭, 孙文佳, 白红妹, 马雁冰.
- FENG Xue-jun, LONG Qiong, TANG Zeng-hua, HUANG Wei-wei, LIU Cun-bao, YANG Xu, SUN Wen-jia, BAI Hong-mei, MA Yan-bing.
- 重组小鼠白细胞介素-33的原核表达制备及其粘膜免疫佐剂活性
- The Prokaryotic Expression of Recombinant Murine Interlukin (IL)-33 and Its Mucosal Immunization Affect as Adjuvant
- 中国生物工程杂志, 2017, 37(4): 26-32
- China Biotechnology, 2017, 37(4): 26-32
- http://dx.doi.org/DOI:10.13523/j.cb.20170404
-
文章历史
- 收稿日期: 2016-11-01
- 修回日期: 2016-11-16
2. 云南省重大传染病疫苗研发重点实验室 昆明 650118;
3. 云南省重大传染病疫苗工程技术研究中心 昆明 650118
2. Yunnan Key Laboratory of Vaccine Research & Developent on Severe Infection Disease, Kunming 650118, China;
3. Yunnan Engineering Research of Vaccine Research and Development on Severe Infection Disease, Kunming 650118, China
白细胞介素 (IL)-33是由Schmitz等[1]在2005年发现的一个IL-1家族的新成员,主要由树突状细胞 (DCs),巨噬细胞,上皮细胞,成纤维细胞和平滑肌细胞表达[2],在细胞坏死或损伤时释放,可起到“警报素”作用,促发一系列下游免疫反应。细胞释放的IL-33与Ⅱ型固有淋巴细胞ST2受体结合,激活MyD88和IRAK-1/4,导致NF-κB和MAPK途径的活化,产生Ⅱ型免疫反应细胞因子和趋化因子。此外,IL-33具有很强的刺激Th2的分化与激活的功能,同时也是特异的Th2细胞趋化物[3]。
研究还发现,IL-33能够影响DCs的成熟和活化[4],包括诱导骨髓单核-巨噬细胞协同刺激因子的表达并促进CD11c+DCs的产生,以及促进DCs主要组织相容性复合物Ⅱ和CD86及IL-6等的表达[5]。IL-33作用于DCs、巨噬细胞、NK、CD8+CTLs等免疫细胞[6],在抗病毒感染特异细胞免疫应答中具有重要作用[7-8]。有文献报道,以IL-33作为佐剂在HPV相关的肿瘤模型中,可以增强肿瘤抗原特异治疗性疫苗的抗肿瘤Th1/CTLs免疫应答,并且显著抑制肿瘤的生长[9-11]。
概言之,IL-33作用于DCs、NK、NKT、CTLs、Th2、嗜酸性粒细胞,嗜碱性粒细胞等免疫细胞,在固有免疫和适应性免疫中发挥着重要调节作用[3, 5, 10],具有作为分子免疫佐剂的应用潜能。本研究旨在探讨小鼠来源的重组IL-33在大肠杆菌中的制备技术,并考察其对粘膜免疫所激发的特异抗体应答水平及类型的影响。
1 材料与方法 1.1 实验动物6~8周龄Balb/c雌性小鼠,体重16~18g, 购自北京维通利华实验技术有限公司[编号:SCXK (京)2012-0001],饲养于清洁级动物房。
1.2 质粒及细胞系表达硫氧还蛋白 (thioredoxin, Trx)/IL-33融合蛋白的重组质粒pThioHisA/IL-33, 由本实验室构建并保存 (pThioHisA质粒购自Invitrogen公司)。大肠杆菌 (E.coli) DH5α感受态购自北京全式金生物技术有限公司。小鼠巨噬细胞系 (Raw264.7) 由昆明医科大学第二附属医院陈斌老师惠赠。
1.3 试剂生物素化的羊抗鼠IgA、TNF-α、IgG1与IgG2a,抗体,购自eBioscience公司。亲和素偶联碱性磷酸酶,碱性磷酸酶底物购自Sigma-Aldrich公司。Q-Sepharose FF-、Ni++-Sepharose FF、Sephadex G25填料购自美国GE公司。DMEM细胞培养液购自HyClone公司。IL-33标准品购自Peprotech公司,肠激酶购自Sigma-Aldrich公司。
1.4 Trx/IL-33融合蛋白的诱导表达将重组表达质粒pThioHisA/IL-33转化感受态DH5α,挑取单菌落并接种至LB液体培养基中,37℃,220r/min, 培养过夜,然后按照2%~5%的比例将菌液转接至新的LB液体培养基中,37℃, 280r/min摇床培养,至菌液OD600值为0.4~0.6时,加入IPTG至浓度为1mmol/L,诱导4~6h。离心收集菌体,离心条件为8 000 r/min,4℃,10min。所表达的目的蛋白经12%的SDS-PAGE电泳分析。
1.5 Trx/IL-33融合蛋白的纯化离心收集的菌体用20mmol/L Tris-HCl (pH8.0) 重悬,超声波破碎。离心收集破碎上清,条件为4℃,12 000r/min,20min。将收集的上清经0.45μm的滤膜过滤后以Q-Sepharose FF阴离子交换进行纯化。经10个柱床体积达1mol/L NaCl (20mmol/L Tris-HCl, pH=8.0),流速为1ml/min。利用自动部分收集仪收集样品并进行SDS-PAGE电泳分析。目的峰进一步经Ni++金属螯合亲和层析纯化,A液为含5mmol/L咪唑、0.3mol/L NaCl的20mmol/LTris-HCl (pH8.0),B液为含500mmol/L咪唑、0.3mol/L NaCl的20mmol/LTris-HCl (pH8.0)。流速为1ml/min,0%~50% B液梯度洗脱,10个柱床体积,利用自动部分收集仪收集样品并经SDS-PAGE电泳分析。纯化的融合蛋白经Sephadex G25脱盐后,加入肠激酶,20℃水浴孵育12h以释放成熟形式的IL-33,进一步以Ni++金属螯合柱吸附切割出的硫氧化蛋白,流过液主要为纯化的成熟IL-33蛋白,经脱盐处理后冻存备用。
1.6 IL-33的生物活性检测用系列稀释的商业化的小鼠重组IL-33和纯化获得的Trx/IL-33融合蛋白及成熟形式的IL-33,分别刺激培养的RAW264.7巨噬细胞 (浓度为1 ×105/ml,培养12 h后,收集上清,以ELISA检测上清中TNF-α的表达水平,并计算出三种形式的IL-33的半最大效应 (EC50) 值。ELISA采用夹心法按Ebioscience公司产品说明进行。简单过程如下,以抗小鼠TNF-α单克隆抗体包被酶标板,5% BSA封闭2h,加入样品孵育2h,加入生物素化的抗小鼠TNF-α单克隆抗体孵育2h,加入碱性磷酸酶标记的亲和素孵育1h,最后以碱性磷酸酶底物显色,酶标仪读取OD405值。
1.7 小鼠免疫HBcAg病毒样颗粒的制备参考本室发表的研究论文所描述方法[11]。通过小动物麻醉机以异氟烷麻醉小鼠,将40 μl抗原溶液滴到小鼠两个鼻腔内,分HBcAg和HBcAg+IL-33两组,HBcAg剂量为50μg,成熟形式的IL-33浓度为1 μg,每两周免疫1次,共3次。末次免疫后隔周进行小鼠腿部隐静脉采血,用于检测HBcAg特异性抗体应答。
1.8 ELISA检测抗体水平以实验室制备的HBcAg包被酶标板,50μl/孔,于湿盒中4℃过夜,用PBST (含5%的Tween20的PBS,pH7.2) 洗涤3次,加入含5% BSA的PBST室温封闭2h,PBST洗涤3次,加入小鼠血清或组织灌洗液,室温下孵育1h,PBST洗3次,再加入生物素标记的抗小鼠IgA、IgG1与IgG2a(1:10 000稀释),最后,加入亲和素-碱性磷酸酶 (1:10 000稀释),洗涤后加入碱性磷酸酶底物溶液,30 min后,在酶标仪上测OD405值。
2 结果 2.1 重组Trx/IL-33融合蛋白的表达转化了质粒pThioHisA/IL-33的重组菌在IPTG诱导4h后,经SDS-PAGE分析显示,较之诱导前,诱导后在32kDa处有明显的表达条带,与预期的融合蛋白理论分子量32.38kDa相符 (图 1)。
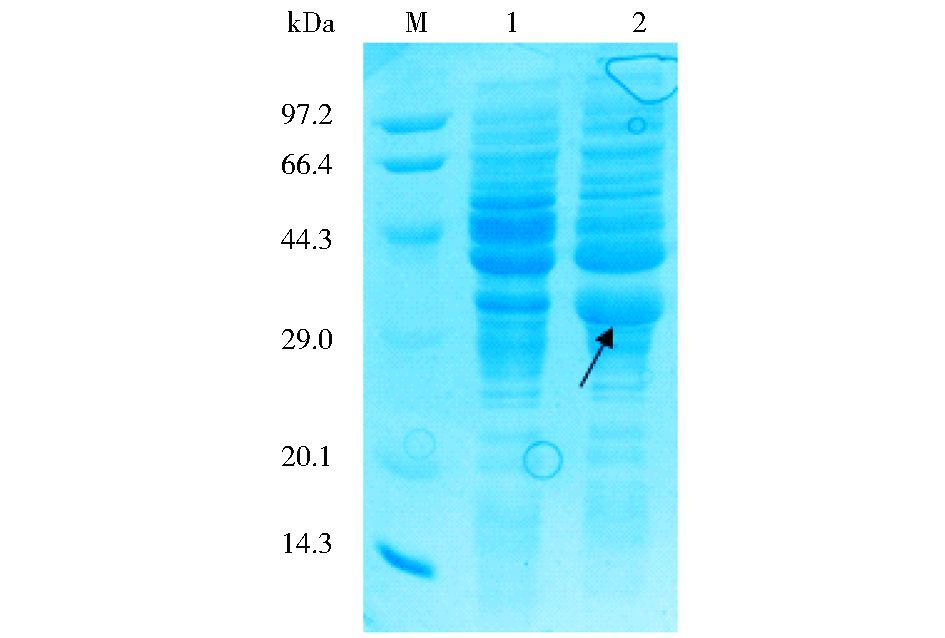
|
| 图 1 重组Trx/IL-33融合蛋白的诱导表达 Figure 1 The expression of recombinant Trx/IL-33 fusion protein M: Molecular markers; 1:Pre-induction with IPTG; 2:Post induction |
超声破碎上清经Q-sepharose FF阴离子交换层析可以得到初步纯化的目的蛋白 (图 2),纯度达到75%以上。根据电泳结果,将纯度相近的自动部分收集器收集的融合蛋白样品合并,进一步经过Ni++-Sepharose FF亲和层析纯化,纯度可以达到90%以上 (图 3)。
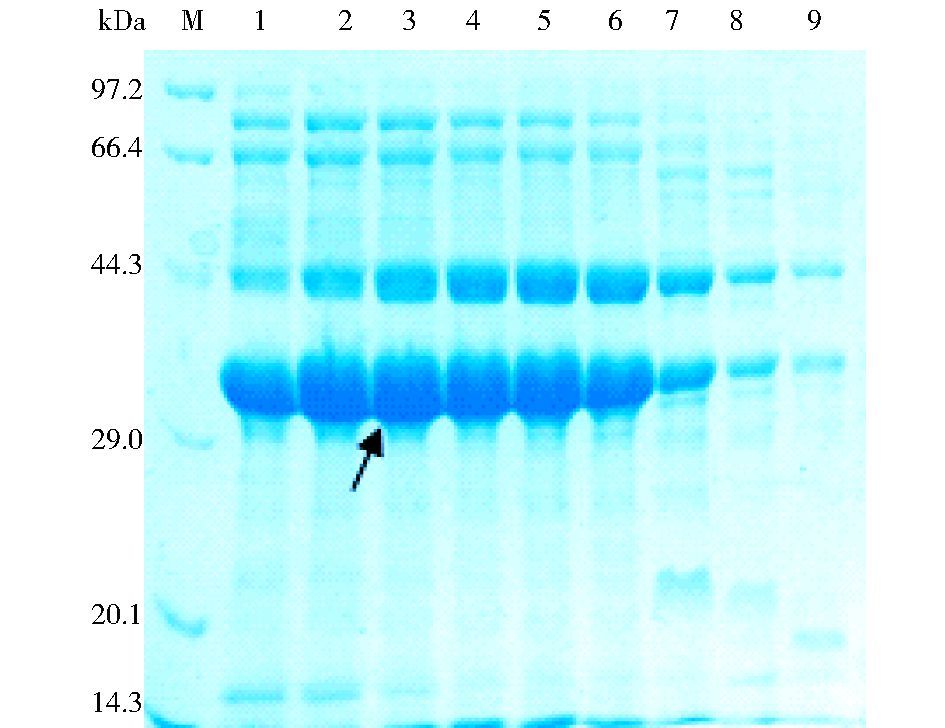
|
| 图 2 重组Trx/IL-33融合蛋白经Q-sepharose FF离子交换纯化 Figure 2 Purification of recombinant Trx/IL-33 fusion protein with Q-Sepharose FF ionic exchange chromatography M: Molecular makers; 1~9: Eluted protein samples |
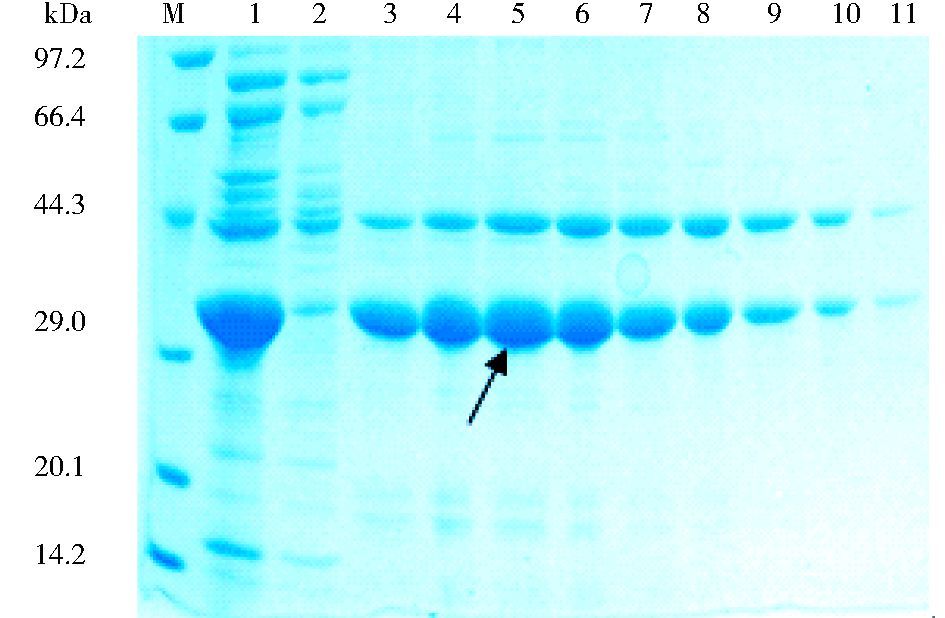
|
| 图 3 重组Trx/IL-33融合蛋白经Ni++-Sepharose FF亲和层析纯化 Figure 3 Purification of recombinant Trx/IL-33 fusion protein with Ni++-Sepharose FF affinity chromatography M: Molecular markers; 1~11: Eluted protein samples |
将纯化的Trx/IL-33融合蛋白用肠激酶处理,预计切割为硫氧化蛋白与成熟形式的IL-33,经Ni++-Sepharose FF亲和层析纯化后,硫氧还蛋白等被吸附到柱子上,而非融合的IL-33成熟蛋白直接穿过柱子。经SDS-PAGE分析,得到了纯的IL-33成熟蛋白,目的蛋白的表观分子量与预期的17.38kDa相符 (图 4)。
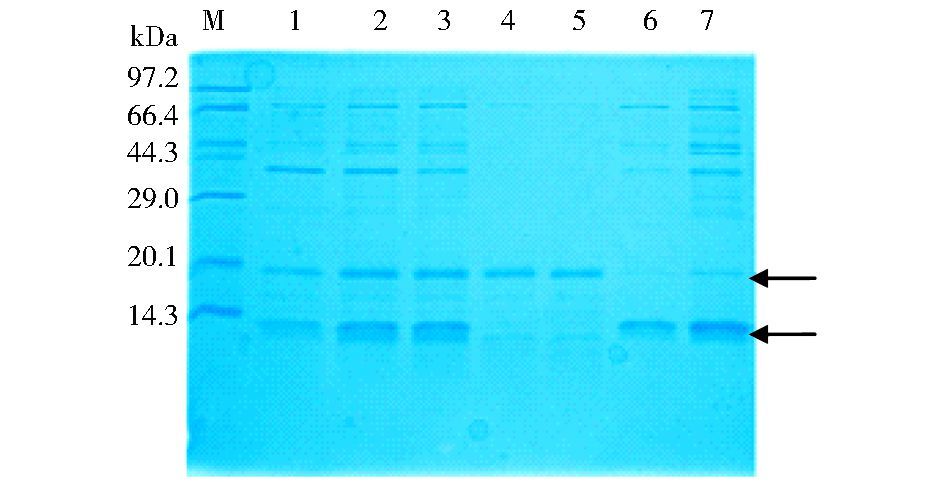
|
| 图 4 经肠激酶切割处理融合蛋白Trx/IL-33及Ni++-Sepharose FF亲和层析获得成熟形式的IL-33 Figure 4 Purification of mature IL-33 from Trx/IL-33 fusion protein after enterokinase treatment and Ni++-Sepharose FF chromatography M: Molecular markers; 1~3:Trx/IL-33 fusion protein after enterokinase treatment; 4~5:The flow-through samples from Ni++-Sepharose FF chromatography of enterokinase-treated fusion protein; 6~7:The thioredoxin and impure protein absorbed in the Ni++-Sepharose FF chromatography |
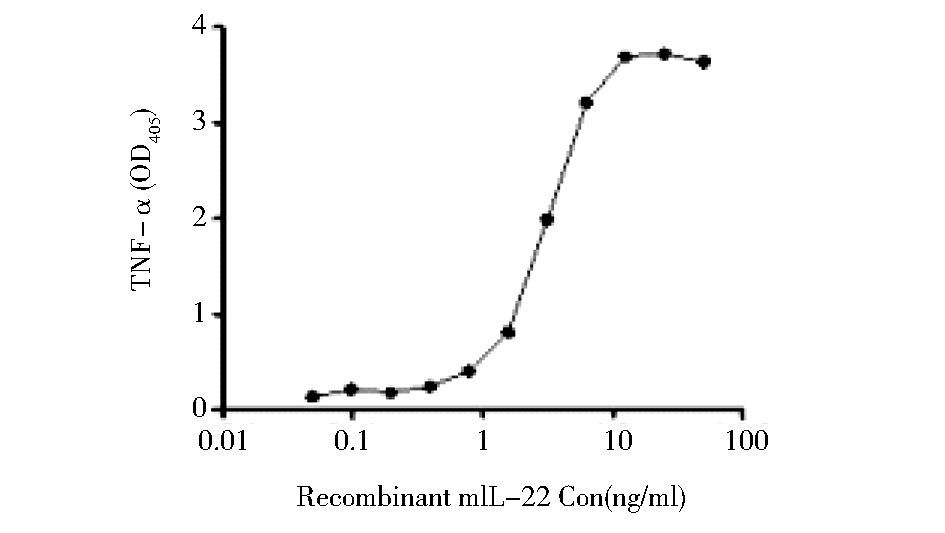
将商业化途径获得的重组IL-33及纯化制备的Trx/IL-33与成熟形式IL-33从50ng/μl开始倍比稀释,刺激培养的Raw264.7巨噬细胞,通过ELISA检测培养上清中TNF-α水平。以IL-33标准品刺激结果绘图作为代表显示IL-33刺激Raw264.7产生TNF-α的剂量效应 (图 5)。结果显示,IL-33标准品、Trx/IL-33融合蛋白、成熟形式IL-33的EC50值分别为3.037 ng/ml、12.97 ng/ml、1.186 ng/ml,表明纯化的IL-33成熟蛋白具有与商业化重组IL-33相当的细胞生物学活性。
|
| 图 5 ELISA检测IL-33刺激Raw264.7细胞产生TNF-α的剂量效应 Figure 5 Dose dependent production of TNF-α by Raw264.7 cells stimulated with recombinant IL-33 |
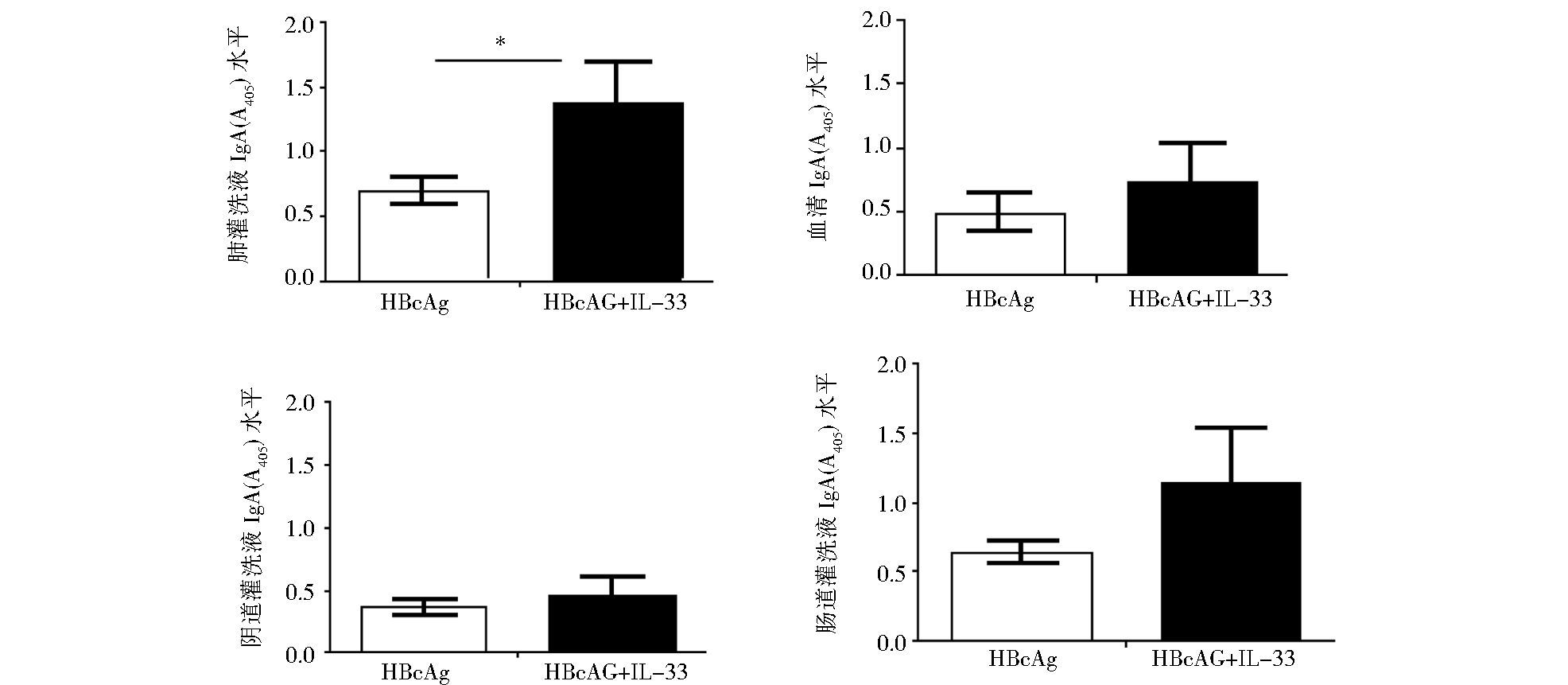
采集经滴鼻免疫小鼠的支气管肺泡灌洗液 (BALF),血清,阴道灌洗液,肠灌洗液样品,以ELISA检测HBcAg特异的IgA水平。结果显示 (图 6),HBcAg作为模式抗原经鼻免疫小鼠后,在不同粘膜组织及血清中都诱导产生了特异的IgA抗体应答。以IL-33作为佐剂,可以增强HBcAg特异的IgA的水平,经Student t检验分析表明在BALF中IL-33显著增加了HBcAg特异的IgA水平,具统计学意义 (P<0.05, n = 4 /组)。
|
| 图 6 经滴鼻免疫的小鼠不同粘膜组织中HBcAg特异的IgA应答 Figure 6 HBcAg-specific IgA responses to intranasal immunization in multiple mucosal tissues and serum |
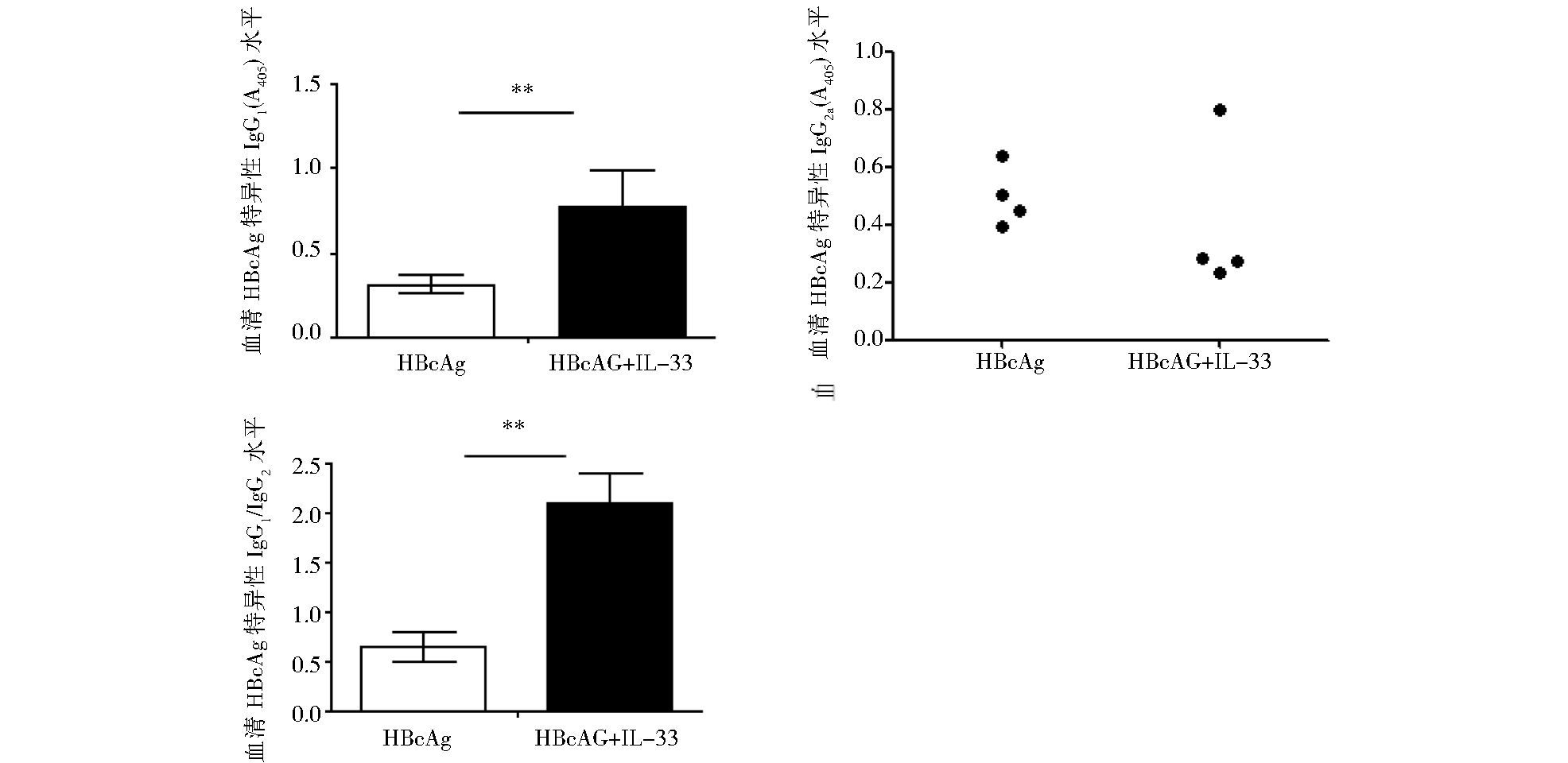
ELISA检测血清中HBcAg特异的IgG1和IgG2a的结果显示 (图 7),经滴鼻进行HBcAg粘膜免疫,可诱导系统的特异性IgG1和IgG2a抗体应答。以IL-33作为佐剂,显著促进IgG1的水平增高 (Student t检验,P<0.01, n = 4 /组),而对IgG2a有轻微下调,导致IgG1/IgG2a比值显著增高 (Student t检验,P<0.01, n=4/组),提示IL-33作为佐剂经鼻粘膜免疫可调控Th1/Th2平衡,促进Th2样免疫应答。
|
| 图 7 血清中HBcAg特异的IgG1、IgG2a应答 Figure 7 HBcAg-specific IgG1 and IgG2a responses in serum |
进一步分析粘膜组织中HBcAg特异的IgG1和IgG2a水平,结果显示 (图 8),以IL-33作为佐剂,可显著促进BALF中IgG1水平,而同时显著下调IgG2a(Student t检验,P<0.01, n = 4 /组),提示IL-33作为佐剂经鼻粘膜免疫调控了Th1/Th2平衡,可促进Th2而抑制Th1样免疫应答。

|
| 图 8 BALF中HBcAg特异的IgG1、IgG2a应答 Figure 8 HBcAg-specific IgG1 and IgG2a responses in BALF |
IL-33具有显著的免疫调控作用,尤其作为“警报素”在组织损伤和病原侵入早期即产生应答,进而诱发机体免疫应答。IL-33对DCs、巨噬细胞、T细胞等重要免疫细胞的显著作用,提示其具有分子免疫佐剂的应用潜能。近来有文献报道IL-33在肿瘤疫苗研究中可显著提升肿瘤抗原特异的细胞免疫应答,展示了其促Th1/CTLs应答的潜能[12-13]。然而,很多研究也显示IL-33作用于II型固有淋巴细胞、Th2细胞、以及2型巨噬细胞等,在2型免疫的促发、维持、发展中发挥着极为关键的作用。因此,IL-33是促进Th1/CTLs应答还是Th2应答,可能取决于具体的组织与病理生理条件。因此,本研究旨在更多了解IL-33的免疫佐剂活性与特点。
粘膜是病原体侵入机体的重要途径,同时诱导粘膜及系统的全面免疫应答,应该能够提供较之单独诱导系统免疫更为有效的保护。因此,粘膜免疫及其诱导的研究具有重要意义。然而,目前尚缺乏安全有效的粘膜免疫佐剂,限制了经粘膜免疫接种诱导全面免疫应答的这一策略的有效应用。考虑到IL-33在呼吸道上皮中的组成型表达,及其关键的“警报素”效应,我们推测IL-33具有作为粘膜免疫佐剂的潜能。
首先,我们利用基因重组的方式,通过融合蛋白表达策略促进IL-33表达水平及有效折叠,经离子交换与金属螯合亲和层析两种不同分离纯化机理的层析,组合作用下使融合蛋白获得有效纯化。进一步,通过肠激酶处理,使硫氧还蛋白与IL-33成熟蛋白分离,再经过金属螯合亲和层析获得IL-33。理论上,金属螯合亲和层析获得的融合蛋白样品经肠激酶处理后,只有释放的IL-33不被亲和层析柱子吸附,因而可得到有效纯化。通过这样的技术流程,我们制备了大量高活性的重组IL-33蛋白,为进一步的小鼠免疫研究提供了基础。
Ag可在大肠杆菌中高效表达,并有效装配为病毒样颗粒。本课题组利用HBcAg作为载体,有效呈递了多个抗原表位,诱导了特异的体液与细胞免疫应答,在疾病模型中进行了有效的干预[11]。因此,在本研究中我们采用HBcAg作为模式抗原,考察IL-33潜在的免疫佐剂作用与特点。经滴鼻免疫,研究发现IL-33显著增强了特异IgA的应答。同时,IL-33显著提升了IgG1的水平,而抑制了IgG2a, 提示IL-33调控了Th1/Th2的平衡,其促Th2应答作用与研究报道的IL-33是重要的Th2应答推动者相符。此外,本实验室先前的研究显示,在哮喘模型中,以呈现IL-33分子的HBcAg免疫小鼠诱导特异的IL-33中和抗体,拮抗过敏原诱导的IL-33过度积累,可抑制Th2型过敏性炎症应答,增强了Th1与IgG2a应答,这与本研究IL-33促2型应答的结果一致。
总之,本研究实现了高活性IL-33的有效制备,并显示IL-33增强粘膜免疫抗体应答,具有粘膜免疫佐剂的应用前景,同时,具备调控Th1/Th2应答的特点。
致谢 感谢协和高校科研业务团队 (2012N08)、协和青年基金和中央高校基本科研业务费专项基金 (3332015047) 对本研究的资助。| [1] | Schmitz J, Owyang A, Oldham E, et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines. Immunity, 2005, 23(5) : 479–490. DOI:10.1016/j.immuni.2005.09.015 |
| [2] | Moussion C, Ortega N, Girard J P. The IL-1-like cytokine IL-33 is constitutively expressed in the nucleus of endothelial cells and epithelial cells in vivo:a novel 'alarmin'. PLoS One, 2008, 3(10) : e3331. DOI:10.1371/journal.pone.0003331 |
| [3] | Komai-Koma M, Xu D, Li Y, et al. IL-33 is a chemoattractant for human Th2 cells. Eur J Immunol, 2007, 37(10) : 2779–2786. DOI:10.1002/(ISSN)1521-4141 |
| [4] | Su Z, Lin J, Lu F, et al. Potential autocrine regulation of interleukin-33/ST2 signaling of dendritic cells in allergic inflammation. Mucosal Immunology, 2013, 6(5) : 921–930. DOI:10.1038/mi.2012.130 |
| [5] | Luzina I G, Pickering E M, Kopach P, et al. Full-length IL-33 promotes inflammation but not Th2 response in vivo in an ST2-independent fashion. Journal of Immunology, 2012, 189(1) : 403–410. DOI:10.4049/jimmunol.1200259 |
| [6] | Bourgeois E, Van L P, Samson M, et al. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur J Immunol, 2009, 39(4) : 1046–1055. DOI:10.1002/eji.v39:4 |
| [7] | Bonilla W V, Frohlich A, Senn K, et al. The alarmin interleukin-33 drives protective antiviral CD8+ T cell responses. Science, 2012, 335(6071) : 984–989. DOI:10.1126/science.1215418 |
| [8] | Gao X, Wang X, Yang Q, et al. Tumoral expression of IL-33 inhibits tumor growth and modifies the tumor microenvironment through CD8+ T and NK cells. Journal of Immunology, 2015, 194(1) : 438–445. DOI:10.4049/jimmunol.1401344 |
| [9] | Villarreal D O, Wise M C, Walters J N, et al. Alarmin IL-33 acts as an immunoadjuvant to enhance antigen-specific tumor immunity. Cancer Res, 2014, 74(6) : 1789–1800. DOI:10.1158/0008-5472.CAN-13-2729 |
| [10] | Froidure A, Vandenplas O, D'Alpaos V, et al. Persistence of asthma following allergen avoidance is associated with proTh2 myeloid dendritic cell activation. Thorax, 2015, 70(10) : 967–973. DOI:10.1136/thoraxjnl-2014-206364 |
| [11] | Chu Xiaojie, Li Yang, Long Qiong, et al. Development of a HPV16 E7 CTLs peptides-based virus-like particle therapertic vaccine. China Biotechnology, 2015, 35(2) : 45–51. |
| [12] | Gao K, Li X, Zhang L, et al. Transgenic expression of IL-33 activates CD8(+) T cells and NK cells and inhibits tumor growth and metastasis in mice. Cancer Letters, 2013, 335(2) : 463–471. DOI:10.1016/j.canlet.2013.03.002 |
| [13] | Bagarazzi M L, Yan J, Morrow M P, et al. Immunotherapy against HPV16/18 generates potent TH1 and cytotoxic cellular immune responses. Science Translational Medicine, 2012, 4(155) : 138. |
 2017, Vol. 37
2017, Vol. 37




