文章信息
- 刘雁霞, 樊振川.
- LIU Yan-Xia, FAN Zhen-Chuan.
- 莱茵衣藻LZTFL1蛋白的多克隆抗体制备及应用
- Polyclonal Antibody Preparation and Application of C.reinhardtii LZTFL1 Protein
- 中国生物工程杂志, 2017, 37(11): 109-115
- China Biotechnology, 2017, 37(11): 109-115
- http://dx.doi.org/DOI:10.13523/j.cb.20171115
-
文章历史
- 收稿日期: 2017-05-08
- 修回日期: 2017-07-12
莱茵衣藻(C. reinhardtii)是一种结构简单的单细胞真核藻类,是目前国内外研究纤毛结构、组装及功能的主要模式生物之一[1]。纤毛根据其运动状态分为运动纤毛和原生纤毛,运动纤毛是由“9+2”型微管蛋白骨架形成的从细胞基体部位伸出的较长细胞突起,原生纤毛由“9+0”型微管蛋白骨架形成,通常所研究纤毛都为运动纤毛。纤毛具有协调细胞生长和进行细胞信号转导的作用,纤毛缺失或信号转导功能障碍会造成一系列的疾病,目前已发现许多纤毛基因的缺失或突变导致一系列纤毛病,如肾囊肿、肝脏纤维化、视网膜变性、先天性心脏病、肥胖等都与纤毛缺陷有关,而由纤毛缺陷引起的人类疾病数量正在迅速增长[2]。因此了解纤毛的功能、组装原理及信号通路可以为纤毛病的诊断和治疗提供分子依据。从20世纪90年代以来,人们对纤毛的研究逐步加深,从纤毛结构的研究到纤毛组装、功能、纤毛蛋白间的相互作用、纤毛信号转导及纤毛与疾病间的关系均取得了一定进展。已知纤毛内存在一种BBSome复合物,BBSome依赖于纤毛内运输机制(IFT)由IFT蛋白携带运送至纤毛顶端,参与完成纤毛的组装,BBSome的基因突变或基因缺失也会引起一系列纤毛类疾病,这种由BBSome引起的各类疾病,统称为“巴德-毕氏综合征”(Bardet-Biedl syndrome,BBS),其典型症状为肥胖、精神紊乱、失明等[3]。另有研究表明,IFT27功能一旦缺失会导致纤毛内BBSome无法输出,造成BBSome在纤毛内的积累,进而引发毕氏综合征,由此可见,IFT蛋白与BBSome之间可能存在直接或间接的联系,目前尚未可知。
在动物实验研究中,亮氨酸拉链转录因子1(LZTFL1)编码基因位于3号染色体3p21.3区域,与毕氏综合征有密切关系,是迄今为止发现的第17个与BBS有关的基因,因此又被称为BBS17,Lztfl1基因5个碱基的缺失便会引起BBS[4-11];Lztfl1基因突变会引发恶性肿瘤,继而发展为癌症,如肺癌、胃癌等[12-13]。另外,在人体及小鼠的实验研究中,敲除Lztfl1基因会导致纤毛内BBSome的累积[14-18],与ift基因缺陷对BBSome造成的影响一致,动物临床表现为小鼠体重增加及引起失明[12],由此可判断,BBSome、LZTFL1与IFT三种蛋白质间存在一定相互作用,Seo等[15]已经证实LZTFL1在小鼠体内与BBS9直接作用,而与IFT蛋白的作用至今没有明确数据证实,有研究者猜测IFT27与BBSome之间可能是通过LZTFL1蛋白连接[14],从而实现BBSome与IFT蛋白之间的相互作用的。
为进一步研究BBSome与IFT蛋白的作用方式,验证两者是否通过LZTFL1蛋白作为连接桥梁实现间接联系,特制备检测莱茵衣藻内LZTFL1蛋白的多克隆抗体,实验以C.reinhardtii CC125总RNA为模板,采用RT-PCR技术扩增Lztfl1基因片段,克隆至原核表达载体pET-28a (+),诱导表达融合蛋白6×His-LZTFL1,并以此纯化产物制备多克隆抗体,为进一步研究LZTFL1的生物学功能及其与莱茵衣藻中的蛋白质的相互作用奠定基础。
1 材料与方法 1.1 实验材料 1.1.1 菌株及质粒克隆表达载体pET-28a (+)、感受态细胞E. coli XL1-blue、感受态细胞E. coli BL21 (DE3)、C. reinhardtii CC125均由本实验室保存。
1.1.2 实验试剂限制性内切核酸酶(EcoRI/XhoI)、T4 DNA连接酶及蛋白质Marker等均购自美国Thermo公司;DNA Marker购自北京全式金公司;质粒小提试剂盒及琼脂糖凝胶回收试剂盒购自北京索来宝科技有限公司;抗体纯化介质(Protein A SepharoseTM CL-4B)及亲和纯化介质(Ni SepharoseTM 6 Fast Flow)购自美国GE Healthcare公司;硝酸纤维素膜(NC膜)购自美国PALL公司;弗式完全佐剂及弗氏不完全佐剂购自美国Sigma公司;His-tag抗体购自碧云天生物技术研究所;HRP标记的羊抗兔/鼠抗体购自美国Jackson公司;荧光标记的羊抗兔二抗,羊抗小鼠二抗购买自美国Sigma公司;ECL化学发光显色液购买自德国Millipore公司;其他药品试剂均为国产分析纯。
1.1.3 实验动物实验用雄性新西兰大白兔1只,3~4月龄,体重1.5~2.0kg,由天津欧阳实验种兔场提供。
1.2 实验方法 1.2.1 重组表达质粒pET-28a (+)-Lztfl1的构建利用基因库Phytozome查找Lztfl1的cDNA序列,长度为981bp,设计引物序列如表 1所示(下划线部分为XhoI限制性内切核酸酶切位点),由北京奥科鼎盛生物有限公司合成。Lztfl1 cDNA全基因序列来源于C. reinhardtii CC125,通过Trizol法提取莱茵衣藻总RNA,反转录为cDNA。以cDNA为模板,分别以上游引物、下游引物进行PCR扩增。PCR反应条件为:95℃预变性5min;95℃变性45s,52℃退火45s,72℃延伸2min,共30个循环;72℃终延伸10min。将纯化后的PCR产物及表达载体pET-28a(+)用EcoRI和XhoI双酶切,分别回收大小为981bp的PCR产物目的片段和5 344bp的载体片段,利用T4 DNA连接酶进行4℃过夜连接,同时设置不含目的片段的对照组;将连接产物及对照组转化至感受态细胞E. coli XL1-blue,在含有卡纳抗生素(100μg/ml)的LB平板上37℃过夜培养14~16h;挑取阳性克隆继续培养过夜,提取质粒,进行EcoRI/XhoI双酶切验证,将验证结果为阳性的质粒进行测序。
| Primer name | Primer sequence (5′-3′) |
| Forward | CCGAATTCATGTCAATACAACTC |
| Reverse | GGCTCGAGCTAGGCGGTGTCTGC |
1.2.2 融合蛋白6×His-LZTFL1诱导表达
将测序正确的重组质粒pET-28a(+)-Lztfl1进行诱导表达,诱导方法参照文献中报道[18],设定诱导温度为25℃,IPTG浓度为0.2mmol/L。经4℃、6 000g离心15min,收集菌体,加入裂解液/结合液(20mmol/L NaH2PO4,0.5mol/L NaCl,20mmol/L咪唑,pH=7.4)将菌体重悬(20ml裂解液重悬200ml菌体),超声破碎细胞,获得全蛋白质;分别收集部分全蛋白质,上清和沉淀,进行12% SDS-PAGE,鉴定表达融合蛋白是在上清中还是在沉淀中[19];同时采用蛋白质免疫印迹方法鉴定所诱导蛋白质是否为目的蛋白[20]。
1.2.3 融合蛋白6×His-LZTFL1纯化将诱导表达后的菌体离心收集,加入裂解液/结合液(20mmol/L NaH2PO4,0.5mol/L NaCl,20mmol/L咪唑)超声波破碎,将上清液过0.22μm滤膜后与1ml Ni SepharoseTM 6 Fast Flow填料4℃结合过夜;收集流穿液,用5倍柱体积的洗涤缓冲液(同结合液)洗涤,去杂蛋白;再用和柱体积相同的洗脱缓冲液(20mmol/L NaH2PO4,0.5mol/L NaCl,60mmol/L咪唑,pH=7.4)依次洗脱5次。将纯化后的融合蛋白冻干,经PBS溶解为1mg/ml,存-80℃备用。
1.2.4 动物免疫实验首次免疫,取1ml融合蛋白与1ml弗氏完全佐剂完全混合,采用颈背部多点皮下注射法免疫新西兰大白兔,免疫前,经兔耳动脉采血100μl作为阴性对照血清。每隔10天加强1次免疫,共加强免疫4次,加强免疫取1ml融合蛋白与1ml弗氏不完全佐剂混合,免疫剂量及途径同初免。末次免疫一周后,经耳动脉采血100μl[21],分离血清,间接ELISA法测定抗血清效价。将效价合格的家兔经股动脉采血,分离血清,于-80℃冻存。
1.2.5 多克隆抗体效价的测定采用间接ELISA法测定抗体效价[18],将纯化后的融合蛋白4℃包被过夜,用5%的脱脂乳粉封闭;一抗为按照1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:32 000、1:64 000、1:128 000、1:256 000、1:512 000稀释的抗血清及阴性对照血清;二抗为HPR标记的羊抗兔抗体IgG(1:20 000稀释),用TMB显色,酶标仪测定450nm处吸光度值。若试验组抗血清OD450/阴性对照组抗血清OD450≥2.1判为阳性,则其最高稀释度便为抗血清的效价。
1.2.6 多克隆抗体纯化及检测采用纯化介质Protein A SepharoseTM CL-4B纯化抗血清[19],将纯化后的抗血清稀释至1mg/ml后,置-80℃保存。
采用Western blot法检测抗体特异性,取20μg经过蛋白质定量处理的莱茵衣藻上清蛋白质,加入上样缓冲液后,进行12% SDS-PAGE,电转至NC膜,封闭后以1:400的稀释比孵育多克隆抗体,二抗采用HRP标记的羊抗兔IgG(1:10 000稀释),进行ECL显色。
1.2.7 莱茵衣藻中LZTFL1蛋白的定位分别取对数期生长的野生型藻种CC-125和在LZTFL1蛋白C端添加GFP标签的转基因藻种进行双重验证,转基因藻种通过莱茵衣藻电转化法[17]获得,将质粒Lztfl1∷GFP∷Paro转入野生型藻种CC125核基因组,通过抗性标记筛选阳性克隆,通过Western blot验证阳性克隆。
采用免疫荧光技术对莱茵衣藻内LZTFL1蛋白进行定位分析,固定制片后,于室温下利用牛血清白蛋白(BSA)封闭1h,分别采用纯化后的LZTFL1多克隆抗体(1:10稀释比)和商业化GFP抗体(1:10稀释比)室温孵育4h,采用荧光标记羊抗兔/小鼠二抗室温孵育1h,封片后在荧光显微镜下拍照。
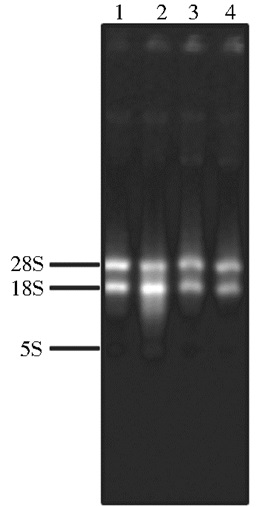
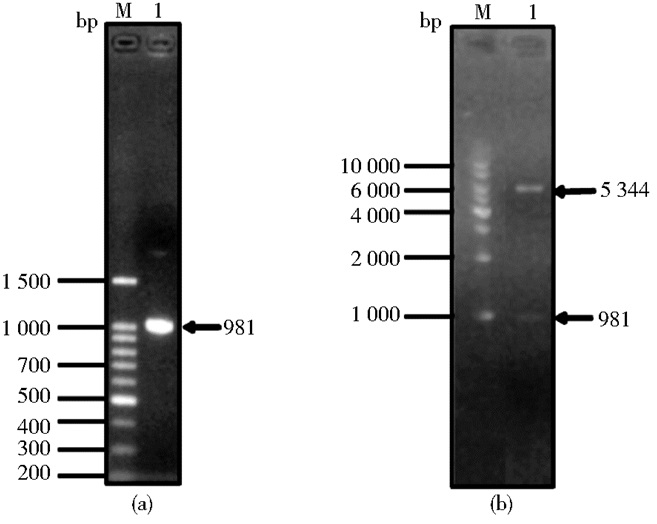
2 结果与分析 2.1 重组质粒pET-28a (+)-Lztfl1的构建通过RT-PCR扩增获得981bp的Lztfl1基因,连接至载体后,转化挑取单克隆提质粒并酶切验证。图 1显示C. reinhardtii CC125总RNA提取结果;图 2a显示PCR扩增产物,条带单一且大小正确;图 2b显示重组表达质粒pET-28a (+)-Lztfl1阳性克隆双酶切验证结果,验证大小与预期结果一致,经测序验证结果正确,说明表达载体pET-28a(+)-Lztfl1构建成功。
|
| 图 1 C. reinhardtii CC125总RNA的提取 Figure 1 Total RNA extract of C. reinhardtii CC125 1~4: The different tube of the total RNA |
|
| 图 2 Lztfl1 PCR扩增及重组质粒双酶切 Figure 2 PCR amplification of Lztfl1 and identification of recombinant expression plasmid by restriction enzyme digestion (a) PCR verification of Lztfl1 gene. M: 100bp DNA Marker; 1: PCR product of Lztfl1 gene (b) Restriction digestion analysis of pET-28a(+)-Lztfl1 M: 1kb marker; 1: pET-28a(+)-Lztfl1 digested with EcoRI and XhoI |
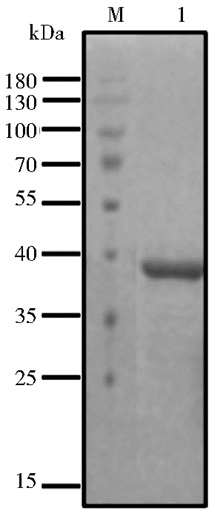
融合蛋白6×His-LZTFL1由DNAMan预测大小约38kDa,添加IPTG诱导后,经SDS-PAGE分析显示(图 3a),在35kDa有明亮条带,且融合蛋白大多存在于上清中;进一步经蛋白质免疫印迹用His-tag抗体检测证实该蛋白质确定为目标蛋白(图 3b);将纯化后的蛋白质冻干溶于PBS中,纯度可达90%以上,可作为免疫抗原(图 4)。

|
| 图 3 SDS-PAGE及蛋白质免疫印迹检测重组蛋白在E. coli BL21 (DE3)中的表达 Figure 3 SDS-PAGE and Western blot analysis of the expression of recombinant protein in E. coli BL21 (DE3) (a) Expression of the recombinant protein 6×His-LZTFL1 M: Protein marker 1: The total protein of BL21 lysates with 6×His-LZTFL1 before induced; 2: The total protein of BL21 lysates with 6×His-LZTFL1 after induced; 2: The supernatant of BL21 lysates with 6×His-LZTFL1 before induced; 3: The sediment of BL21 lysates with 6×His-LZTFL1 (b) Western blot analysis with anti-His-tag The lane isas same as (a) |
|
| 图 4 SDS-PAGE分析纯化产物 Figure 4 SDS-PAGE analysis of the purified 6×His-LZTFL1 recombinant protein by affinity purification M: Protein marker; 1: Purified 6×His-LZTFL1 recombinant protein |
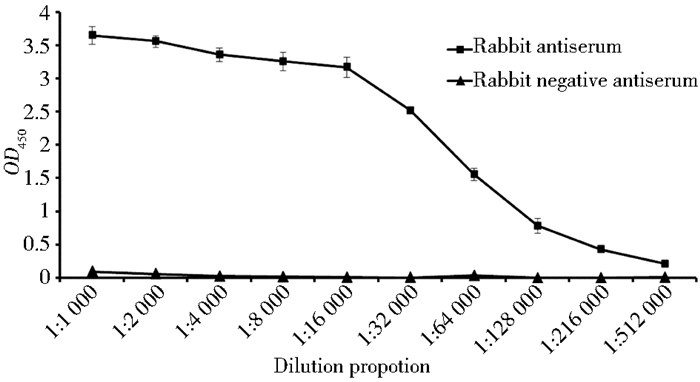
抗血清检测参照纤毛内运输蛋白IFT46抗体制备方法[19],采用间接ELISA法测定,抗血清滴定度达到1:512 000(图 5),Western blot分析显示,纯化后的抗血清在35kDa处可见特异性结合条带,由此可知抗血清可与莱茵衣藻LZTFL1蛋白发生特异性结合(图 6),表明所制备的多克隆抗体特异性良好。
|
| 图 5 间接ELISA法测定抗血清效价 Figure 5 Determination of anti-LZTFL1 polyclonal antiserum by indirect ELISA |

|
| 图 6 免疫印迹法验证抗血清特异性 Figure 6 The specificity and sensitivity of LZTFL1 anti-serum against C. reinhardtii by western blot The wide-type C. reinhardtii CC125 was probed with affinity purified anti-LZTFL1, in contrast, the pre-immune werum with no specific band. α-Tubulin as the internal reference |
采用电转化法获得LZTFL1-GFP转基因藻种,转化效率可达10%,利用GFP抗体通过Western blot初筛有信号的阳性克隆,融合蛋白大小约62kDa,从信号克隆中复筛高表达量藻种,利用表达量最高的藻种进行免疫荧光实验,图 7(a)为野生型藻种CC125与转基因藻种LZTFL1-GFP考马斯亮蓝染色,作为上样对照;图 7(b)为利用GFP抗体检测结果。
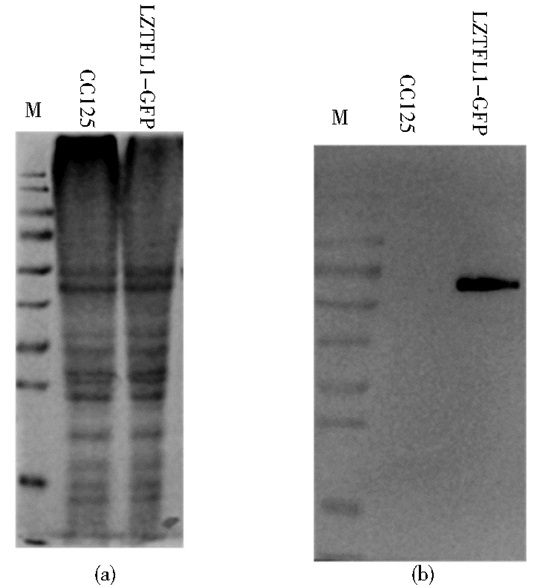
|
| 图 7 LZTFL1-GFP转基因藻种筛选 Figure 7 Screening of transgenic algae species of LZTFL1-GFP |
通过免疫荧光技术对莱茵衣藻LZTFL1蛋白进行定位分析(图 8),通过荧光信号看出多克隆抗体可以与莱茵衣藻内的LZTFL1蛋白进行特异性结合,且该蛋白质可以进入莱茵衣藻纤毛内,该蛋白质在细胞和纤毛中均有分布,图 8(a)显示野生型藻种中LZTFL1蛋白在纤毛中有红色荧光信号;图 8(b)显示在转基因藻种中利用GFP抗体可检测到纤毛内的绿色荧光信号。
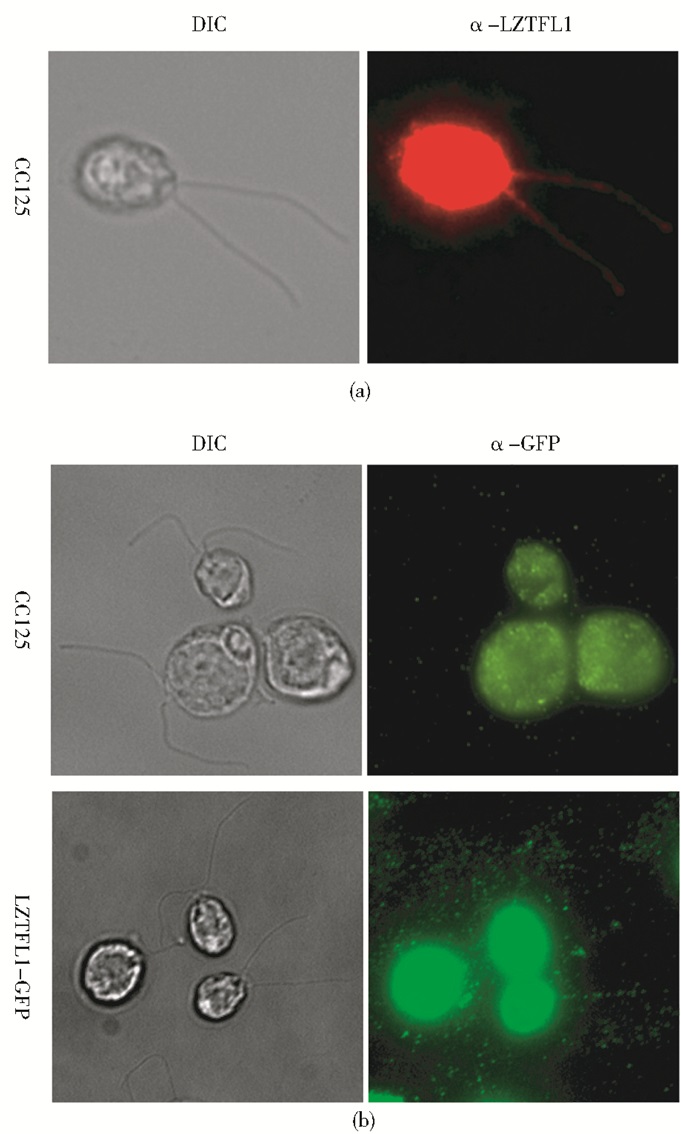
|
| 图 8 免疫荧光检测LZTFL1蛋白在莱茵衣藻纤毛中的定位 Figure 8 Immunofluorescence analysis the flagella localization of LZTFL1 (a) The polyclonal antibody of LZTFL1 as the primary antibody, it showed that LZTFL1 is localized along the flagella (b) The antibody of GFP as the primary antibody, it showed that LZTFL1 is localized along the flagella as punctuated dots |
抗体是研究蛋白质之间相互作用及共定位的必备工具,而使用原核生物制备多克隆抗体是实验室获得所需抗体的常用手段之一。本实验室常用的原核表达载体主要有pET、pMAL、pGEX三大系列载体,pET系列载体含有6个组氨酸编码序列,可与外源蛋白融合表达后带有6个组氨酸的纯化标签,整个标签大小约为4.3kDa,一般不会影响蛋白质的结构和功能;另外,通过组氨酸与金属离子(Ni2+)的螯合作用,对表达蛋白质进行亲和纯化的方法体系日渐完善,因此本次实验优先选择pET-28a(+)作为表达载体。
在诱导表达过程中,认为对温度及IPTG浓度的控制是诱导能否成功的关键所在。高温诱导融合蛋白虽然表达量较高,但易于形成包涵体,变性后的蛋白质由于其空间结构破坏,产生的抗体不利于后期实验研究,如免疫荧光。本次实验6×His-LZTFL1融合蛋白经诱导后主要存在于上清中,所制备的抗体不仅可用于Western blot,同时也可用于免疫荧光实验。由于目前没有LZTFL1蛋白抗体制备的报道,本实验室首次得到该抗体,为后期对莱茵衣藻LZTFL1蛋白在纤毛信号转导中所发挥的作用研究奠定了基础。
另外,在免疫荧光实验中,利用LZTFL1多克隆抗体得到的结果不及利用GFP抗体在转基因藻种上得到的效果明显,一方面可能由于制备的多克隆抗体相对于商业化的GFP抗体较差;另一方面可能由于转基因藻种存在基因过表达现象,以及利用抗体将信号放大,从而使得检测效果较为明显。
| [1] |
Merchant Sabeeha S, Prochnik Simon E, Vallon O, et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions. Science, 2007, 318(5848): 245-250. DOI:10.1126/science.1143609 |
| [2] |
Badano J L, Mitsuma N, Beales P L, et al. The ciliopathies:an emerging class of human disorders. Annu Rev Genomics Hum Genet, 2006, 7: 125-148. DOI:10.1146/annurev.genom.7.080505.115610 |
| [3] |
Aldahmesh M A, Li Y, Alhashem A, et al. IFT27, encoding a small GTPase component of IFT particles, is mutated in a consanguineous family with Bardet-Biedl syndrome. Hum Mol Genet, 2014, 23(12): 3307-3315. DOI:10.1093/hmg/ddu044 |
| [4] |
Schaefer E, Lauer J, Durand M, et al. Mesoaxial polydactyly is a major feature in Bardet-Biedl syndrome patients with LZTFL1(BBS17) mutations. Clin Genet, 2014, 85(5): 476-481. DOI:10.1111/cge.2014.85.issue-5 |
| [5] |
Forsythe E, Beales P L. Bardet-Biedl syndrome. Eur J Hum Genet, 2013, 21(1): 8-13. DOI:10.1038/ejhg.2012.115 |
| [6] |
Marion V, Stutzmann F, Gerard M, et al. Exome sequencing identifies mutations in LZTFL1, a BBSome and smoothened trafficking regulator, in a family with Bardet——Biedl syndrome with situs inversus and insertional polydactyly. J Med Genet, 2012, 49(5): 317-321. DOI:10.1136/jmedgenet-2012-100737 |
| [7] |
Marion V, Mockel A, De Melo C, et al. BBS-induced ciliary defect enhances adipogenesis, causing paradoxical higher-insulin sensitivity, glucose usage, and decreased inflammatory response. Cell Metab, 2012, 16(3): 363-377. DOI:10.1016/j.cmet.2012.08.005 |
| [8] |
Zhang Q, Nishimura D, Seo S, et al. Bardet-Biedl syndrome 3(Bbs3) knockout mouse model reveals common BBS-associated phenotypes and Bbs3 unique phenotypes. Proc Natl Acad Sci U S A, 2011, 108(51): 20678-20683. DOI:10.1073/pnas.1113220108 |
| [9] |
Yen H J, Tayeh M K, Mullins R F, et al. Bardet-Biedl syndrome genes are important in retrograde intracellular trafficking and Kupffer's vesicle cilia function. Hum Mol Genet, 2006, 15(5): 667-677. DOI:10.1093/hmg/ddi468 |
| [10] |
Mykytyn K, Mullins R F, Andrews M, et al. Bardet-Biedl syndrome type 4(BBS4)-null mice implicate Bbs4 in flagella formation but not global cilia assembly. Proc Natl Acad Sci USA, 2004, 101(23): 8664-8669. DOI:10.1073/pnas.0402354101 |
| [11] |
Kim J C, Badano J L, Sibold S, et al. The Bardet-Biedl protein BBS4 targets cargo to the pericentriolar region and is required for microtubule anchoring and cell cycle progression. Nat Genet, 2004, 36(5): 462-470. DOI:10.1038/ng1352 |
| [12] |
Jiang J, Promchan K, Jiang H, et al. Depletion of BBS protein LZTFL1 affects growth and causes retinal degeneration in mice. J Genet Genomics, 2016, 43(6): 381-391. DOI:10.1016/j.jgg.2015.11.006 |
| [13] |
Kiss H, Kedra D, Kiss C, et al. The LZTFL1 gene is a part of a transcriptional map covering 250 kb within the common eliminated region 1(C3CER1) in 3p21.3. Genomics, 2001, 73(1): 10-19. DOI:10.1006/geno.2000.6498 |
| [14] |
Eguether T, San Agustin J T, Keady B T, et al. IFT27 links the BBSome to IFT for maintenance of the ciliary signaling compartment. Dev Cell, 2014, 31(3): 279-290. DOI:10.1016/j.devcel.2014.09.011 |
| [15] |
Seo S, Zhang Q, Bugge K, et al. A novel protein LZTFL1 regulates ciliary trafficking of the BBSome and Smoothened. PLoS Genet, 2011, 7(11): e1002358. DOI:10.1371/journal.pgen.1002358 |
| [16] |
Wang Z, Fan Z C, Williamson S M, et al. Intraflagellar transport (IFT) protein IFT25 is a phosphoprotein component of IFT complex B and physically interacts with IFT27 in Chlamydomonas. PLoS One, 2009, 4(5): e5384. DOI:10.1371/journal.pone.0005384 |
| [17] |
Fan Z C, Bird R C. An alternative -1/+2 open reading frame exists within viral N(pro)(1-19) region of bovine viral diarrhea virus SD-1. Virus Res, 2012, 163(1): 341-351. DOI:10.1016/j.virusres.2011.10.022 |
| [18] |
董彬, 吴淞, 王晶, 等. 莱茵衣藻纤毛内运送蛋白IFT27的原核表达纯化及多克隆抗体制备. 生物技术学报, 2016, 26(6): 532-538. Dong B, Wu S, Wang J, et al. Prokaryotic expression, purification and polyclonal antibody preparation of the Chlamydomonas Reinhardtii intraflagellar transport protein (IFT27). Biotechnology, 2016, 26(6): 532-538. |
| [19] |
任海月, 董彬, 樊振川, 等. 莱茵衣藻纤毛内运输蛋白IFT46的原核表达纯化及其多克隆抗体的制备. 生物工程学报, 2016, 32(8): 1124-1132. Ren H Y, Dong B, Fan Z C, et al. Prokaryotic expression and purification of Chlamydomonas reinhardtii intraflagellar transport protein 46(IFT46) and preparation of polyclonal antibody. Chinese Journal of Biotechnology, 2016, 32(8): 1124-1132. |
| [20] |
Valcourt U, Gouttenoire J, Aubert-Foucher E, et al. Alternative splicing of type Ⅱ procollagen pre-mRNA in chondrocytes is oppositely regulated by BMP-2 and TGF-beta1. FEBS Lett, 2003, 545(2-3): 115-119. DOI:10.1016/S0014-5793(03)00510-6 |
| [21] |
田伟, 董彬, 李振芳, 等. 莱茵衣藻IFT139蛋白抗原的原核表达、纯化及多克隆抗体的制备. 天津科技大学学报, 2016, 31(8): 27-33. Tian W, Dona B, Li Z F, et al. Prokaryotic expression, purification and polyclonal antibody preparation of Chlamydomonas reinhardtii IFT139 protein antigen. Journal of Tianjin University of Science & Technology, 2016, 31(8): 27-33. |
 2017, Vol. 37
2017, Vol. 37




