文章信息
- 梁姗, 蒋子川, 冯均.
- LIANG Shan, JIANG Zi-chuan, FENG Jun.
- 胭脂萝卜花青素提取及对NCI-N87细胞增殖侵袭的影响
- The Effect on NCI-N87 Cell Proliferation and Invasion by Carmine Radish Anthocyanin
- 中国生物工程杂志, 2017, 37(11): 101-108
- China Biotechnology, 2017, 37(11): 101-108
- http://dx.doi.org/DOI:10.13523/j.cb.20171114
-
文章历史
- 收稿日期: 2017-07-05
- 修回日期: 2017-09-04
花青素是存在于植物液泡中的黄酮类化合物,天然花青素可分为矢车菊素(cyanidin)、天竺葵素(anthocyanin)、飞燕草素(delphinidin)、芍药素(peonidin)、锦葵花素(malvidin)及牵牛花素(petunidin)[1]。研究表明,花青素具有一定的抗肿瘤活性,主要机制是作用于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3-激酶-丝氨酸/苏氨酸激酶(phosphatidylinositol-3-kinase-serine/threonine kinase,PI3K-Akt)途径,抑制肿瘤细胞的增殖与侵袭,促进细胞凋亡[2-4]。胃癌是来自于上皮的恶性肿瘤,其中20%胃癌为人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达型。胭脂萝卜(carmine radish)为重庆涪陵特色蔬菜,富含花青素,其中95%为天竺葵素[5-8]。本研究建立了超声波辅助提取胭脂萝卜花青素的最佳工艺,分析其对胃癌细胞株NCI-N87的增殖和侵袭能力的影响,并探讨其对HER2信号通路相关蛋白质的影响。
1 材料与方法 1.1 主要试剂及仪器胭脂萝卜:胭脂红1号;NCI-N87美国ATCC细胞库;胰蛋白酶(≥180 units)、牛血清蛋白(bovine serum albumin,BSA)、ECL显影液Millipore公司;蛋白质Marker、磷酸盐缓冲液(phosphate buffer saline,PBS)、磷酸盐缓冲液(PBS):TaKaRa公司;PVDF膜、Tris-HCl (pH 6.8,pH 8.8)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液、ACR(丙烯酸脂共聚物)溶液、结晶紫:Bio-Rad公司;RPMI1640培养基:Hyclone公司;MTT试剂盒(C0009)、HER2(AF0177):碧云天公司;兔抗AKT(380617)、兔抗p-AKT(Ser473)(381555)、兔抗GADPH(380626)、辣根过氧化物酶(horseradish Peroxidase,HRP)标记的山羊抗兔二抗(511201):正能生物公司;其他化学试剂均为国产分析纯试剂。
GelDoc XR+凝胶成像系统:美国Bio-Rad公司;TS100相差倒置显微镜:日本Nikon公司。MK3酶标仪:美国Thermo公司;JY98-Ⅱ超声波细胞粉碎机:宁波新芝公司;T6紫外-可见分光光度计:北京普析公司。
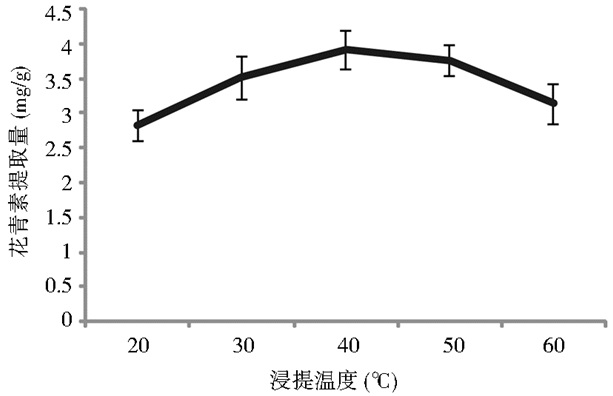
1.2 方法 1.2.1 超声波辅助提取花青素胭脂萝卜切片,60℃烘干到恒重,粉碎并过40目筛,避光常温保存。称取胭脂萝卜粉1.0g,以1%盐酸乙醇为浸提剂,调节液料比,在一定温度下浸提,随后用不同功率和时间的超声进行处理,旋转蒸发仪去除液体,以去离子水溶解花青素并测定含量[9]:
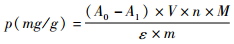 |
式中,p为花青素含量(mg/g);A0和A1分别pH1.0、pH4.5时花青素在520nm处的吸光度;V为提取液总体积(ml);n为稀释倍数;M为天竺葵素-3-槐二糖苷相对分子质量(648.5);ε为消光系数(302 00);m为样品质量(g)。
1.2.2 单因素试验设计(1) 液料比对花青素提取率的影响。称取1g胭脂萝卜干粉,按液料比5:1、10:1、15:1、20:1、25:1加入1%盐酸乙醇,在25℃浸提2h,探讨不同的液料比对花青素提取率的影响。
(2) 浸提温度对花青素提取率的影响。称取1g胭脂萝卜干粉,按液料比10:1加入1%盐酸乙醇,在20℃、30℃、40℃、50℃、60℃浸提2h,比较不同的温度对花青素提取率的影响。
(3) 浸提时间对花青素提取率的影响。称取1g胭脂萝卜干粉,按液料比10:1加入12%盐酸乙醇,在40℃浸提0.5h、1h、1.5h、2h、2.5h、3h,研究提取时间对花青素提取率的影响。
(4) 超声功率对花青素提取率的影响。称取1g胭脂萝卜干粉,按液料比10:1加入1%盐酸乙醇,分别以功率为0W、100W、200W、300W、400W、500W的超声处理每次10s,间隔10s,输出总时间15min,然后在40℃浸提2h,探讨超声功率对花青素提取率的影响。
(5) 超声时间对花青素提取率的影响。称取1g胭脂萝卜干粉,按液料比10:1加入1%盐酸乙醇,超声功率400W,处理每次10s,间隔10s,输出总时间5min、15min、25min、35min、45min,然后在40℃浸提2h,探讨超声时间对花青素提取率的影响。
1.2.3 响应面法试验设计根据单因素试验结果,以浸提时间(A)、超声功率(B)、浸提温度(C)这3个因素为自变量,以胭脂萝卜花青素提取量为响应值,进行对提取胭脂萝卜花青素条件的优化,因素水平表见表 1。
| 水平 | 因素 | ||
| 浸提时间(A)(h) | 超声功率(B)(W) | 浸提温度(C)(℃) | |
| -1 | 1.5 | 300 | 30 |
| 0 | 2.0 | 400 | 40 |
| 1 | 2.5 | 500 | 50 |
1.2.4 大孔树脂纯化花青素
在层析柱中加入预处理好的AB-8大孔树脂,加入花青素提取液,以1%盐酸乙醇进行解析,收集滤液,用旋转蒸发仪在40℃回收乙醇,得到花青素纯化液。
1.2.5 细胞培养NCI-N87细胞购自于美国ATCC公司,于本实验室保存。采用添加10%胎牛血清的RPMI-1640培养基,在37℃,5%CO2培养箱内培养,长至汇合度为80%~90%时,用0.25%胰蛋白酶消化并传代。
1.2.6 细胞MTT实验根据碧云天公司细胞增殖及细胞毒性检测试剂盒(C0009)说明书进行操作:在96孔板中,每孔加入100μl 2 000个NCI-N87细胞,于37℃、5%CO2细胞培养箱中孵育24h。以0.1%DMSO为对照组,实验组用不同浓度的花青素(10μg/ml、20μg/ml、30μg/ml、40μg/ml),分别处理细胞24h、48h、72h后,每孔加入10μl MTT溶液(5mg/ml),在细胞培养箱内孵育4h。每孔加入100μl溶解液,在细胞培养箱中继续孵育4h。用酶标仪在570nm测定吸光度(A值),实验重复3次,每次设3个平行样。
1.2.7 细胞侵袭实验用0.25%胰蛋白酶消化NCI-N87细胞,取5×104个细胞加入200μl培养基培养于侵袭小室中,以0.1%DMSO为对照组,实验组加入不同浓度花青素(10μg/ml、20μg/ml、30μg/ml、40μg/ml),将侵袭小室放置于24孔板中,24孔板预先加入700μl细胞培养基。培养12h后,取出侵袭小室,吸去培养基,用甲醛固定15min,0.1%结晶紫染色10min,用PBS清洗3次后,擦去小室外底部,置于倒置显微镜下,20倍随机挑选3个视野,进行拍照并计数,实验重复3次。
1.2.8 免疫印迹检测蛋白质表达将NCI-N87细胞接种于6孔板中,细胞汇合率至90%时,在实验组中加入不同浓度花青素(10μg/ml、20μg/ml、30μg/ml、40μg/ml),以0.1%DMSO为对照组,孵育24h后,消化并收集细胞,提取总蛋白质并上样50μg,200V SDS-PAGE分离,转膜封闭1h后,加入HER2、p-Akt、Akt、GAPDH一抗4℃孵育过夜,二抗室温孵育1h后,ECL显色,选取合适的曝光度进行成像分析。
1.2.9 统计学处理所有实验数据以x±s表示,应用SPASS 22.0统计软件对资料进行分析,两组均数间比较采用方差分析,P < 0.05表示差异有统计学意义。
2 结果讨论 2.1 花青素提取工艺 2.1.1 液料比对花青素提取量的影响由图 1可知,在低于10:1液料比时,更多的乙醇能增大与萝卜粉的接触面积,提高花青素的溶解力[10-11]。当料液比达到10:1后,随液料比的增加,花青素提取量反而下降增加,说明此时花青素的溶解力达到最大,再增加提取液用量既增加生产成本也不能获更高的提取量。液料比为10:1时花青素提取量达到最大,与其它比例的提取量差异不显著。
|
| 图 1 液料比对花青素提取量的影响 Figure 1 Effect of solid-liquid ratio on anthocyanin content |
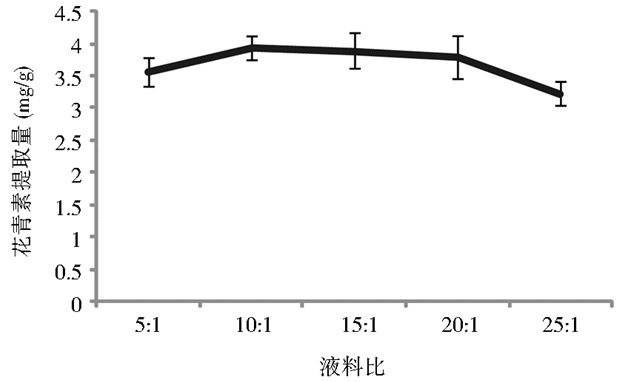
由图 2可见,在2h之前,花青素提取量随浸提时间的延长而逐渐提高,在2h以后则开始下降。可能由于浸提时间过长,受外部环境因素的影响导致花青素降解,影响其提取量[11]。浸提时间在2h时花青素提取量显著高于1h与1.5h(P < 0.05)。
|
| 图 2 浸提时间对花青素提取量的影响 Figure 2 Effect of the digestion time on anthocyanin content |
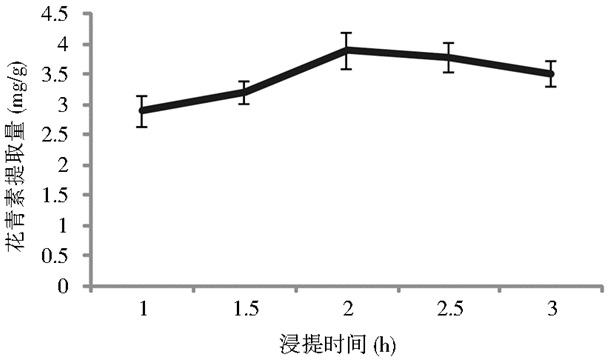
由图 3可见,浸提温度低于40℃时,花青素的提取量随着温度升高而增高,当温度高于40℃时,提取量明显降低。花青素的稳定性受温度影响较大,高温可以使其单体结构破坏[12],同时高温可能使胭脂萝卜的其他成分析出,影响花青素纯度。浸提温度40℃时花青素提取量显著高于在20℃、30℃及60℃下的提取量(P < 0.05)。
|
| 图 3 浸提温度对花青素提取量的影响 Figure 3 Effect of the digestion temperature on anthocyanin content |
由图 4可见,超声持续时间对花青素提取量的影响较小,当超声时间为15~25min时,花青素提取量最高,但继续延长时间,其提取量无明显上升。超声时间15min时花青素的提取量与其他时间的提取量无显著差异。
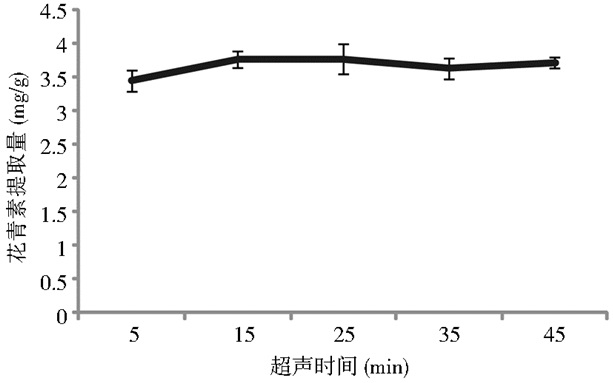
|
| 图 4 超声时间对花青素提取量的影响 Figure 4 Effect of the ultrasonic time on anthocyanin content |
由图 5可见,随着超声功率的提高,花青素提取量也提高,当超声功率为400W时花青素含量最高。超声波功率过大时,非花青素成分溶解量可能增加,降低了花青素的提取量。超声波功率400W时,其花青素提取量显著高于100W及200W时的提取量。
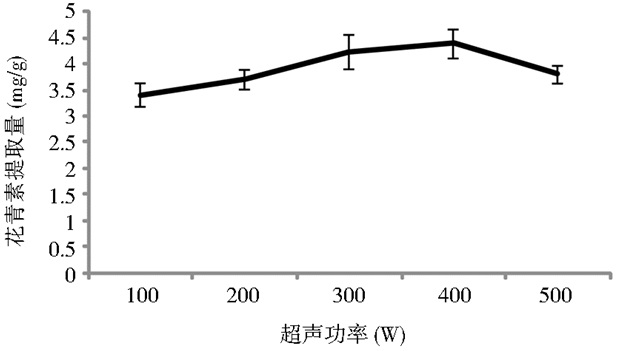
|
| 图 5 超声功率对花青素提取量的影响 Figure 5 Effect of the ultrasonic power on anthocyanin content |
基于单因素实验结果,不同液料比、超声时间对花青素提取量影响不显著,选取浸提时间(A)、超声功率(B)、浸提温度(C)进行响应面实验,以筛选出最优化的组合。响应面实验结果见表 2(3次重复),以花青素提取量(mg/g)为响应值(Y),使用软件Design Expert 8.0进行多元化回归分析,拟合出回归方程:Y=3.92+0.27*A-0.013*B+0.14*C-0.42*A2-0.098*B2-0.28*C2。
| 试验号 | A | B | C | 提取量 | |
| 实测值 | 预测值 | ||||
| 1 | -1 | 0 | 1 | 3.06 | 3.09 |
| 2 | 1 | 0 | 1 | 3.67 | 3.63 |
| 3 | 1 | 0 | -1 | 3.35 | 3.36 |
| 4 | -1 | 0 | -1 | 2.81 | 2.81 |
| 5 | 1 | -1 | 0 | 3.72 | 3.69 |
| 6 | 1 | 1 | 0 | 3.65 | 3.67 |
| 7 | 0 | -1 | 1 | 3.67 | 3.69 |
| 8 | 0 | -1 | -1 | 3.45 | 3.42 |
| 9 | 0 | 1 | 1 | 3.67 | 3.66 |
| 10 | 0 | 1 | -1 | 3.37 | 3.39 |
| 11 | 1 | -1 | 0 | 3.65 | 3.69 |
| 12 | -1 | 1 | 0 | 3.15 | 3.12 |
| 13 | 0 | 0 | 0 | 3.91 | 3.92 |
| 14 | 0 | 0 | 0 | 3.89 | 3.92 |
| 15 | 0 | 0 | 0 | 3.95 | 3.92 |
| 16 | 0 | 0 | 0 | 3.93 | 3.92 |
| 17 | 0 | 0 | 0 | 3.92 | 3.92 |
由方差分析结果(表 3)可知,该回归方程(模型)的回归效果显著(P < 0.000 1),失拟项不显著(0.416 4),该回归方程的效果显著,拟合程度好,有实际应用的意义。其中超声功率(B)对花青素提取量影响较不显著(P > 0.000 1),剔除掉不显著项,进行优化可得3.92+0.27*A+0.14*C-0.42*A2-0.098*B2-0.28*C2。
| 因素 | 总和 | 自由度 | 均方 | F值 | P值 | 显著性 |
| 模型 | 1.785 828 | 6 | 0.297 638 | 301.317 6 | < 0.000 1 | * |
| A | 0.483 347 | 1 | 0.483 347 | 489.322 5 | < 0.000 1 | * |
| B | 0.001 27 | 1 | 0.001 27 | 1.286034 | 0.283 2 | |
| C | 0.148 513 | 1 | 0.148 513 | 150.348 5 | < 0.000 1 | * |
| A2 | 0.699 204 | 1 | 0.699 204 | 707.848 1 | < 0.000 1 | * |
| B2 | 0.039 002 | 1 | 0.039 002 | 39.4839 9 | < 0.000 1 | * |
| C2 | 0.321 414 | 1 | 0.321 414 | 325.387 8 | < 0.000 1 | * |
| 残差 | 0.009 878 | 10 | 0.000 988 | |||
| 失拟项 | 0.005 428 | 5 | 0.001 086 | 1.219 749 | 0.416 4 | |
| 纯误差 | 0.004 45 | 5 | 0.000 89 | |||
| 总和 | 1.795 706 | 16 | ||||
| R2=0.994 5 | ||||||
| Note: *Pepresents P < 0.000 1 | ||||||
2.2.2 响应面分析及提取条件优化
分析图 6可知,浸提时间和浸提温度对花青素提取量影响较大。经响应面分析优化,从胭脂萝卜里提取花青素的最佳提取工艺为浸提温度42.22℃,浸提时间2.11h,超声功率386.67W,在此条件下,花青素的提取量预测值最高为3.976mg/g。为验证此理论条件的可行性,并考虑到实际操作的便利,将工艺参数修正为:浸提温度40℃,超声功率400W,浸提时间2h。在此实验条件下进行5次实验,结果为3.92mg/g,标准差为0.0224mg/g,说明该优化工艺所得试验结果稳定,优化提取条件可靠。
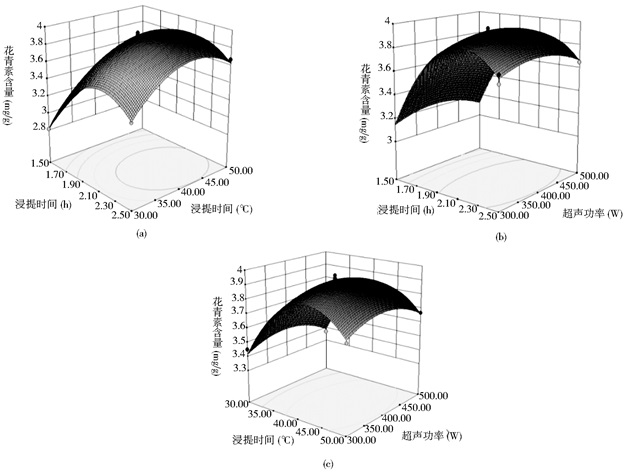
|
| 图 6 响应面分析结果 Figure 6 Response surface analysis (a) Digestion time and temperature (b) Digestion time and ultrasonic power (c) Digestion temperature and ultrasonic power |
已报道来源于果蔬的花青素粗提物及纯品均能抑制多种肿瘤细胞的增殖[13-14]。MTT实验结果表明(表 4),10μg/ml花青素对细胞增殖无显著影响,20μg/ml、30μg/ml、40μg/ml花青素均能抑制细胞增殖,30μg/ml与40μg/ml与对照组相比差异显著(P < 0.05),30μg/ml与40μg/ml相比差异不显著,说明30μg/ml胭脂萝卜花青素对细胞增殖有较显著的抑制效果。
| 组别 | 24h | 48h | 72h |
| 对照 | 1.02±0.11 | 1.05±0.12 | 1.08±0.11 |
| 10μg/ml | 0.92±0.08 | 0.94±0.10 | 0.96±0.11 |
| 20μg/ml | 0.78±0.09* | 0.80±0.10* | 0.82±0.08*# |
| 30μg/ml | 0.65±0.07* | 0.66±0.06*# | 0.68±0.05*#Δ |
| 40μg/ml | 0.63±0.06* | 0.61±0.08* | 0.70±0.07*# |
| Note: * Represents compared with the control group P < 0.05;# Represents compared with the same doze group in 24h P < 0.05;Δ Represents compared with the same doze group in 48h P < 0.05 | |||
2.3.2 花青素抑制NCI-N87细胞侵袭
细胞侵袭实验结果显示(图 7),随着花青素处理浓度的增强,细胞侵袭能力逐渐下降。10μg/ml与20μg/ml处理组与对照组差异不显著,30μg/ml与40μg/ml与对照组相比差异显著(P < 0.05),30μg/ml与40μg/ml处理组的之间的抑制能力差异不显著,说明30μg/ml花青素对细胞侵袭已有较显著的抑制效果。
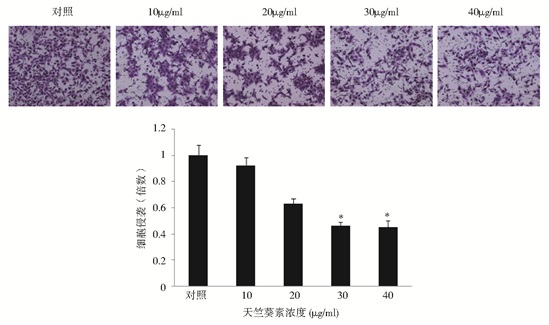
|
| 图 7 花青素对NCI-N87细胞侵袭能力的影响 Figure 7 Effects of anthocyanin on the invasion of NCI-N87 * Represents compared with the control group P < 0.05 |
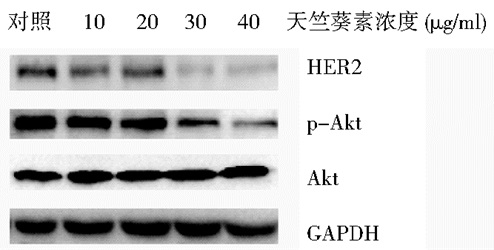
HER2蛋白是具有酪氨酸蛋白激酶活性的跨膜蛋白,属于表皮生长因子受体(epidermal growth factor receptor,EGFR)家族成员,可通过磷酸化下游Akt蛋白,诱导肿瘤的发生及转移[15-16]。花青素能通过抑制HER2及下游信号从而抑制HER2高表达的乳腺癌细胞株(BT474、MDA-MB-231、MCF-7)的迁移和侵袭能力[17-18]。本研究中通过蛋白质印迹分析花青素对HER2及下游Akt蛋白表达发现(图 8),10μg/ml花青素处理组的HER2、p-Akt蛋白表达无显著差异;20μg/ml、30μg/ml、40μg/ml花青素处理使HER2、p-Akt均受到抑制,Akt蛋白的表达均无显著差异。提示胭脂萝卜花青素抑制HER2高表达胃癌NCI-N87细胞的侵袭可能与HER2蛋白表达水平和Akt的磷酸化表达密切相关。
|
| 图 8 花青素对HER2及Akt蛋白表达的影响 Figure 8 Effects of anthocyanin on the HER2和Akt expression |
本研究采用Box.Behnken的中心组合设计及响应面分析,建立了超声波提取胭脂萝卜花青素提取的二次多项式数学模型。经检验证明该模型是合理可靠的,能够优化胭脂萝卜花青素提取量。超声波辅助提取胭脂萝卜花青素最佳工艺参数为:以1%盐酸乙醇为提取剂,液料比10:1,浸提温度40℃,超声功率400W,浸提时间2h,花青素提取量最高为3.92mg/g。进一步研究经AB-8大孔树脂纯化后的花青素抗肿瘤活性发现,30μg/ml胭脂萝卜花青素对胃癌细胞NCI-N87的增殖和侵袭均有一定的抑制作用,且降低了HER2以及磷酸化Akt蛋白的表达,说明胭脂萝卜花青素可以通过HER2-Akt信号途径抑制HER2阳性胃癌细胞增殖的和侵袭。进一步利用肿瘤移植小鼠模型,分离胭脂萝卜中主要成分天竺葵素,探讨其是否具有更高效的抑制肿瘤细胞增殖和侵袭的作用,能为此品种花青素产品的开发提供理论支持。
| [1] |
Jeong J W, Lee W S, Shin S C, et al. Anthocyanins downregulate lipopolysaccharide induced inflammatory responses in BV2 microglial cells by suppressing the NF-κB and Akt/MAPKs signaling pathways. International Journal of Molecular Sciences, 2013, 14(1): 1502-1515. DOI:10.3390/ijms14011502 |
| [2] |
Shin D Y, Lee W S, Lu J N, et al. Induction of apoptosis in human colon cancer HCT-116 cells by anthocyanins through suppression of Akt and activation of p38-MAPK. International Journal of Oncology, 2009, 35(6): 1499-1504. |
| [3] |
Oak M H, Bedoui J E, Maderira S V F, et al. Delphinidin and cyanidin inhibit PDGFAB-induced VEGF release in vascular smooth muscle cells by preventing activation of p38 MAPK and JNK. British Journal of Pharmacology, 2006, 149(3): 283-290. DOI:10.1038/sj.bjp.0706843 |
| [4] |
Huang H P, Shih Y W, Chang Y C, et al. Chemoinhibitory effect of mulberry anthocyanins on melanoma metastasis involved in the Ras/PI3K pathway. Journal of Agricultural and Food Chemistry, 2008, 56(19): 9286-9293. DOI:10.1021/jf8013102 |
| [5] |
时建伟, 腾晓旭, 曹团武. 涪陵胭脂萝卜红色素的提取、分离及精制研究进展. 广州化工, 2016, 44(2): 6-7. Shi J W, Teng X X, Cao T W. The red pigmen extraction separation and refined research progress from Fuling specialty rouge radish. Guangzhou Chemical Industry, 2016, 44(2): 6-7. |
| [6] |
范龚健, 韩永斌, 顾振新, 等. 萝卜红色素的提取工艺及其稳定性. 江苏农业学报, 2006, 22(2): 159-163. Fan G J, Han Y B, Gu Z X, et al. Extraction technology and stability of red radish pigments from Raphnus sativus. Jiangsu Journal of Agricultural Sciences, 2006, 22(2): 159-163. |
| [7] |
梁姗, 蒋子川, 杨霞, 等. 高效液相色谱法测定胭脂萝卜中天竺葵素含量. 广州化工, 2017, 45(7): 92-93. Liang S, Jiang Z C, Yang X, et al. Determination of pelargonidin in carmine radish by high performance liquid chromatography. Guangzhou Chemical Industry, 2017, 45(7): 92-93. |
| [8] |
刘海军, 孙井坤. 萝卜红色素的提取工艺研究. 黑龙江八一农垦大学学报, 2014(1): 55-58. Liu H J, Sun J K. Research of extraction process of red radish pigment. Journal of Heilongjiang Bayi Agricultural University, 2014(1): 55-58. |
| [9] |
桑戈, 赵力, 谭婷婷, 等. pH示差法测定紫薯酒中花青素的含量. 酿酒科技, 2015(6): 88-91. Sang G, Zhao L, Tan T T, et al. Determination of anthocyanin content in purple potato wine by pH-differential method. Liquor-Making Science & Technology, 2015(6): 88-91. |
| [10] |
程威, 周亮, 吴正奇. 萝卜红色素的稳定性和抗氧化性研究. 湖北工业大学学报, 2014, 29(2): 113-116. Cheng W, Zhou L, Wu Z Q. Research of stability and oxidative stability of red radish pigment. Journal of Hubei University of Technology, 2014, 29(2): 113-116. |
| [11] |
阳晖, 曾召银. 超声波辅助法提取胭脂萝卜色素的工艺研究. 食品工业科技, 2012, 33(24): 325-327. Yang H, Zeng Z Y. Study on extracting technology of pigment from carmine radish by ultrasonic-assisted method. Science and Technology of Food Industry, 2012, 33(24): 325-327. |
| [12] |
张春玲, 杜以文, 翟明昌. 紫心萝卜红色素提取工艺及其稳定性研究. 食品科学, 2008, 29(11): 290-293. Zhang C L, Du Y W, Zhai M C. Study on extraction technology of red pigment from purple-heart turnip and Its stability. Food Science, 2008, 29(11): 290-293. DOI:10.3321/j.issn:1002-6630.2008.11.065 |
| [13] |
Li Y W, Wang D, Li X G, et al. Anthocyanins extracted from Chinose blueberry and its antieancer effects on HepG2 cells. Advanced Materials Research, 2014, 2989(887): 592-595. |
| [14] |
Johnson A S, Arjmandi H B. Evidence for anti-cancer properties of blueberries:a mini-review. Anti-Cancer Agents in Medicinal Chemistry, 2013, 13(8): 1142-1144. DOI:10.2174/18715206113139990137 |
| [15] |
Lordick F, Al-Batran S E, Dietel M, et al. HER2 testing in gastric cancer:results of a German expert meeting. Journal of Cancer Research & Clinical Oncology, 2017, 143(5): 835-841. |
| [16] |
Güttlein L N, Benedetti L G, Fresno C, et al. Predictive outcomes for HER2-enriched cancer using growth and metastasis signatures driven By SPARC. Molecular Cancer Research Mcr, 2017, 15(3): 304. DOI:10.1158/1541-7786.MCR-16-0243-T |
| [17] |
Ozbay T, Nahta R. Delphinidin inhibits HER2 and Erkl/2 signaling and suppresses growth of HER2-overexpressing and triple negative breast cancer cell lines. Breast Cancer:Auckl, 2011(5): 143-154. |
| [18] |
Xu M, Bower K A, Wang S Y, et al. Cyanidin-3-glucoside inhibits ethanol-induced invasion of breast cancer cells overexpressing ErbB2. Molecular Cancer, 2010, 9(1): 1-14. DOI:10.1186/1476-4598-9-1 |
 2017, Vol. 37
2017, Vol. 37




