文章信息
- 苏晓蕊, 李伟国, 王延辉, 高晓静, 闪伊红, 谭菲菲, 李向东, 田克恭.
- SU Xiao-rui, LI Wei-guo, WANG Yan-hui, GAO Xiao-jing, SHAN Yi-hong, TAN Fei-fei, LI Xiang-dong, TIAN Ke-gong.
- 重组杆状病毒细小VP2蛋白40L生物反应器放大工艺研究
- Scale-up Process Optimization for Recombinant PPV-VP2 Protein Production Using Baculovirus Expression System in 40L Bioreactor
- 中国生物工程杂志, 2017, 37(10): 60-64
- China Biotechnology, 2017, 37(10): 60-64
- http://dx.doi.org/DOI:10.13523/j.cb.20171008
-
文章历史
- 收稿日期: 2017-03-19
- 修回日期: 2017-05-03
猪细小病毒(PPV)是一种高度稳定且持久感染的自主型病毒[1]。引起怀孕母猪的繁殖障碍,流产、死胎及木乃伊胎等, 还引起仔猪皮炎、腹泻、非化脓性心肌炎和呼吸系统疾病[2-3],成年猪不表现明显的临床症状。疫苗免疫是目前预防和控制该病的重要措施,但现有疫苗存在毒力返祖、免疫能力低下、生产成本高等缺陷。基因工程亚单位疫苗中病毒样颗粒疫苗(VLPs)是目前研究的热点,VLPs是由一种或多种病毒衣壳蛋白自行装配而成的空壳颗粒,不含病毒核酸,不能复制,没有感染性,形态结构上与天然病毒粒子相同或相似,即使没有佐剂也可刺激机体产生强烈的体液和细胞免疫[4]。有研究表明[5],体外表达的PPV-VP2蛋白具有良好的免疫原性,可诱导机体产生保护性免疫反应。
昆虫细胞-杆状病毒表达系统具有重组蛋白表达量高,能同时表达多个基因等优点。实验室利用IC/BEVS系统表达的猪细小病毒VP2蛋白,具有良好的免疫原性,可以用于预防猪细小病毒病。为了满足工业化生产的需求,本文在3L反应器培养的基础上,运用输入搅拌功率的放大策略,通过体积溶氧系数、输入搅拌功率和叶尖线速度的计算,实现了重组杆状病毒PPV-VP2生产规模从3L到40L的放大。
1 材料与方法 1.1 材料 1.1.1 细胞培养Sf9细胞,本实验室保藏。无血清培养基SF-900TM Ⅲ SFM(Gibco,USA)。
1.1.2 病毒株表达细小病毒VP2蛋白的重组杆状病毒,本实验室构建并保存。
1.1.3 3L/14L/40L生物反应器美国NBS CelliGen115、CelliGen310、CelliGen510。
1.1.4 实验动物25只体重约为250g健康成年豚鼠。
1.2 方法 1.2.1 细胞的复苏及扩增常规复苏Sf9细胞,800~1 000r/min离心后,弃去上清,另取20ml新鲜生长液重悬,置于110r/min、27℃摇床培养。2~3d后,按照1:10的比例进行扩增传代。
1.2.2 3L反应器重组杆状病毒PPV-VP2培养工艺优化将CelliGen115-3L反应器清洗、灭菌备用。种子细胞放大后,将细胞按照0.3~0.5×106 cells/ml的密度接种进3L反应器中,最后补加新鲜培养基至终体积2.0L。培养72h后,新鲜培养基稀释至2.0~2.5×106 cells/ml,按照MOI=10接种病毒液。
(1) DO的优化。培养参数为:搅拌转速(Agit) 50r/min、Temp 27℃、pH6.2;DO设置20%、40%、60%、80%四个梯度,通入空气和纯氧两种气体维持溶液中溶解氧的浓度,空气的通气量设置为0.005vvm。检测不同DO值下的VP2蛋白HA效价,选择一个最优的DO。
(2) 搅拌转速上限的测定。搅拌范围的下限是保证生物反应器中传质传氧的充分;上限是不会因高的剪切力导致细胞活率下降。
其他参数不变,同(1),DO设为40%,将最高转速定为150r/min,在该转速下比较与50r/min时细胞的生长曲线变化。
1.2.3 40L生物反应器放大工艺研究根据3L反应器优化的结果,在培养工艺放大过程中,pH、DO、Temp大罐与小罐3L一致,主要解决在几何相似性原则(高径比均为2:1)下,放大后罐体的空气流量、搅拌转速和功率消耗的问题。
按照输入搅拌功率放大的方法,依据体积溶氧系数KL a值相同,则有:
 |
(1) |
依据单位体积液体消耗功率P/V相等,则有:
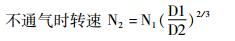 |
(2) |
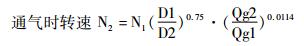 |
(3) |
依据搅拌桨叶尖线速度nDi相等,则有:
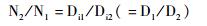 |
(4) |
CelliGen115-3L、CelliGen510-40L尺寸及比例见表 1,结构示意图见图 1。
| Variable | 3-L bioreactor | 14-L bioreactor | 40-L bioreactor |
| Vt(L) | 3 | 14 | 40 |
| Vw(L) | 2.2 | 10.5 | 32.0 |
| Di(in) | 6.5 | 11 | 15.5 |
| Dt(in) | 12.0 | 21 | 30 |
| L=Ht+Hb | 19.5 | 30.3 | 45.3 |
| Ht(in) | 24 | 42 | 60 |
| Ht/Dt | 2:1 | 2:1 | 2:1 |

|
| 图 1 生物反应器示意 Figure 1 The schematic diagrams of bioreactors |
参照文献[6]测定VP2的HA效价及HI抗体。
1.2.5 40L反应器中表达的VP2蛋白免疫原性试验将3L和40L反应器中表达的PPV VP2蛋白分别与佐剂按照一定比例乳化,制成亚单位疫苗;设置阴性对照,全病毒灭活疫苗阳性对照,同时与商品化的PPV疫苗作对比。
2 结果 2.1 DO对细胞生长、病毒感染以及VP2蛋白表达的影响DO作为细胞培养过程的一个重要控制参数,影响着细胞的生长、代谢以及目标产物的表达,严格的溶氧控制可以省去生物反应器的pH控制。
采用批培养的方式,按照0.5×106 cells/ml接种Sf9细胞,DO在20%、40%、60%和80%时,3d后细胞均可以达到最大密度(5.0×106 cells/ml),且在细胞生长、活率(图 2)、营养消耗以及摄氧率(OUR)方面也未见明显的不同。这表明,Sf9细胞的生长和代谢对DO水平是相对不敏感的。

|
| 图 2 Sf9细胞在不同DO下的生长曲线 Figure 2 Sf9 cell profiles in four DO levels during growth and infection |
随后,新鲜培养基将细胞稀释至2.0~2.5×106 cells/ml,接种病毒液(MOI=10)。接种病毒液后,病毒感染发生在24h内,四种条件下细胞活细胞密度基本一致(图 2)。病毒接种后培养72h~96h收获全部培养液,离心后,取上清液检测HA效价(表 2),DO由20%升高至80%时,VP2蛋白的HA效价基本一致。我们的结论是,Sf9细胞可以适应一个较大的DO浓度范围。这与文献[7]中报道的结果一致,Sf9细胞无论是在生长阶段还是病毒感染、蛋白表达对低DO都是不敏感的。所以本文将生物反应器中的DO设定为20%。
| DO | 20% | 40% | 60% | 80% |
| HA titer | 214 | 214 | 214 | 213 |
2.2 Sf9细胞在不同转速下细胞生长曲线
当Temp 27℃、pH6.2;DO 40%时,在Agit 50 r/min和150r/min时,Sf9细胞在3L反应器中的生长曲线见图 3,在150r/min时,Sf9细胞的生长曲线与50 r/min基本一致。其中,叶尖线速度与搅拌转速的关系如表 3。

|
| 图 3 转速对Sf9细胞生长的影响 Figure 3 Effect of agitator on Sf-9 cell growth |
| impeller tip(m/s) | 3L bioreactor(r/min) | 14L bioreactor(r/min) | 40L bioreactor(r/min) |
| 0.02 | 50 | 35 | 25 |
| 0.03 | 100 | 52 | 37 |
| 0.05 | 150 | 87 | 62 |
2.3 40L生物反应器放大培养
在几何相似性原则下进行培养规模的放大。放大过程中,大罐的pH、Temp、DO与小罐相同,根据不同的放大准则,计算14L和40L反应器的搅拌转速,见表 4。
| Criteria | Model | 3-L | 14-L | 40-L |
| KL a | Equation(1) | 50~150 r/min | 32~96r/min | 23~70r/min |
| P/V | Equation(3) | 50~150 r/min | 34~103r/min | 27~80r/min |
| nDi | Equation(4) | 50~150 r/min | 35~87r/min | 25~62r/min |
根据工程参数的计算,不同放大准则下大罐的搅拌转速有差异。当3L生物反应器搅拌转速设定为50r/min时,40L反应器为25r/min左右,此转速无法满足传质传氧的需求。生物反应器在放大的时候,可以实现罐体、搅拌桨等部件的几何相似性放大,但表面积和体积等参数无法实现线性放大,因此实际放大过程中,多以单位体积输出功率作为准则。三种规格反应器的培养参数见表 5。
| Parameters | 3-L bioreactor | 14-L bioreactor | 40-L bioreactor |
| Temperature(℃) | 27 | 27 | 27 |
| pH | 6.20 | 6.20 | 6.20 |
| Dissolved oxygen(%) | 40 | 40 | 40 |
| Agitation speed(r/min) | 50 | 80 | 60 |
| Gas flow to sparger | 0.05vvm | 0.05vvm | 0.075vvm |
对上述工艺进行连续三批验证试验,得到的培养数据见表 6。
| 培养批次 | pH范围 | DO范围 | 温度范围 | VP2蛋白HA效价 |
| 第1批 | 6.12~6.30 | 39.6%~40.1% | 26.2~27.1 | 216 |
| 第2批 | 6.17~6.35 | 39.1%~41.4% | 26.6~27.3 | 215 |
| 第3批 | 6.15~6.27 | 39.9%~47.7% | 26.1~27.0 | 215 |
2.4 免疫原性试验
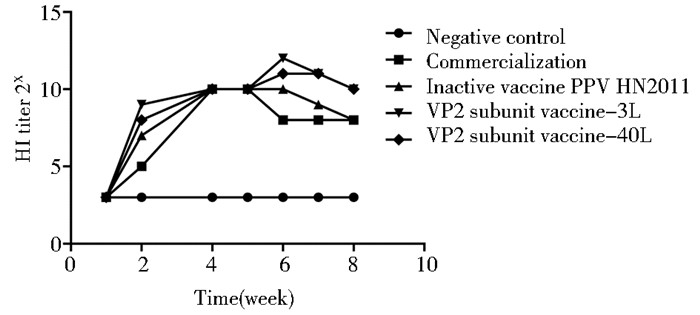
体重约为250g成年健康豚鼠25只,分为5组,每组5只,分别进行3L、40L反应器亚单位疫苗、PPV全病毒疫苗、商品化疫苗、空白对照的免疫,首免后在1、2、4、5、6、7、8周分别采集各组豚鼠血,分离血清,进行血凝抑制检测抗体,结果见图 4。
|
| 图 4 HI实验检测4组PPV疫苗豚鼠抗体水平 Figure 4 HI assay for PPV specific antibodies of sera from guinea pigs immunized with 4 kinds of PPV vaccines |
无论是VP2蛋白与全病毒还是商品化PPV疫苗相比,还是不同的反应器规模生产的VP2蛋白比较,豚鼠免疫试验表明,VP2蛋白产生的抗体水平上升较快且高于传统灭活苗。从免疫原性考察,也证明实现了反应器从3L~40L的放大。
3 讨论杆状病毒表达系统具有与哺乳动物细胞相似的转录、翻译和翻译后加工等功能,表达的外源蛋白基本保持了原有的生物学活性,其表达的细小病毒VP2结构蛋白可形成病毒样颗粒(Virus-Like Particles,VLPs)[7-8]。
本实验室成功构建了表达PPV-VP2的重组杆状病毒,为了实现规模化培养,探索了从3L至40L生物反应器的放大工艺。分别计算小罐和大罐反应器的基本工程参数,确定初步的放大参数,最终使得在大罐中的剪切力不超过细胞的最大耐受程度,氧气的传递速率满足耗氧需求,CO2分压低于毒性水平,气泡伤害和泡沫积累在安全范围,pH和营养分布梯度不会对蛋白产量和质量造成较大影响。为了提高放大的成功几率,采用逐级放大法,由3L到14L再到40L反应器。放大过程中,温度、pH、DO不会随着培养体积的变化而发生变化[9-10],主要考虑搅拌转速和通气量的改变。
本文以输入搅拌功率为放大准则,对3L~40L生物反应器细胞放大工艺进行了初探,事实上,当培养规模放大至生产级的几百升、几千升时,仅仅考虑输入搅拌功率的放大是远远不够的,还需要考虑混合时间、CO2的积累、罐压等因素,更深层次来讲,最好是通过细胞生理状态一致性来进行放大则更为有效。由于实验条件的限制,在细胞培养、病毒感染以及蛋白表达阶段未进行代谢、OUR等生理状态的监测。但是,从培养过程中氧气通入百分比观察,在杆状病毒的感染阶段,耗氧率增加;感染阶段结束,进入蛋白表达阶段,纯氧的消耗逐渐较少。这与文献[12]中通过检测OUR得出的杆状病毒表达外源蛋白时的耗氧变化结论一致。
| [1] |
杜毅超, 吴健敏, 刘金凤. 猪细小病毒病毒样颗粒研究进展. 动物医学进展, 2016, 37(7): 71-75. Du Y C, Wu J M, Liu J F. Progress on porcine parvovirus virus-like particles. Progress in Veterinary Medicine, 2016, 37(7): 71-75. |
| [2] |
Lager K M, Mengeling W L. Porcine parvovirus associated with cutaneous lesions in piglets. J Vet Diagn Invest, 1994, 6(3): 357-359. DOI:10.1177/104063879400600313 |
| [3] |
Bolt D M, Waldvogel A S, Häni H, et al. Non-suppurative myocarditis in piglets associated with porcine parvovirus infection. J Comp Pathol, 1997, 117(2): 107-118. DOI:10.1016/S0021-9975(97)80027-8 |
| [4] |
Kushnir N, Streatfield S J, Yusibov V. Virus-like particles as a highly efficient vaccine platform:Diver-sity of targets and production systems and advances in clinical development. Vaccine, 2012, 31(1): 58-83. DOI:10.1016/j.vaccine.2012.10.083 |
| [5] |
苌生科. PPV/HN-2011毒株分子生物学特性研究及利用杆状病毒表达其VP2蛋白. 郑州: 河南农业大学, 2013. Chang S K. Porcine parvovirus HN-2011 molecular biological characteristics and expressed VP2 protein in insect baculovirus cell system. Zhengzhou:Henan Agricultural University, 2013. |
| [6] |
Martine Z C, Dalsgaard K, Lopezde Turiso J A, et al. Production of porcine parvovirus empty capsids with high immunogenic activity. Vaccine, 1992, 10(10): 684-690. DOI:10.1016/0264-410X(92)90090-7 |
| [7] |
Adriaan F G, Christianne J M, Palomar, et al. A novel recombinant virus-like particle vaccine for prevention of porcine parvovirus-induced reproductive failure. Vaccine, 2006, 24: 5481-5490. DOI:10.1016/j.vaccine.2006.03.089 |
| [8] |
Yang J D, Lu C, Stasny B, et al. Fed-batch bioreactor process scale-up from 3-L to 2500-L scale for monoclonal antibody production from cell culture. Biotechnology and Bioengineering, 2007, 98(1): 141-154. DOI:10.1002/(ISSN)1097-0290 |
| [9] |
Dreher T, Husemann U, Adams T, et al. Design space definition for a stirred single-use bioreactor family from 50 to 2000L scale. Eng Life Sci, 2014, 14: 304-310. DOI:10.1002/elsc.v14.3 |
| [10] |
Agathos S N. Insect cell bioreactors. Cytotechnology, 1996, 20: 173-189. DOI:10.1007/BF00350398 |
 2017, Vol. 37
2017, Vol. 37




