文章信息
- 周忠厅, 张权, 王胜涛, 蔡颖, 中西秀树, 尹健.
- ZHOU Zhong-ting, ZHANG Quan, WANG Sheng-tao, CAI Yin, NAKANISHI Hideki, YIN Jian.
- 共价连接BODIPY光敏剂的聚合物纳米胶束及其靶向光动力疗效的研究
- Polymeric Nanomicelles Conjugated with BODIPY-based Photosensitizers for Targeted Photodynamic Therapy
- 中国生物工程杂志, 2017, 37(10): 33-41
- China Biotechnology, 2017, 37(10): 33-41
- http://dx.doi.org/DOI:10.13523/j.cb.20171005
-
文章历史
- 收稿日期: 2017-04-07
- 修回日期: 2017-05-15
2. 江南大学生物工程学院 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi 214122, China
光动力治疗是一项通过光动力学反应选择性破坏病变组织的全新技术[1-2]。近年来,将光动力治疗应用于癌症治疗已成为生物学领域研究的热点[3-4]。这种治疗手段主要依赖于将光敏剂输送至肿瘤部位,并在肿瘤部位集聚,通过特定波长的光进行照射,经过一系列的光化学和光生物学反应, 在分子氧的参与下产生活性氧,尤其是单态氧[5],从而氧化性破坏肿瘤细胞成分,使肿瘤细胞发生不可逆的损伤,最终使细胞凋亡或裂解,达到治疗肿瘤的目的[6]。然而光敏剂水溶性较差,且缺乏对恶性肿瘤部位的选择性[7],其在光动力治疗中会损伤正常组织,生物利用度不高。此外,在特定波长的光照下产生的单态氧半衰期短,在肿瘤部位扩散的距离受限。为了解决以上问题需要研发出新型的光敏剂输送系统。
聚合物胶束是近年来备受关注的一种新型输送载体,主要通过两亲性分子形成具有疏水空腔内核和亲水外壳[8-9]。聚合物胶束在机体内具有良好的生物相容性和稳定性,延长负载药物在体内的循环时间[10],但聚合物胶束并不能实现对肿瘤细胞的主动靶向作用,为了进一步改善聚合物胶束对肿瘤细胞的靶向作用,通常选择在聚合物上修饰能被肿瘤细胞表面高表达的受体特异识别的靶向分子,如抗体[12]、多肽[13]、叶酸[14]等,使聚合物胶束通过受体识别被细胞内吞进入细胞内,即实现对输送载体的靶向功能,也大大降低了对机体正常组织的毒副作用[15]。近年来,甘露糖被用于肿瘤细胞表面高表达的甘露糖受体特异性识别,从而增强输送载体对肿瘤部位的靶向识别作用已经有了许多报道[16]。但是在具有靶向性输送载体上修饰光敏剂,尤其是在具有靶向功能的聚合物上修饰光敏剂,以实现理想的光动力疗效的文章却鲜有报道。
氟硼二吡咯(BODIPY)是近年来广泛应用的一种典型光敏剂[17-18]。该光敏剂具有较好的光稳定性,量子产率高,较大的摩尔消光系数,理想的吸收和发射波长等特性[19]。但因其疏水性和缺乏对肿瘤细胞的靶向性,导致将其应用于癌症的光动力治疗受限。为了克服以上困难,本文首先制备了高分子嵌段聚合物,借助酰胺缩合反应将能被肿瘤细胞表面高表达的甘露糖受体特异性识别的甘露糖修饰在聚合物的一端,同时在另一端修饰上BODIPY,制备得到表面甘露糖修饰的负载光敏剂聚合物胶束,并应用于光动力治疗乳腺癌实验研究。
1 材料与方法 1.1 试剂丙烯酸叔丁酯(tBA,97%)、1, 1, 4, 7, 7-五甲基-二乙烯基三胺(PMDETA,99%)、甲基丙烯酸缩水甘油酯(GMA,97%)、(+)-L-抗坏血酸钠(99%)、碳二亚胺(EDC,99%)、五水硫酸铜(98%)、2-溴丙酸甲酯(MBrP,99%)均为百灵威科技有限公司产品;D-甘露糖(D-Mannose,分析纯)购于国药集团化学试剂有限公司;溴化亚铜(CuBr,99%)、氯化亚铜(CuCl,99%),购自阿拉丁试剂公司;1-羟基苯并三唑(HOBT,99%),购自迈瑞尔试剂公司;9, 10-蒽基-双(亚甲基)二丙二酸(ABDA,90%),购自Sigma试剂公司。
1.2 仪器AVANCE 400M型核磁共振仪,德国Bruker公司生产;Nexus 470红外光谱仪(FTIR),美国Nicolet公司生产;Nano ZS动态光散射仪(DLS),英国Malvern公司生产;Waters1515凝胶渗透色谱(GPC)仪,美国Waters公司生产;JEM-2 100透射电子显微镜(TEM),日本电子株式会社生产;激光共聚焦显微镜(CLSM),日本尼康株式会社生产。
1.3 Man-PAA-b-PGMA-BODIPY的合成 1.3.1 氨基-α-D-吡喃甘露糖的合成按照参考文献[20]制备氨基-α-D-吡喃甘露糖。
1.3.2 碘代炔基-BODIPY的合成 1.3.3 PtBA-b-PGMA的合成按照参考文献[23-24]制备嵌段共聚物PtBA-b-PGMA。
1.3.4 Man-PAA-b-PGMA-BODIPY的合成称取0.5 g PtBA-b-PGMA溶解在3 ml无水二氯甲烷(DCM)中,密封烧瓶,在氩气保护下,向瓶中加入1.5 ml无水四氢呋喃(THF),室温下搅拌反应2 h,再向反应瓶中加入1.5 ml无水THF,反应2 h后,向反应瓶中加入0.5 ml H2O,搅拌反应3 h。终止反应,旋转蒸发除去溶剂,向反应液中加入3 ml H2O,冻干即可得PAA-b-PGMA。
称取200 mg嵌段共聚物PAA-b-PGMA溶解在20 ml无水N, N′-二甲基甲酰胺(DMF)中,密封烧瓶,在氩气保护下,冰浴搅拌40 min,在室温下向反应瓶中加入505 mg EDC,356 mg HOBT,室温搅拌15 min,然后升温至40 ℃反应3 h。在冰浴条件下向反应瓶中加入0.8 ml三乙胺和378 mg氨基-α-D-吡喃甘露糖,在冰浴条件下搅拌1 h后,室温反应24 h。终止反应,将反应液过滤,有机溶剂旋出,将反应液移至截留分子量为15 000的透析袋内透析三天。透析结束后冷冻干燥,即可得Man-PAA-b-PGMA。
称取120 mg Man-PAA-b-PGMA溶解于7.5 ml无水DMF中,在氩气保护下,向反应瓶中加入42 mg叠氮钠, 33 mg氯化铵,在50 ℃搅拌反应15 h。终止反应,待反应液冷却至室温后,过滤后将有机溶剂旋出抽干,即可得Man-PAA-b-PGMA-N3。
量取3 ml蒸馏水于20 ml样品瓶中,通氩气鼓泡10 min除去水溶氧,氩气保护下,加入17 mg五水硫酸铜,搅拌溶解后,加入45 mg抗坏血酸钠,制得A混合溶液备用。将60 mg Man-PAA-b-PGMA-N3溶于5 ml无水DMF中,氩气保护下,加入53 mg BODIPY制得B溶液,将反应瓶密封,将A混合溶液加到B中,70 ℃反应48 h。终止反应,将反应液过滤除去不溶物,滤液移至透析袋(MWCO 15000)进行透析,透析3天冷冻干燥,即可得Man-PAA-b-PGMA-BODIPY。
1.4 负载光敏剂的聚合物胶束单态氧的测定单态氧的生成对于成功制备负载光敏剂的聚合物胶束是一个非常重要的参数。使用ABDA作为单态氧生成的捕获剂,它能够被生成的单态氧氧化使荧光吸收强度降低,从而表征负载光敏剂的聚合物胶束单态氧的生成。称取1 mg ABDA溶于1 ml二甲亚砜(DMSO)中,配置成1 mg/ml的母液待用。通过Agilent Cary Eclipse荧光分光光度计测定ABDA的最适浓度为0.004 mg/ml,再配制1 mg/ml负载光敏剂的聚合物胶束水溶液,通过实验条件摸索最佳检测浓度为0.0002 mg/ml;将配制好的0.0002 mg/ml负载光敏剂的聚合物胶束水溶液加到0.004 mg/ml的ABDA溶液中。在535 nm的LED光源下对溶液进行连续0、2、4、6、8、10、12min照射,在激发波长为380 nm的条件下,测定上述溶液在荧光波段(390 nm~500 nm)处的荧光光谱。
1.5 负载光敏剂的聚合物胶束的细胞内吞将对数期生长的MDA-MB-231和HEK293两种细胞分别接种于U-dish中,在培养箱中孵育24 h使其贴壁。向U-dish中加入含有负载光敏剂的聚合物胶束(45 μg/ml)的培养液继续培养24 h。移除培养液,用pH 7.4的磷酸盐缓冲液(PBS)清洗3次。4.0%的甲醛固定细胞后用1 μg/ml的DAPI染色。在CLSM下观察负载光敏剂的聚合物胶束在细胞内的分布情况,观察的激发波长为405/561 nm,发射波长为417~477/570~1000 nm。
1.6 负载光敏剂的聚合物胶束的光动力治疗将对数期生长的MDA-MB-231和HEK293两种细胞分别接种于U-dish中,在培养箱中孵育24 h使其贴壁。向U-dish中加入含有负载光敏剂的聚合物胶束(45 μg/ml)的培养液继续培养24 h。弃去培养液,加入1 ml新鲜培养基,在535 nm的LED光源下照射50 min,移除培养液。然后用4.0%的甲醛将细胞固定并染色。在CLSM观察细胞形态,观察的激发波长为405/561 nm,发射波长为417~477/570~1000 nm。
1.7 细胞毒性评价采用MTT实验在光暗条件下评价负载光敏剂的聚合物胶束的细胞毒性。将100 μl MDA-MB-231或HEK293的细胞悬液植于96孔板,10 000个细胞/孔。在培养箱中孵育24 h,用pH 7.4的PBS清洗3次,向每孔中加入含不同浓度负载光敏剂的聚合物胶束的培养液。培养48 h后,移除培养液,用pH 7.4的PBS清洗3次,向每孔中加入100 μl MTT溶液(1mg/ml)继续培养4 h。每孔用100 μl DMSO替换100 μl MTT溶液,摇床振荡15 min。用酶标仪在490 nm处测量各孔的吸光度值(OD)。
2 结果与分析 2.1 Man-PAA-b-PGMA-BODIPY的合成Man-PAA-b-PGMA-BODIPY的合成路线如图 1所示。首先以MBrP为引发剂引发单体tBA聚合,得到PtBA;再以PtBA作为大分子引发剂引发单体GMA聚合,制得嵌段共聚物PtBA-b-PGMA,通过调整引发剂和单体的比例,结合核磁共振氢谱和GPC对其结构进行确认及分析,最终选取最适比例和分散性良好的嵌段共聚物PtBA126-b-PGMA42,通过GPC测得共聚物相对分子量为16 924,其分散系数为1.36;然后经水解反应将PtBA上的叔丁基脱去生成羧基,核磁氢谱如图 2a所示,在5.2×10-6处即为羧基上氢的特征峰;下一步通过酰胺缩合反应将氨基α-D-吡喃甘露糖修饰在PtBA的羧基端,核磁氢谱如图 2b所示,在3.5~4.0×10-6处即为甘露糖上质子氢的特征峰;接下来PGMA上的环氧基通过叠氮钠开环生成带有叠氮基的Man-PAA126-b-PGMA42-N3。最后通过“click”反应,将带有炔基的光敏剂BODIPY共价连接到Man-PAA126-b-PGMA42-N3上,制得Man-PAA126-b-PGMA42-BODIPY,核磁氢谱如图 2c所示,在7.3~7.6×10-6处即为光敏剂BODIPY苯环上氢的特征峰,在8.2×10-6处即为三氮唑上氢的特征峰,标志着BODIPY的成功引入和“click”反应的成功发生。
|
| 图 1 Man-PAA-b-PGMA-BODIPY的合成示意 Figure 1 Synthetic route of the Man-PAA-b-PGMA-BODIPY |

|
| 图 2 嵌段聚合物的核磁共振1H NMR谱图 Figure 2 1H NMR spectra of the polymers (a) PAA126-b-PGMA42. (DMSO as solvent) (b) Man-PAA126-b-PGMA42. (DMSO as solvent) (c) Man-PAA126-b-PGMA42-BODIPY (DMF as solvent) |
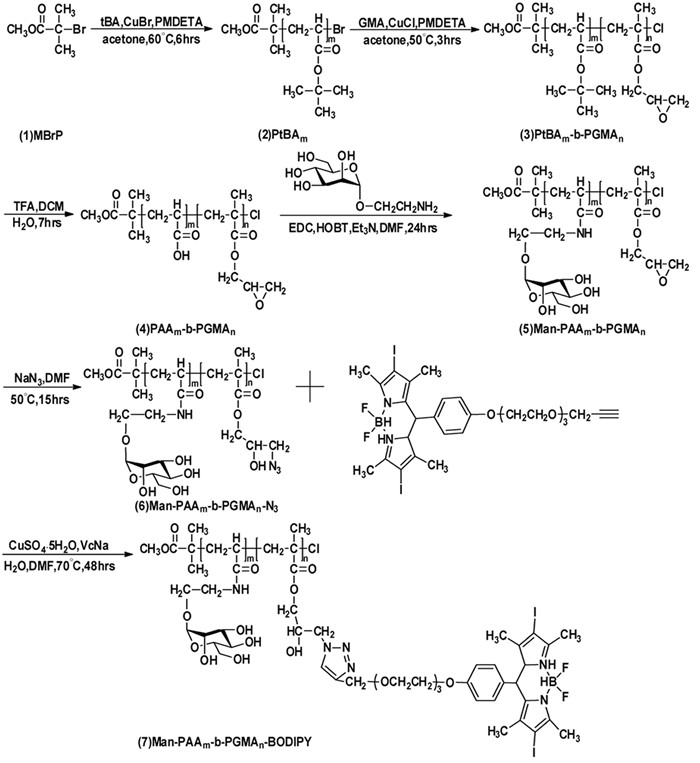
如图 3a所示,在1 720 cm-1处出现较强的伸缩振动峰,即为PtBA126-b-PGMA42的C=O伸缩振动峰,经水解后生成PAA126-b-PGMA42,如图 3b所示,在1 740 cm-1处出现较明显的伸缩振动峰,即水解后生成的羧基特征峰;然后PAA126-b-PGMA42通过酰化反应将氨基α-D-吡喃甘露糖引入生成Man-PAA126-b-PGMA42,如图 3c所示,在1 670 cm-1处出现明显的伸缩振动峰,即生成的酰胺键的特征峰;随后Man-PAA126-b-PGMA42上的环氧基通过叠氮钠开环生成带有叠氮基的Man-PAA126-b-PGMA42-N3,如图 3d所示,在2 106 cm-1处明显地看到伸缩振动峰,即叠氮基的特征峰;最后Man-PAA126-b-PGMA42-N3通过“click”反应,将带有炔基的光敏剂BODIPY成功引入生成Man-PAA126-b-PGMA42-BODIPY,如图 3e所示,在2 106 cm-1处的特征峰消失,在1 637 cm-1处出现较明显的伸缩振动峰,即三氮唑的特征峰,从而标志着“click”反应的成功发生和负载光敏剂的聚合物胶束的成功合成。
|
| 图 3 嵌段聚合物的红外光谱 Figure 3 FT-IR spectra of the polymers a: PtBA126-b-PGMA42; b: PAA126-b-PGMA42; c: Man-PAA126-b-PGMA42; d: Man-PAA126-b-PGMA42-N3; e: Man-PAA126-b-PGMA42-BODIPY |
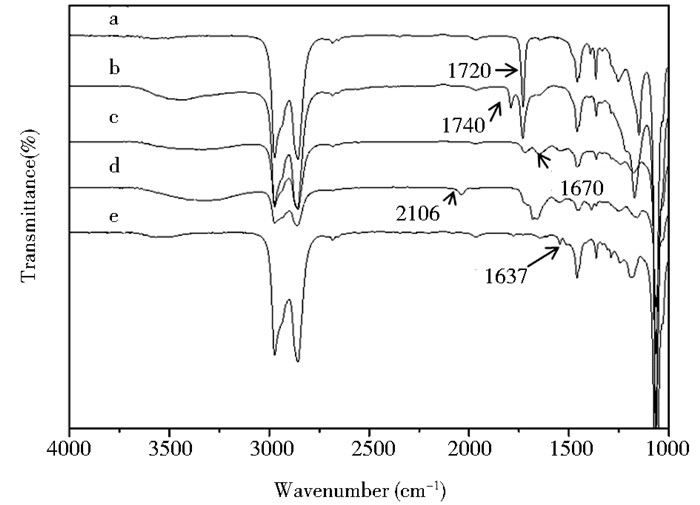
通过TEM观察负载光敏剂的聚合物胶束的形貌,结果见图 4a,负载光敏剂的聚合物胶束呈球形且粒径分散均匀,分散性良好。通过DLS测定负载光敏剂的聚合物胶束的流体力学直径,结果见图 4(b),负载光敏剂的聚合物胶束在水溶液中粒度分布较窄(PDI =0.298),其流体力学直径为178 nm。
|
| 图 4 负载光敏剂的聚合物胶束的透射电镜照片(a)和水溶液中的流体力学直径分布(b) Figure 4 The TEM image of Man-PAA126-b-PGMA42-BODIPY (a) and its diameter and distribution (b) |
单态氧的产生是对光敏剂的光动力疗效评估所必不可少的参数。负载光敏剂的聚合物胶束在特定波长光照下产生的单态氧能将单态氧的捕获剂ABDA氧化。使ABDA荧光强度在400~490 nm的吸收峰减弱,进而间接证明负载光敏剂的聚合物胶束在特定波长光照下产生单态氧。由图 5a可知,单态氧捕获剂在535 nm的LED光照下不会产生单态氧。由图 5b可知,负载光敏剂的聚合物胶束在535 nm的LED光照下产生的单态氧将捕获剂ABDA氧化,其荧光猝灭,从图中明显看出随着照射时间的延长,单态氧不断产生。以上实验结果证明,负载光敏剂的聚合物胶束在特定波长光照下产生单态氧,为理想的光动力疗效提供了一个非常重要的参数。

|
| 图 5 不同时长(0、2、4、6、8、10、12 min)光(535 nm, 20 mW/cm2)照下ABDA的荧光光谱(波长范围390~500 nm) Figure 5 Fluorescence spectra (between 390 and 500 nm) of ABDA in DMSO (a) and ABDA plus Man-PAA126-b-PGMA42-BODIPY in DMSO (b) Irradiated with a 535 nm LED light (20 mW/cm2) in varied time |
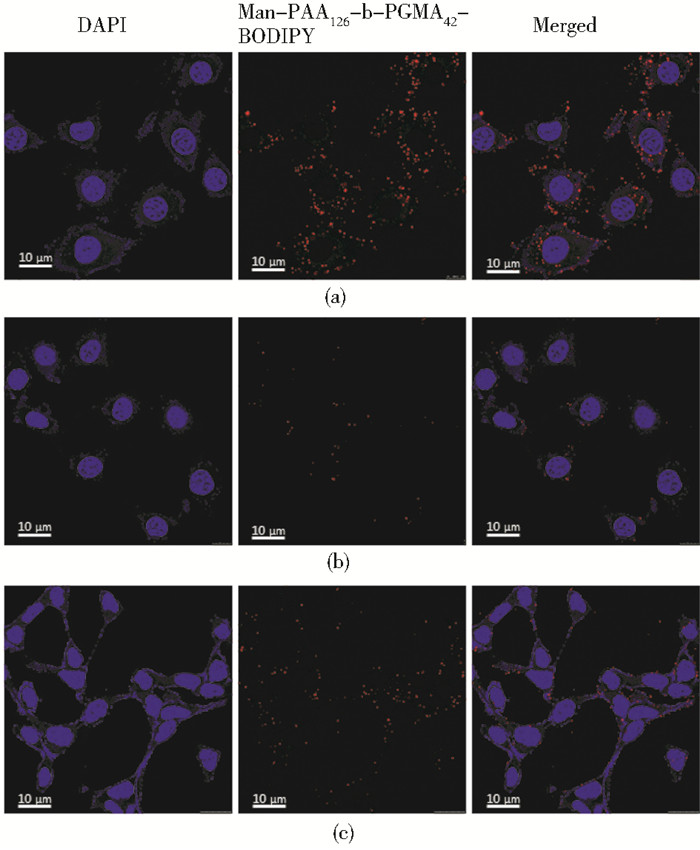
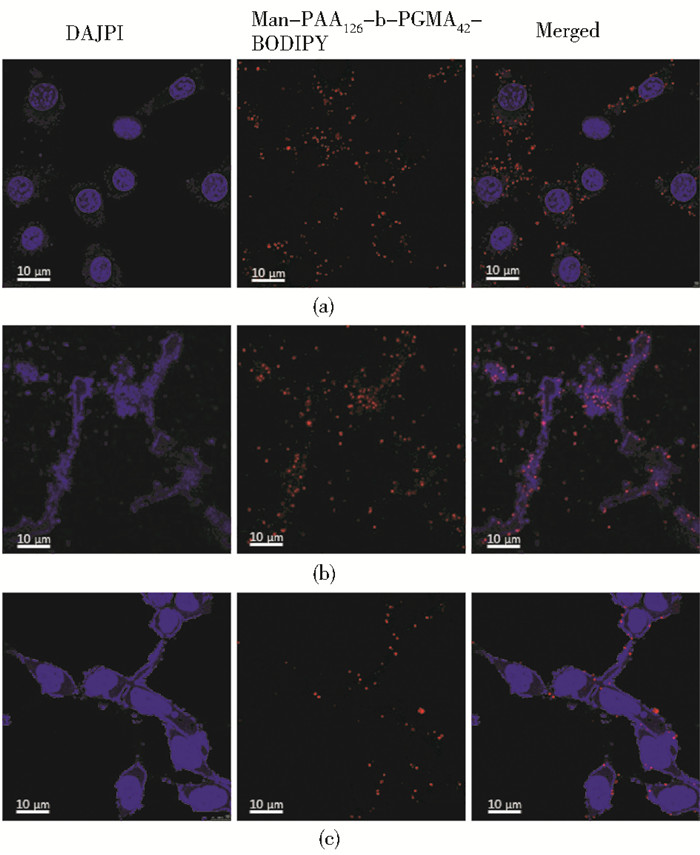
通过CLSM考察负载光敏剂的聚合物胶束的细胞内吞作用,结果见图 6。选取MDA-MB-231和HEK293两种细胞作为细胞内吞实验研究的细胞模型,分别与负载光敏剂的聚合物胶束进行培养,再选取一组同样的MDA-MB-231细胞先进行甘露糖封堵,再与负载光敏剂的聚合物胶束进行培养;细胞核经DAPI染色后呈蓝色,BODIPY自身发红色荧光,因此,负载光敏剂的聚合物胶束呈红色。如图 6a所示,未经甘露糖封堵的MDA-MB-231细胞内出现红色荧光,且在红色荧光和蓝色荧光叠加部分较明显,说明负载光敏剂的聚合物胶束被MDA-MB-231癌细胞大量摄取进入细胞内。如图 6b所示,被甘露糖封堵后MDA-MB-231癌细胞表面的甘露糖受体大量减少,从而在MDA-MB-231癌细胞内基本没有出现红色荧光,该现象与未被封堵的MDA-MB-231癌细胞形成较明显的差异。如图 6c所示,由于在HEK293正常细胞表面的甘露糖受体低表达,导致HEK293细胞内出现的红色荧光较弱。上述实验结果证明了负载光敏剂的聚合物胶束能够被MDA-MB-231癌细胞表面的甘露糖受体特异性识别内吞进入到细胞,而细胞表面甘露糖受体低表达的HEK293正常细胞只摄取少量的负载光敏剂的聚合物胶束。
|
| 图 6 MDA-MB-231癌细胞,甘露糖封堵的MDA-MB-231癌细胞和HEK293正常细胞分别对Man-PAA126-b-PGMA42-BODIPY的摄取情况 Figure 6 Celluar uptake of Man-PAA126-b-PGMA42-BODIPY (a) MDA-MB-231 cancer cells (b) MDA-MB-231 cancer cells with mannose competition (c) HEK293 normal cell |
细胞水平上的光动力疗效,是评价光敏剂光疗性能的重要参数。通过CLSM对经光暗条件处理的MDA-MB-231癌细胞和HEK293正常细胞进行形态的考察和评价。如图 7所示:图 7a未经535 nm LED灯光照,细胞核大小均一且圆润,图 7b经LED光照50 min后,可以看到与图 7a呈现明显的差异,其细胞核严重蜷缩且被破坏。图 7c经LED光照50 min,其细胞形态未发生破坏。以上实验结果证明负载光敏剂的聚合物胶束对MDA-MB-231癌细胞具有良好的光动力治疗效果,经535 nm LED灯光照后,其诱导产生的单态氧对MDA-MB-231癌细胞具有较大的杀伤作用。
|
| 图 7 Man-PAA126-b-PGMA42-BODIPY(45 μg/ml)与MDA-MB-231癌细胞共培养24 h暗环境(a)和光照50 min(b),与HEK293正常细胞共培养24 h光照50 min (c)的激光共聚焦显微镜照片 Figure 7 CLSM images of PDT with Man-PAA126-b-PGMA42-BODIPY micelles (45μg/ml) (a) MDA-MB-231 cancer cells in dark (b) MDA-MB-231 cancer cells and (c) HEK293 with 535 nm LED irradiation |
采用MTT法考察负载光敏剂的聚合物胶束在光暗条件下对MDA-MB-231和HEK293两种细胞的细胞毒性,以评估负载光敏剂的聚合物胶束的生物相容性及光动力治疗疗效。分别配制5种浓度的负载光敏剂的聚合物胶束:0、50、100、150、200、250 μg/ml,将培养的细胞分为A组和B组,两组细胞培养24 h后加入不同浓度的负载光敏剂的聚合物胶束溶液继续培养24 h,A组通过酶标仪统计细胞存活率,B组在535 nm的LED灯下照射30 min,通过酶标仪统计细胞存活率。结果如图 8所示,由图 8a可知,负载光敏剂的聚合物胶束溶液浓度达到250 μg/ml,两种细胞存活率仍在90%以上,说明负载光敏剂的聚合物胶束对MDA-MB-231癌细胞和HEK293正常细胞无暗毒性,生物相容性较好。由图 8b可知,两组细胞经光照后随着胶束溶液浓度的不断增大,MDA-MB-231癌细胞存活率不到20%,而HEK293正常细胞存活率仍在85%以上,结果显示负载光敏剂的聚合物胶束能被MDA-MB-231癌细胞表面高表达的甘露糖受体特异性识别进入细胞内,而细胞表面甘露糖受体低表达的HEK293正常细胞只摄取少量的负载光敏剂的聚合物胶束。以上实验结果证明,负载光敏剂的聚合物胶束对肿瘤细胞具有较好的靶向识别作用,且该胶束在特定波长的光照下通过产生的单态氧对肿瘤细胞具有较理想的杀伤作用,可作为潜在的光敏剂应用于癌症的光动力治疗。

|
| 图 8 在不同浓度下Man-PAA126-b-PGMA42-BODIPY与MDA-MB-231癌细胞和HEK293正常细胞共培养24 h后的细胞存活率(a)和在535 nm LED灯照射30 min后细胞存活率(b) Figure 8 Viability of MDA-MB-231 cells and HEK293 cells after 24h of incubation with Man-PAA126-b-PGMA42-BODIPY doses followed by incubation in the dark(a) or irradiation with a 535 nm LED light for 30 min (b) |
本研究合成嵌段聚合物PtBA126-b-PGMA42,在聚合物的一端修饰上甘露糖,另一端通过共价键连接上BODIPY,利用嵌段聚合物上的亲疏水片段形成负载光敏剂的聚合物纳米胶束。通过研究负载光敏剂的聚合物胶束的形貌特征,粒径大小,并考察其对MDA-MB-231癌细胞和HEK293正常细胞的光动力疗效。结果显示,负载光敏剂的聚合物胶束能被MDA-MB-231癌细胞表面高表达的甘露糖受体特异性识别内吞进入细胞,在LED灯照射下,负载光敏剂的聚合物胶束对MDA-MB-231癌细胞具有较好的杀伤作用,而对HEK293正常细胞毒性作用较小。因此,所制备的具有靶向功能和光动力疗效的负载光敏剂的聚合物胶束有望成为一种理想的新型光敏分子胶束,应用于癌症的光动力治疗。
| [1] |
Tian J, Ding L, Xu H J, et al. Cell-specific and pH-activatablerubyrin-loaded nanoparticles for highly selective near-infrared photodynamic therapy against cancer. Journal of the American Chemical Society, 2013, 135(50): 18850-18858. DOI:10.1021/ja408286k |
| [2] |
Garland M J, Cassidy C M, Woolfson D, et al. Designing photosensitizers for photodynamic therapy:strategies, challenges and promising developments. Future Med Chem, 2009, 1(4): 667-691. DOI:10.4155/fmc.09.55 |
| [3] |
Huang L, Li Z J, Zhao Y, et al. Ultralow-power near infrared lamp light operable targeted organic nanoparticle photodynamic therapy. J Am Chem Soc, 2016, 138(44): 14586-14591. DOI:10.1021/jacs.6b05390 |
| [4] |
付怀秀, 于翔, 康宏向, 等. Photosan脂质立方液晶纳米光敏剂的制备及光动力杀伤效应研究. 中国生物工程杂志, 2015, 35(3): 35-41. Fu H X, Yu X, Kang H X, et al. Preparation of photosensitizer-loaded cubic liquid crystalline and its photodynamic therapy effects. China Biotechnology, 2015, 35(3): 35-41. |
| [5] |
Tang C Y, Liao Y H, Tan G S, et al. Targeted photosensitizer nanoconjugates based on human serum albumin selectively kill tumor cells upon photo-irradiation. RSC Adv, 2015, 5(62): 50572-50579. DOI:10.1039/C5RA05251C |
| [6] |
Ge Y, Weng X, Tian T, et al. A mitochondria-targeted zinc(Ⅱ) phthalocyanine for photodynamic therapy. Rsc Advances, 2013, 3(31): 12839-12846. DOI:10.1039/c3ra41647j |
| [7] |
Lu Z, Zhang X, Wu Z, et al. BODIPY-based macromolecular photosensitizer with selective recognition and enhanced anticancer efficiency. Rsc Advances, 2014, 4(37): 19495-19501. DOI:10.1039/c4ra01412j |
| [8] |
Liu Z J, Yao P. Versatile injectable supramolecular hydrogels containing drug loaded micelles for delivery of various drugs. Polymer Chemistry, 2014, 5(3): 1072-1081. DOI:10.1039/C3PY01083J |
| [9] |
Meng Q B, Kou Y Y, Ma X, et al. Tunable self-assembled peptide amphiphile nanostructures. Langmuir, 2012, 28(11): 5017-5022. DOI:10.1021/la3003355 |
| [10] |
Zhang Y, Wang C, Xu C, et al. Morpholino-decorated long circulating polymeric micelles with the function of surface charge transition triggered by pH changes. Chemical Communications, 2013, 49(66): 7286-7288. DOI:10.1039/c3cc43334j |
| [11] |
Liu T J, Liu S, Sheng S H, et al. EPR effect of amphiphilic copolymer micelles observed by fluorescent imaging. Chem Res Chin Univ, 2011, 27(4): 628-634. |
| [12] |
Noh T H, Kook Y H, Park C Y, et al. Block copolymer micelles conjugated with anti-EGFR antibody for targeted delivery of anticancer drug. Journal of Polymer Science, Part A:Polymer Chemistry, 2008, 46(22): 7321-7331. DOI:10.1002/pola.v46:22 |
| [13] |
Danhier F, LeBreton A, Preat V. RGD-based strategies to target alpha(v) beta(3) integrin in cancer therapy and diagnosis. Molecular Pharmaceutics, 2012, 9(11): 2961-2973. DOI:10.1021/mp3002733 |
| [14] |
Prabaharan M, Grailer J J, Pila S, et al. Folate-conjugated amphiphilic hyperbranched block copolymers based on Boltorn® H40, poly(l-lactide) and poly(ethylene glycol) for tumor-targeted drug delivery. Biomaterials, 2009, 30(16): 3009-3019. DOI:10.1016/j.biomaterials.2009.02.011 |
| [15] |
汪舒婷, 张权, 叶舟, 等. D-甘露糖修饰聚合物胶束的制备及其在靶向药物输送中的应用. 生物工程学报, 2016, 32(1): 84-94. Wang S T, Zhang Q, Ye Z, et al. D-mannose-conjugated polymeric micelles for targeted drug delivery. Chin J Biotech, 2016, 32(1): 84-94. |
| [16] |
Wang S T, Zhang Q, Ye Z, et al. Tumour-targeted drug delivery with mannose-functionalized nanoparticles self-Assembled from amphiphilic β-cyclodextrins. Chem Eur J, 2016, 22(43): 15216-15221. DOI:10.1002/chem.v22.43 |
| [17] |
Liu L, Fu L, Jing T, et al. pH-triggered polypeptides nanoparticles for efficient BODIPY imaging-guided near infrared photodynamic therapy. Acs Applied Materials & Interfaces, 2016, 8(14): 8980-8990. |
| [18] |
Kamkaew A, Lim S H, Hong B L, et al. BODIPY dyes in photodynamic therapy. Chem Soc Rev, 2013, 42(1): 77-88. DOI:10.1039/C2CS35216H |
| [19] |
Zhang Q, Cai Y, Wang X J, et al. Targeted photodynamic killing of breast cancer cells employing heptamannosylated β-cyclodextrin-mediated nanoparticle formation of an adamantine-functionalized BODIPY photosensitizer. Acs Applied Materials & Interfaces, 2016, 8(49): 33405-33411. |
| [20] |
Kaya E, Gutsmiedl K, Vrabel M, et al. Synthesis of threefold glycosylated proteins using click chemistry and genetically encoded unnatural amino acids. Chembio Chem, 2009, 10(18): 2858-2861. DOI:10.1002/cbic.v10:18 |
| [21] |
Lu G, Lam S, Burgess K. An iterative route to "decorated" ethylene glycol-based linkers. Chemical Communications, 2006, 2006(15): 1652-1654. |
| [22] |
Ke M R, Yeung S L, Ng D K, et al. Preparation and in vitro photodynamic activities of folate-conjugated distyryl boron dipyrromethene based photosensitizers. Journal of Medicinal Chemistry, 2013, 56(21): 8475-8483. DOI:10.1021/jm4009168 |
| [23] |
Qin J, Jiang X, Gao L, et al. Functional polymericnanoobjects by cross-linking bulk self-assemblies of poly(tert-butylacrylate)-block-poly(glycidylmethacrylate). Macromolecules, 2010, 43(19): 3103-3109. |
| [24] |
Frenzel R, Höhne S, Hanzelmann C, et al. Tunable hydrophilic or amphiphilic coatings:A "reactive layer stack" approach. Acs Applied Materials & Interfaces, 2015, 7(23): 12355-12366. |
 2017, Vol. 37
2017, Vol. 37




