文章信息
- 杨恬然, 吴世杰, 辛明秀.
- YANG Tian-ran, WU Shi-jie, XIN Ming-xiu.
- 达托霉素作为新的胰蛋白酶激活剂的初探
- Study on Daptomycin as a New Trypsin Activator
- 中国生物工程杂志, 2017, 37(10): 26-32
- China Biotechnology, 2017, 37(10): 26-32
- http://dx.doi.org/DOI:10.13523/j.cb.20171004
-
文章历史
- 收稿日期: 2017-04-13
- 修回日期: 2017-05-19
达托霉素(daptomycin)是由玫瑰孢链霉菌产生,对多重耐药革兰氏阳性细菌有快速杀菌作用的环脂肽类抗生素,2003年美国食品与药物管理局(Food and Drug Administration,FDA)允许将该抗生素用于治疗由革兰氏阳性病原体引起的皮肤和软组织结构感染。达托霉素是第一批批准使用的环脂肽类新型抗生素,近年来主要围绕其杀菌机制开展研究工作[1-3]。本研究发现,达托霉素可促进胰蛋白酶的活性,而胰蛋白酶是蛋白质组学(Proteogenomics)分析中重要的工具酶。因此,达托霉素作为胰蛋白酶的激活剂在蛋白质组学分析中具有潜在应用价值。
胰蛋白酶因其良好的质谱特征使其广泛应用于蛋白质组学分析中[4]。蛋白质组学研究需要快速有效地分析大量的蛋白质,鉴定其种类,以及确定其各种修饰位点[5]。目前,蛋白质组学研究已经取得了许多重要发现,如大规模绘制出了蛋白质-蛋白质相互作用的网络图谱,定量分析了蛋白质翻译后修饰以及绘制了人类第一张蛋白质图谱[6]等。蛋白质组学研究策略中最常用的是自下而上(bottom-up)的方法[7],在这一研究方法中首先利用胰蛋白酶将目的蛋白质破碎为短肽后再进行串联质谱分析。胰蛋白酶作为丝氨酸蛋白酶家族中的特异性肽链内切酶使用,底物蛋白被胰蛋白酶酶解后会得到C-端为精氨酸或赖氨酸的C-端质子化的多肽,有利于其后的多肽测序[8]。因此,绝大多数蛋白质组学分析首先选择胰蛋白酶来破碎靶标蛋白[9-10]。
利用胰蛋白酶进行酶解靶标蛋白的过程中有几个方面的问题需要解决。首先是胰蛋白酶的催化效率有待提高,常规酶解需要在pH 8和37℃反应12~18h。长时间的酶解反应会导致蛋白质的一些较为脆弱的基团在这段时间内发生磷酸化位点的变化,还有些位点发生氧化等,导致对蛋白质结构分析失真。其次是胰蛋白酶本身是蛋白质存在自降解,酶分子间相互催化降解为多肽,增加了体系的复杂程度。三是蛋白质的溶解度不同,也会影响胰蛋白酶对蛋白质的降解和消化。向酶解液中加入一些试剂可增加底物蛋白的可溶解性,如二硫苏糖醇用于降低二硫键,碘乙酸或碘乙酰胺降低半胱氨酸的烷化[11],从而得到完全降解的蛋白质化合物。对于肌血球素和膜蛋白等难消化的蛋白,增加脱氧胆酸钠可提高蛋白质的变性及酶解效率[12]。
达托霉素是一种脂肽类抗生素,同时是一种生物表面活性剂。生物表面活性剂具有增溶的作用[13],本研究发现达托霉素可增强胰蛋白酶的比活性。因此,达托霉素具有增溶和提高胰蛋白酶比活性的双重功能。在蛋白质组学分析的酶解过程中加入达托霉素,既可提高目的蛋白质的酶解效率又能提高胰蛋白酶的比活性,在蛋白质组学研究中具有潜在的应用价值。利用福林酚法研究了达托霉素对胰蛋白酶比活性的影响,并用计算机分子模拟技术和等温滴定量热法验证了达托霉素是一种新的胰蛋白酶激活剂。说明了达托霉素除具有抗菌、抗肿瘤等功能外,还具有提高胰蛋白酶比活性的新的生物学功能。既促进了对胰蛋白酶激活剂及其机制的认识,同时拓展了达托霉素新的功能,为达托霉素的功能研究奠定基础,为这种新型抗生素在酶激活等生物领域的研究提供了新的思路。
1 材料与方法 1.1 材料与仪器达托霉素(购自玛雅试剂公司),胰蛋白酶(1:2 500生工进口分装A100785-0001),福林酚试剂(北京鼎国昌盛生物技术有限公司),Tris,干酪素,酪氨酸,三氯乙酸,无水碳酸钠等均为分析纯试剂。
1.2 方法 1.2.1 不同浓度达托霉素对胰蛋白酶比活力的影响蛋白酶活性测定使用福林酚法[14-15]。将0.1 ml浓度分别为50、25、12.5、6.25、3.125、1.5625 μg/ml的达托霉素溶液分别加入到含有0.5 ml(0.5 mg/ml)和0.5 ml(2.5 mg/ml)的胰蛋白酶溶液的试管中,37 ℃恒温作用5 min;将2 ml用pH 8.0的磷酸缓冲液(0.2 mol/L)制备的1 %酪素分别加入到以上各反应试管中,37 ℃恒温作用15 min;然后分别向各管中加入3 ml浓度为10 %的三氯乙酸溶液,4 000 r/min离心3 min,分别取上清1 ml,加入5 ml Na2CO3(0.55 mol/L)和1 ml福林-酚试剂(1mol/L),37 ℃恒温中作用15 min,冷却静置10 min,于680 nm测定OD值,设置3个平行,空白对照组用无菌去离子水替代达托霉素,以酪氨酸作标准曲线。
胰蛋白酶比活力的定义为1mmol胰蛋白酶,在37摄氏度和pH=8.0条件下,1 min水解酪蛋白产生酪氨酸的微克数,其计算公式为:蛋白酶比活力=K·E·6/15·N·1/W。式中K代表吸收系数,E代表样品光密度,6代表水解液总体积(ml),15代表反应时间(min),N代表稀释倍数,W代表胰蛋白酶量(mmol)。达托霉素对胰蛋白酶的酶活激活率计算公式为:(J-C)/C×100%。式中J代表加了达托霉素后的胰酶比活,C代表不加达托霉素的胰酶比活。
1.2.2 达托霉素与胰蛋白酶晶体结构分子对接受配体文件准备:牛胰蛋白酶的空间结构数据通过RCSB蛋白质数据银行网站下载,将胰蛋白酶的空间结构数据保存为PDB文件,编号为4I8H。从chemspider网站获取达托霉素空间结构的mol数据(Daptomycin的ID为10482098)之后在openbabel软件上将mol文件转为mol2文件。
(1) LeDock打开mol2文件,通过pymol寻找活性口袋坐标,按照特定的格式输入到dock.in的信息之中,然后设置ligand poses的数量为30[16],保存信息。输入受体文件加氢以后,配置dock.in信息,输入受体文件信息,开始对接,得到结果。
(2) AutoDock vina运行PRODRG服务器将获取的mol2数据输入,然后获取PDB数据,存为PDB文件后待使用。然后通过ADT软件处理配受体,存为pdbqt文件备用。建立conf.txt文件,在其中用命令输入配体和受体,通过pymol输入活性口袋坐标等等信息,保存待用。打开cmd,输入命令,运行vina,得到最终结果。
1.2.3 等温滴定量热法[17](Isothermal titration calorimetry,ITC)检验胰蛋白酶与达托霉素的结合称取0.2142 g胰蛋白酶溶于1 ml Tris-HCl溶液(11 mmol/L, pH=8)置于截留分子量为10 kDa的即用型透析袋中,透析48 h;称取0.04862 g达托霉素溶于2 ml Tris-HCl溶液(11 mmol/L, pH=8)置于截留分子量为500 D的即用型透析袋中,透析48 h;最后12 h放在同一溶液中透析,该溶液可留作稀释缓冲液,透析后测定浓度。将透析后的达托霉素稀释到1.01 mmol/L,胰蛋白酶稀释到110.51 μmol/L,设置反应温度为25 ℃,将1.01 mmol/L的达托霉素滴定到110.51 μmol/L的胰蛋白酶溶液中,初始滴加体积0.5 μl,初次间隔时间1 s,随后每次滴加2 μl,滴加次数共20次,持续时间4 s,间隔150 s,过滤时长5 s,在25 ℃环境下收集数据,以buffer作为配体进行空白组实验对照。
2 结果 2.1 福林-酚法测定不同浓度达托霉素对胰蛋白酶活力的影响通过福林酚法得到了酪氨酸标准曲线如图 1a所示,线性拟合线为y = 0.0006x+0.0007,拟合系数R2为0.9965,拟合程度较高,可以用于胰蛋白酶酶活力的测定。如图 1b所示,当以0.5 mg/ml的胰蛋白酶浓度检测时,发现随着胰蛋白酶与达托霉素的摩尔比的增加,达托霉素对胰蛋白酶的酶活激活率也随之增加,当胰蛋白酶和达托霉素的摩尔比达到34.05时,达托霉素对胰蛋白酶比活力的激活率达到最高;为了进一步了解达托霉素对胰蛋白酶的激活规律,本文进一步增加了胰蛋白酶与达托霉素的摩尔比,以2.5 mg/ml的胰蛋白酶浓度进行检测,如图 1c所示,同样可以发现当胰蛋白酶和达托霉素的摩尔比为34.05时,达托霉素对胰蛋白酶比活力的激活率达到最大值,综合图 1b和图 1c结果可知当摩尔比达到34.05时,胰蛋白酶比活力平均增加了32.92 %,说明达托霉素对胰蛋白酶比活具有激活作用。

|
| 图 1 胰蛋白酶酶活力测定 Figure 1 Determination of trypsin enzymatic active (a) The standard curve of tyrosine (b) The Trypsin activity affected by the ratio of daptomycin when the concentration of trypsin was 0.5mg/ml (c) The trypsin activity affected by the ratio of daptomycin when the concentration of trypsin was 2.5mg/ml |
通过LeDock分子对接得到了一系列的对接能量值,选取最好的结合构象,通过pymol打开,观察达托霉素与胰蛋白酶的结合位置之间的关系(图 2a),达托霉素的结合位点与胰蛋白酶活性中心非常靠近,这会对酶活性中心的构象产生一定的影响。在pymol中可显示达托霉素与胰蛋白酶的相互作用(图 2b),从绿色箭头所示的部分可明显看到达托霉素链状结构中的天冬氨酸的R基与酶活性中心组氨酸-57发生了氢键相互作用。根据AutoDock vina结合能的大小和RMSD的值,选取其中最好的结果,在pymol中打开,观察达托霉素与胰蛋白酶的结合位置(图 2c),达托霉素与胰蛋白酶的活性中心结合较近,同时,在图中红色区域的中部发现,达托霉素的一个氨基酸伸入到胰蛋白酶表面环状结构形成的空腔之中。胰蛋白酶与达托霉素的相互作用如图 2d所示,可以发现达托霉素的天冬氨酸的R基与胰蛋白酶的组氨酸-57之间发生了相互作用。

|
| 图 2 达托霉素与胰蛋白酶分子对接结果 Figure 2 Molecular docking results between daptomycin and trypsin (a) The LeDOCK Surface combining conformation between trypsin and daptomycin Trypsin overall conformation is shown as green, conformation of trypsin activity center is shown as red and daptomycin overall conformation is shown as blue (b) The LeDOCK interaction between trypsin and daptomycin The activity of trypsin center is shown as red, daptomycin is shown as yellow and the hydrogen bond is shown as green arrow (c) The vina combining conformation between trypsin and daptomycin (d) The vina interaction between trypsin and daptomycin in which the hydrogen bond is shown in green arrow |
综合AutoDock vina和LeDock的结果,可以看出达托霉素与胰蛋白酶的活性位点很靠近,达托霉素链状结构中的天冬氨酸的R基与胰蛋白酶活性中心的组氨酸-57发生了氢键相互作用,推断这是导致达托霉素影响胰蛋白酶活性的原因之一。将达托霉素与胰蛋白酶和底物复合物进行分子对接发现达托霉素并不影响底物和胰蛋白酶的结合。比较两个方面的能量的最低值,发现达托霉素与胰蛋白酶结合以后,可使复合物能量由-7.32 kcal/mol降低到-10.81 kcal/mol,因此推测达托霉素可促进胰蛋白酶与底物形成稳定的复合物,更有利于酶的催化反应。
2.3 等温滴定量热法(Isothermal Titration Calorimetry, ITC)检验达托霉素与胰蛋白酶相互作用设置反应温度为25 ℃,将1.01 mmol/L的达托霉素滴定到110.51 μmol/L的胰蛋白酶溶液中,初始滴加体积0.5 μl,初次间隔时间1 s,随后每次滴加2 μl,滴加次数共20次,持续时间4 s,间隔150 s,过滤时长5 s。结果如图 3所示,图 3a上部分为胰蛋白酶和达托霉素的结合曲线,下部分为结合曲线通过积分得到的结合反应热对胰蛋白酶和达托霉素摩尔比的非线性拟合曲线,从图中可以看出达托霉素与胰蛋白酶的结合反应为吸热反应,随着滴定次数的增加,滴定曲线逐渐减小。图 3b为缓冲液与胰蛋白酶作用的对照组,图中数值散乱并没有显示明显趋势。利用模型得到该过程的解离常数、摩尔结合焓、摩尔结合熵和胰蛋白酶的达托霉素结合位点数分别为:Kd=17.83 μmol/L,△H=237.9±28.17 cal/mol,△S=22.5 cal/mol·deg,n=1.22±0.0993。当拟合曲线斜率最大时所对应的摩尔比为两者相互作用的化学计量学常数n,也就是说n值代表结合位点数[18],近似一个结合位点,与分子模拟中达托霉素的天冬氨酸的R基与胰蛋白酶的组氨酸-57之间发生了相互作用的结果一致,从热力学角度分析证明了分子模拟的结果。其Kd值并不高,说明达托霉素与胰蛋白酶的亲和力在反应体系中并不能完全与胰蛋白酶结合,只有在一定浓度比例下才能够完成结合,未结合的达托霉素在体系中起到增溶和促进结合的作用,因此酶活测定的结果也说明了这一点。
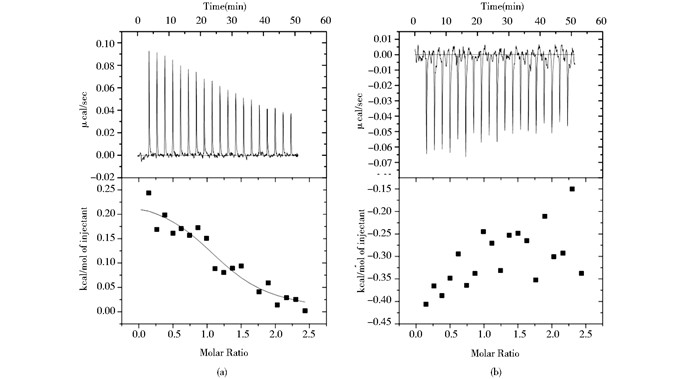
|
| 图 3 达托霉素与胰蛋白酶的ITC结果 Figure 3 ITC determination of the binding thermodynamics between daptomycin and trypsin (a) Titration of daptomycin into a trypsin solution (b) Titration of buffer into a trypsin solution |
本研究首次证明达托霉素作为一种新的胰蛋白酶激活剂,其激活机制可能是通过达托霉素的链状天冬氨酸的R基与酶活性中心组氨酸-57发生了氢键相互作用,从而促进酶与底物的结合,提高酶的催化活性。目前胰蛋白酶的激活剂主要分为物理激活剂、化学激活剂。有研究发现,超声波能够提高胰蛋白酶与底物碰撞的几率[19],从而提高酶活性;化学激活剂中,适宜浓度的Ca2+、Cd2+、Mg2+、Mn2+对胰蛋白酶均表现为显著性激活作用[20];适量甲醇可增强胰蛋白酶的催化活性[21];曲酸对胰蛋白酶也有一定程度的激活作用[22]。本研究中证明达托霉素作为一种具有生物表面活性的脂肽类抗生素也能激活胰蛋白酶的活性,这可拓展胰蛋白酶激活剂的种类,同时也为胰蛋白酶激活剂的设计提供了新的思路。
达托霉素自发现以来,证实其可用于治疗细菌引起的皮肤或皮肤组织感染[23]、菌血症和心内膜炎[24]、骨髓炎[25]以及肺炎[26]等。针对达托霉素可作用于多药耐药的革兰氏阳性菌的杀菌作用机制进行了许多研究[27],也发现其可对癌症及嗜中性白血球减少症有一定效果[28]。但尚未看到有关达托霉素对酶活性影响的报道。本文发现达托霉素具有胰蛋白酶激活剂的功能,丰富了对达托霉素功能的研究,为达托霉素在更多领域的应用提供了理论依据,拓展了达托霉素的应用范围。
本研究还有需要深入研究的问题,如如何增加胰蛋白酶和达托霉素的亲和力以增加催化效率,以及可进一步对达托霉素与胰蛋白酶复合物的晶体结构进行研究,从结构水平揭示其激活的机制。还可探索和研究达托霉素对其他酶的活性的影响,为达托霉素作为酶的激活剂奠定基础。
| [1] |
Kerry L T, Pharm D, Michael J R, et al. Daptomysin. Pharmacotherapy, 2004, 24(1): 41-57. DOI:10.1592/phco.24.1.41.34802 |
| [2] |
Andres B F, Ferdinand V, Ralf S, et al. Daptomycin:a novel lipopeptide antibiotic against Gram-positive pathogens. Infect Drug Resist, 2010, 3: 95-101. |
| [3] |
Robert S, Markus R, Wolfgang G, et al. Daptomycin:a review 4 years after first approval. Pharmacology, 2008, 81(2): 79-91. DOI:10.1159/000109868 |
| [4] |
Elien V A, Michael M, Lennart M. Getting intimate with trypsin, the leading protease in proteomics. Mass Spectrom Rev, 2013, 32(6): 453-465. |
| [5] |
Marc R W, Keith L W, Ron D A, et al. Proteome Research:New Frontiers in Functional Genomics. Berlin:Springer Berlin Heidelberg, 1997.1-12. http://www.springer.com/gp/book/9783662034934
|
| [6] |
Mathias W, Judith S, Hannes H, et al. Mass-spectrometry-based draft of the human proteome. Nature, 2014, 509(7502): 582-587. DOI:10.1038/nature13319 |
| [7] |
Michael B S, Nathan C V, David L T, et al. Characterization of the 70S ribosome from Rhodopseudomonas palustris using an integrated "top-down" and "bottom-up" mass spectrometric approach. J Proteome Res, 2004, 3(5): 965-978. DOI:10.1021/pr049940z |
| [8] |
王胜. 蛋白质组学高效酶解新技术. 上海: 复旦大学, 2008, 38-39. Wang S. A series of new strategies of high efficient proteolysis for proteomic analysis. Doctor Dissertation. Shanghai:Fudan University, 2008, 38-39. http://www.cnki.com.cn/Article/CJFDTOTAL-RPGY200908008.htm |
| [9] |
江锟. 鲈鱼蛋白的酶解工艺优化及活性肽的功能特性研究. 湖北: 华中农业大学, 2013, 5-6. Jiang K. Studies of bass protein hydrolysis process optimization and active peptide functional propertie. Master Dissertation. Hubei:Huazhong Agricultural University, 2013, 5-6. http://www.doc88.com/p-0008547109404.html |
| [10] |
刘宝阳. 蛋白质组学技术的改进及对肝细胞肝癌的研究. 天津: 天津医科大学, 2014, 5-10. Liu B Y. Proteomics technology improvement and the study of HCC. Master Dissertation. Tianjin:Tianjin Medical University, 2014, 5-10. |
| [11] |
王镜岩, 朱圣庚, 徐长法. 生物化学教程. 北京: 高等教育出版社, 2008, 161-163. Wang J Y, Zhu S G, Xu C F. Essential Biochemistry. Beijing: Higher Education Press, 2008, 161-163. |
| [12] |
林勇, 周健, 毕登, 等. 脱氧胆酸钠(SDC)促进的蛋白质酶解与鉴定. 中国科技论文在线精品论文. 2009, 2(7): 1-6. Lin Y, Zhou J, Bi D, et al. Sodium deoxycholate-improved enzymolysis and identification of proteins. The Best Online Papers in China Scientific and Technological Papers, 2009, 2(7):1-6. |
| [13] |
戴超. 脂肽类生物表面活性剂的提取工艺及其乳化性的研究. 南京: 南京农业大学, 2013, 10-11. Dai C. Lipopeptide biosurfactant process and its emulsifying properties. Doctor Dissertation.Nanjing:Nanjing Agricultural University, 2013, 10-11. |
| [14] |
Anson M L. The estimation of pepsin, trypsin, papain, and cathepsin with hemoglobin. J Gen Physiol, 1938, 22(1): 79-89. DOI:10.1085/jgp.22.1.79 |
| [15] |
Carrie C E. Sigma's non-specific protease activity assay -casein as a substrate. J Vis Exp, 2008, 19(19): 899. |
| [16] |
Hongtao Zhao. Tutorial for LeDock. Switzerland:Lephar Research, 2015.3-5.
|
| [17] |
张幼怡. 蛋白质-蛋白质相互作用方法与应用. 北京: 北京大学医学出版社, 2008, 39-57. Zhang Y Y. Beijing:Peking University Medical Press. 2008, 39-57. |
| [18] |
Emesto F, Obdulio L M, Martin S. Isothermal titration. Analytical Chemistry, 1990, 62(18): 950-959. DOI:10.1021/ac00217a715 |
| [19] |
朱少娟, 施用晖, 乐国伟. 超声波对胰蛋白酶水解酪蛋白的影响. 食品与生物技术学报, 2005, 24(2): 50-54. Zhu S J, Shi Y H, Le G W. Effects of ultrasound on the hydrolysis of casein by trypsin. Journal of Food Science and Biotechnology, 2005, 24(2): 50-54. |
| [20] |
胡毅. 三疣梭子蟹消化酶性质的研究. 青岛: 中国海洋大学, 2003, 37-44. Hu Y. Studies on characterization of the digestive enzymes from Portunus. Master Dissertation. Qingdao:Graduate School of Ocean University of China, 2003, 37-44. |
| [21] |
宋翼行, 黎春怡, 黄卓烈, 等. 甲醇对胰蛋白酶催化活性影响的机理研究. 生命科学研究, 2010, 14(4): 311-315. Song Y H, Li C Y, Huang Z L, et al. Study on the effects of carbinol solvents on trypsin activity. Life Science Research, 2010, 14(4): 311-315. |
| [22] |
李黎, 谭进, 刘志芳. 曲酸与胰蛋白酶相互作用的光谱学研究. 四川大学学报(自然科学版), 2009, 46(5): 1466-1472. Li L, Tan J, Liu Z F, et al. Studies on the interaction between kojic acid and trypsin by fluorescence spectrophotometry. Journal of Sichuan University (Natural Science Edition), 2009, 46(5): 1466-1472. |
| [23] |
Robert D A, Dennis M, Francis P T, et al. The safety and efficacy of daptomycin for the treatment of complicated skin and skin-structure infections. Clinical Infectious Diseases, 2004, 38(12): 1673-1681. DOI:10.1086/420818 |
| [24] |
Fowler V G, Boucher H W, Corey G R. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. N Engl J Med, 2006, 355(7): 653-665. DOI:10.1056/NEJMoa053783 |
| [25] |
Lamp K C, Friedrich L V, Mendez-Vigo L, et al. Clinical experience with daptomycin for the treatment of patients with osteomyelitis. Am J Med, 2007, 120(10): 13-20. |
| [26] |
Jared A S, Lawrence I M, Andrew D G, et al. Inhibition of daptomycin by pulmonary surfactant:in vitro modeling and clinical impact. J Infect Dis, 2005, 191(12): 2149-2152. DOI:10.1086/jid.2005.191.issue-12 |
| [27] |
Zhang T H. Daptomycin:mechanism of action and bacterial resistance. Canada:The University of Waterloo, 2015, 5-34. https://uwaterloo.ca/chemistry/events/calendar/2015-02
|
| [28] |
Rolston K V, McConnell S A, Brown J, et al. Daptomycin use in patients with cancer and neutropenia:data from a retrospective registry. Adv Hematol, 2010, 8(4): 249-256, 290. |
 2017, Vol. 37
2017, Vol. 37




