文章信息
- 司洪宇, 王丙莲, 梁晓辉, 张晓东.
- SI Hong-yu, WANG Bing-lian, LIANG Xiao-hui, ZHANG Xiao-dong.
- 酶电极法快速测定甘油含量的研究
- Study of Rapid Determination for Glycerol Content by Enzyme Electrode
- 中国生物工程杂志, 2016, 36(12): 79-85
- China Biotechnology, 2016, 36(12): 79-85
- http://dx.doi.org/DOI:10.13523/j.cb.20161212
-
文章历史
- 收稿日期: 2016-08-04
- 修回日期: 2016-09-13
2. 山东省生物质气化技术重点实验室 济南 250014;
3. 山东省科学院生物研究所 济南 250014;
4. 山东省生物传感器重点实验室 济南 250014
2. Key Laboratory for Biomass Gasification Technology of Shandong Province, Jinan 250014, China;
3. Biology Institute of Shandong Academy of Sciences, Jinan, 250014, China;
4. Key Laboratory for Biosensors of Shandong Province, Jinan 250014, China
甘油是一种重要的微生物碳源,发酵生产中,甘油作为碳源广泛应用于基因工程菌培养及生物活性大分子表达[1]。当前发酵领域广泛采用的毕赤酵母(Pichia pastoris),其生长阶段以甘油为唯一碳源,表达阶段以甲醇为碳源。研究表明,混合碳源的流加控制[2]、培养温度[3]等条件均影响毕赤酵母的活性或活力,进而影响重组蛋白的表达量。发酵后期,培养基中残留甘油则会抑制目的蛋白的表达[4]。因此,发酵液中甘油含量的监控是保证高发酵单位的关键,精确分析甘油含量在毕赤酵母类发酵过程中非常重要。
此外,作为一种重要的生物化工产品及平台化合物,甘油来源及应用均极其广泛[5]。无论是传统皂化废液蒸馏法,还是作为生物柴油副产物,甘油的质量控制及含量检测均至关重要[6-7]。另外,甘油浓度测定在食品和酒精饮料质量和鉴别真伪方面具有重要应用[8],因此其受到法律的严格监管,亦是各种饮料基质质量监控的常规手段。
目前,国内外有关发酵液中,甘油含量的测定方法有传统高碘酸氧化法、分光光度法、以及原子吸收法、气相色谱法[9]、近红外光谱法、高效液相色谱法[10]、甘油激酶法[11]等。但这些方法或者所需仪器昂贵, 样品前处理麻烦; 或操作繁琐, 实验精确度低。而且,甘油样品成分复杂,多羟基醇等类似产物,以及其他过渡碳源,甘露醇、山梨醇、海藻糖、乳酸等均对甘油的测定结果产生明显影响[12-13]。而较为快速的甘油检测试剂盒,价格昂贵,成本较高。所以皆不适于实际生产中甘油含量的快速测定及实时监控。依据SBA-40E型生物传感分析仪的测定原理,以及甘油相关生化反应,本论文采用酶固定化技术,研制高活性、高稳定性、高催化效率的甘油酶膜,制成甘油酶电极,并测定甘油含量,探讨其用于甘油检测的实用性及优势。
1 材料与方法 1.1 试剂与仪器甘油-3-磷酸氧化酶(GPO, EC 1.1.3.21; Aerococcus viridans, 96U/mg)、甘油激酶(GK, 2.7.1.30; Escherichia coli, 60U/mg):美国Sigma公司,Immobilon膜、Biodyne膜:美国Sigma公司,核微孔膜:美国Nucleopore公司,戊二醛、牛血清蛋白(BSA, 进口分装):上海化学试剂站,均为分析纯。
生物传感分析仪:SBA-40E型,山东省科学院生物研究所;精密pH计:上海雷磁仪器厂;台式离心机:上海安亭科学仪器厂;FA1004N型电子天平:上海天谱分析仪器有限公司。
1.2 测定原理试制的固定化甘油酶膜,采用特制的银-氯化银电极制成甘油酶电极,甘油酶电极催化底物进行反应,并由SBA-40E型设备读取响应的电流信息,从而实现甘油浓度的测定。反应原理为:甘油激酶与甘油-3-磷酸氧化酶专一性催化甘油底物生成甘油酮等产物和过氧化氢,其反应方程式如下:
 |
一定时间内,H2O2的产量与甘油含量成正比,SBA-40E型生物传感分析仪检测H2O2的电流信号,进行显示和记录。在一定浓度范围内,生物传感分析仪记录的电流信号与甘油含量呈线性关系。
1.3 甘油酶膜的研制 1.3.1 GK与GPO的固定化方法物理吸附法制备GK-GPO双酶酶膜:以GK:GPO质量比为1:1、2.5:1、5:1、1:2.5、1:5,分别配制0.5mg/10μl的GK-GPO混合酶液。按照葡萄糖酶膜制备方法[14],以核微孔膜为载体膜,将5μl的1% BSA、5μl的0.25%戊二醛、5μlGK-GPO酶液、1μl苯甲酸-庆大霉素混合液(体积比为1:1)混匀,滴注于载体膜,并涂布均匀,室温反应20min,未反应的戊二醛用0.1mol/L甘氨酸浸湿封闭后室温干燥。最后在制好的酶膜外层涂一层醋酸纤维素膜,以防止大分子物质的干扰,制备出随机固定化甘油酶膜,即(GK+GPO)-载体膜。后将各比例GK-GPO酶液所制酶膜用于甘油催化,记录并比较反应产生的电流信号,筛选GK、GPO随机吸附固定化的最佳比例。
共价结合法制备GK-GPO双酶酶膜:分别配制0.2mg/10μlGK、GPO酶液,以核微孔膜为载体。按方法[15-16]报道的共价固定化方法,先用2%二甲基硫酸和无水乙醇活化Biodyne膜,后以1%赖氨酸反应2h,再以12.5%戊二醛处理45min,最后以pH7.0、0.1mol/L磷酸缓冲液冲洗整夜,完成Biodyne膜的活化。吸取GPO液涂在活化的Biodyne膜的一侧,2min后吸取GK液涂于该膜的另一侧,同时GK酶液紧密附着在空白核微孔膜上,反应2h。Biodyne膜、核微孔膜共价偶联为双层膜,制备GK、GPO不均匀共价固定化酶膜,即GPO-Biodyne膜+GK-核微孔膜。测试该甘油酶膜对于甘油催化的电流信号。
1.3.2 GK与GPO固定化载体及固定模式采用Biodyne膜、ImmobilonAV膜、核微孔膜作为GK、GPO固定化载体膜材料。分别采用上述方法[14-16]及试验筛选的GK、GPO随机固定化最佳比例,以及GK-GPO双酶共价固定化方法。制备三种随机固定化酶膜,包括:(GK+GPO)-核微孔酶膜、(GK+GPO)-Biodyne膜、(GK+GPO)-Immobilon AV酶膜;以及两种共价固定酶膜,分别为GK-核微孔膜+GPO-Biodyne膜、和GK-核微孔膜+ GPO-Immobilon AV膜。比较几种甘油酶膜用于甘油催化时的响应电流信号,从而确定信号最强的甘油酶固定化载体膜,以及固定化方法模式。
1.4 测定方法制备的甘油酶膜安装于SBA系列专用过氧化氢电极,建立甘油酶电极系统。本实验采用0.1mol/L磷酸氢二钠-磷酸二氢钠缓冲液(pH=7.5)作为反应环境,保持反应温度25℃,设置反应时间为40s。依据SBA-40E型生物传感分析仪测定步骤,吸取25μl甘油标准溶液(质量浓度为9.0 g/L)注入酶电极反应池内,进行“定标”,再准确吸取同体积待测样品注入仪器反应池,反应40s后,仪器自动记录并显示响应电流信号及甘油浓度。
2 结果与分析 2.1 GK与GPO固定化方法筛选按“1.3.1 ”步骤,将GK、GPO按不同质量比进行物理吸附随机固定化、以及GK、GPO共价固定化所制甘油酶膜,分别装配为甘油酶电极,并进行甘油催化测试,记录各自响应的电流信号。每个测定重复4次,取其平均值,结果见图 1a、图 1b。图 1a表明,当GK、GPO质量比为1:1进行随机固定化时,甘油酶电极对甘油催化响应电信号最高。且在试验浓度范围内,且响应电信号与甘油浓度具有更好的线性关系,线性方程式为Y=313.1X+23.8,R2=0.998 9:线性范围亦更宽。图 1b显示,GK、GPO最佳比例(质量比为1:1)随机吸附固定化酶膜,与其共价固定化甘油酶膜,进行甘油催化活性比较时,在本试验浓度范围内,均选择核微孔膜为载体膜时,两种固定化模式中催化电流信号与甘油浓度的线性关系均良好。共价结合法所制GK-GPO酶膜,在同浓度甘油位点,其催化甘油的响应电流信号更高。鉴于以上结果,可以认为,对于甘油浓度的测定,共价固定化GK、GPO所制的GK-GPO双酶酶膜更高效。
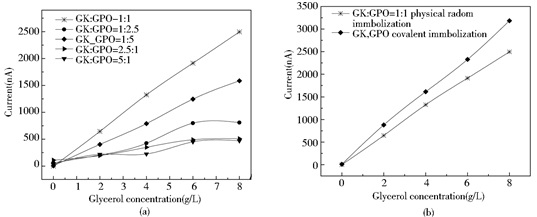
|
| 图 1 不同固定化甘油酶膜对甘油浓度的响应信号(n=4) Figure 1 Current signal response of enzyme membrane with different immobilization to glycerol concentration (n=4) |
采用“1.3.2 ”中三种不同载体膜,按GK、GPO最佳固定比例(GK:GPO=1:1)、以及最佳固定化方法制备五种甘油酶膜:(GK+GPO)-核微孔膜、(GK+GPO)-Biodyne膜、(GK+GPO)-Immobilon AV膜、GK-核微孔膜+GPO-Immobilon AV膜。该5种酶膜分别用于催化甘油时,分别测试其电流信号,每个测试重复4次,其结果如图 2。由图 2可知,GK:GPO=1:1随机固定化于核微孔膜所得(GK+GPO)-核微孔膜,以及GK、GPO分别共价固定于核微孔膜、Biodyne膜而制备的双酶酶膜:GK-核微孔膜+GPO-Biodyne膜,均对试验浓度范围内甘油含量呈现明显的线性曲线,且GK-核微孔膜+GPO-Biodyne酶膜的电流信号更高。故本研究最终选择GK-核微孔膜+GPO-Biodyne酶膜装配甘油酶电极。
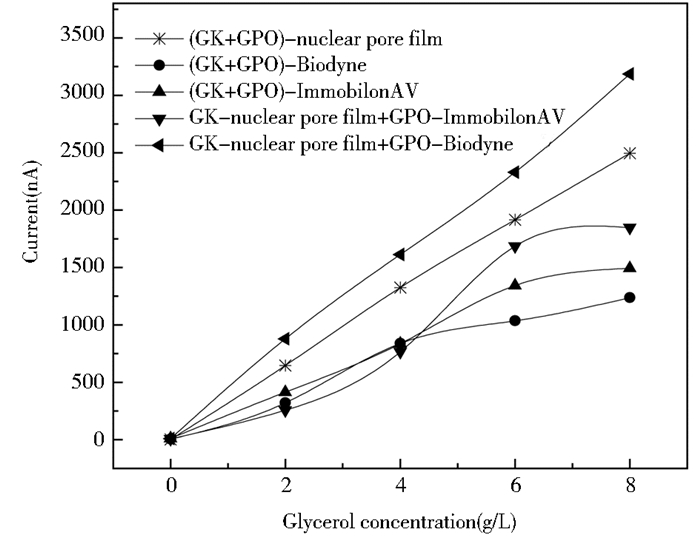
|
| 图 2 基于不同载体的甘油酶膜对甘油浓度的响应信号(n=4) Figure 2 Response signal of glycerol enzyme membrane based on different carrier material to glycerol concentration (n=4) |
分别在10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50 ℃温度条件下,以0.1mol/L Na2HPO4-NaH2PO4缓冲液(pH值7.5)为离子反应环境、且保持试验电压稳定、远离热源等试验条件,测试甘油酶电极用于甘油催化时的电流信号,研究反应温度对酶电极活性的影响,探讨其最佳催化温度。每个测定重复4次,甘油酶电极响应电流平均值与反应温度关系如图 3。
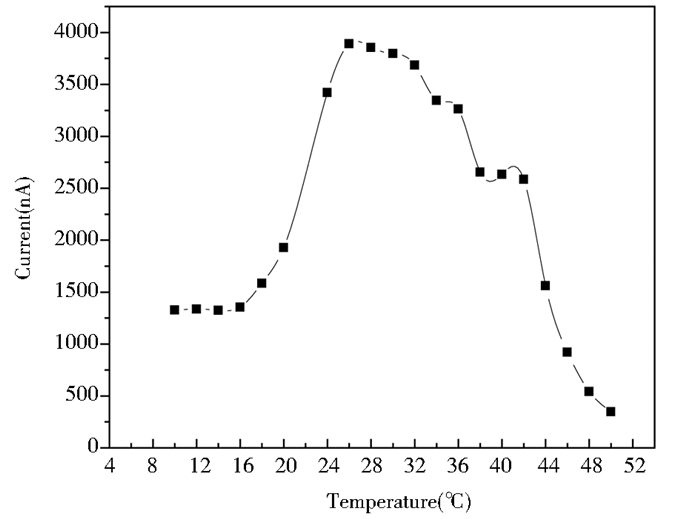
|
| 图 3 反应温度对甘油酶膜响应电流的影响(n=4) Figure 3 Effects of reaction temperature on response current of glycerol enzyme membrane (n=4) |
由图 3可知,当反应温度低于20℃时,随温度升高电流信号增幅减小,之后电流信号随温度迅速增大,当温度达26℃时,电流信号增至最高水平。反应温度在26℃~32℃范围时,电流信号一直保持较高水平;之后随温度上升而逐级下降,当反应温度为50℃时,电流信号很低,甘油酶膜几乎丧失对甘油的催化能力。故甘油酶电极的工作温度最适宜相对恒定于26~32℃范围内。
2.4 甘油酶电极最适pH以0.1mol/L Na2HPO4-NaH2PO4缓冲液作为甘油酶电极反应环境(pH值为5~9),进行最适pH试验。研究不同pH值对甘油酶电极响应信号的影响,探讨其最适pH值环境,测定重复4次,取平均值,结果见图 4。结果表明,当pH值在5~7.5范围内时,酶电极响应产生的电流信号随pH值增大而升高,至pH值为7.5时,电流信号最大,酶活性最高;之后随pH值增大而略有降低。在本试验pH值范围内,当pH为6~9时,甘油酶电极电流信号均保持较高水平;且pH值为7.5时,电流信号最高,可作为本研究甘油酶电极的最适pH值。
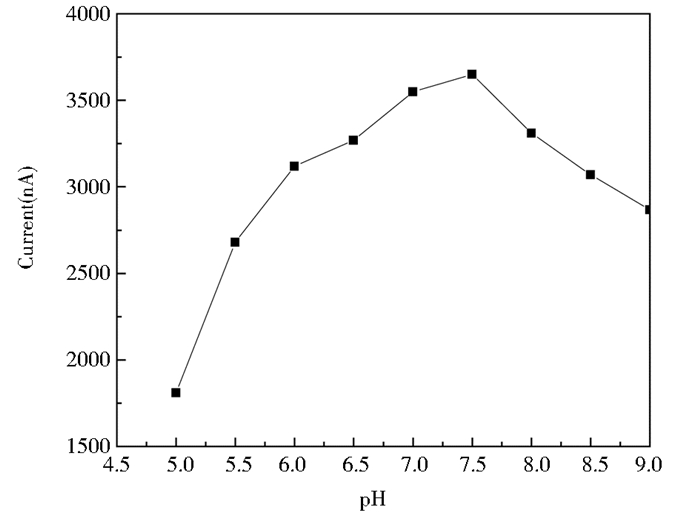
|
| 图 4 反应环境pH值对甘油酶电极响应电流的影响(n=4) Figure 4 Effects of pH on response current signal of glycerol enzyme electrode (n=4) |
在浓度为1 g/L标准甘油溶液中,分别加入乙二醇(35/100)、甲醇、乙醇、正丁醇、甘露醇、山梨醇、乙醇酸(27/100)、乳酸、葡萄糖、NH4+、Cu2+、Mg2+等9种可能的干扰物质,并使干扰物质浓度为甘油浓度的50倍,测其对甘油酶膜响应信号的干扰。结果表明,甘油类似物乙二醇(35/100)、甲醇、乙醇、正丁醇、乙醇酸(27/100),以及葡萄糖、甘露醇、山梨醇、乳酸、Cu2+、Mg2+对甘油测定没有明显影响,只有NH4+对甘油酶膜响应信号有较大影响。而NH4+在发酵液中存在较为普遍,故进一步研究了NH4+对甘油酶膜的影响,结果发现当NH4+浓度≤10 g/L时,其对1 g/L甘油样品测定无明显影响。由此可见,甘油酶电极的抗干扰性较强,但实际测试时,需保证NH4+浓度不能超过其要求水平。此外,鉴于NH4+的较为广泛存在性,结合当前纳米修饰、胶体金修饰技术等,下一步可研究甘油酶电极的专一性修饰,进一步增强甘油酶膜的抗干扰性等性能和优势。
2.6 工作标准曲线反应温度、pH值等均保持最适试验条件时,准确称取甘油(质量分数为99%)质量,溶解于蒸馏水。依次配制质量浓度为0.05~10.00 g/L标准甘油溶液。按“1.4”方法:甘油酶电极传感器自动定标后,用微量进样器依次吸取待试验甘油标准溶液25μl,进行测定,每个浓度测定4次,以甘油浓度为横标、响应电信号为纵标,绘制甘油酶电极对不同浓度甘油的响应工作曲线,见图 5。
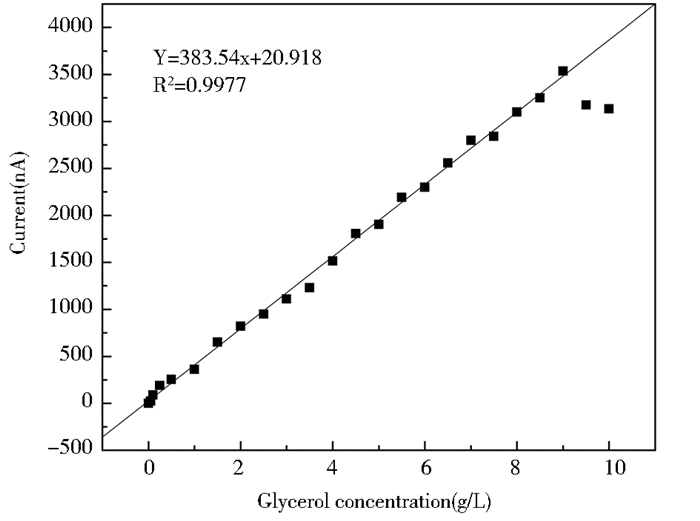
|
| 图 5 甘油酶膜工作标准曲线 Figure 5 Standard curve of glycerol enzyme membrane |
从图 5可知,在0.05~9.00 g/L浓度范围内,甘油酶电极响应信号与甘油浓度具有良好的线性相关性,其回归方程为:Y=384.54x+20.918,其相关系数R2=0.9977;甘油浓度为9.50、10.00 g/L时,响应电流信号远离线性曲线。由此可认为,该甘油酶电极的线性响应范围为0.05~9.00 g/L,对甘油最大响应浓度为9.00 g/L。
2.7 回收率试验最佳试验条件下,取3个甘油样品进行加标回收率试验。稀释后每个样品平均分成2份,每份100ml,其中一份加入0.25g甘油纯品做回收试验。按“1.4”方法测定各样品的甘油含量,每个样品重复测定3次,求平均值。由回收率计算公式:P=(加标试样测定值-试样测定值)/加标量×100%,即得甘油酶电极对甘油测定的回收率,在98.4%~102.4%,结果见表 1。
| Samples | Value before adding standard (g/L) | measured value after adding standard (g/L) | Recovery (%) |
| 1# | 1.51 | 3.97 | 98.4 |
| 2# | 2.17 | 4.64 | 98.8 |
| 3# | 0.96 | 3.52 | 102.4 |
试验结果表明,该方法回收率较高,样品中其他成分对测定结果影响较小,可以认为该方法是可行的。
2.8 精密度试验采用与“2.6”相同的最佳试验条件,取6个甘油样品,按甘油酶电极标准曲线浓度范围,分别进行稀释,并以试验的酶电极法测定样品中甘油含量。每个样品重复测定5次,求标准偏差(SD)及相对标准偏差(RSD),其RSD均小于5%,符合生物样品分析要求。甘油浓度越高,相对标准偏差越大的现象,结果见表 2。
| Samples | Glycerol determination (g/L) | (SD) | (RSD) | ||||
| 1 | 1.52 | 1.50 | 1.53 | 1.52 | 1.51 | 0.01 | 1.14 |
| 2 | 3.72 | 3.80 | 3.75 | 3.79 | 3.83 | 0.04 | 1.14 |
| 3 | 13.71 | 14.34 | 14.26 | 13.93 | 14.54 | 0.32 | 2.33 |
| 4 | 19.14 | 19.56 | 20.23 | 20.15 | 21.08 | 0.74 | 3.70 |
| 5 | 9.43 | 9.24 | 9.46 | 9.49 | 9.61 | 0.14 | 1.51 |
| 6 | 17.12 | 17.25 | 17.82 | 18.15 | 18.54 | 0.60 | 3.37 |
2.9 对比试验(g/L)
最佳实验条件下,另取2个发酵液(a、b)、2个甘油纯品(c、d)。分别采用甘油酶电极法、高碘酸氧化法、高效液相色谱法测试4个样品中甘油含量,每个测定重复5次。比较几种测定方法,并进行显著性T检验,数据见表 3。
| Enzyme electrode method (g/L) | Periodate oxidation method (g/L) | HPLC (g/L) | ||||||||||
| a | b | c | d | a | b | c | d | a | b | c | d | |
| 1 | 2.35 | 1.69 | 5.02 | 12.04 | 2.43 | 1.61 | 5.11 | 12.45 | 2.38 | 1.70 | 5.01 | 12.02 |
| 2 | 2.39 | 1.65 | 5.01 | 12.09 | 2.32 | 1.72 | 5.08 | 12.16 | 2.37 | 1.68 | 5.00 | 12.04 |
| 3 | 2.40 | 1.70 | 5.03 | 12.10 | 2.25 | 1.69 | 5.07 | 12.66 | 2.39 | 1.71 | 5.01 | 12.06 |
| 4 | 2.37 | 1.72 | 5.02 | 12.06 | 2.28 | 1.74 | 4.95 | 11.91 | 2.40 | 1.73 | 5.01 | 12.07 |
| 5 | 2.42 | 1.73 | 5.01 | 12.05 | 2.45 | 1.59 | 4.97 | 19.95 | 2.41 | 1.71 | 5.02 | 12.05 |
| Average value | 2.39 | 1.70 | 5.02 | 12.07 | 2.35 | 1.67 | 5.03 | 12.23 | 2.39 | 1.71 | 5.01 | 12.05 |
| RSD/% | 1.13 | 1.82 | 0.16 | 0.22 | 3.79 | 4.01 | 1.41 | 2.62 | 0.67 | 1.05 | 0.14 | 0.16 |
| T test | - | - | - | - | 0.37 | 0.42 | 0.59 | 0.29 | 0.78 | 0.63 | 0.14 | 0.20 |
由上述结果可以看出,对于4个甘油样品的测定,酶电极法与高碘酸氧化法、高效液相色谱法(HPLC)比较时,均无显著性差异(P>0.05);且酶电极法与HPLC法的测定结果更接近,相对标准偏差(RSD)均小于高碘酸氧化法。该结果说明,酶电极法测定甘油含量时,其准确度接近HPLC水平;较之HPLC的昂贵费用、复杂操作,其更适用于甘油相关行业实际生产的定量及实时监控。另外,发酵液与甘油纯品相比较时,纯品甘油测定的RSD更低,说明对于纯品及成品甘油产品,该方法可用于其准确定量及标定。
3 结论本文采用酶固定化技术,研制了能够快速催化甘油的甘油酶膜,制备了简易甘油酶电极,并研究了甘油酶电极法快速测定甘油含量专一性、稳定性、精确性等。结果证明,该方法用于甘油检测,其稳定性、专一性均较强,且准确度高,线性范围宽,抗干扰能力较强;同时操作简便,反应快速,仪器要求简单,成本低廉;可满足实际生产中,甘油含量快速、实时、以及低成本测定的要求,有望为相关行业中甘油快速检测提供有效、快捷的手段。为完善甘油酶电极,使其能真正应用于各甘油相关行业,还需要进一步改进甘油酶膜固定化方法,引入诸如纳米修饰等技术,减少固定GK、GPO所用量、提高酶利用效率,提高甘油酶膜及酶电极的专一性、抗干扰性等性能。
| [1] | 张树军, 杨磊, 黄瑾. 巴斯德毕赤酵母表达系统的研究进展. 农垦医学 , 2007, 3 : 231–233. Zhang S J, Yang L, Huang J. Research progress of Pichia pastoris expression system of Pasteur. Journal of Nongken Medicine, , 2007, 3 : 231–233. |
| [2] | Thorpe E D, Anjou M C, Daugulis A J. Sorbitol as a non-repressing carbon source for Fed-batch fermentation of recombinant Pichia pastoris. Biotechnology Letters , 1999, 21 : 669–672. DOI:10.1023/A:1005585407601 |
| [3] | Li Z J, Xiong F, Lin Q S, et al. Low-temperature increases the yield of biologically active herring antifreeze protein in Pichia pastoris. Protein Expression and Purification , 2001, 21 : 438–455. DOI:10.1006/prep.2001.1395 |
| [4] | Chen C C, Wu P H, Huang C T, et al. A Pichia pastoris fermentation strategy for enhancing the heterologous expression of an Escherichia coli phytase. Enzyme Microbial. Technology , 2004, 35 (4) : 315–320. |
| [5] | 汪多仁. 发酵甘油的研发与应用进展. 发酵科技通讯 , 2010, 39 (2) : 45–49. Wang D R. Progress in research and application of glycerol fermentation. Fermentation Technology Communication , 2010, 39 (2) : 45–49. |
| [6] | 郭萍梅, 黄庆德. 生物柴油中游离甘油和总甘油测定方法研究. 粮食与油脂 , 2003, 8 : 41–42. Guo P M, Huang Q D. Study on analytical method of free glycerin and total glycerin in bio-diesel. Journal Cereal Oil , 2003, 8 : 41–42. |
| [7] | Meier D, Oasmaa A, Peacocke G V. Properties of fast pyrolysis liquids:status of test methods.In:Bridgwate A V, Boocock D G.Developments in Thermochemical Biomass Conversion. Chapman & Hall in London:CPL Press for Aston University, 1999.66-101. |
| [8] | Ruoff K, Bogdanov S. Authenticity of honey and other bee products. Apiacta , 2004, 38 (38) : 317–327. |
| [9] | 李丹, 周明辉, 刘莹峰, 等. 气相色谱法测定粗甘油中的游离甘油含量. 分析测试学报 , 2011, 30 (9) : 1055–1058. Li D, Zhou M H, Liu Y F, et al. Determination of free glycerol in crude glycerine by gas chromatography. Journal of Instrumental Analysis , 2011, 30 (9) : 1055–1058. |
| [10] | 陈菁, 陈建华, 周怡雯, 等. 高效液相色谱法检测发酵液中二羟基丙酮和甘油的含量. 中国生化药物杂志 , 2007, 3 : 170–172. Chen J, Chen J H, Zhou Y W, et al. Quantitative determination of dihydroxyacetone and glycerol in the fermentation broth by HPLC. Chinese Journal of Biochemical Pharmaceutics , 2007, 3 : 170–172. |
| [11] | 郭兑山, 潘莉莉, 李强. 甘油激酶偶联法测定解冻红细胞的甘油含量. 中国输血杂志 , 2002, 15 (5) : 344–345. Guo D S, Pan L L, Li Q. Determination of glycerol content in frozen thawed red blood cells by glycerol kinase coupled method. China Journal Blood Transfusion , 2002, 15 (5) : 344–345. |
| [12] | Mehmet I, Michael M M. Non-repressing carbon sources for alcohol oxidase (Aox1) promoter of Pichia pastoris. Journal of Bioscience Bioengineering , 2001, 92 (6) : 585–589. DOI:10.1016/S1389-1723(01)80321-2 |
| [13] | Xie J L, Zhou Q W, Du P, et al. Use of different carbon sources in cultivation of recombinant Pichia pastoris for angiostatin production. Enzyme Microbial Technol , 2005, 36 (2) : 210–216. |
| [14] | 冷鹏, 郑彦, 李其云. 纳米金-生物酶膜在葡萄糖生物传感器上的应用. 化学分析计量 , 2005, 14 (5) : 46–48. Leng P, Zheng Y, Li Q Y. Application of nanogold-biological enzyme film in the glucose biosensor. Chemical Analysis Meterage , 2005, 14 (5) : 46–48. |
| [15] | Mascini M, Iannello M, Palleschi G. Enzyme electrodes with improved mechanical and analytical characteristics obtained by binding enzymes to nylon nets. Analytica Chimica Acta , 1983, 146 : 135–148. DOI:10.1016/S0003-2670(00)80600-5 |
| [16] | Messia M C, Compagnone D, Esti M, et al. A bienzyme electrode probe for malate. Analytical Chemistry , 1996, 68 (2) : 360–365. DOI:10.1021/ac9508006 |
 2016, Vol. 36
2016, Vol. 36




