文章信息
- 曹莹莹, 邓盾, 夏方亮, 孙爱君, 张云, 胡云峰.
- CAO Ying-ying, DENG Dun, XIA Fang-liang, SUN Ai-jun, ZHANG Yun, HU Yun-feng.
- 南海深海微生物酯酶EST12-7在制备(R)-2-氯丙酸乙酯中的应用研究
- Utilization of a Marine Microbial Esterase in the Enantio-selective Preparation of (R)-Ethyl 2-chloropropionate
- 中国生物工程杂志, 2016, 36(12): 59-65
- China Biotechnology, 2016, 36(12): 59-65
- http://dx.doi.org/DOI:10.13523/j.cb.20161209
-
文章历史
- 收稿日期: 2016-06-16
- 修回日期: 2016-08-25
2. 中国科学院南海海洋研究所 广东省海洋药物重点实验室 广州 510301;
3. 南海生物资源开发和利用协同创新中心 广州 510275;
4. 滨州市食品药品检验检测中心 滨州 256618
2. Guangdong Key Laboratory of Marine Materia Medica, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China;
3. South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center, Guangzhou 510275, China;
4. Binzhou Food and Drug Inspection and Testing Center, Binzhou 256618, China
随着科学技术的发展,化工产品在农业方面的应用逐渐增多。农药是继化肥之后应用于农业生产的最重要化工产品,在化学防治作物病虫害方面起着重要作用。其中除草剂已成为现代农业生产中不可缺少的化工产品。
手性2-氯丙酸酯是制备光学纯的芳氧基丙酸类除草剂/植物生长调解剂以及手性非甾体类消炎解热镇痛药的重要中间体[1]。消旋的2-氯丙酸酯作为中间体被用于合成医药或农药,但由于消旋中间体中含有低效、无效甚至有毒副作用的光学异构体,不仅会降低药效带来毒性,而且会造成原料的巨大浪费[2]。近年来,拆分技术已经成为手性酸和其酯的重要制备方法,相应的拆分技术主要包括化学拆分法、生物酶拆分法、色谱拆分法和萃取拆分法等[3-6]。但是化学拆分法等拆分方法需要昂贵的对环境污染较大的手性拆分试剂,而且使用化学拆分法所制备的手性产物的光学纯度较差。相比较,以酯酶和脂肪酶为代表的生物催化剂可以高效地通过转酯和水解等反应拆分制备手性酸、手性醇以及其相应的手性酯类化工产品[7-8]。通常酶促拆分反应所制备的手性化工产品的光学纯度很高,反应的产率也较高,为手性化工产品的产业化生产提供了很好的制备方法[9]。此外,酶促拆分反应是绿色的生产过程,生产过程对环境污染小,符合提倡的环保理念。
手性2-氯丙酸甲酯和手性2-氯丙酸乙酯同为重要的2-氯丙酸酯化工产品[10]。由于分子中存在酯键,可以使用酯酶或脂肪酶生物催化剂,通过不对称水解相应的酯键,从而高效制备高附加值的手性2-氯丙酸甲酯和手性2-氯丙酸乙酯[11]。前期克隆、表达并鉴定了一个南海深海微生物来源的新颖酯酶EST12-7,并使用酯酶EST12-7通过手性拆分制备了高光学纯度的(R)-2-氯丙酸甲酯。本研究利用酯酶EST12-7拆分手性制备(R)-2-氯丙酸乙酯,并对酯酶EST12-7催化的拆分反应过程进行了系统的优化,以得到高光学纯度的(R)-2-氯丙酸乙酯。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒大肠杆菌E.coli DH5α,E.coli BL21(DE3)菌株以及表达载体pET28a (+)均为本实验室保存。Pseudonocardia antitumoralis SCSIO 01299分离自中国南海(120° 0.975′E 19° 0.6649′N,-3258 m)由中国科学院南海海洋研究所分离保存。
1.1.2 试剂主要试剂:(±)-2-氯丙酸乙酯、(S)-2-氯丙酸乙酯购自阿拉丁试剂公司,其他试剂均为分析纯。
主要仪器:福立气相色谱仪。
1.1.3 酯酶基因的克隆及载体构建表达和纯化酯酶基因的克隆及载体构建表达和纯化的方法见参考文献[12]。
1.2 方法拆分方法:0.5 ml的酶反应体系中含有一定pH的Tris-HCl缓冲溶液,一定量的酯酶EST12-7纯酶液,拆分不同浓度的(±)-2-氯丙酸乙酯,用福立气相检测拆分效果。
具体分析条件为:采用福立气相色谱仪,配有手性柱(30 m ×0.25 mm Cyclosil B chirl column)和氢离子火焰检测器。仪器分析条件设置为:注射器温度220 ℃,检测器温度250 ℃,载气为N2,流速1.2 ml/min,采用梯度升温进行分析:60 ℃保持1 min,20 ℃/min,120℃保持1 min,10 ℃/min到220 ℃,保持1 min。
底物转化率和对映体过量值的计算见公式(1)~(3)。
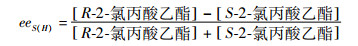 |
(1) |
 |
(2) |
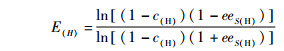 |
(3) |
e.e.s为底物对映体过量值;A1、A0为R-2-氯丙酸乙酯的峰面积;B0、B1为S-2-氯丙酸乙酯的峰面积;c(H)为底物转化率;E(H)为对映过量值[13]。
1.2.1 反应温度对酯酶拆分2-氯丙酸乙酯的影响0.5 ml的酶反应体系含有50 mmol/L Tris-HCl (pH 8.5),5 μl 1.975 μg/ml的酯酶EST12-7纯酶液和50 mmol/L的(±)-2-氯丙酸乙酯。将反应体系置于10~50℃反应1h后,用气相检测不同反应温度对酯酶EST12-7拆分(±)-2-氯丙酸乙酯的影响。
1.2.2 pH对酯酶拆分2-氯丙酸乙酯的影响0.5 ml的酶反应体系含有不同pH的50 mmol/L Tris-HCl,5 μl 1.975 μg/ml的酯酶EST12-7纯酶液和50 mmol/L的(±)-2-氯丙酸乙酯。在30 ℃条件下反应1 h,用气相检测不同pH对酯酶拆分2-氯丙酸乙酯的影响。
1.2.3 有机溶剂对酯酶拆分2-氯丙酸乙酯的影响0.5 ml的酶反应体系含有pH 8.5的50 mmol/L Tris-HCl缓冲溶液,5 μl 1.975 μg/ml的EST12-7纯酶液,50 mmol/L的(±)-2-氯丙酸乙酯和2%的有机溶剂(乙醇、异丙醇、正丁醇、正己烷、正己醇、正癸醇、仲丁醇、环己烷、环己酮),并在30 ℃下反应1 h。使用气相检测反应产率和产物的光学纯度。
1.2.4 底物浓度对酯酶拆分2-氯丙酸乙酯的影响0.5 ml的酶反应体系含有pH 8.5的50 mmol/L Tris-HCl缓冲溶液,5 μl 1.975 μg/ml的EST12-7纯酶液,不同浓度的(±)-2-氯丙酸乙酯(20、40、50、60、70、80、90 mmol/L),在30 ℃条件下反应1 h,检测不同底物浓度对酯酶EST12-7水解拆分效果的影响。
1.2.5 不同反应时间对拆分2-氯丙酸乙酯的效果影响0.5 ml的酶反应体系含有pH 8.5的50 mmol/L Tris-HCl缓冲溶液,5 μl 1.975 μg/ml的EST12-7纯酶液和50 mmol/L的(±)-2-氯丙酸乙酯。将0.5 ml的反应体系置于20 ℃反应,每隔10 min取样进行气相检测一次,检测不同反应时间对拆分酯酶EST12-7水解拆分(±)-2-氯丙酸乙酯的影响。
1.2.6 酯酶EST12-7浓度对拆分2-氯丙酸乙酯的效果影响0.5 ml的酶反应体系含有pH 8.5的50 mmol/L Tris-HCl缓冲溶液,加入不同浓度的酯酶EST12-7纯酶液和50 mmol/L的(±)-2-氯丙酸乙酯。将0.5 ml的反应体系置于30 ℃反应,反应1 h,检测不同反应时间对拆分酯酶EST12-7水解拆分(±)-2-氯丙酸乙酯的影响。
2 结果 2.1 温度对酯酶拆分2-氯丙酸乙酯的影响不同的反应温度对酯酶EST12-7拆分(±)-2-氯丙酸乙酯的效果影响较大,在温度为10℃时,酯酶存在一定的拆分活性,e.e.s为33.5%,转化率为25.9%;随着温度的升高,酯酶拆分活性随之提高,当温度为30℃的时候,拆分效果最好,e.e.s为51.2%,转化效率为34.5%。当温度高于30℃后,拆分效果随着温度的升高而减小。当温度为50℃时,e.e.s及c(H)分别为8.2%和8.53%,所以温度对于酯酶拆分2-氯丙酸乙酯的影响较大。因此,酯酶EST12-7拆分(±)-2-氯丙酸乙酯的最适反应温度为30℃(表 1)。
| Temperature (℃) | ees(H)(%) | c(H)(%) | E(H) |
| 10 | 33.5 | 25.9 | 65.4 |
| 20 | 38.5 | 28.4 | >100 |
| 30 | 51.2 | 34.5 | >100 |
| 40 | 38.2 | 28.3 | 86.2 |
| 50 | 8.2 | 8.53 | 16.3 |
2.2 pH对酯酶拆分2-氯丙酸乙酯的影响
不同pH对酯酶的拆分反应也会有较大的影响。如表 2所示,在最适反应温度30℃条件下,Tris-HCl缓冲溶液pH为8.5时,酯酶EST12-7拆分(±)-2-氯丙酸乙酯的效果最佳,所得到的产物的光学纯度e.e.s为60.5%,转化率最高为38.2%。当pH在6.5b到7.5b的范围内,酯酶拆分2-氯丙酸乙酯的光学纯度及转化率变化不大,e.e.s分别为26.8%、25.7%和25.5%,转化效率分别为21.7%、20.9%和21%。当pH大于8.5时,拆分的得率越来越低,所得到的(R)-2-氯丙酸乙酯的光学纯度越来越低。因此,pH 8.5为酯酶EST12-7拆分制备(R)-2-氯丙酸乙酯的最适反应pH。
| pH | ees(H)(%) | c(H)(%) | E(H) |
| 6.5a | 19.2 | 16.8 | 46.9 |
| 6.5b | 26.8 | 21.7 | 77.5 |
| 7.0b | 25.7 | 20.9 | 98.3 |
| 7.5b | 25.5 | 21 | 66.8 |
| 8.0c | 48.3 | 33.1 | >100 |
| 8.5c | 60.5 | 38.2 | >100 |
| 9.0c | 21.6 | 18.3 | 66.3 |
| 9.5d | 13.3 | 12.3 | 41.7 |
| a: Buffer for 50 mmol/L Na2HPO4-NaH2PO4; b: Buffer for 50 mmol/L Tris-HCl; c: Buffer for 50 mmol/L glycine-NaOH | |||
2.3 有机溶剂对酯酶拆分2-氯丙酸乙酯的影响
不同有机溶剂对酯酶EST12-7拆分(±)-2-氯丙酸乙酯同样会有较大的影响。如表 3所示,在最适反应温度及pH条件下,10种有机溶剂中,DMSO、正癸醇和环己醇对酯酶EST12-7拆分(±)-2-氯丙酸乙酯具有较好的促进作用。当反应体系添加DMSO时,拆分的e.e.s值及转化率与对照组的值相比提高了9.3%和5.5%;当反应体系添加环己醇时,拆分的e.e.s值及转化率与对照组的值相比提高了7.3%和4.3%。当反应体系中的正癸醇浓度为2%时,酯酶EST12-7水解拆分(±)-2-氯丙酸乙酯的转化率为39.2%,与对照组的转化率相比提高了15.0%,产物(R)-2-氯丙酸乙酯的光学纯度为63.4%,比对照组的e.e.s提高了25.2%。其他有机溶剂则对酯酶EST12-7水解拆分(±)-2-氯丙酸乙酯的活性有不同程度的抑制作用。这10种有机溶剂中,正己烷对酯酶拆分2-氯丙酸乙酯的影响效果最大,e.e.s值及转化率分别为30.1%和23.7%。
| Organic solvents | ees(H)% | c(H)% | E(H) |
| 对照 | 50.4 | 34.1 | >100 |
| DMSO | 55.1 | 36 | >100 |
| 丁醇 | 42.1 | 30.1 | >100 |
| 乙醇 | 48.3 | 33.1 | >100 |
| 异丙醇 | 39.5 | 28.9 | >100 |
| 正己烷 | 30.1 | 23.7 | 81.8 |
| 环己烷 | 39.8 | 29.1 | 99.4 |
| 环己酮 | 35.8 | 26.9 | >100 |
| 环己醇 | 54.1 | 35.6 | >100 |
| 甲醇 | 48.9 | 33.4 | >100 |
| 正癸醇 | 63.1 | 39.2 | >100 |
2.4 底物浓度对拆分2-氯丙酸乙酯的影响
底物浓度是决定酶催化拆分反应效果的主要因素之一。本实验在最适温度30℃和最适pH 8.5的条件下,检测了不同底物浓度对酯酶EST12-7拆分(±)-2-氯丙酸乙酯的影响。由图 1可知,当底物浓度在20~50 mmol/L范围内时,酯酶EST12-7拆分(±)-2-氯丙酸乙酯的光学纯度和转化率逐渐增大,当底物浓度为50 mmol/L时,产物(R)-2-氯丙酸乙酯的光学纯度和反应转化率均为最大,反应转化率和产物(R)-2-氯丙酸乙酯的光学纯度分别为38.7%和61.7%。当底物浓度大于50 mmol/L时,酯酶EST12-7制备(R)-2-氯丙酸乙酯的光学纯度和反应转化率随之减小。因此,50 mmol/L为酯酶EST12-7拆分(±)-2-氯丙酸乙酯的最适底物浓度。

|
| 图 1 底物浓度对酯酶拆分2-氯丙酸乙酯活性的影响 Figure 1 Effect of concentration of (±)-ethyl 2-chloropropinate on the kinetic resolution |
在最适温度30℃、最适反应pH 8.5和50 mmol/L (±)-2-氯丙酸乙酯的反应体系中,检测不同反应时间对酯酶EST12-7拆分(±)-2-氯丙酸乙酯的影响(图 2)。反应时间在10~45 min范围内时,酯酶拆分2-氯丙酸乙酯的转化率和e.e.s的效率不高。光学纯度保持在30%~40%之间,转化率保持在20%~30%之间,当反应时间超过45 min后,酯酶拆分效率提高,在反应时间为50 min时,酯酶拆分的转化率为38.1%,e.e.s值为60.46%。在反应时间为55 min时,酯酶拆分的转化率为46.8%,e.e.s值为86.19%。在反应1 h时,拆分反应的转化率为49%,产物(R)-2-氯丙酸乙酯的光学纯度可达98%。当反应时间为80 min时,拆分反应的转化率为49.2%,产物(R)-2-氯丙酸乙酯的光学纯度可达97.6%。随着反应时间的延长,酯酶拆分2-氯丙酸乙酯的效果不变,说明酯酶EST12-7立体选择性高。因此,酯酶EST12-7拆分(±)-2-氯丙酸乙酯的最适反应时间为60 min。

|
| 图 2 反应时间对EST12-7拆分2-氯丙酸乙酯的影响 Figure 2 Process of reaction time on the resolution of (±) -ethyl 2-chloropropinate. |
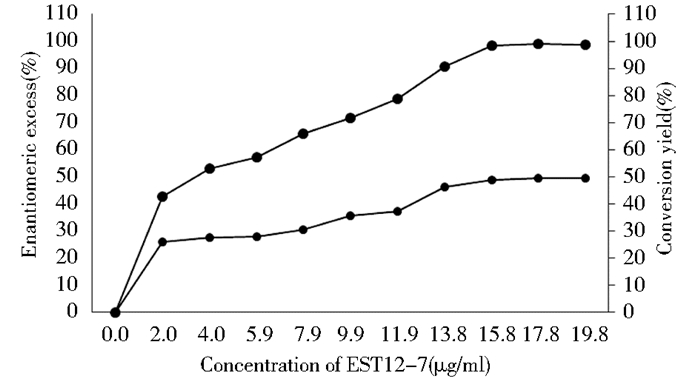
在最适温度30℃、最适反应pH 8.5和50 mmol/L (±)-2-氯丙酸乙酯的反应体系中,反应1 h后,添加不同浓度的酯酶EST12-7对不同拆分反应的影响如图 3所示,在反应体系中,随着酶浓度的增加拆分2-氯丙酸乙酯的效果越来越好,呈正相关。当浓度达到13.8 μg/ml时,拆分反应的转化率为49%,产物(R)-2-氯丙酸乙酯的光学纯度可达98.4%,随着酶浓度的增大,拆分底物的效果稳定,酯酶拆分2-氯丙酸乙酯的立体选择性高。因此,酯酶EST12-7拆分(±)-2-氯丙酸乙酯的最适酶底物浓度为13.8 μg/ml。
|
| 图 3 酯酶EST12-7浓度对酯酶拆分2-氯丙酸乙酯活性的影响 Figure 3 Effect of concentration of EST12-7 on the kinetic resolution of (±) -ethyl 2-chloropropinate |
本工作利用南海深海微生物Pseudonocardia antitumoralis SCSIO 01299中的酯酶EST12-7通过不对称水解消旋2-氯丙酸乙酯以制备高附加值(R)-2-氯丙酸乙酯。本研究发现pH和温度等条件对酯酶EST12-7拆分消旋的2-氯丙酸乙酯有显著影响;当反应pH为8.5,温度为30 ℃时,酯酶EST12-7能较好地拆分消旋2-氯丙酸乙酯。添加2%(v/v)的助溶剂正癸醇可以很好地促进酯酶EST12-7通过水解拆分制备(R)-2-氯丙酸乙酯和(S)-2-氯丙酸。在优化后的反应条件下,酯酶EST12-7通过水解拆分廉价的消旋2-氯丙酸乙酯得到光学纯度为98%的(R)-2-氯丙酸乙酯。

|
| 图 4 酯酶EST12-7拆分制备(R)-2-氯丙酸乙酯 Figure 4 Preparation of (R) -ethyl 2-chloropropinate by esterase EST12-7 (a) Enzymatic reaction catalyzed by esterase EST12-7 (b) Standard of racemic ethyl 2-chloropropinate (c) (R)-ethyl 2-chloropropinate prepared through the hydrolytic reaction catalyzed by esterase EST12-7 |
与此同时本研究还对比了本部分工作中酯酶EST12-7拆分(±)-2-氯丙酸乙酯与本实验室前面拆分(±)-2-氯丙酸甲酯的效果的差别。在最适反应条件下,酯酶EST12-7拆分(±)-2-氯丙酸甲酯在30 min拆分完,得到的(R)-2-氯丙酸甲酯的光学纯度和反应转化率分别为99%和49%。酯酶EST12-7拆分(±)-2-氯丙酸乙酯则在反应60 min后反应完全,得到的(R)-2-氯丙酸乙酯的光学纯度和反应转化率分别为98%和49%。酯酶EST12-7拆分(±)-2-氯丙酸甲酯的最适反应温度(20 ℃)与拆分(±)-2-氯丙酸乙酯的最适反应温度(30 ℃)有所不同;酯酶EST12-7拆分(±)-2-氯丙酸甲酯的最适反应pH (8.0)与拆分(±)-2-氯丙酸乙酯的最适反应pH (8.5)有所不同。同时消旋底物中的酯链长度对酯酶EST12-7拆分的效果有很大影响;当酯链的长度增加时(由C1变成C2),酯酶EST12-7的水解拆分反应变慢,可能是由于酯链的增长影响了酯酶EST12-7对底物的识别以及催化效率[14-15]。
本工作研究了深海微生物酯酶EST12-7通过水解拆分制备手性(R)-2-氯丙酸乙酯的酶促拆分优化过程[16],为酯酶通过水解拆分反应高效制备高附加值的手性酸/酯以及有机溶剂对酶拆分立体选择性的影响提供了一定的实验依据。今后还需进一步研究有机溶剂对酯酶EST12-7构象变化的影响,并结合分子模拟等手段更为深入研究酯酶构象变化的机制。
| [1] | 文辉, 王敏, 边庆花. 光学纯2_氯丙酸及其酯的合成与在手性农药中的应用. 农药 , 2004, 43 (8) : 363–366. Wen H, Wang M, Bian Q H. Synthesis and application of optical purity 2-chloropropionic acid in chiral pesticides. Chinese Journal of Pesiticides , 2004, 43 (8) : 363–366. |
| [2] | 施介华, 金迪, 李祥, 等. 2-氯丙酸及其酯的拆分研究进展. 浙江工业大学学报 , 2006, 34 (5) : 502–507. Shi J H, Jin D, Li X, et al. Research progress on the resolution of 2-chloropropionic acid and ester. Journal of Zhejiang University of Technology , 2006, 34 (5) : 502–507. |
| [3] | 戴荣继, 佟斌, 孟薇薇, 等. 膜拆分法分离制备手性药物. 膜科学与技术 , 2006, 26 (3) : 84–89. Dai R J, Tong B, Meng W W, et al. Membrane technology for the separation of racemic drugs. Membrane Science and Technology , 2006, 26 (3) : 84–89. |
| [4] | 谢华松, 丘明建, 刘文龙, 等. 色谱法在手性药物拆分中的应用. 亚太传统医药 , 2011, 7 (4) : 158–160. Xie H S, Qiu M J, Liu W L, et al. Application of chromatography in the resolution of chiral drug. Asia-Pacific Traditional Medicine , 2011, 7 (4) : 158–160. |
| [5] | 刘凤艳, 庞小琳, 郑轶群, 等. 手性物质及其拆分方法. 辽宁化工 , 2007, 36 (11) : 784–785. Liu F Y, Pang X L, Zheng Y Q, et al. Chiral compounds and the methods of chiral separation. Liaoning Chemical Industry , 2007, 36 (11) : 784–785. |
| [6] | 杨千姣, 曲蕾, 吴族悌, 等. 手性拆分技术及其在手性药物合成中的应用新进展. 中国药物化学杂志 , 2009, 19 (6) : 429–435. Yang Q J, Qu L, Wu Z T, et al. Application progress of novel optical resolution technologies in the chiral drugs. Chinese Journal of Medicinal Chemistry , 2009, 19 (6) : 429–435. |
| [7] | 韩祝平, 叶鹏, 王新平, 等. 脂肪酶的固定化及其手性拆分的研究进展. 应用化工 , 2011, 40 (11) : 1823–1827. Han Z P, Ye P, Wang X P, et al. Lipase immobilization and research progress in chiral resolution. Applied Chemical Industry , 2011, 40 (11) : 1823–1827. |
| [8] | Vilas Athawale N M, Manoj A. Enzymatic synthesis of chiral menthyl methacrylate monomer by Pseudomonas cepacia lipase catalysed resolution of (±)-menthol. Journal of Molecular Catalysis B:Enzymatic , 2001, 16 (3) : 169–173. |
| [9] | Antoine P L, Overbeeke J A. Enantioselectivity of Candida rugosa lipase in the hydrolysis of 2-chloropropionic acid methyl ester. Journal of Molecular Catalysis B:Enzymatic , 2003, 21 : 89–91. DOI:10.1016/S1381-1177(02)00143-1 |
| [10] | Atsushi Kurata T K, Harumi K A, Nobuyoshi Esakia. Harumi K A, Nobuyoshi Esakia. Asymmetric reduction of 2-chloroacrylic acid to (S)-2-chloropropionic acid by a novel reductase from Burkholderia sp. WS. Tetrahedron:Asymmetry , 2004, 15 : 2837–2839. DOI:10.1016/j.tetasy.2004.06.035 |
| [11] | 施介华, 蔡栋材, 叶蒙. 固载化猪胰脂肪酶的制备及其在2-氯丙酸甲酯水解中应用. 浙江工业大学学报 , 2009, 37 (1) : 32–35. Shi J H, Cai D C, Ye M. Immobilization of porcine pancreas lipase and its application in hydrolysis of methyl 2-chloropropionate. Journal of Zhejiang University of Technology , 2009, 37 (1) : 32–35. |
| [12] | 曹莹莹, 邓盾, 张云, 等. 南海深海新颖低温脂肪酶的克隆、表达及酶学性质鉴定. 中国生物工程杂志 , 2016, 36 (3) : 43–52. Cao Y Y, Deng D, Zhang Y, et al. Cloning, expression and characterization of a novel Psychrophile lipase from the deep sea of the south China Sea. China Biotechnology , 2016, 36 (3) : 43–52. |
| [13] | Chen C S, Yoshinori F, Gary G, et al. Quantitative analyses of biochemical kinetic resolutions of enantiomers. Journal of the American Chemical Society , 1982, 104 : 1294–1299. |
| [14] | Antoine Overbeeke P L. Enantioselectivity of Candida rugosa lipase in the hydrolysis of 2-chloropropionic acid methyl ester. Journal of Molecular Catalysis B:Enzymatic , 2003, 21 : 89–91. DOI:10.1016/S1381-1177(02)00143-1 |
| [15] | Erland Holmberg I, Erik Hedenstriim M H, Per B, et al. Reaction conditions for the resolution of 2-methylalkanoic acids in esterification and hydrolysis with lipase from Candida cylindracea. Applied Microbiology and Biotechnology , 1991, 35 : 572–578. |
| [16] | Cao Y Y, Dun D, Aijun Sun, et al. Functional characterization of a novel marine microbial esterase and its utilization in the enantioselective preparation of (R)-methyl 2-chloropropionate. Applied Biochemistry and Biotrchnology, 20 April 2016. DOI: 10.1007/s12010-016-2094-2098. |
 2016, Vol. 36
2016, Vol. 36




