文章信息
- 钟成, 刘伶普, 李清亮, 杨攀飞, 郝俊光, 贾士儒.
- ZHONG Cheng, LIU Ling-pu, LI Qing-liang, YANG Pan-fei, HAO Jun-guang, JIA Shi-ru.
- 采用代谢组学分析技术分析工业啤酒发酵过程中风味物质生成规律
- Analyze the Mechanism of Flavor Compounds Formation Using Metabonomics Method During Industrial Beer Fermentation
- 中国生物工程杂志, 2016, 36(12): 49-58
- China Biotechnology, 2016, 36(12): 49-58
- http://dx.doi.org/DOI:10.13523/j.cb.20161208
-
文章历史
- 收稿日期: 2016-06-21
- 修回日期: 2016-07-06
2. 啤酒生物发酵工程国家重点实验室 青岛 266061
2. State Key Lab of Biological Fermentation Engineering of Beer, Qingdao 266061, China
啤酒是由麦芽和大米等为主要原料酿造的一种富含二氧化碳的低酒精饮料。与啤酒产品风味相关联的风味物质有千种之多,包括醇类、酯类、羰基类、有机酸类、硫化物等,它们之间微妙的平衡关系,共同构成了啤酒特有的风味。
高级醇和酯类化合物是两种重要的风味物质,它们是啤酒发酵过程中产生的副产物。高级醇能赋予啤酒丰满、厚实的口感;酯类能赋予啤酒芳香,并且高级醇和酯含量的比例对于啤酒的影响也很明显,通常酯类总量与高级醇总量比值为1:4~1:4.5。如果高级醇含量超过酯类的4.5倍,则啤酒口味不协调,并且饮后“易上头”,使人产生不适感,若高级醇含量低于酯类的4倍,则啤酒酯香味突出,影响啤酒正常口感[1]。因此风味物质的好坏直接影响到啤酒的品质。如何提高啤酒关键风味物质的控制水平,确保产品的风味一致性和风味稳定性一直是啤酒领域研究的重点、热点。随着研究的深入,很多研究者在啤酒风味控制领域取得了一定的成果,为提升我国啤酒质量奠定了基础,为推动我国由啤酒大国向啤酒强国的战略转变提供了保障。但风味物质调控还是面临着一系列的问题,例如研究面有待进一步拓展、研究层次需要进一步深入等等。啤酒风味物质特别是高级醇(正丙醇、异丁醇和异戊醇)及酯类(乙酸乙酯、乙酸异戊酯、己酸乙酯和辛酸乙酯)对啤酒质量影响很大,而影响这些风味物质的因素非常多,如发酵条件(麦汁组成、发酵温度、接种量)、酵母菌种等都会对最终的风味物质产生影响[2],因此,本研究中所有样品均取自啤酒工业发酵罐,与工业大生产的工艺紧密相关,研究结果可为指导工业啤酒发酵过程提供直接的理论依据。
啤酒中的高级醇主要来自两条途径:其一,通过氨基酸的异化作用,经Ehrlich机制形成;其二,通过糖代谢途径,经由氨基酸的合成途径生成。异丁醇、异戊醇和活性戊醇的前体物质分别为:缬氨酸、亮氨酸和异亮氨酸,这些高级醇的生成和这些对应的氨基酸的代谢密切关联并互相影响[3-4]。酯类风味物质主要包括乙酸酯类和乙酯类,酯类的生成主要是在醇酰基转移酶的催化作用下,由脂酰辅酶A和高级醇缩合而得到,高麦芽汁浓度发酵有利于挥发酯的生成[3],也有研究者通过分子生物学手段,过表达编码醇酰基转移酶的基因ATF1,使得乙酸酯的产量大大提升[5]。在啤酒发酵过程中,酵母的代谢是一个很复杂的过程,麦汁组成的变化、发酵温度的变化、压力的变化等,都会对酵母的代谢产生影响,并最终影响风味物质合成。本研究运用代谢组学方法分析工业啤酒发酵过程中酵母胞内代谢物和啤酒风味物质的对应关系,从代谢水平上研究风味物质形成过程中的关键影响因素,寻找关键的代谢物质,找出啤酒酿造过程中的关键代谢点,以期从系统生物学的角度挖掘实际发酵过程中重要代谢物的变化规律与醇酯调控之间的相互关系。
1 材料与方法 1.1 材料菌种:Lager酵母。
主要仪器:CLARUS 580气相色谱仪(Perkin Elmer公司);HS40顶空进样器(Perkin Elmer公司);WZ-112/ATC手持折光仪(北京阳光亿事达贸易有限公司)。
主要试剂:正丙醇、异丁醇、异戊醇、乙酸乙酯、乙酸异戊酯、辛酸乙酯、己酸乙酯、乙醛、双乙酰、戊二酮(色谱纯,Sigma-Aldrich公司)、蛋白胨、酵母膏、葡萄糖。
麦芽汁培养基:麦芽通过粉碎、糖化后进行煮沸灭菌,过滤后得到新鲜麦汁,pH值自然;固体麦芽汁培养基加1.5%~2%的琼脂。
YEPD培养基:蛋白胨2%,酵母膏1%,葡萄糖2%,pH6.0,固体麦芽汁培养基需另加1.5%~2%的琼脂,121℃灭菌20 min。
发酵培养基:与液体麦芽汁培养基相同。
1.2 方法 1.2.1 发酵条件样品选取自某工厂的发酵罐,产品为13°P优质啤酒。
满罐酵母数为2.05×107个/ml,24 h酵母数为3.3×107个/ml;初始糖度为12.8°P,满罐温度:8.5℃,主酵温度:9.1~9.5℃,主酵时间117 h (满罐到升温还原)。
1.2.2 取样通过试验发现第0 h由于酵母浓度较低,且发酵液刚充氧结束,固形物没有完全沉降,细胞的收集洗涤比较困难,对代谢分析影响很大,达不到理想效果。因此本实验共设计5个取样点:分别于第24 h、48 h、72 h、96 h和120 h进行取样分析,取样量为1 L发酵液,于4℃下6 000 r/min离心5 min,上清用于风味物质的测定,用PBS缓冲液清洗下层细胞,在离心后的细胞中加入适量PBS缓冲液,震荡,4 000 r/min 4℃离心5 min,弃上层缓冲液保留下层细胞,反复3次,弃上清,以去除细胞表面培养基成分。用Milli-Q水清洗细胞,在PBS缓冲液清洗后的下层细胞中加入适量Milii-Q水,震荡,4 000 r/min 4℃离心5 min,弃上清,保留下层细胞,以去除经PBS缓冲液清洗后残留的离子成分。将清洗后的细胞置于液氮中,淬灭5 min并于-80℃冻存,准备胞内小分子代谢物的提取。
1.3 分析方法 1.3.1 糖度的测定先从发酵罐取样口取200 ml发酵液,将发酵液转移到量筒中,量筒置于恒温水箱中,将糖度范围0~20的糖度计放入发酵液中,待糖度计稳定,读取分界线的刻度值即为发酵液糖度[6]。
1.3.2 啤酒风味物质测定采用气相色谱法结合顶空进样测定发酵液中的风味物质[7-12],主要包括“三醇四酯”:正丙醇、异戊醇、异丁醇;乙酸乙酯、乙酸异戊酯、已酸乙酯和辛酸乙酯;乙醛;“联二酮类”:双乙酰,戊二酮。
其中醇酯以及乙醛的检测条件如下:
顶空进样:炉温60℃,加热时间40 min,传输线温度110℃,取样针110℃,载气25 psi。
气相色谱:起始温度50℃,保持3 min;以30℃/min程序升温至180℃,保持3 min;载气为氮气,流设为15 psi,氢气流量45 ml/min,空气流量450 ml/min。
检测器:氢火焰离子化检测器(FID)温度250℃;injection温度150℃。
样品前处理:取50 ml发酵液过滤,将滤液震荡除气,取5 ml于20 ml顶空进样瓶中用Milli-Q水稀释一倍,密封。将密封后的顶空进样瓶放入进样盘中待测。
联二酮检测条件:
顶空进样:炉温68℃,加热时间40 min,传输线温度110℃,取样针110℃,载气30 psi。
气相色谱:起始温度50℃,维持3 min;以45℃/min程序升温至90℃,维持6 min;载气为氮气,流速20 psi,氢气45 ml/min,空气450 ml/min。
检测器:电子捕获检测器(ECD)温度150℃;injection温度150℃。
样品前处理:取50 ml发酵液过滤,将滤液震荡除气,取5 ml于经20 ml顶空进样瓶中用Milli-Q水稀释一倍,密封。将密封后的顶空进样瓶放入进样盘中待测。
1.3.3 酵母胞内小分子代谢物的提取将冻存细胞利用液氮在研钵中研磨20 min,将细胞磨至细粉状。称取50 mg,用液氮研磨好的细胞置于1.5 ml离心管中用于小分子代谢物的提取,每个取样点取五个平行样品。离心管中加入1 ml预冷的提取液(先加500 μl -80℃纯甲醇,再加500 μl 4℃ Millin-Q),涡旋1 min至匀,液氮冻融,每次冻2 min,重复4次。细胞提取液以10 000 r/min 4℃离心5 min,保留上清于新的EP管中。取200 μl于新的EP管中,加入30 μl内标(氘标记琥珀酸,1.4 mg/ml),混匀后真空冷冻干燥。样品衍生化:冻干后样品加50 μl甲氧基铵盐酸盐/吡啶溶液(20 mg/ml),涡旋使冻干的样品充分溶解,置于40℃水浴中,反应80 min;加80 μl MSTFA,混合均匀,置于40℃水浴中,反应80 min;将衍生化后的样品离心,104 r/min,5 min;取100 μl上清液装于密封瓶中,并编号,于室温放置2 h,准备进行GC-MS检测[13]。
1.3.4 酵母胞内小分子代谢物的检测GC条件:HP-5气相色谱柱:60 m×0.25 mm×0.25 mm;进样量为1 μl;分流比设为5:1;进样口温度:280℃;载气:高纯氦;氦气流速:恒压,91 KPa;升温程序:初始温度70℃,保持2 min,以5℃/min升温到290℃,保持6 min。
质谱条件:EI电离电压:70 eV;离子源温度:250℃;扫描范围:50~800 m/z;扫描速度:2 scan/s。每个样品平行检测5次,保证平行性。
2 结果与讨论 2.1 数据采集本研究旨在分析工业啤酒发酵过程中酵母胞内代谢物和啤酒风味物质的对应关系,从代谢水平上研究风味物质形成过程中的关键代谢节点。采用高通量的现代分析手段,结合多元统计分析方法从代谢水平研究啤酒发酵过程中酵母胞内代谢物的变化规律。数据采集包括两部分:发酵过程中常规指标的测定,即发酵过程参数(包括糖度、pH、酵母细胞数等)和啤酒风味物质(高级醇、酯类、醛类、联二酮类等);发酵过程中酵母胞内代谢物的测定。
2.1.1 发酵过程常规指标测定实验跟踪啤酒发酵过程中糖度、pH和酵母数的变化,结果见图 1。结果表明主酵过程中糖度下降明显,平均1.5°P/d,说明主酵过程中酵母代谢、生长活跃。通过酵母生长曲线可知,第24 h酵母生长进入对数期,酵母细胞数迅速增加,第72 h开始增长速率减缓,直至第96 h达到峰值4.9×107个/ml。发酵液pH在主酵过程中呈下降趋势,主要是因为主酵过程中产生大量CO2,部分CO2溶于发酵液产生H2CO3和HCO3-,从而导致发酵液pH下降。

|
| 图 1 发酵过程中常规参数检测 Figure 1 Conventional parameter detection of beer fermentation process |
发酵过程中的风味物质检测结果见表 1,其中双乙酰和戊二酮单位为10-3 mg/L,其余风味物质单位为mg/L。结果表明,发酵过程中高级醇(正丙醇、异丁醇和异戊醇)、酯类(乙酸乙酯、乙酸异戊酯、己酸乙酯和辛酸乙酯)的含量呈逐步上升的趋势,其中异戊醇和乙酸乙酯含量最高,且增加趋势最明显,其他高级醇和酯类特别是己酸乙酯和辛酸乙酯含量本身就低,在整个主酵过程中变化不明显。主酵过程结束时,发酵液中异戊醇含量达到53.16 mg/L;乙酸乙酯含量达到10.34 mg/L。
| 24h | 48h | 72h | 96h | 120h | 趋势图 | |
| 乙醛 | 9.44 | 11.76 | 16.32 | 15.96 | 15.08 | 
|
| 正丙醇 | 2.9 | 4.18 | 5.78 | 6.08 | 6.48 | 
|
| 乙酸乙醋 | 1.02 | 2.32 | 6.02 | 7.06 | 9.7 | 
|
| 异丁醇 | 1.9 | 3.48 | 5.92 | 6.4 | 7.46 | 
|
| 异戊醇 | 11.62 | 23.88 | 41.02 | 43.36 | 48.92 | 
|
| 乙酸异戊酯 | 0.06 | 0.16 | 0.48 | 0.58 | 0.86 | 
|
| 己酸乙酯 | 0.02 | 0.02 | 0.06 | 0.08 | 0.12 | 
|
| 辛酸乙酯 | 0 | 0.04 | 0.08 | 0.1 | 0.16 | 
|
| 双乙酰 | 209.2 | 335.1 | 398.6 | 397.7 | 375.9 | 
|
| 戊二酮 | 103.4 | 227.4 | 325.9 | 335.8 | 337.1 | 
|
乙醛是啤酒酵母在发酵过程中的重要中间代谢产物,是乙醇与乙酸的前体物质,在发酵初期大量产生。在主酵阶段乙醛的含量呈先上升后下降趋势,在发酵第3天达到峰值16.32 mg/L,随后因转化为乙醇等含量逐渐下降。双乙酰是反映啤酒成熟度的一项重要理化指标,其含量高低直接影响啤酒口味,在啤酒中的味阈值为0.1 mg/L,超过阈值就会产生一种令人不愉快的味道。联二酮的前驱物质α-乙酰乳酸和α-乙酰羟基丁酸主要是在主酵阶段形成的,发酵的二至五天形成高峰值(双乙酰375.9×10-3 mg/L、戊二酮337.1×10-3 mg/L),当主酵过程结束,发酵过程进入升温还原阶段,双乙酰含量逐渐消减。而且双乙酰/戊二酮的值可以作为啤酒是否染菌的判别标准,发酵液或成品啤酒中双乙酰/戊二酮的比值在1~3范围,若双乙酰/戊二酮的比值≥4,则表明成品酒或发酵液可能受微生物污染[14]。
2.1.2 发酵过程胞内代谢物检测将离心收集的酵母细胞,洗涤、淬灭以阻断代谢过程,利用液氮研磨法破碎细胞,并利用冷甲醇法提取胞内小分子代谢物。提取的代谢物经过冷冻干燥去除水分,经过衍生化后通过气质进行检测。酵母胞内代谢物的总离子流图溶剂延迟3 min,积分参数:初始峰宽为0.02,初始阀值设为12,初始面积截留为0。共检测到约120个峰,除去溶剂峰,共定性到80种代谢物。通过定性发现,同一种代谢物出现在不同的保留时间,这可能是因为每个保留时间下物质的硅烷化程度不同,即出现衍生化不完全的现象,此次试验将不同保留时间出现的同一代谢物归为一种,因此共定性、定量62种胞内代谢物。
代谢物种类主要包括氨基酸,糖醇类,单糖类,二糖类,糖酸,有机酸,脂肪酸等。其中含量最多的为氨基酸类,这与Ding等[15]的研究结果相似,在其研究中通过飞行时间质谱(GC-TOF-MS)定性到的代谢物种包含16种与氨基酸代谢相关代谢物。其他代谢物如琥珀酸等是TCA代谢的重要中间产物,葵酸、月桂酸、十六烷烯酸、十八烷烯酸等是脂肪酸代谢途径中的重要产物。海藻糖是酿酒酵母胞内重要的贮藏性碳源,也是良好的抗胁迫保护剂。磷酸是重要的代谢中间物并参与磷酸化、信号转导通路的调控等重要代谢过程。
2.2 数据分析通过高通量数据收集之后得到海量的、多维的代谢数据,必须采用一系列多元统计分析方法对数据进行有效的转换和提取,以得到数据中的潜在信息。多元统计分析方法根据有无供学习利用的训练样本可分为无监督(无导师)学习方法和有监督(有导师)学习方法。无监督的学习方法主要包括主成分分析、聚类分析、自组织映射以及簇类分析等研究手段。有监督的学习方法主要有偏最小二乘分析、ANN、支持向量机等。研究采用了两种分析方法:主成分分析和偏最小二乘分析法。
2.2.1 主成分分析主成分分析(PCA)利用矩阵的线性转换从原始多个变量中选出较少个数的能解释大部分数据的重要变量,即实现数据降维的过程,是一种无监督的学习方法。PCA得分图(Score plot)表示样本数据的分类信息,数据越相似的样本在得分图上距离越近;载荷图(Loading plot)表示对样本分类有贡献的变量信息及其贡献程度,主要用于发掘生物标志物,即对分类有重要贡献的自变量。其分析结果如图 2。
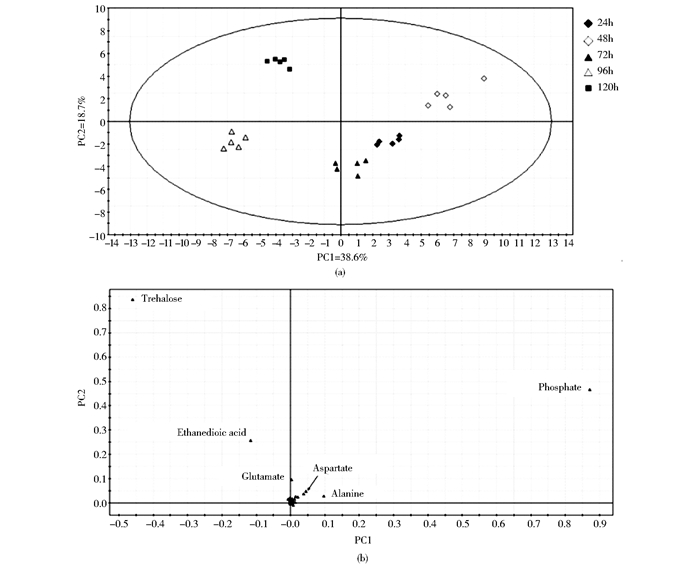
|
| 图 2 主成分分析得分图(a)和载荷图(b) Figure 2 The score plot (a) and loading plot (b) of PCA |
PCA得分图的聚散程度反映了样本代谢物的相近程度,即胞内代谢物的聚类情况,代谢水平越接近的点在得分图上越接近。图 2a表明不同发酵时间的样本在得分图上能有效分开,说明不同发酵时间的酵母胞内代谢差异比较大,随着发酵时间的改变,酵母细胞内代谢变化明显。且第24 h、48 h和72 h即主酵前期的代谢物样本主要集中在第一、四象限,而发酵第96 h、120 h即主酵后期的代谢物样本主要集中在第二、三象限,说明发酵前期跟后期酵母代谢差异明显。
PCA载荷图反映每个变量(胞内代谢物)对样本分类的贡献程度,载荷绝对值越大,离原点越远,说明该项变量与该主成分之间的相关性越大。图 2b表明对主成分贡献明显的为磷酸、海藻糖、草酸、谷氨酸、天冬氨酸、丙氨酸。说明这些代谢物随着发酵的进行,在不同发酵阶段含量变化明显,其变化规律见图 3。

|
| 图 3 关键代谢物变化图 Figure 3 Variation trend of the key metabolites |
磷酸是一种重要的中间代谢产物并参与信号转导通路的调节,其变化趋势见图 3a。磷酸的减少可能是因为大量磷酸用于糖酵解途径和TCA循环中ADP的磷酸化,同时一部分磷酸用于激活一些蛋白来调控信号转导通路来适应环境。海藻糖是酿酒酵母胞内重要的贮藏性碳源,也是良好的抗胁迫保护剂,其变化趋势见图 3b。随着发酵的进行,营养物质的消耗、乙醇等毒性物质的积累使酵母产生大量海藻糖来应对环境胁迫。发酵中期TCA循环的中间物及其代谢衍生物(草酸、谷氨酸、天冬氨酸,图 3c, d, e)代谢水平较高,这可能与啤酒发酵过程中缺氧的环境下酵母细胞呼吸减弱有关,在无氧条件下,TCA循环中间代谢物保持较高的水平[15]。酿酒酵母中丙氨酸在乙醇长时间胁迫下,其胞内含量会下降,变化趋势见图 3f。
PCA载荷图研究了胞内代谢物对样本分类的贡献,即发酵过程中哪些代谢物变化明显,是组学分析寻找标志代谢物的重要手段。但发酵过程中变化明显的代谢物是否是对风味物质影响明显的代谢物,还需要进一步探讨每个胞内代谢物对风味物质的贡献率。
2.2.2 偏最小二乘分析偏最小二乘分析(PLS)是一种研究多线性因变量对多线性自变量回归建模的多元统计数据分析方法,是一种有监督的学习方法。为了分析胞内代谢物变化规律及其与风味物质变化的关联,以不同发酵时间的酵母样品的胞内代谢物组成X矩阵,与之对应的样品中的醇酯值构成Y矩阵,进行PLS分析。所得PLS模型的R2X,R2Y及Q2分别为0.559,0.984,0.975,具有较强解释能力,说明所得模型能够较好地解释不同发酵时间酿酒酵母代谢物的变化与醇酯变化的关联性。
PLS得分图与PCA得分图类似,其聚散程度反映了胞内代谢物的聚类情况,代谢水平越接近的点在得分图上越接近,不同发酵时间的样本在PLS得分图(图 4)上也能有效分离。要寻找发酵过程中对风味物质影响较大的关键代谢节点就必须量化每个变量(胞内代谢物)对风味物质的影响,论文采用VIP值(Variable Importance Plot,变量投影重要性值)来实现量化[16]。VIP值可以量化模型中每个变量对观测样本的贡献率,其值越大表明对应变量对目标样本的贡献度越大,即组间比较所表现的差异越明显,其计算公式如下:
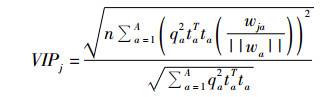 |
(式1) |

|
| 图 4 偏最小二乘得分图 Figure 4 The score plot of PLS |
其中j为第j个变量;n为变量数;A为X矩阵主成分数;T为Y矩阵主成分数;a为第a个主成分;q为Y矩阵中主成分的载荷;t为X矩阵中主成分的载荷;W为权重矩阵。
在本研究中,VIP值反映了每一种胞内代谢物对风味物质的影响程度,VIP值越大说明该胞内代谢物对啤酒风味的影响越大,即影响风味的标志性胞内代谢物。一般选取VIP值>1的代谢物作为标志性代谢物,认为其对啤酒风味影响显著,表 2显示了VIP值>1的14种代谢物。
| VIP值 | 代谢物 | VIP值 | 代谢物 |
| 1.5533 | 丝氨酸 | 1.3465 | 琥珀酸 |
| 1.5434 | 缬氨酸 | 1.3310 | 脯氨酸 |
| 1.5338 | 苏氨酸 | 1.3277 | 异亮氨酸 |
| 1.4342 | 赖氨酸 | 1.3025 | 葵酸 |
| 1.4319 | 丙氨酸 | 1.2994 | 海藻糖 |
| 1.4281 | 亮氨酸 | 1.2915 | 十六烯酸 |
| 1.4050 | 天冬酰胺 | 1.2888 | 磷酸 |
结果表明这些胞内代谢物主要涉及氨基酸代谢、糖代谢和脂肪酸代谢,对风味物质影响最大的胞内代谢物主要为氨基酸,其中有7种氨基酸的VIP值>1.4,包括丝氨酸、缬氨酸、苏氨酸、赖氨酸、丙氨酸、亮氨酸和天冬酰胺,脯氨酸VIP值为1.3310、异亮氨酸VIP值为1.3277,说明氨基酸对风味物质影响最大。其他一些代谢物如TCA循环中间代谢产物琥珀酸的VIP值为1.3465,脂肪酸代谢相关的葵酸VIP值为1.3025、十六烯酸VIP值为1.2915,以及海藻糖VIP值为1.2994,磷酸VIP值为1.2888,说明这些代谢物对啤酒风味物质的生成具有显著影响,VIP物质的变化规律见图 5。

|
| 图 5 关键代谢物变化图 Figure 5 Variation trend of the key metabolites |
由图 5可知,随着发酵的进行,丝氨酸、缬氨酸、苏氨酸、亮氨酸和异亮氨酸(图 5a, b, c, d, h)的胞内含量持续降低,在120 h时略有上升。其中支链氨基酸亮氨酸、异亮氨酸和缬氨酸在Ehrlich代谢途径中,经转氨、脱羧、还原作用分别形成异戊醇、活性异戊醇和异丁醇,它们含量的降低与风味物质的形成有一定的关系。在发酵进行到120 h时,这些氨基酸包括癸酸和十六烯酸(图 5i, j)等脂肪酸的含量开始上升,这可能是由于发酵过程中,随着乙醇含量的增加,氨基酸以及脂肪酸等物质的存在可以对细胞起到保护作用,以应对乙醇等不利条件对细胞的破坏[3, 17]。另外,苏氨酸、天冬酰胺和脯氨酸(图 5c, e, g)作为酵母自身能够合成的氨基酸,在24~48 h内一直处于较高含量,在48 h后开始降低,结合图 1以及表 1数据可知,在48 h后,酵母达到生长稳定期,此时酵母代谢旺盛,风味物质的含量急剧上升,导致天冬酰胺、脯氨酸和苏氨酸等氨基酸以及其他脂肪酸含量的下降。
2.2.3 代谢途径分析代谢途径分析是将数据分析得到的结果结合具体的生物代谢系统进行生物学意义的解释。将PLS分析得到的关键代谢节点结合酵母代谢网络分析胞内代谢物与胞外风味物质的对应关系,如图 6。

|
| 图 6 啤酒发酵过程中代谢网络 Figure 6 Metabolic networks of beer fermentation process |
酵母胞内代谢途径包括EMP途径,TCA循环、氨基酸代谢途径和脂肪酸代谢途径,其中虚线框标注的为关键代谢节点。胞外风味物质包括丙醇、乙醛、乙酸乙酯、异丁醇、异戊醇、辛酸乙酯和己酸乙酯。图 6表明关键代谢节点缬氨酸、亮氨酸与异丁醇、异戊醇含量变化关系密切,胞内缬氨酸、亮氨酸含量在发酵过程中呈下降趋势,异丁醇、异戊醇随发酵进行含量逐渐上升,该结论与参考文献[10]中Chen等的研究结论相符,在Ehrlich pathway途径中,缬氨酸,亮氨酸,异亮氨酸都转氨化为α-酮酸,α-酮酸脱羧形成的醛,再由醛还原成对应的高级醇。同时在氨基酸代谢途径中苏氨酸能够转化为异亮氨酸,因此其对啤酒风味物质也有显著影响。脯氨酸并没有直接参与酵母醇酯代谢,其对风味物质的影响可以认为是其参与谷氨酰胺合成,在酵母生长期被吸收利用于菌体生长。
酯类特别是乙酸乙酯的合成与相应醇类相关联,乙酸乙酯是乙酰辅酶A和高级醇经过酰基转移酶催化的缩合反应生成,然后再经细胞膜分泌到胞外,见图 6。脂肪酸代谢中的葵酸和十六烯酸与中链脂肪酯类代谢密切相关。
3 结论本研究对工业发酵过程Lager酵母胞内代谢物进行了鉴定,共定性定量到62种胞内代谢物,包括氨基酸类,糖醇类,糖类,糖酸,有机酸,脂肪酸等,其中氨基酸种类最多,通过主成分分析(PCA)和偏最小二乘分析(PLS)对高通量数据进行分析。对比PCA和PLS分析结果可知,琥珀酸、磷酸、丙氨酸及海藻糖在酵母代谢过程中变化明显,虽不直接参与酵母醇酯代谢,但对啤酒风味物质仍有显著影响。同时根据PLS分析结果,丝氨酸、赖氨酸对啤酒风味物质影响显著,采用同位素标记可以进一步帮助研究其代谢和其发酵过程中的次生代谢产物。利用本研究得到的关键代谢节点,解析其分子机制, 挖掘更多的与风味物质形成有关的关键基因和调控因子,将有助于通过分子手段调控啤酒酿造中风味物质的产量。
| [1] | 刘海兵. 高级醇对啤酒风味的影响及其在啤酒生产中的控制措施. 酿酒 , 2005, 32 (1) : 54–55. Liu H B. Effect of higher alcohols on beer flavors and content control during beer brewing. Liquor-making , 2005, 32 (1) : 54–55. |
| [2] | 钟成, 杨攀飞, 刘伶普, 等. 啤酒发酵过程对重要醇酯影响的研究. 酿酒科技 , 2015, 4 : 7–12. Zhong C, Yang P F, Liu L P, et al. The effects of beer fermentation process on the content of higher alcohols and esters. Liquor-Making Science and Technology , 2015, 4 : 7–12. |
| [3] | 顾国贤, 李崎, 郑飞云. 啤酒风味物质代谢与控制. 啤酒科技 , 2009, 5 : 17–23. Gu G X, Li Q, Zheng F Y. Metabolism and control of beer flavor compounds. Beer Scienceand Technology , 2009, 5 : 17–23. |
| [4] | 宋含, 王家林. 啤酒中高级醇的形成与控制. 啤酒科技 , 2013, 3 : 42–45. Song H, Wang J L. Formation and control of higher alcohols in beer. Beer Scienceand Technology , 2013, 3 : 42–45. |
| [5] | Fujii T, Yoshimoto H, Tamai Y. Acetate ester production by Saccharomyces cerevisiae lacking the ATF1 gene encoding the alcohol acetyltransferase. Journal of Fermentation and Bioengineering , 1996, 81 (6) : 538–542. DOI:10.1016/0922-338X(96)81476-0 |
| [6] | 王士安, 胡南, 张坤迪, 等. 酿酒酵母麦芽汁糖代谢与啤酒发酵度研究. 酿酒科技 , 2010, 10 : 44–47. Wang S A, Hu N, Zhang K D, et al. Study on the correlations between wort glycometabolism by Saccharomyces cerevisiae and beer fermentation degree. Liquor-Making Science and Technology , 2010, 10 : 44–47. |
| [7] | Hrivňák J, Šmogrovi ová D, Nádaský P, et al. Determination of beer aroma compounds using headspace solid-phase microcolumn extraction. Talanta , 2010, 83 (1) : 294–296. DOI:10.1016/j.talanta.2010.08.041 |
| [8] | Liu M, Zeng Z, Xiong B. Preparation of novel solid-phase microextraction fibers by sol-gel technology for headspace solid-phase microextraction-gas chromatographic analysis of aroma compounds in beer. Journal of Chromatography A , 2005, 1065 (2) : 287–299. DOI:10.1016/j.chroma.2004.12.073 |
| [9] | Castro R, Natera R, Durán E, et al. Application of solid phase extraction techniques to analyse volatile compounds in wines and other enological products. European Food Research and Technology , 2008, 228 (1) : 1–18. DOI:10.1007/s00217-008-0900-4 |
| [10] | 张丛文, 赵萍. 采用SPME/GC6820测定啤酒风味物质. 计量与测试技术 , 2005, 32 (5) : 45–46. Zhang C W, Zhao P. Making use of SPME/GC6820 analize beer of relish matter. Metrology and Measurement Technique , 2005, 32 (5) : 45–46. |
| [11] | Tian J. Determination of several flavours in beer with headspace sampling-gas chromatography. Food Chemistry , 2010, 123 (4) : 1318–1321. DOI:10.1016/j.foodchem.2010.06.013 |
| [12] | Li H, Li H, Liu X, et al. Analysis of volatile flavor compounds in top fermented wheat beer by headspace sampling-gas chromatography. International Journal of Agricultural and Biological Engineering , 2012, 5 (2) : 67–75. |
| [13] | Kato H, Izumi Y, Hasunuma T, et al. Widely targeted metabolic profiling analysis of yeast central metabolites. Journal of Bioscience and Bioengineering , 2012, 113 (5) : 665–673. DOI:10.1016/j.jbiosc.2011.12.013 |
| [14] | 钟晓盈, 杨永红, 曾玉萍. 啤酒双乙酰与戊二酮比值研究. 啤酒科技 , 2015, 4 : 22–26. Zhong X Y, Yang Y H, Zeng Y P. Research of the ratio of diacetyl and 2, 3-pentanedione in beer. Beer Science and Technology , 2015, 4 : 22–26. |
| [15] | Ding M Z, Cheng J S, Xiao W H, et al. Comparative metabolomic analysis on industrial continuous and batch ethanol fermentation processes by GC-TOF-MS. Metabolomics , 2009, 5 (2) : 229–238. DOI:10.1007/s11306-008-0145-z |
| [16] | Chong I G, Jun C H. Performance of some variable selection methods when multicollinearity is present. 2005 : 103 -112. |
| [17] | Li H, Ma M L, Luo S, et al. Metabolic responses to ethanol in Saccharomyces cerevisiae using a gas chromatography tandem mass spectrometry-based metabolomics approach. The International Journal of Biochemistry & Cell Biology , 2012, 44 (7) : 1087–1096. |
 2016, Vol. 36
2016, Vol. 36




