文章信息
- 王丽燕, 王煜, 吴坚平, 徐刚, 杨立荣.
- WANG Li-yan, WANG Yu, WU Jian-ping, XU Gang, YANG Li-rong.
- 腈水合酶NHaseK在大肠杆菌中的功能表达
- Functional Expression of a Nitrile Hydratase from Klebsiella oxytoca KCTC 1686 in E. coli
- 中国生物工程杂志, 2016, 36(12): 42-48
- China Biotechnology, 2016, 36(12): 42-48
- http://dx.doi.org/DOI:10.13523/j.cb.20161207
-
文章历史
- 收稿日期: 2016-06-12
- 修回日期: 2016-07-05
2. 江南大学 无锡 214122
2. Jiangnan University, Wuxi 214122, China
腈水合酶(Nitrile Hydratase, EC 4.2.1.84, 简称NHase)是一类重要的工业用酶,它可以催化腈类化合物水合生成相应的酰胺[1],目前已成功应用于丙烯酰胺、烟酰胺和5-氰基戊酰胺的工业化生产[2]。2-(4-氯苯基)-3-甲基丁腈(CPIN)在腈水合酶和酰胺酶的耦合作用下可转化为2-(4-氯苯基)-3-甲基丁酸[3],用于合成高效拟除虫菊酯类杀虫剂戊菊酯和氰戊菊酯等[4]。但目前报道的可转化CPIN的腈水合酶数量较少且活力很低,极大地限制了催化效率。Fallon等[5]报道,在CPIN初始浓度为10 mmol/L时,Pseudonocardia putida 5B野生菌转化CPIN的速率为0.18 μmol/min· g wet cells。通过异源表达可实现腈水合酶的过量表达,以此提高催化活性。如P.putida 5B腈水合酶的E.coli重组菌对CPIN的转化速率为8.42 μmol/ min· g dry cells[6],约为野生菌的10倍。
腈水合酶是由α亚基和β亚基构成的多亚基酶,通常以(αβ)、(αβ)2形式存在[2]。在野生菌中,腈水合酶基因以基因簇形式存在,其上/下游基因编码的蛋白对其有不同的调控作用[7]。因而在异源表达时,必须共表达位于其结构基因上/下游的特定活化元件才能形成活性蛋白[6, 8-11]。如Petrillo等[8]研究了来源于Comamonas testosteroni 5-MGAM-4D的腈水合酶在E.coli中的重组表达,发现共表达位于结构基因下游的活化元件后活力提高20倍以上。由此可见,调控双亚基以及活化元件的表达比例,是腈水合酶功能表达的关键所在。
本文以实验室前期获得的对CPIN有较高活性的腈水合酶NHaseK为研究对象[11],其α亚基、β亚基和活化元件17k的GenBank ID分别为KOX_20505, KOX_20500, KOX_20495[12]。首先选择单一载体/双启动子控制的pETDuet-1为载体,通过启动子调控三段基因的表达强度,确定合适的蛋白质表达比例。然后采用复制子不同的双启动子质粒为载体,考察质粒拷贝数对NHaseK重组表达的影响,从而实现NHaseK在大肠杆菌中功能表达的优化。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒表达宿主E.coli BL21(DE3),表达载体pETDuet-1、pACYCDuet-1、pCDFDuet-1、pRSFDuet-1由本实验室保存;重组质粒pET-N-SD17k由本实验室构建[11]。
1.1.2 工具酶与试剂限制性内切酶EcoRⅠ、HindⅢ、BglⅡ、XhoⅠ, PrimerSTAR® MAX DNA Ploymerase, T4 DNA连接酶购自TaKaRa公司;质粒DNA小量制备试剂盒购自Axygen公司;DNA ladder购自Fermentas公司;蛋白Marker ProteinRulerI、Ni-NTA琼脂糖树脂购自北京全式金生物科技公司;卡那霉素、氨苄青霉素、氯霉素、链霉素、IPTG购自北京鼎国生物技术有限责任公司;CoCl2·6H2O购自国药集团;底物CPIN、产物CPIAm由本实验室合成。
1.1.3 引物引物见表 1。
| 引物名称 | 引物序列5′→3′ |
| NHaseK1-F | CGGAATTCCATGAGCCATAAACACGACCAC |
| NHaseK1-R | CCCAAGCTTTTATGGTGTAACTCCATTATCGA |
| NHaseK2-F | GAAGATCTTATGAGCCATAAACACGACCA |
| NHaseK2-R | CCGCTCGAGTTATGGTGTAACTCCATTATCG |
| α-F | CGGAATTCCATGAGCCATAAACACGACCACG |
| α-R | CCCAAGCTTTTATGGTGCGCTAACCACACC |
| αβ-F | CGGAATTCCATGAGCCATAAACACGACCA |
| αβ-R | CCCAAGCTTTTATGCTTCCTCCAGATAGTCG |
| β-F | GAAGATCTTATGAACGGGATACATGATCTGGG |
| β-R | CCGCTCGAGTTATGCTTCCTCCAGATAGTCGTCC |
| 17k-F | GAAGATCTTATGAATACGGTAGCACAACAC |
| 17k-R | CCGCTCGAGTTATGGTGTAACTCCATTATCG |
| β17k-F | GAAGATCTTATGAACGGGATACATGATCTG |
| β17k-R | CCGCTCGAGTTATGGTGTAACTCCATTATCGA |
1.2 方法 1.2.1 表达策略的设计
选择pETDuet-1为载体,将NHaseK的α亚基、β亚基和活化元件17k基因分别插入于不同启动子之后,以期实现它们的差异表达,具体策略如表 2所示。此外,为考察质粒拷贝数对表达的影响,构建重组质粒pACYCDuet-NHaseK、pCDFDuet-NHaseK、pRSFDuet-NHaseK,它们的构建方式与pETDuet-NHaseK相同。
| 重组质粒名称 | 表达策略 | 目的 |
| pET-N-SD17 | 
|
原表达策略,以pET-30a (+)为载体 |
| pETDuet-NHaseK | 
|
利用其中一个启动子表达NHaseK |
| pETDuet-none-NHaseK | 
|
|
| pETDuet-αβ-17k | 
|
利用双启动子增强17k的表达 |
| pETDuet-NHaseK-17k | 
|
|
| pETDuet-NHaseK-β | 
|
利用双启动子增强β亚基的表达 |
| pETDuet-α-β17k | 
|
利用双启动子同时增强β亚基与17k的 表达 |
| pETDuet-αβ-β17k | 
|
|
| pETDuet-NHaseK-β17k | 
|
|
| Note: T7 represented the T7 promoter in pET-30a (+). T7-1 represented T7 promoter-1, the first promoter in pETDuet-1. T7-2 represented T7 promoter-2, the second promoter in pETDuet-1. Tag1 represented the nucleotide sequence of pET-30a (+) from initiator codon to EcoRⅠ restriction sites, containing His tag. Tag2 represented the nucleotide sequence of pETDuet-1from initiator codon following T7 promoter-1 to EcoRⅠ restriction sites, containing His tag. Tag3 represented the nucleotide sequence of pETDuet-1 from initiator codon following T7 promoter-2 to BglⅡ restriction sites without actual tag | ||
1.2.2 重组质粒的构建
以重组质粒pET-N-SD17为模板,按照表 1选择相应引物扩增各目的基因片段并纯化回收。PCR程序:95℃2 min;98℃10 s,58℃15 s,72℃20 s,循环30次;72℃2 min。按照表 3,分别采用EcoRⅠ/HindⅢ或BglⅡ/XhoⅠ双酶切PCR产物和质粒,经切胶回收后采用T4 DNA连接酶对相应基因和质粒进行连接,转化入E.coli BL21(DE3)。
| 构建质粒 | 来源质粒 | 插入基因 | 限制性内切酶 |
| pETDuet-NHaseK | pETDuet-1 | NHaseK1 | EcoRⅠ, HindⅢ |
| pETDuet-NHaseK-β | pETDuet-NHaseK | β | BglⅡ, XhoⅠ |
| pETDuet-NHaseK-17k | pETDuet-NHaseK | 17k | BglⅡ, XhoⅠ |
| pETDuet-NHaseK-β17k | pETDuet-NHaseK | β17k | BglⅡ, XhoⅠ |
| pETDuet -none-NHaseK | pETDuet-1 | NHaseK2 | BglⅡ, XhoⅠ |
| pETDuet-α | pETDuet-1 | α | EcoRⅠ, HindⅢ |
| pETDuet-α-β17k | pETDuet-α | β17k | BglⅡ, XhoⅠ |
| pETDuet-αβ | pETDuet-1 | αβ | EcoRⅠ, HindⅢ |
| pETDuet-αβ-17k | pETDuet-αβ | 17k | BglⅡ, XhoⅠ |
| pETDuet-αβ-β17k | pETDuet-αβ | β17k | BglⅡ, XhoⅠ |
| pCDFDuet-NHaseK | pCDFDuet-1 | NHaseK1 | EcoRⅠ, HindⅢ |
| pACYCDuet-NHaseK | pACYCDuet-1 | NHaseK1 | EcoRⅠ, HindⅢ |
| pRSFDuet-NHaseK | pRSFDuet-1 | NHaseK1 | EcoRⅠ, HindⅢ |
1.2.3 重组酶的诱导表达
除氨苄青霉素浓度为100 μg/ml外,卡那霉素、氯霉素、链霉素为50 μg/ml。其余方法见参考文献[11]。
1.2.4 蛋白的纯化与浓度测定采用Ni-NTA亲和层析法对粗酶液进行纯化,采用SDS-PAGE分析蛋白表达及纯化情况,采用Bradford protein assay kit测定蛋白浓度,具体方法见参考文献[13]。
1.2.5 酶活的定义与测定酶活定义:在测定条件下每分钟生成1 μmol CPIAm所需要的酶量为一个酶活单位(U)。测定方法:反应总体系为1.0 ml,含50 mmol/L柠檬酸-Na2HPO4缓冲液(pH 6.5)、2 mmol/L CPIN、5% (v/v)助溶剂甲醇,添加适量酶液起始反应。35℃振荡反应(纯酶2 min,粗酶10 min),添加0.5 ml乙腈终止反应。反应液离心,采用高效液相色谱法(福立FL2200)测定上清液中产物浓度。色谱柱采用PntulipsTM QS-C18 (5 μm × 4.6 mm × 250 mm),流动相为乙腈:水=55:50 (v/v),流速为1.0 ml/min,UV检测波长为220 nm,产物和底物的出峰时间分别为7.9 min和29.3 min。
2 结果与讨论 2.1 重组质粒的PCR验证各基因片段的大小分别为α (609 bp)、β(654 bp)、17k(468 bp)、αβ(1.3 kb)、β17k(1.1 kb)、NHaseK(1.8 kb)。对于重组质粒pETDuet-α、pETDuet-αβ、pETDuet-NHaseK、pACYCDuet-NHaseK、pCDFDuet-NHaseK、pRSFDuet-NHaseK,采用各目的基因扩增引物进行PCR验证和测序验证,结果表明各重组质粒构建成功。在上述重组质粒的T7 promoter-2之下插入相应基因,构建其余质粒。采用质粒测序引物DuetUP2 Primer和T7 Terminator Primer进行PCR验证和测序验证,结果表明各重组质粒构建成功。
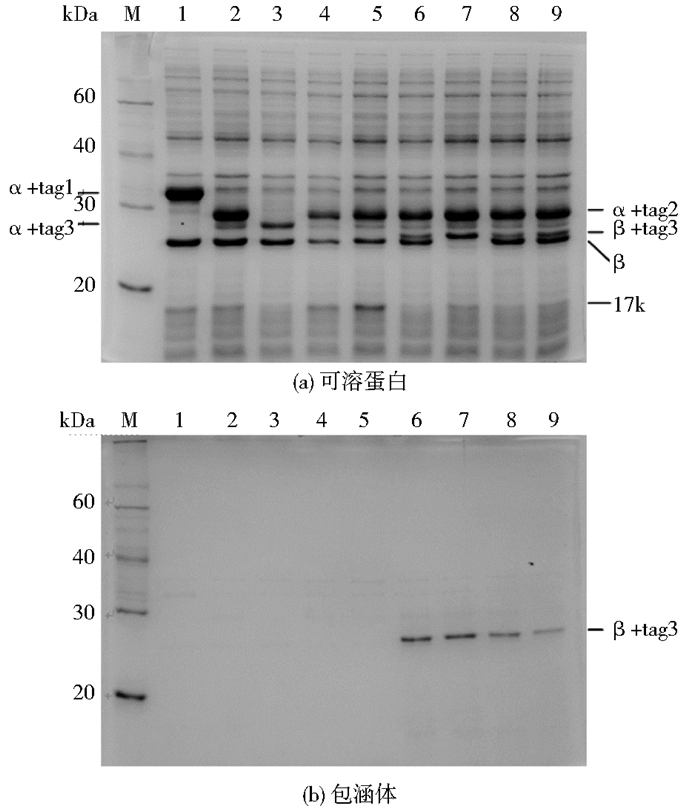
2.2 单启动子表达结果本文的出发质粒pET-N-SD17k以pET-30a (+)为载体,虽可实现NHaseK的过量表达,但存在着亚基表达量不均衡、活化元件17k表达量少的问题(图 1)。为解决该问题,本文选择pETDuet-1为载体来探索NHaseK的功能表达策略。一方面,该质粒与pET-30a (+)的复制子相同,可排除质粒拷贝数对表达的影响。另一方面,该质粒具有双T7启动子,为NHaseK三段必需基因的表达提供了更多构建可能。各表达策略的SDS-PAGE分析结果如图 1所示,部分策略的纯化结果如图 2所示,采用BandScan分析可溶蛋白表达水平,结果如表 4所示,重组酶活力如表 4所示。
|
| 图 1 以pET-30a (+)或pETDuet-1为载体的蛋白表达 Figure 1 Protein expression result of recombinant NHaseK constructed in pET-30a (+) or pETDuet-1 M:Marker; 1: pET-N-SD17k; 2: pETDuet-NHaseK; 3: pETDuet-none-NHaseK; 4: pETDuet-αβ-17k; 5: pETDuet-NHaseK-17k; 6: pETDuet-NHaseK-β; 7: pETDuet-α-β17k; 8: pETDuet-αβ-β17k; 9: pETDuet-NHaseK-β17k |

|
| 图 2 NHaseK蛋白表达及纯化电泳 Figure 2 SDS-PAGE analysis of expression and purification of NHaseK M:Marker; 1~2:Soluble protein and purified protein of pET-N-SD17k; 3~4:Soluble protein and purified protein of pETDuet-NHaseK; 5~6:Soluble protein and purified protein of pETDuet-NHaseK-17k |
| 重组质粒 | α亚基表达水平 / % |
β亚基表达水平 / % |
17k表达水平 / % |
可溶蛋白表达量 / g/L |
粗酶活力 / U/L |
纯酶比活力 / U/g |
| pET-N-SD17k | 47.0 | 27.5 | 6.0 | 0.69 | 164.92 | 630.23 |
| pETDuet-NHaseK | 31.6 | 29.6 | 5.5 | 0.75 | 183.06 | 780.05 |
| pETDuet-none-NHaseK | 22.4 | 39.4 | -- | 0.63 | 145.27 | NT |
| pETDuet-αβ-17k | 24.6 | 18.6 | 13.4 | 0.58 | 82.94 | NT |
| pETDuet-NHaseK-17k | 25.1 | 18.1 | 17.4 | 0.69 | 119.84 | 817.39 |
| pETDuet-NHaseK-β | 30.0 | 27.1 | -- | 0.66 | 144.33 | NT |
| pETDuet-α-β17k | 33.4 | 20.3 | 4.0 | 0.65 | 16.61 | NT |
| pETDuet-αβ-β17k | 32.6 | 30.8 | -- | 0.70 | 148.86 | NT |
| pETDuet-NHaseK-β17k | 29.3 | 27.0 | 3.8 | 0.69 | 136.68 | NT |
| NT: not tested | ||||||
首先考察单启动子表达结果。pET-N-SD17k、pETDuet-NHaseK、pETDuet-none-NHaseK都只采用一个启动子进行表达,pETDuet-NHaseK的亚基表达最为均衡,其α、β亚基表达量比例接近1:1;而pET-N-SD17k和pETDuet-none-NHaseK在表达时,α、β表达量比例分别为1:0.6和1:1.8,分别造成了部分α亚基和β亚基的无效表达。结合活力来看,亚基均衡表达的pETDuet-NHaseK重组菌表现出一定优势的单位蛋白粗酶活力,且纯酶比活力是pET-N-SD17k的124%。由此可见,亚基的平衡表达对提高NHaseK活力有重要作用。
2.3 双启动子增强β亚基的表达在pETDuet-NHaseK的T7 promoter-2下插入β基因,构建pETDuet-NHaseK-β,以期增强β亚基的表达。由表 4可知,与初始策略pET-N-SD17k相比,其α、β亚基表达水平更为均衡;但与pETDuet-NHaseK相比,其β亚基表达水平并没有进一步提升,结合电泳图 1b,可以发现“β+tag3”多以包涵体形式出现,说明插入于T7 promoter-2之下的β基因没有实现功能表达。此外,pETDuet-NHaseK-β表达的17k极少,这可能是导致其单位蛋白活力低于pETDuet-NHaseK的重要原因。
2.4 双启动子增强17k的表达为增强17k的表达,构建pETDuet-αβ-17k和pETDuet-NHaseK-17k。由表 4可知,它们表达17k的能力得到明显强化,其表达水平是其它策略的2~3倍;但由于受到总蛋白表达能力的限制,它们的αβ亚基表达量降低、β亚基表达量低于α亚基,最终导致粗酶活力降低。进一步对比这两种策略,发现它们的α、β亚基表达水平基本相同,但pETDuet-NHaseK-17k表达17k的能力更强,其单位蛋白的粗酶活力也更高,说明17k的增加确实可以提高NHaseK的活力。此外,pETDuet-NHaseK-17k的纯酶比活力是pETDuet-NHaseK的105%,这也意味着17k对提高比活力有积极作用,但由于降低了纯酶的亚基含量、存在着亚基表达不均衡的状况而只能表现出5%的提升效果。
2.5 双启动子同时增强β亚基和17k的表达pETDuet-α-β17k、pETDuet-αβ-β17k和pETDuet-NHaseK-β17k都在T7 promoter-2下插入β基因和17k基因,以期同时提高β亚基和17k的表达水平,但效果并不理想。从图 1b看,部分“β+tag3”以包涵体形式出现,未能实现活性表达。结合pETDuet-none-NHaseK和pETDuet-α-β17k的表达情况来看,T7 promoter-2之后插入的第一段基因表达水平较低,这可能是因为融合表达的tag3 (由质粒上的核苷酸序列编码的四个氨基酸)对表达存在着一定负面影响。另一方面,pETDuet-α-β17k的活力很低,这可能是因为当α、β由不同启动子控制独立转录时,会对它们的配对带来阻碍,不利于形成成熟蛋白。
2.6 质粒拷贝数对表达的影响考虑到Duet Vectors的各质粒除复制子、抗性不同外,其余结构无明显差异,故选取pACYCDuet-1、pETDuet-1、pCDFDuet-1、pRSFDuet-1为载体,按照pETDuet-NHaseK的构建策略,构建NHaseK在以上质粒的工程菌,以此考察质粒拷贝数对表达的影响。蛋白表达结果与活力测定结果如图 3和表 5所示。

|
| 图 3 以Duet Vectors为载体表达NHaseK的蛋白表达结果 Figure 3 Protein expression result of recombinant NHaseK constructed in Duet Vectors M:Marker; 1~2:Soluble protein and inclusion body of pETDuet-NHaseK; 3~4:Soluble protein and inclusion body of pACYCDuet-NHaseK; 5~6:Soluble protein and inclusion body of pCDFDuet-NHaseK; 7~8:Soluble protein and inclusion body of pRSFDuet-NHaseK |
| 重组质粒 | 载体 | 拷贝数 | OD600 | 蛋白浓度/g·L-1 | 粗酶活力/U·L-1 | 单位蛋白的粗酶 活力/ U·g-1 |
| pACYCDuet-NHaseK | pACYACDuet-1 | 10~12 | 3.56 | 0.671 | 173.9 | 260 |
| pETDuet-NHaseK | pETDuet-1 | 15~20 | 3.57 | 0.692 | 193.8 | 280 |
| pCDFDuet-NHaseK | pCDFDuet-1 | 15~20 | 3.74 | 0.744 | 216.8 | 290 |
| pRSFDuet-NHaseK | pRSFDuet-1 | 100~200 | 4.01 | 0.771 | 222.6 | 289 |
从图 3可知,各工程菌都能较好地实现NHaseK的可溶表达。对SDS-PAGE电泳图进行BandScan灰度扫描后发现各工程菌的亚基表达水平基本一致,并且各菌株的单位蛋白粗酶活力都在260~290 U/g范围之内(表 5),可见质粒拷贝数对单位蛋白的活力几乎无影响。另一方面,在对蛋白表达量的影响上,对比pACYCDuet-NHaseK和pETDuet-NHaseK (表 5)可知,当质粒拷贝数较低为10~12时,提高质粒拷贝数对蛋白表达量有一定的积极作用。对比pETDuet-NHaseK、pCDFDuet-NHaseK和pRSFDuet-NHaseK可知,当质粒拷贝数为15~20后,继续提高质粒拷贝数的作用很微弱,此时发酵液菌体浓度OD600对表达量的影响更为明显。
3 总结本文利用单一载体/多个启动子控制的pETDuet-1载体,成功实现了NHaseK在大肠杆菌中的功能表达。当将NHaseK的α亚基、β亚基、活化元件17k以基因簇的形式插入于pETDuet-1的T7 promoter-1之下(pETDuet-NHaseK)时,α亚基:β亚基表达水平由初始策略的1:0.6提升至1:1,均衡表达后纯酶比活力由630.23 U/g提升至780.05 U/g,证实亚基的平衡表达对腈水合酶有重要意义。进一步在T7 promoter-2之下重复插入17k基因(pETDuet-NHaseK-17k),使得17k表达水平提高2倍,但双启动子的竞争使得亚基表达水平降低。从比活力来看,pETDuet-NHaseK-17k为817.39,虽与pETDuet-NHaseK策略相比仅提高5%,但考虑到亚基含量的降低对比活力有负面影响,因而可推测17k的补充表达对NHaseK的活力有积极作用。此外,本文研究了质粒拷贝数对NHaseK重组表达的影响,结果表明15~20的质粒拷贝数足以实现其功能表达。
| [1] | Asano Y, Tani Y, Yamada H. A new enzyme nitrile hydratase which degrades acetonitrile in combination with Amidase. Agricultural and Biological Chemistry , 1980, 44 (9) : 2251–2252. |
| [2] | Prasad S, Bhalla T C. Nitrile hydratases (NHases):at the interface of academia and industry. Biotechnol Adv , 2010, 28 (6) : 725–741. DOI:10.1016/j.biotechadv.2010.05.020 |
| [3] | Masutomo S, Inoue A, Kumagai K, et al. Enantioselective hydrolysis of (RS)-2-Isopropyl-4'-chlorophenylacetonitrile by Pseudomonas sp.B21C9. Bioscience Biotechnology and Biochemistry , 1995, 59 (4) : 720–722. DOI:10.1271/bbb.59.720 |
| [4] | 蒋木庚, 邢月华, 王鸣华, 等. 高效立体选择性戊菊酯和氰戊菊酯的合成. 南京农业大学学报 , 1990, 13 (4) : 110–116. Jiang M G, Xing Y H, Wang M H, et al. Stereosyntheses of S (+)-5439 and esfenvalerate. Journal of Nanjing Agricultural University , 1990, 13 (4) : 110–116. |
| [5] | Fallon R D, Stieglitz B, Turner I. A Pseudomonas putida capable of stereoselective hydrolysis of nitriles. Applied Microbiology and Biotechnology , 1997, 47 (2) : 156–161. DOI:10.1007/s002530050905 |
| [6] | Wu S, Fallon R D, Payne M S. Over-production of stereoselective nitrile hydratase from Pseudomonas putida 5B in Escherichia coli:activity requires a novel downstream protein. Applied Microbiology and Biotechnology , 1997, 48 (6) : 704–708. DOI:10.1007/s002530051119 |
| [7] | Komeda H, Kobayashi M, Shimizu S. Characterization of the gene cluster of high-molecular-mass nitrile hydratase (H-NHase) induced by its reaction product in Rhodococcus rhodochrous J1. Proceedings of the National Academy of Sciences of the United States of America , 1996, 93 (9) : 4267–4272. DOI:10.1073/pnas.93.9.4267 |
| [8] | Petrillo K L, Wu S J, Hann E C, et al. Over-expression in Escherichia coli of a thermally stable and regio-selective nitrile hydratase from Comamonas testosteroni 5-MGAM-4D. Applied Microbiology and Biotechnology , 2005, 67 (5) : 664–670. DOI:10.1007/s00253-004-1842-9 |
| [9] | Song L, Yuan H J, Coffey L, et al. Efficient expression in E. coli of an enantioselective nitrile hydratase from Rhodococcus erythropolis. Biotechnol Lett , 2008, 30 (4) : 755–762. DOI:10.1007/s10529-007-9611-3 |
| [10] | Rzeznicka K, Schatzle S, Bottcher D, et al. Cloning and functional expression of a nitrile hydratase (NHase) from Rhodococcus equi TG328-2 in Escherichia coli, its purification and biochemical characteriation. Appl Microbiol Biotechnol , 2010, 85 (5) : 1417–1425. DOI:10.1007/s00253-009-2153-y |
| [11] | Guo F M, Wu J P, Yang L R, et al. Overexpression of a nitrile hydratase from Klebsiella oxytoca KCTC 1686 in Escherichia coli and its biochemical characterization. Biotechnology and Bioprocess Engineering , 2015, 20 (6) : 995–1004. DOI:10.1007/s12257-015-0370-z |
| [12] | Shin S H, Kim S, Kim J Y, et al. Complete genome sequence of Klebsiella oxytoca KCTC 1686, used in production of 2, 3-butanediol. Journal of Bacteriology , 2012, 194 (9) : 2371–2372. DOI:10.1128/JB.00026-12 |
| [13] | 裴晓林. 腈水合酶基因资源开发及其重组表达体系在制备烟酰胺中的应用. 杭州:浙江大学 , 2013 . Pei X L. Discovery of nitrile hydratase genes and their recombinant expression for the production of nicotanamide. Hangzhou:Zhejiang University , 2013 . |
 2016, Vol. 36
2016, Vol. 36




