文章信息
- 吴芹, 胡蝶, 李雪晴, 袁风娇, 李剑芳, 邬敏辰.
- WU Qin, HU Die, LI Xue-qing, YUAN Feng-jiao, LI Jian-fang, WU Min-chen.
- Y13F定点突变改良米曲霉中温木聚糖酶的耐热性
- Site-directed Mutagenesis of Y13F to Improve the Thermotolerance of Mesophilic Xylanase from Aspergillus oryzae
- 中国生物工程杂志, 2016, 36(12): 36-41
- China Biotechnology, 2016, 36(12): 36-41
- http://dx.doi.org/DOI:10.13523/j.cb.20161206
-
文章历史
- 收稿日期: 2016-06-06
- 修回日期: 2016-06-30
2. 江南大学食品学院 无锡 214122;
3. 江南大学无锡医学院 无锡 214122
2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China;
3. Wuxi Medical School, Jiangnan University, Wuxi 214122, China
内切β-1, 4-D-木聚糖酶通常简称为木聚糖酶(xylanases, EC 3.2.1.8),是木聚糖降解酶系中的关键组分。基于酶蛋白一级结构的同源比对和疏水簇分析,绝大多数木聚糖酶归属于糖苷水解酶家族(GHF) 10和11[1]。目前野生型或商品化的木聚糖酶多数为最适温度Topt在40~50℃的中温酶,然而酶在使用过程中(如纸浆漂白和饲料制粒等)经常会遭遇或需要高温环境[2]。因此,木聚糖酶耐热性差已成为制约其发展的瓶颈。
采用蛋白质/基因工程技术对木聚糖酶分子进行改造,以获取催化活性高且酶学特性优良的突变木聚糖酶,已成为众多研究者关注的热点。Zhang等[3]将源自Streptomyces olivaceoviridis的中温木聚糖酶SoxB的N端区域替换为耐热酶TfxA的对应区域,获得了最适温度和热稳定性均显著提高的杂合木聚糖酶STxAB。Turunen等[4]在Trichoderma reesei木聚糖酶分子中引入一个二硫键,突变酶的半衰期t1/265由野生型的小于1 min延长至14 min。Georis等[5]在Streptomyces sp. S38中温木聚糖酶Xyl1中引入额外的芳香族氨基酸疏水相互作用Tyr11-Tyr16,突变酶的熔解温度Tm较Xyl1提高了9℃。
作者所在实验室前期从A. oryzae CICC40186基因组中克隆了一种GHF11木聚糖酶基因Aoxyn11A,并成功将其在P. pastoris中进行了表达。除耐热性较差外,AoXyn11A是一种具有催化活性高、酶学特性优良的催化剂[6]。本研究基于AoXyn11A与同一家族代表性耐热酶的多序列比对、三维结构的同源建模和分子动力学模拟,将AoXyn11A的Y13置换为疏水性强的F,增强疏水相互作用,以提高酶的热稳定性。据此,采用PCR技术对Aoxyn11A实施定点突变构建Aoxyn11AY13F,分别将Aoxyn11A和Aoxyn11AY13F在P. pastoris中表达,并分析和比较AoXyn11A和AoXyn11AY13F的耐热性。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养基Escherichia coli JM109、E. coli DH5α、Pichia pastoris GS115和表达质粒pPIC9K均由作者所在实验室保存;重组表达质粒pPIC9K-Aoxyn11A (含His标签)由本实验室构建和保存;克隆质粒pUCm-T购自上海Sangon公司;培养基LB、MD、YPD、YPD-G418、BMGY和BMMY的配制,参照Multi-Copy Pichia Expression Kit (Invitrogen公司)操作手册。
1.1.2 工具酶和试剂限制性内切酶、T4 DNA连接酶和rTaq DNA聚合酶,购自大连TaKaRa公司;EZ-10柱式DNA胶回收试剂盒、Geneticin G418,DNA Marker和蛋白质Marker,均购自上海Sangon公司;桦木木聚糖、D-木糖和考马斯亮蓝R-250为Sigma公司产品;其他试剂均为国产或进口分析纯。
1.2 方法 1.2.1 耐热木聚糖酶的获取和分析以AoXyn11A一级结构(GenBank:AFA51067)为模板,在GenBank数据库(http://www.ncbi.nlm.nih.gov/genbank/)中运用BLAST服务器搜寻与模板一级结构同源性大于50%的GHF11耐热木聚糖酶,去除重复和不完整序列并查阅相关文献,最终获得7种温度特性数据齐全的代表性耐热木聚糖酶。
运用ClustalW2程序(http://www.ebi.ac.uk/Tools/msa/clustalw2)将AoXyn11A与7种耐热木聚糖酶进行多序列同源比对,在N端区域寻找和分析可能对酶耐热性有影响的芳香族氨基酸及其位点。
1.2.2 木聚糖酶三维结构的同源建模和分析在PDB数据库(http://www.rcsb.org/)中搜索与AoXyn11A一级结构同源性高、且晶体结构已知的GHF11木聚糖酶,
采用PIC程序(http://pic.mbu.iisc.ernet.in/)分析AoXyn11A突变前后三维结构中存在的可能影响酶蛋白分子热稳定性的疏水相互作用力。
1.2.3 PCR引物的设计基于AoXyn11A一级和三维结构的分析,拟将其Tyr13替换为Phe,即将Aoxyn11A中编码Tyr13的密码子TAC突变为Phe的TTC。根据Aoxyn11A核苷酸序列(GenBank:JQ326257)设计一对PCR引物,委托上海Sangon公司合成。引物名称和序列如下:
Y13F-F:5′-GAATTCTCCACACCCAGTAGCACGGGCTATAACAATGGCTACTTC
Xyn11-R:5′-GCGGCCGCTCAatgatgatgatgatgatgATAAACAGTGATAGC-3′,下划线为NotⅠ酶切位点,小写字母为编码His标签的序列。
1.2.4 Aoxyn11AY13F重组表达质粒的构建以pPIC9K-Aoxyn11A为模板、Y13F-F和Xyn11-R为上下游引物,PCR扩增突变木聚糖酶基因Aoxyn11AY13F。将目的PCR产物与pUCm-T连接,转化E. coli JM109,经蓝白斑筛选、双酶切鉴定和DNA测序。将测序正确的重组质粒pUCm-T-Aoxyn11AY13F用EcoRⅠ和NotⅠ双酶切,回收目的基因,与经同样双酶切的表达质粒pPIC9K连接,获重组表达质粒pPIC9K-Aoxyn11AY13F,转化E. coli DH5α,DNA测序验证。
1.2.5 木聚糖酶的表达和纯化将pPIC9K-Aoxyn11A和pPIC9K-Aoxyn11AY13F分别用SalⅠ线性化,电转化P. pastoris GS115,具体操作参照基因脉冲仪(Bio-Rad公司)说明书。重组毕赤酵母的鉴定、多拷贝筛选和诱导表达等参考Multi-Copy Pichia Expression Kit操作手册。重组子经1.0% (v/v)甲醇诱导表达72 h,上清液采用Ni-NAT亲和层析柱(北京Tiandz公司)纯化目的酶蛋白。采用SDS-PAGE分析重组表达产物。
1.2.6 木聚糖酶活性的测定酶活性测定参照文献[7]并略作修改。在2.4 ml 5 mg/ml桦木木聚糖溶液(pH 5.5、50 mmol/L柠檬酸-Na2HPO4缓冲液配制)中加入0.1 ml适当稀释的酶液,50℃准确反应10 min,加入2.5 ml DNS试剂,在沸水浴中显色7 min,测定OD540 nm值。在上述条件下,每分钟产生1 μmol还原糖(以D-木糖计)所需要的酶量定义为1个木聚糖酶活性单位(U)。
1.2.7 温度对木聚糖酶活性的影响在不同温度(45~65℃)下,按1.2.6节的方法测定木聚糖酶活性;最适温度Topt定义为最高酶活性(以相对酶活性100%计)所对应的反应温度。将酶液分别在45、50和55℃处理不同时间,按1.2.6节的方法测定残留酶活性,未经处理酶液的活性以100%计;50℃半衰期t1/250定义为酶液经50℃处理残留酶活性为50%时所对应的反应时间。
2 结果与讨论 2.1 木聚糖酶一级结构的分析基于GHF11耐热木聚糖酶的搜寻及相关文献的查阅,总结了7种代表性耐热木聚糖酶的温度特性数据(表 1)。一级结构同源比对表明,7种耐热酶分别与AoXyn11A的同源性分布在52%~64%之间。
柏文琴等[15]的研究表明,GHF11木聚糖酶的耐热性与其N端区域内的芳香族氨基酸及其疏水相互作用密切相关,以此为基础对中温酶进行改造能有效提高其最适温度和耐热性。将中温酶AoXyn11A和7种耐热酶的N端区域进行了多序列同源比对(图 1)。结果显示,AoXyn11A的Y13所对应的7种耐热酶的氨基酸大多数为F。由于Y的侧链比F的多出一个亲水性羟基,由K-D法测得Y和F的疏水参数分别为-1.3和2.8,数值越大的氨基酸其疏水性越强[16]。当F或Y与同一个氨基酸之间形成疏水相互作用时,前者所形成的疏水相互作用则更强。根据上述分析,拟将AoXyn11A的Y13替换为疏水性强的F,以改良其耐热性。

|
| 图 1 8种GHF11木聚糖酶的N端区域多序列比对 Figure 1 Multiple alignment of eight GHF11 xylanases at their N-termini |
以Penicillium funiculosum(PDB:1TE1)、E. coli (2VUL)和Hypocrea jecorina(1ENX)木聚糖酶晶体结构为模板,对AoXyn11A三维结构进行了多模板同源建模。突变前后酶三维结构中疏水相互作用的分析表明,AoXyn11A和AoXyn11AY13F的疏水作用力数目无变化,其中第13位的Y或F分别与Y8、Y169和I171形成疏水相互作用(图 2)。由于F较Y有更强的疏水性,因此F13与3个氨基酸形成更强的疏水相互作用,使酶的三维结构尤其是N端区域更加稳定,从而提高了酶的热稳定性。蛋白质/酶的N或C端是影响其热稳定性的重要区域,当发生热变性时,该区域首先去折叠导致蛋白质构象的破坏[17]。

|
| 图 2 AoXyn11AY13F的三维结构模型 Figure 2 The three-dimensional structure model of AoXyn11AY13F |
RMSD值指在模拟高温下某一时刻的蛋白质构象与初始构象之间各原子的根均方偏差值,可用作评价蛋白质/酶耐热性的指标。RMSD值越低,蛋白质/酶分子中各原子在高温下的运动幅度越小,即蛋白质/酶的耐热性越高[18]。由图 3可见,Aoxyn11AY13F的RMSD值较AoXyn11A的低,推测前者的热稳定性高于后者。

|
| 图 3 AoXyn11A (黑线)和AoXyn11AY13F (灰线)的RMSD值 Figure 3 RMSD values of AoXyn11A (black line) and AoXyn11AY13F (gray line) |
将Aoxyn11A中编码Y13的密码子TAC突变为F的TTC。以pPIC9K-Aoxyn11A为模板,PCR扩增获得长度约为600 bp的突变酶基因Aoxyn11AY13F (图 4泳道1和2)。DNA测序结果表明,Aoxyn11AY13F全长585 bp,编码188个氨基酸的突变酶AoXyn11AY13F和6个氨基酸的His标签,与预期的完全一致。将DNA测序正确的Aoxyn11AY13F克隆至pPIC9K,获重组表达质粒pPIC9K-Aoxyn11AY13F。
|
| 图 4 突变酶基因Aoxyn11AY13F的PCR扩增 Figure 4 PCR amplification for a mutant xylanase gene Aoxyn11AY13F M: DNA marker; 1, 2: Aoxyn11AY13F |
分别将pPIC9K-Aoxyn11A和pPIC9K-Aoxyn11AY13F电转化至P. pastoris GS115,挑选若干在YPD-G418 (4.0 g/L)平板上生长良好的单菌落,经1.0% (v/v)甲醇诱导72 h,按1.2.6节的方法测定上清液酶活性,筛选获得2个分别产最高AoXyn11A和AoXyn11AY13F活性的转化子,命名为GS/pPIC9K-Aoxyn11A和GS/pPIC9K-Aoxyn11AY13F,酶活性分别为104.0和89.4U/ml,而在空白对照(GS/pPIC9K)诱导上清液中并未检测到木聚糖酶活性。分别取两种转化子的表达上清液,采用Ni-NAT柱纯化目的酶蛋白。SDS-PAGE分析显示,纯化的AoXyn11A和AoXyn11AY13F均约在22.1 kDa (表观相对分子质量)处呈现单一蛋白条带(图 5泳道2和4)。

|
| 图 5 表达上清液和纯化酶的SDS-PAGE分析 Figure 5 SDS-PAGE analysis of the expressed supernatants and purified xylanases M: Protein marker; 1, 3: Expressed supernatants; 2, 4: Purified AoXyn11A and AoXyn11AY13F |
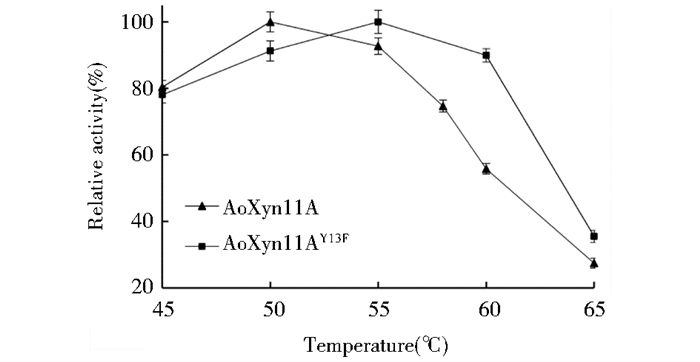
按1.2.6节的方法分析了AoXyn11A和AoXyn11AY13F的温度特性(图 6和图 7)。由图 6可见,AoXyn11A的Topt为50℃,而AoXyn11AY13F的Topt为55℃,较原酶提高了5℃。
|
| 图 6 AoXyn11A和AoXyn11AY13F最适温度的分析 Figure 6 Analysis of the temperature optima of AoXyn11A and AoXyn11AY13F |
|
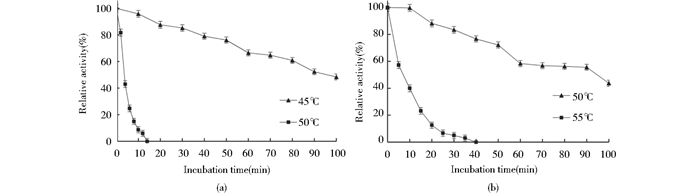
| 图 7 AoXyn11A (a)和AoXyn11AY13F (b)耐热性的分析 Figure 7 Analysis of the thermostabilities of AoXyn11A (a) and AoXyn11AY13F (b) |
由图 7可见,AoXyn11A的t1/245和t1/250分别为96和6 min,在50℃处理13 min酶活性完全丧失;而AoXyn11AY13F的t1/250为95 min,较野生型酶延长了约15倍,在55℃完全丧失酶活性的时间为40 min。
3 结论本研究通过对AoXyn11A和同一家族7种耐热木聚糖酶一级结构的多序列比对,拟将AoXyn11A N端区域的Y13替换为F,后者可与Y8、Y169和I171之间形成更强的疏水相互作用,使突变酶AoXyn11AY13F的构象更加稳定,从而改善酶的耐热性。同时,通过对AoXyn11A突变前后三维结构的分子动力学模拟和分析,发现AoXyn11AY13F的RMSD值低于AoXyn11A的,证实了AoXyn11AY13F的耐热性较AoXyn11A的高。综上所述,借助蛋白质/核酸数据库和相关文献中的数据以及计算机辅助的理性设计,可为目的蛋白质/酶分子的定向改造提供较可靠的预测结果。
基于上述木聚糖酶耐热性改造的理性设计,采用PCR技术将Aoxyn11A中编码Y13的密码子TAC突变为F的TTC,构建了一种突变酶基因Aoxyn11AY13F,并将其在P. pastoris GS115中进行了表达。酶学性质分析表明:与AoXyn11A相比,AoXyn11AY13F的耐热性得到了显著的改善。本实验方案为GHF11木聚糖酶乃至其他蛋白质/酶分子的耐热性定向改造提供了一种新的途径。
| [1] | Collins T, Gerday C, Feller G. Xylanases:xylanase families and extremephilic xylanases. FEMS Microbiol Rev , 2005, 29 (1) : 3–23. DOI:10.1016/j.femsre.2004.06.005 |
| [2] | Zhang H M, Li J F, Wang J Q, et al. Determinants for the improved thermostability of a mesophilic family 11 xylanase predicted by computational methods. Biotechnol Biofuels , 2014, 7 (1) : 1–10. DOI:10.1186/1754-6834-7-1 |
| [3] | Zhang S, Zhang K, Chen X Z, et al. Five mutations in N-terminus confer thermostability on mesophilic xylanase. Biochem Biophys Res Commun , 2010, 395 (2) : 200–206. DOI:10.1016/j.bbrc.2010.03.159 |
| [4] | Turunen O, Etuaho K, Fenel F, et al. A combination of weakly stabilizing mutations with a disulfide bridge in the α-helix region of Trichoderma reesei endo-1, 4-β-xylanaseⅡ increases the thermal stability through synergism. J Biotechnol , 2001, 88 (1) : 37–46. DOI:10.1016/S0168-1656(01)00253-X |
| [5] | Georis J, de Lemos Esteves F, Lamotte-Brasseur J, et al. An additional aromatic interaction improves the thermostability and thermophilicity of a mesophilic family 11 xylanase:Structural basis and molecular study. Protein Sci , 2000, 9 (3) : 466–475. |
| [6] | Li J F, Gao S J, Liu X T, et al. Modified pPIC9K vector-mediated expression of a family 11 xylanase gene, Aoxyn11A, from Aspergillus oryzae in Pichia pastoris. Ann Microbiol , 2013, 63 (3) : 1109–1120. DOI:10.1007/s13213-012-0568-7 |
| [7] | Wang J Q, Zhang H M, Wu M C, et al. Cloning and sequence analysis of a novel xylanase gene, Auxyn10A, from Aspergillus usamii. Biotechnol Lett , 2011, 33 (5) : 1029–1038. DOI:10.1007/s10529-011-0524-9 |
| [8] | Dumon C, Varvak A, Wall M A, et al. Engineering hyperthermostability into a GH11 xylanase is mediated by subtle changes to protein structure. J Biol Chem , 2008, 283 (33) : 22557–22564. DOI:10.1074/jbc.M800936200 |
| [9] | Hakulinen N, Turunen O, Jänis J, et al. Three-dimensional structures of thermophilic β-1, 4-xylanases from Chaetomium thermophilum and Nonomuraea flexuosa.Comparison of twelve xylanases in relation to their thermal stability. Eur J Biochem , 2003, 270 (7) : 1399–1412. DOI:10.1046/j.1432-1033.2003.03496.x |
| [10] | Zhao L, Geng J, Guo Y, et al. Expression of the Thermobifida fusca xylanase Xyn11A in Pichia pastoris and its characterization. BMC Biotechnol , 2015, 15 : 18. DOI:10.1186/s12896-015-0135-y |
| [11] | Zhang F, Chen J J, Ren W Z, et al. Cloning, expression, and characterization of an alkaline thermostable GH11 xylanase from Thermobifida halotolerans YIM 90462T. J Ind Microbiol Biotechnol , 2012, 39 (8) : 1109–1116. DOI:10.1007/s10295-012-1119-8 |
| [12] | Zhang M, Jiang Z, Yang S, et al. Cloning and expression of a Paecilomyces thermophila xylanase gene in E. coli and characterization of the recombinant xylanase. Bioresour Technol , 2010, 101 (2) : 688–695. DOI:10.1016/j.biortech.2009.08.055 |
| [13] | Sriyapai T, Somyoonsap P, Matsui K, et al. Cloning of a thermostable xylanase from Actinomadura sp. S14 and its expression in Escherichia coli and Pichia pastoris. J Biosci Bioeng , 2011, 111 (5) : 528–536. DOI:10.1016/j.jbiosc.2010.12.024 |
| [14] | Morris D D, Gibbs M D, Chin C W, et al. Cloning of the xynB gene from Dictyoglomus thermophilum Rt46B.1 and action of the gene product on kraft pulp. Appl Environ Microbiol , 1998, 64 (5) : 1759–1765. |
| [15] | 柏文琴, 王钦宏, 马延和. 嗜热和嗜碱木聚糖酶研究进展. 生物工程学报 , 2014, 30 (6) : 828–837. Bai W Q, Wang Q H, Ma Y H. Progress in the thermophilic and alkalophilic xylanases. Chinese J Biotechnol , 2014, 30 (6) : 828–837. |
| [16] | 阎隆飞, 孙之荣. 蛋白质分子结构. 北京: 清华大学出版社, 1999 : 17 -18. Yan L F, Sun Z R. Molecular Structure of Protein. Beijing: Tsinghua University Press, 1999 : 17 -18. |
| [17] | Vieille C, Zeikus G J. Hyperthermophilic enzymes:sources, uses, and molecular mechanisms for thermostability. Microbiol Mol Biol Rev , 2001, 65 (1) : 1–43. DOI:10.1128/MMBR.65.1.1-43.2001 |
| [18] | Badieyan S, Bevan D R, Zhang C. Study and design of stability in GH5 cellulases. Biotechnol Bioeng , 2012, 109 (1) : 31–44. DOI:10.1002/bit.v109.1 |
 2016, Vol. 36
2016, Vol. 36




