文章信息
- 张强, 李大帅, 卢文玉.
- ZHANG Qiang, LI Da shuai, LU Wen yu.
- 大肠杆菌异源合成三萜化合物研究进展和前景分析
- Progress and Prospect of Heterologous Biosynthesis of Ttriterpenoids in Engineered Escherichia coli
- 中国生物工程杂志, 2016, 36(11): 83-89
- China Biotechnology, 2016, 36(11): 83-89
- http://dx.doi.org/DOI:10.13523/j.cb.20161112
-
文章历史
- 收稿日期: 2016-04-21
- 修回日期: 2016-05-05
三萜化合物(triterpenoids)一般是由30个碳原子构成基本碳架的萜类化合物,大多数可看成是由6个异戊二烯单体连接而成。三萜类化合物在自然界分布广泛,部分以游离的皂苷元形式存在,如原人参二醇(protopanaxadiol)、齐墩果酸(oleanolic acid);部分由三萜苷元和糖基结合以皂苷形式存在,如人参皂苷(ginsenoside)、柴胡皂苷(saikosaponin)等,这些存在于植物中的三萜类化合物多为名贵中药材的有效药用成分,具有抗菌、抗炎、抗肿瘤、提高免疫力等功效,也有少数三萜类化合物存在于动物体和微生物体中,如羊毛甾醇(lanosterol)、鲨烯(squalene)、2,3-氧化鲨烯(2,3-oxidosqualene)等[1]。目前三萜类天然产物主要从植物中提取,但大部分三萜在其原产植物中的含量非常低,制备过程容易受到许多杂质组分干扰,而且很多珍稀药用植物生长缓慢,受严格的地域和气候条件限制,导致提取工艺复杂、产率低、成本高且环境不友好。近年来,随着合成生物学技术的迅速发展,通过利用生长快速、遗传背景清晰、易于操作的模式微生物,如大肠杆菌(Escherichia coli)和酿酒酵母(Saccharomyces cerevisiae)等作为底盘细胞异源合成天然产物成为研究热点[2]。目前,通过对酿酒酵母进行基因工程改造,合成植物源三萜类天然产物已经取得了诸多进展,但利用大肠杆菌合成三萜类化合物或其关键前体的报道尚不多见,本文针对大肠杆菌异源合成三萜类化合物的现有研究进展进行综述,对大肠杆菌作为三萜化合物底盘的前景进行分析。
1 三萜化合物微生物异源合成研究进展三萜化合物的结构类型较多,已经发现的达30多种,除个别属于直链三萜、二环三萜及三环三萜外,主要类型是四环三萜和五环三萜两大类。存在于自然界的四环三萜皂苷的苷元主要类型有:达玛烷型,如原人参二醇;羊毛脂烷型,如灵芝酸C;环阿屯烷型,如黄芪苷元;葫芦烷型,如葫芦素等。五环三萜皂苷的苷元主要类型有:齐墩果烷型,如齐墩果酸;乌苏烷型,如熊果酸;羽扇豆烷型,如桦木酸;木栓烷型,如雷公藤酮等[3]。三萜化合物的生物合成途径从生源来看,是由鲨烯或2,3-氧化鲨烯通过不同的环化方式转变而来的,鲨烯是由众多萜类化合物的共同前体焦磷酸金合欢酯(farnesyl pyrophosphate,FPP)尾尾缩合而成,2,3-氧化鲨烯由鲨烯经鲨烯环氧酶催化而来[4-5],再通过不同环化酶(oxidosqualene cyclase,OSC)环化成不同类型的萜类骨架,进一步由细胞色素P450酶(cytochrome P450)的羟基化或羧基化作用、糖基转移酶(UDP-glycosyltransferase,UGT)的糖基化作用形成复杂的三萜苷元及皂苷(图 1)[3]。
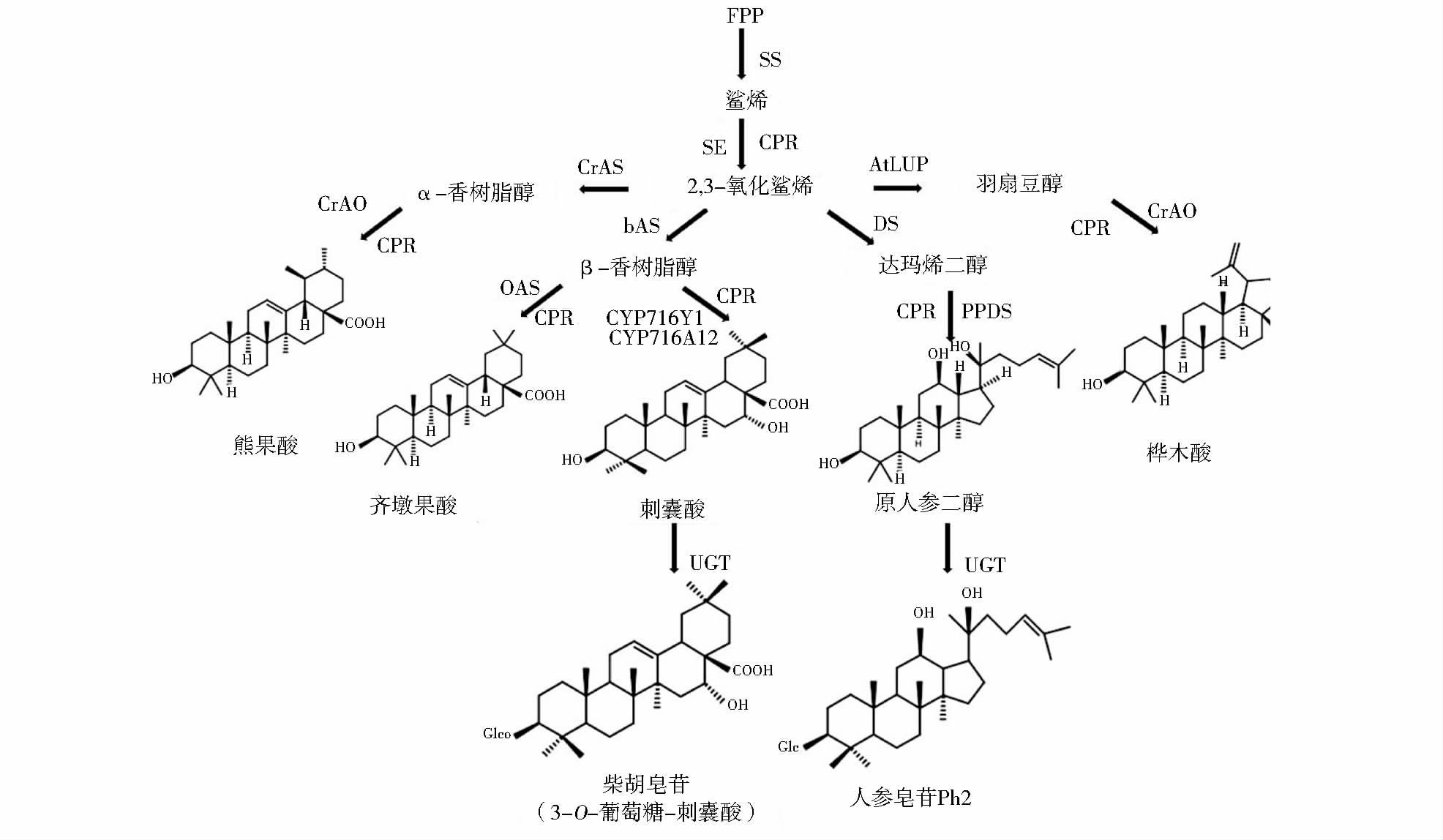
|
| 图 1 三萜类化合物生物合成途径 Figure 1 Biosynthesis pathway of triterpenoids |
随着合成生物技术的发展,在微生物中重构重要植物代谢途径已成为研究热点,通过代谢途径优化、候选基因文库筛选、基因功能鉴定、多基因组装和表达、多因素表达调控等方法,实现了多种天然产物的微生物从头合成或半合成[6-7]。其中微生物异源合成三萜类化合物取得的研究进展包括:Dai等[8-9]在酿酒酵母中重构并优化原人参二醇合成途径,获得原人参二醇产量1.2g/L,此外还获得了合成生产原人参三醇及齐墩果酸的酿酒酵母菌株;作者课题组通过优化细胞色素P450酶系统等方式,在酿酒酵母中获得原人参二醇产量1.4g/L[10];Yan等[11]利用代谢工程等方法,在酿酒酵母中首次实现了人参皂苷Compound K的从头合成;Wang等[12]通过转录组分析筛选人参皂苷合成途径的糖基转移酶基因,经代谢工程改造,在酿酒酵母中合成了人参皂苷Rh2、Rg3;Moses等[13]从植物柴胡中筛选到催化齐墩果酸和乌苏酸C16位的羟化酶CYP716Y1,并在酿酒酵母中重构了柴胡皂苷的合成途径;Davidovich-Rikanati等[14]从西瓜中筛选到葫芦二烯醇的合成基因CcCDS,并在酵母中合成葫芦二烯醇;Huang等[15]从药用植物长春花中首次分离了熊果酸与齐墩果酸合成途径中的两个关键基因CrAS和CrAO,并将这两个基因转入酵母细胞,构建具备合成熊果酸与齐墩果酸能力的酵母细胞。而环状三萜类化合物在大肠杆菌中鲜有报道,作者课题组[16]在大肠杆菌中重构人参皂苷关键前体达玛烯二醇合成途径,在大肠杆菌中从头合成四环三萜类化合物达玛烯二醇,摇瓶产量为8.63mg/L。直链三萜化合物在大肠杆菌中异源合成的研究包括:Katabami等[17]在大肠杆菌重构鲨烯合成途径,并通过优化前体FPP供应,获得鲨烯产量230mg/L;Laden等[18]鉴定表达人源鲨烯环氧酶基因,通过大肠杆菌表达和纯化,在添加NADPH-细胞色素P450还原酶情况下,体外酶转化合成了2,3-氧化鲨烯。
2 大肠杆菌异源合成三萜化合物过程分析虽然三萜化合物的微生物异源合成研究取得了一定的突破,但目前仍然面临许多亟待解决的问题:①微生物底盘的限制因素。以合成复杂三萜类化合物为例,酿酒酵母作为真核细胞具备合成高附加值植物次级代谢三萜类化合物的优势,如酿酒酵母具有内源三萜前体化合物鲨烯、2,3-氧化鲨烯,良好的细胞色素P450酶及其还原酶表达系统,糖基化修饰功能,等等,但酿酒酵母在生产三萜类化合物过程中不可避免的会遇到较长发酵周期(5~7天),较为复杂的内源三萜化合物分流途径,如甾醇合成途径等。与此同时,大肠杆菌具备较短发酵周期(2~3天),简单、较为线性化的萜类合成途径基本不会对三萜类化合物前体形成分流等优势[19]。由此,倘若能将酿酒酵母底盘细胞合成三萜类化合物过程中的细胞色素P450酶及其还原酶系统表达及糖基化修饰的可靠经验引入大肠杆菌,获得高效、快速合成复杂三萜类化合物的基因工程化大肠杆菌,有望获得复杂三萜类化合物生产的新方法。②大肠杆菌从头合成三萜类化合物需要解决的基础问题。三萜化合物合成通路长且有两步氧化还原限速步骤,即鲨烯环氧酶/CPR系统和细胞色素P450/CPR系统,氧化还原反应效率较低,使得上述两步反应成为限制大肠杆菌合成三萜类化合物的瓶颈[20-21]。③大肠杆菌合成三萜化合物的产量提高。虽然在大肠杆菌中成功获得了25g/L的倍半萜紫穗槐二烯产量[22],但更多萜类工程菌株的产量仍局限在毫克或微克每升的水平。因此,开发和优化适合于高效生产三萜类化合物的大肠杆菌底盘细胞、合成途径装配方法和人工生物系统的适配技术具有重要意义。
2.1 大肠杆菌合成三萜化合物基因元件挖掘从文献、数据库等来源调研三萜关键前体化合物鲨烯、2,3-氧化鲨烯合成途径基因,包括鲨烯合酶基因、鲨烯环氧酶基因、NADPH-细胞色素P450还原酶基因和糖基转移酶基因。通过模拟、预测、比对不同物种来源的蛋白结构和功能,构建系统进化树,组装FPP-鲨烯-2,3-氧化鲨烯表达功能模块;进而根据不同目标三萜化合物,调研不同氧化鲨烯环化酶基因,如达玛烯二醇合酶基因[23]、α-香树脂醇合酶基因[24]、β-香树脂醇合酶基因[25]、羽扇豆醇合酶基因[26]等,组装以合成三萜类化合物特异性骨架的氧化鲨烯环化酶功能模块;进一步挖掘不同三萜化合物所需的细胞色素P450酶基因、NADPH-细胞色素P450还原酶基因,组装具有羟基化或羧基化功能的P450/CPR系统表达模块;针对不同物种来源的糖基转移酶基因UGTs,组装相应糖基化修饰功能模块,对羟基化/羧基化修饰后的产物进一步糖基化修饰以形成不同位置带有不同糖基的复杂三萜化合物,如人参皂苷、柴胡皂苷等。
2.2 合成途径中关键酶的表达和优化 2.2.1 细胞色素P450酶细胞色素P450是修饰三萜化合物骨架的关键酶,过去几年中,有超过20种修饰三萜化合物的细胞色素P450被报道,其中大多数修饰β-香树脂醇骨架,修饰其他三萜化合物骨架,如α-香树脂醇、羽扇豆醇、达玛烯二醇的细胞色素P450也相继被鉴定[27-29]。目前为止,尚没有在大肠杆菌中实现细胞色素P450修饰的三萜类化合物合成的报道,但以大肠杆菌为底盘细胞合成其他细胞色素P450修饰的萜类化合物的研究多有开展,如Stephanopoulos课题组[21]利用合成生物学方法构建了紫杉二烯产量达到1g/L的大肠杆菌工程菌株,然后在该菌株中成功表达了来源于红豆杉的细胞色素P450酶-紫杉二烯-5α-羟化酶,成功获得5α-紫杉二烯醇;林章凛课题组[30]在研究降血脂药物普伐他汀的杂合体系P450sca-2/Pdx/Pdr过程中,分别选择了位于细胞色素P450sca-2底物结合口袋、底物通道及计算预测的电子传递界面的5个位点进行改造并利用大肠杆菌进行表达,最好突变株的全细胞转化活性和表观动力学常数kcat分别是初始模板的7.1倍和10.0倍,动力学分析发现其活性提高的关键来自于电子传递的改善。作者课题组[10]通过植物源P450跨膜区改造以及自供电子的P450-CPR融合蛋白质构建,使该步反应的催化效率提高4~5倍,达玛烯二醇转化原人参二醇效率由60%提高到96.8%。
通过对细胞色素P450进行生物信息学分析和三级结构建模,对可能的关键位点进行定点突变,改变底物结合域、连接域的氨基酸序列,显著改善电子传递效率。通过融合表达P450与CPR,拉近二者空间距离,并通过改变融合蛋白之间连接多肽的长短和柔性氨基酸链序列,筛选具有高活性的P450/CPR融合蛋白[31-32]。由此揭示P450/CPR系统的电子传递机制和催化反应规律,解决途径限制因素,指导三萜化合物在大肠杆菌中的异源合成。
2.2.2 NADPH-细胞色素P450还原酶作为一类末端加氧的膜蛋白,需要共表达相应还原型辅酶II(NADPH)依赖的氧化还原蛋白(CPR)才能正常行使功能,CPR是P450的主要电子供体,电子传递给P450之后,P450才能与底物发生氧化还原反应;而鲨烯经鲨烯环氧酶催化生成2,3-氧化鲨烯,该步骤中的鲨烯环氧酶(SE)作为一种单加氧酶,与P450类似,也需要同时表达相应的CPR为其提供电子,以实现催化活性[33-34]。因此需要对这两步氧化还原系统进行优化,以提高其在大肠杆菌细胞中的性能。
以大鼠肝CPR的蛋白质晶体结构为例,其含有5个结构域、3个功能域,包括N端膜连接域、FMN结合域、细胞色素P450(底物)结合域。3个功能域为FMN结合域、连接域、FAD和NADPH结合域,电子传递顺序为NADPH-FAD-FMN-P450/SE,FAD和FMN是两种黄素辅助因子,参与酶的氧化还原催化作用[28]。考虑选取不用物种来源的CPR,通过疏水性分析、跨膜区预测、进化树构建及三级结构建模,预测、鉴定负责电子传递的功能域关键氨基酸位点,结合定点突变,迭代饱和突变等方法,并通过同义突变增加5′端A、T的含量以降低与核糖体结合或翻译时mRNA二级结构的形成,筛选功能更好的CPR以实现P450及其还原酶系统电子传递的高效耦合[20, 35]。
2.2.3 糖基转移酶三萜化合物经常以皂苷形式存在于植物中,即在C-3、C-16、C-28等位置上经糖基转移酶的糖基化作用形成糖链,糖链的供体包括UDP-葡萄糖、UDP-鼠李糖、UDP-半乳糖、UDP-木糖和UDP-阿拉伯糖等,已鉴定的糖基转移酶一般分属UGT73、UGT71、UGT74和UGT91等家族[36-37]。虽然目前没有三萜皂苷在大肠杆菌中从头合成的报道,但萜类糖基转移酶在大肠杆菌中的鉴定和表达已有相关研究:Yan等[11]筛选鉴定了人参中158条潜在糖基转移酶UGT基因,通过进一步的聚类分析后选取了其中的16条序列进行大肠杆菌表达及催化实验验证,获得了催化人参皂苷CK合成的糖基转移酶基因UGTPg1。王勇课题组[38]基于前期构建的甜叶菊RNA序列数据库,对甜菊糖生物合成途径的关键酶进行了广泛地挖掘,并在大肠杆菌底盘细胞中重构了从头合成甜菊糖苷类化合物的非天然合成途径。经一系列理性设计的表达条件优化,使大肠杆菌中甜菊糖生物合成的关键中间体产量得到大幅度提高,并成功地获得了其主要组分RA,该研究在大肠杆菌中成功表达细胞色素P450酶和糖基转移酶,进一步证实萜类化合物在大肠杆菌中羟基化和糖基化的可行性。以上研究工作验证了糖基转移酶在大肠杆菌中功能表达的有效性,为大肠杆菌异源合成三萜类化合物的设计和构建提供了很好的借鉴。
2.3 优化大肠杆菌三萜合成底盘和功能模块适配优化大肠杆菌内源MEP途径、引入外源MVA途径,提高三萜化合物合成前体化合物的积累,从而优化大肠杆菌底盘细胞(图 2)[21, 39]。由于模块由多种基因元件组成,其性能优劣除取决于元件本身外还与元件组装后的整体效果有关,因此要进行模块结构优化。设计功能基因与不同元件及质粒载体的组装,功能模块整合到大肠杆菌基因组,形成多种功能模块与底盘的适配方案。测定功能模块的基因表达水平,通过调控元件(启动子、RBS)替换及拷贝数增减对基因表达强度进行上调或下调,提高模块间、模块与底盘间适配性,获得关键基因模块化构建和表达的最佳组合。通过代谢组学技术,通过对关键中间代谢物的检测,比较分析所得功能模块理论预期与实际功能间的差异,同时结合原始底盘细胞对比人工细胞基因表达差异,分析外源模块的导入对底盘细胞的代谢负荷和功能影响,获得模块与底盘细胞的适配机制。

|
| 图 2 大肠杆菌内源三萜化合物前体FPP代谢途径 Figure 2 Metabolic pathway of triterpenoid precursor FPP in Eschericchia coli |
针对三萜类化合物合成过程、动力学行为及流变学参数变化特性,分析培养基成分、外界环境、生物能及辅助因子等对细胞生长和产物生成的影响,揭示产物生成规律;考察还原力、代谢产生的活性氧自由基等对细胞生长和产物合成的影响;通过改变细胞膜通透性、修饰ATP合成酶,从物质代谢、能量水平及系统层面强化生产过程;基于合成三萜类化合物的特性开展流加培养、环境因子分阶段控制等发酵技术研究,优化培养工艺,获得低成本消耗、高产物转化、高产物浓度及高发酵强度的三萜类化合物合成工艺。
3 结论和展望结合现有研究表明,利用合成生物技术,在微生物中异源合成三萜类化合物具有重要意义。三萜类化合物作为一种重要的萜类化合物,其结构复杂、生物活性广泛,还有许多具有潜在生物活性的物质等待人们去开发利用。目前,越来越多的三萜化合物生物合成途径不断被鉴定和完善,同时利用大肠杆菌合成萜类化合物的研究也取得了大量成果。因此,通过对三萜合酶基因及其他途径上关键基因的调节,对三萜代谢途径进行定向改造,从而在大肠杆菌中重构三萜合成途径,提高三萜化合物的产量,是未来代谢工程发展的一个方向。合成生物技术的发展得益于基因测序技术、蛋白质工程和基因工程操作等技术的不断进步,同时也深刻影响着传统生物技术,如微生物分子育种。继美国生物学家J. Craig Venter创造了“人造生命”生殖器支原体(Mycoplasma genitalium)后,纽约大学Jef Boeke教授等领导的“酿酒酵母基因组合成计划”(Sc2.0 Project),利用人工设计合成基因组这一“自下而上”的技术,选育在温度、酸碱度等不同发酵条件下明显有生长优势的菌株,用于实际生产应用的开发,如食品改良、生物燃油等[40];同时,微生物的最小基因组化,即“自上而下”地将非必要基因一一剔除,尽可能只保留生长、复制或某种产物合成所需的必需基因,这种方法不仅让我们更好地了解生命的基本生化机制,也为选育优良菌种作为合成天然产物的底盘提供重要思路。因此,通过对三萜合成途径等合成生物学中核心元件的发掘及进一步标准化、合理组装方式的分析,建立生物体预测性和调控性的代谢途径,同时结合基因组合成、基因组最小化和基因组编辑等技术,选育优良底盘菌株,必将推动三萜药用成分的合成生物学的发展,为构建人工细胞来实现药用三萜化合物的大规模生产奠定基础。
| [1] | Phillips D R, Rasbery J M, Bartel B, et al. Biosynthetic diversity in plant triterpene cyclization. Current Opinion in Plant Biology , 2006, 9 (3) : 305–314. DOI:10.1016/j.pbi.2006.03.004 |
| [2] | Watanabe K. Proceedings:effective use of heterologous hosts for characterization of biosynthetic enzymes allows production of natural products and promotes new natural product discovery. The Japanese journal of antibiotics , 2015, 68 (1) : 55–67. |
| [3] | Thimmappa R, Geisler K, Louveau T, et al. Triterpene biosynthesis in plants. Annual Review of Plant Biology , 2014, 65 (1) : 225–257. DOI:10.1146/annurev-arplant-050312-120229 |
| [4] | Hoshino T, Sato T. Squalene-hopene cyclase:catalytic mechanism and substrate recognition. Chemical Communications , 2002, 33 (4) : 291–301. |
| [5] | Augustin J M, Kuzina V, Andersen S B, et al. Molecular activities, biosynthesis and evolution of triterpenoid saponins. Phytochemistry , 2011, 72 (6) : 435–457. DOI:10.1016/j.phytochem.2011.01.015 |
| [6] | Facchini P J, Bohlmann J, Covello P S, et al. Synthetic biosystems for the production of high-value plant metabolites. Trends in Biotechnology , 2012, 30 (3) : 127–131. DOI:10.1016/j.tibtech.2011.10.001 |
| [7] | Thimmappa R, Geisler K, Louveau T, et al. Triterpene biosynthesis in plants. Annual Review of Plant Biology , 2014, 65 (1) : 225–257. DOI:10.1146/annurev-arplant-050312-120229 |
| [8] | Dai Z, Liu Y, Zhang X, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides. Metabolic Engineering , 2013, 20 (5) : 146–156. |
| [9] | Dai Z, Wang B, Liu Y, et al. Producing aglycons of ginsenosides in bakers' yeast. Scientific Reports , 2014, 4 (4) : 3698. |
| [10] | Zhao F, Bai P, Liu T, et al. Optimization of a cytochrome P450 oxidation system for enhancing protopanaxadiol production in Saccharomyces cerevisiae. Biotechnology and Bioengineering , 2016, 113 (8) : 1787–1795. DOI:10.1002/bit.v113.8 |
| [11] | Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast. Cell Research , 2014, 24 (6) : 770–773. DOI:10.1038/cr.2014.28 |
| [12] | Wang P, Wei Y, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts. Metabolic Engineering , 2015, 29 : 97–105. DOI:10.1016/j.ymben.2015.03.003 |
| [13] | Moses T, Pollier J, Almagro L, et al. Combinatorial biosynthesis of sapogenins and saponins in Saccharomyces cerevisiae using a C-16α hydroxylase from Bupleurum falcatum. Proceedings of the National Academy of Sciences , 2014, 111 (4) : 1634–1639. DOI:10.1073/pnas.1323369111 |
| [14] | Davidovich-Rikanati R, Shalev L, Baranes N, et al. Recombinant yeast as a functional tool for understanding bitterness and cucurbitacin biosynthesis in watermelon (Citrullus spp.). Yeast , 2015, 32 (1) : 103–114. |
| [15] | Huang L, Li J, Ye H, et al. Molecular characterization of the pentacyclic triterpenoid biosynthetic pathway in Catharanthus roseus. Planta , 2012, 236 (5) : 1571–1581. DOI:10.1007/s00425-012-1712-0 |
| [16] | Li D, Zhang Q, Zhou Z, et al. Heterologous biosynthesis of triterpenoid dammarenediol-Ⅱ in engineered Escherichia coli. Biotechnology Letters , 2016, 38 (4) : 1–7. |
| [17] | Katabami A, Li L, Iwasaki M, et al. Production of squalene by squalene synthases and their truncated mutants in Escherichia coli. Journal of Bioscience and Bioengineering , 2015, 119 (2) : 165–171. DOI:10.1016/j.jbiosc.2014.07.013 |
| [18] | Laden B P, Tang Y, Porter T D. Cloning, heterologous expression, and enzymological characterization of human squalene monooxygenase. Archives of Biochemistry and Biophysics , 2000, 374 (2) : 381–388. DOI:10.1006/abbi.1999.1629 |
| [19] | Jiang M, Stephanopoulos G, Pfeifer B A. Toward biosynthetic design and implementation of Escherichia coli-derived paclitaxel and other heterologous polyisoprene compounds. Applied and Environmental Microbiology , 2012, 78 (8) : 2497–2504. DOI:10.1128/AEM.07391-11 |
| [20] | Leonard E, Koffas M G. Engineering of artificial plant cytochrome P450 enzymes for synthesis of iIsoflavones by Escherichia coli. Applied and Environmental Microbiology , 2007, 73 (22) : 7246–7251. DOI:10.1128/AEM.01411-07 |
| [21] | Ajikumar P K, Xiao W H, Tyo K E, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science , 2010, 330 (6000) : 70–74. DOI:10.1126/science.1191652 |
| [22] | Tsuruta H, Paddon C J, Eng D, et al. High-level production of amorpha-4, 11-diene, a precursor of the antimalarial agent artemisinin, in Escherichia coli. PLoS One , 2009, 4 (2) : e4489. DOI:10.1371/journal.pone.0004489 |
| [23] | Tansakul P, Shibuya M, Kushiro T, et al. Dammarenediol-II synthase, the first dedicated enzyme for ginsenoside biosynthesis, in Panax ginseng. FEBS Letters , 2006, 580 (22) : 5143–5149. DOI:10.1016/j.febslet.2006.08.044 |
| [24] | Li J, Zhang Y. Increase of betulinic acid production in Saccharomyces cerevisiae by balancing fatty acids and betulinic acid forming pathways. Applied Microbiology and Biotechnology , 2014, 98 (7) : 3081–3089. DOI:10.1007/s00253-013-5461-1 |
| [25] | Fukushima E O, Seki H, Ohyama K, et al. CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis. Plant and Cell Physiology , 2011, 52 (12) : 2050–2061. DOI:10.1093/pcp/pcr146 |
| [26] | Shibuya M, Zhang H, Endo A, et al. Two branches of the lupeol synthase gene in the molecular evolution of plant oxidosqualene cyclases. European Journal of Biochemistry , 1999, 266 (1) : 302–307. DOI:10.1046/j.1432-1327.1999.00875.x |
| [27] | Castillo D A, Kolesnikova M D, Matsuda S P. An effective strategy for exploring unknown metabolic pathways by genome mining. Journal of the American Chemical Society , 2013, 135 (15) : 5885–5894. DOI:10.1021/ja401535g |
| [28] | Field B, Fiston-Lavier AS, Kemen A, et al. Formation of plant metabolic gene clusters within dynamic chromosomal regions. Proceedings of the National Academy of Sciences , 2011, 108 (38) : 16116–16121. DOI:10.1073/pnas.1109273108 |
| [29] | Fukushima E O, Seki H, Ohyama K, et al. CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis. Plant and Cell Physiology , 2011, 52 (12) : 2050–2061. DOI:10.1093/pcp/pcr146 |
| [30] | Ba L, Li P, Zhang H, et al. Semi-rational engineering of cytochrome P450sca-2 in a hybrid system for enhanced catalytic activity:Insights into the important role of electron transfer. Biotechnology and Bioengineering , 2013, 110 (11) : 2815–2825. DOI:10.1002/bit.24960 |
| [31] | Fasan R, Crook N C, Peters M W, et al. Improved product-per-glucose yields in P450-dependent propane biotransformations using engineered Escherichia coli. Biotechnology and Bioengineering , 2011, 108 (3) : 500–510. DOI:10.1002/bit.22984 |
| [32] | Li S, Podust L M, Sherman D H. Engineering and analysis of a self-sufficient biosynthetic cytochrome P450 PikC fused to the RhFRED reductase domain. Journal of the American Chemical Society , 2007, 129 (43) : 12940–12941. DOI:10.1021/ja075842d |
| [33] | Shen A L, Porter T, Wilson T, et al. Structural analysis of the FMN binding domain of NADPH-cytochrome P-450 oxidoreductase by site-directed mutagenesis. Journal of Biological Chemistry , 1989, 264 (13) : 7584–7589. |
| [34] | Venkateswarlu K, Lamb D C, Kelly D E, et al. The N-terminal membrane domain of yeast NADPH-cytochrome P450(CYP) oxidoreductase is not required for catalytic activity in sterol biosynthesis or in reconstitution of CYP activity. Journal of Biological Chemistry , 1998, 273 (8) : 4492–4496. DOI:10.1074/jbc.273.8.4492 |
| [35] | Sadeghi S J, Gilardi G. Chimeric P450 enzymes:activity of artificial redox fusions driven by different reductases for biotechnological applications. Biotechnology and Applied Biochemistry , 2013, 60 (1) : 102–110. DOI:10.1002/bab.2013.60.issue-1 |
| [36] | Meesapyodsuk D, Balsevich J, Reed D W, et al. Saponin biosynthesis in Saponaria vaccaria cDNAs encoding β-amyrin synthase and a triterpene carboxylic acid glucosyltransferase. Plant Physiology , 2007, 143 (2) : 959–969. |
| [37] | Naoumkina M A, Modolo L V, Huhman D V, et al. Genomic and coexpression analyses predict multiple genes involved in triterpene saponin biosynthesis in Medicago truncatula. The Plant Cell , 2010, 22 (3) : 850–866. DOI:10.1105/tpc.109.073270 |
| [38] | Wang J, Li S, Xiong Z, et al. Pathway mining-based integration of critical enzyme parts for de novo biosynthesis of steviolglycosides sweetener in Escherichia coli. Cell Research , 2015, 26 (2) : 1–4. |
| [39] | Peralta-Yahya P P, Ouellet M, Chan R, et al. Identification and microbial production of a terpene-based advanced biofuel. Nature Communications , 2011, 2 (9) : 2749–2763. |
| [40] | Sliva A, Yang H, Boeke J D, et al. Freedom and responsibility in synthetic genomics:The Synthetic yeast project. Genetics , 2015, 200 (4) : 1021–1028. DOI:10.1534/genetics.115.176370 |
 2016, Vol. 36
2016, Vol. 36




