文章信息
- 王雅南, 沈宏伟, 杨晓兵, 赵宗保.
- WANG Ya nan, SHEN Hong wei, YANG Xiao bing, ZHAO Zong bao.
- 不同营养元素限制对圆红冬胞酵母油脂生产的影响
- Effects of Lipid Production by Rhodosporidium toruloides under Conditions with Limitation of Different Nutrient Elements
- 中国生物工程杂志, 2016, 36(11): 16-22
- China Biotechnology, 2016, 36(11): 16-22
- http://dx.doi.org/DOI:10.13523/j.cb.20161103
-
文章历史
- 收稿日期: 2016-05-23
- 修回日期: 2016-07-25
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
随着化石能源、资源的过量消耗,能源短缺、资源匮乏和环境污染等问题日益凸显。为此,世界各国的研究者不断挖掘可再生、环境友好型燃料[1]。生物柴油与化石燃料性质相近,但排放的污染气体远低于化石柴油,是最为理想的生物燃料之一[2]。当前生物柴油的原料主要来自于动物、植物油脂,但其生产受时间、地点及气候变化的影响,很难满足生物柴油的大量需求。与传统的动物、植物油脂相比,微生物油脂具有生产周期短、生产潜力大、可连续供给等优点[3]。研究发现,营养限制,如氮限制、磷限制、硫限制和铁限制等,能够促使更多的碳代谢流进入油脂合成途径[4-7]。
最近,利用产油酵母生产微生物油脂已受到广泛关注[8]。圆红冬胞酵母(Rhodosporidium toruloides)是最优良的产油酵母之一,其油脂含量高,底物范围广,生长速率快[9-12]。研究人员已经完成R. toruloides基因组、转录组、蛋白质组等多个组学数据的采集与分析,并构建了相关的遗传操作平台[13-15],为理性设计改造相关的代谢途径提供了基础[16]。此前,虽然已经报道过R. toruloides在氮、磷、硫限制条件下进行微生物油脂的生产[4-5, 9],但未就氮、磷、硫限制对油脂生产的影响进行较为系统的比较,特别是没有在发酵罐水平上对相同磷限制条件下不同初始碳源浓度对油脂生产的影响进行研究。本文通过考察不同营养限制对R. toruloides油脂生产的影响,为微生物油脂的工业化生产提供参考。
1 材料与方法 1.1 供试菌株圆红冬胞酵母Rhodosporidium toruloides AS 2.1389购自中国普通微生物菌种保藏管理中心(CGMCC)。
1.2 培养基YEPD 液体培养基:葡萄糖20g/L,酵母粉10g/L,蛋白胨10g/L。固体培养基在YEPD液体培养基基础上加入15g/L琼脂粉。C/N摩尔比为3.6,C/P摩尔比为130。
发酵培养基:①氮限制培养基,葡萄糖50.0g/L、Na2HPO4·12H2O 1.0g/L、KH2PO4 1.0g/L、MgSO4·7H2O 1.5g/L、NH4Cl从0.5/L到4g/L;②磷限制培养基,葡萄糖50.0g/L、NH4Cl 4.0g/L、K2SO4 1.0g/L、MgSO4·7H2O 1.5g/L、K2HPO4 0.05~0.4g/L;③硫限制培养基,葡萄糖50.0g/L、NH4Cl 4.0g/L、Na2HPO4·12H2O 1.0g/L、KH2PO4 1.0g/L、Na2SO4 0.025~0.3g/L。
氮、磷、硫培养基灭菌后按1%(V/V)加入已过滤除菌的微量元素母液[9]。
1.3 培养方法种子液培养:挑取R. toruloides单菌落接种于50ml YEPD液体培养基中,于30℃、200r/min摇床上培养24h。
摇瓶培养:通过测种子液的OD600值,取适当体积的种子液,在8 000g下离心5min收集菌体,用超纯水洗涤菌体两次后,再用5ml超纯水重悬,使其OD600为12,然后转接到45ml发酵培养基中。培养温度30℃,每隔24h测定葡萄糖浓度并调节pH至5.5~6.0。每组研究三个平行。
发酵罐培养:将培养24h的种子液接种到3L发酵罐(上海保兴B10TECH)中,接种量为10%,工作体积为2L。培养温度为30℃,通气量为50L/h,pH通过自动流加2mol/L NaOH控制在5.6,稀释率为0.085/h,通过溶解氧与搅拌联动控制溶解氧在45%左右。初始葡萄糖浓度分别为25g/L(A)、50g/L(B)和100g/L(C),待初始葡萄耗尽时分别进行补料,每次补料后的葡萄糖浓度与各自初始浓度相同,最终补料A组7次、B组3次、C组1次,3组消耗的葡萄糖总浓度分别为200g/L,3种补料培养基的总体积均为420ml。监测溶解氧曲线并适时取样,测定残糖浓度,以确定补料时间。在发酵过程中,每隔12h取1次样,分成3管进行生物量和油脂含量的测定。
1.4 分析方法 1.4.1 残糖测定采用山东省科学院生产的SBA-40D生物传感分析仪进行葡萄糖浓度的测定。
1.4.2 生物量测定发酵结束后,取30ml发酵液,在8 000g下离心5min收集菌体,加入去离子水洗涤2次,于105℃烘至恒重,以g干菌体/L发酵液表示菌体生物量。
1.4.3 细胞量测定发酵过程中细胞量的测定,在发酵结束前每隔24h取3ml发酵液,在8 000g下离心5min收集菌体,加入去离子水洗涤2次,于105℃烘至恒重,以g干菌体/L发酵液表示细胞量。
1.4.4 油脂含量测定采用酸热法,提取发酵液的总油脂,以g油/L发酵液表示油脂量,油脂含量为油脂量占生物量的质量百分数[9]。
1.4.5 油脂脂肪酸组成分析取油脂样品,按照文献方法进行甲酯化和脂肪酸组成分析[9]。
2 结果与分析 2.1 不同营养限制条件对油脂发酵的影响R. toruloides在初始葡萄糖浓度为50g/L的限氮、限磷、限硫培养基中培养。对于限氮培养,当NH4Cl浓度为1.0g/L时,葡萄糖在80h后耗完。但是,当NH4Cl浓度大于1.0g/L时,发酵80h后仍有残糖剩余。当不添加氮源时,葡萄糖的消耗速率迅速降低,只消耗了34%的葡萄糖[图 1(a)]。对于限磷培养,发酵80h后,只有KH2PO4的浓度为0.4g/L或0.2g/L时会有残糖剩余,其余浓度下的葡萄糖均消耗完。当KH2PO4的浓度为0.4g/L时尚有9.7g/L葡萄糖剩余[图 1(b)]。对于限硫培养,当K2SO4的浓度为0.3g/L或0.1g/L时,需要96h才能将葡萄糖耗完[图 1(c)]。当K2SO4的浓度降低时,葡萄糖的消耗速率明显降低,当不添加硫源时,残糖剩余浓度为16.0g/L。这些结果说明初始磷源浓度越低越有利于葡萄糖的吸收,而其他实验组并无此规律,且当氮源和硫源不存在时,葡萄糖的消耗速率最低。

|
| 图 1 圆红冬胞酵母油脂生产过程中葡萄糖的利用曲线 Figure 1 The time-courses of glucose evolution for lipid production by R. toruloides (a) Nitrogen-limited media (b) Phosphorous-limited media (c) Sulfur-limited media. G: glucose; N: NH4Cl; P: KH2PO4; S: K2SO4. The footnote numbers indicate the concentration (g/L) of the corresponding chemicals |
发酵过程中,除了跟踪葡萄糖的消耗以外,对细胞的生物量也进行了监测(图 2)。发现随着发酵时间的延长,不同营养限制条件下各实验组细胞量增长的变化与葡萄糖的消耗是相呼应的。实验结果表明,在本实验研究条件下磷源的降低对细胞量增长的影响并不显著,而氮源和硫源的降低对细胞量却有着较大的影响。综上所述,在油脂的发酵生产过程中,当发酵开始的接种量一致时,磷限制对细胞的生长和葡萄糖的吸收利用优于氮限制和硫限制。
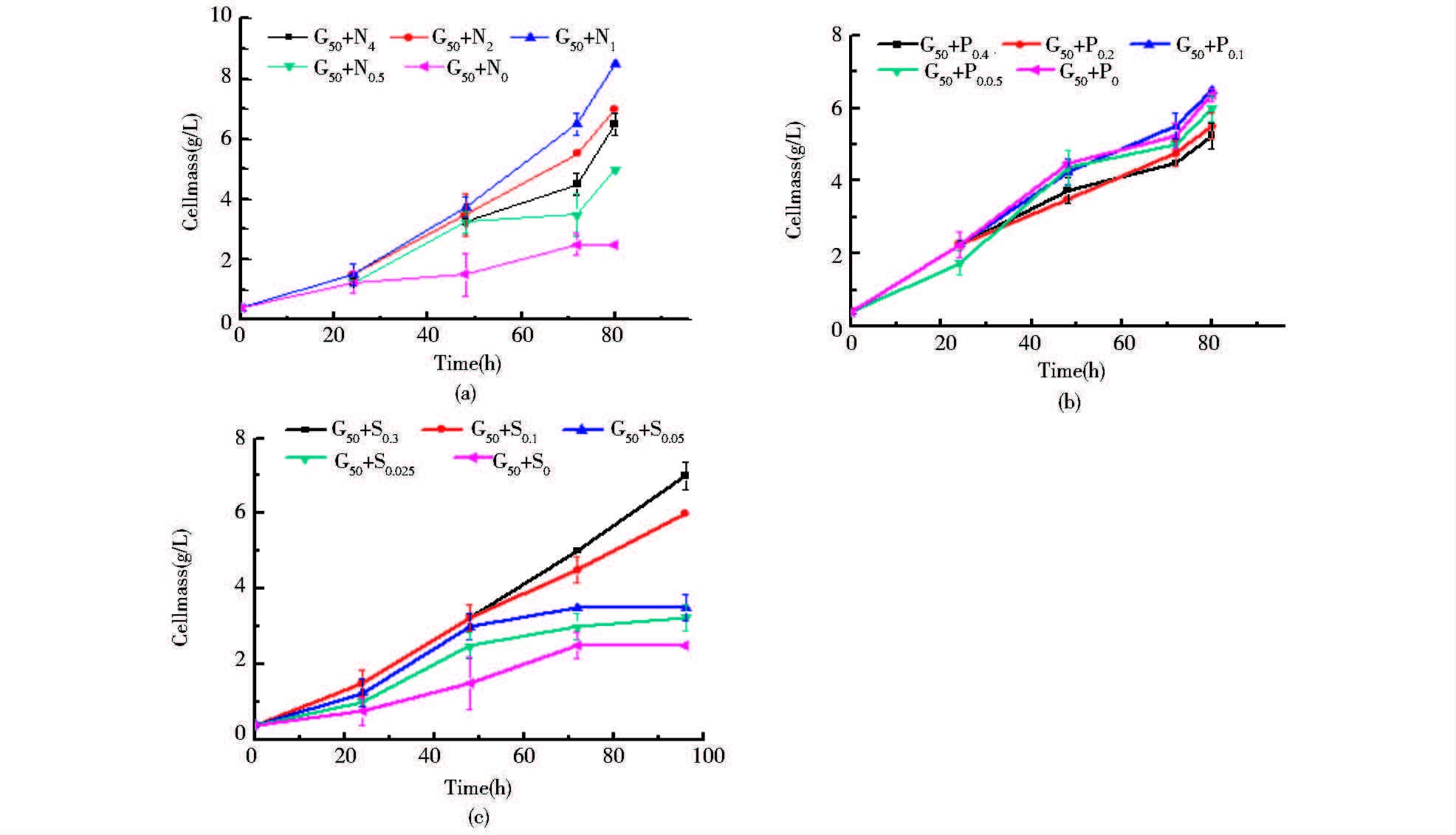
|
| 图 2 圆红冬胞酵母油脂生产过程中细胞量曲线 Figure 2 The time-courses of cellmass for lipid production by R. toruloides (a) Nitrogen-limited media (b) Phosphorous-limited media (c) Sulfur-limited media. G: Glucose; N: NH4Cl; P: KH2PO4; S: K2SO4. The footnote numbers indicate the concentration (g/L) of the corresponding chemicals |
对油脂进行提取测定,发现在合适的氮、磷、硫限制条件下,油脂含量均能超过60%(表 1)。研究结果还表明,C/N、C/P和C/S的摩尔比越高,细胞的油脂含量越高。其中油脂含量高于20%的C/N、C/P和C/S摩尔比阈值分别为于40、1 000和3 000。在研究一种营养元素限制时,其余两种元素的含量均是充足的。例如,氮限制时,初始的C/P和C/S摩尔比分别为164和410,这两者的摩尔比远远低于油脂开始积累的阈值。虽然在限氮培养条件下油脂得率超过0.16g/g,但是油脂产量会随着C/N比的改变而改变(表 1,第3~5行)。与补加氮源的实验组相比,不添加氮源时的油脂产量明显降低,仅为0.03g/(L·h),原因可能是氮缺乏严重影响了细胞增殖及油脂积累[图 1(a)]。虽然在油脂积累研究中氮限制应用较为广泛,但是随着C/N 摩尔比的增加,葡萄糖的消耗速率显著下降,导致细胞的生长速率和油脂产量降低(表 1,第3~5行)。这可能是由于R. toruloides中与脂滴相关的蛋白质超过200个[17],且油脂是储存在一层富含结构蛋白的脂滴中,所以油脂的大量储存需要相应的氮源。对于磷限制条件下的油脂生产,胞内油脂含量、油脂产量和油脂得率均随着C/P摩尔比的增加而增加(表 1,第6~10行)。因此,不添加磷源时,油脂含量和油脂产量均达到最大值,分别为66.7%和0.11g/(L·h)。对于硫限制条件下的油脂生产,随着C/S摩尔比的增加,胞内油脂含量和油脂得率均不断增加。但是,不添加硫源时,其葡萄糖消耗速率降低,导致其油脂产量比C/S摩尔比为9 460时略低。与氮限制相比,磷限制能促进积累更多的油脂(表 1,第9~10行),而硫限制条件下的油脂生产能力要弱于氮限制和磷限制。
| Entry | Nutrient indicator① | C/X(mol/mol) | Cell mass(g/L) | Lipid(g/L) | Lipid content(%) | Lipid yield (g/g) | Productivity[g/(L·h)] |
| 1 | G50-N4 | 22.3 | 17.1±0.5 | 2.7±0.1 | 15.9±1.1 | 0.06±0.00 | 0.03±0.00 |
| 2 | G50-N2 | 44.6 | 17.5±0.3 | 5.1±0.2 | 28.8±0.9 | 0.11±0.02 | 0.06±0.00 |
| 3 | G50-N1 | 89.2 | 16.2±0.8 | 8.1±0.4 | 50.4±4.9 | 0.16±0.01 | 0.10±0.00 |
| 4 | G50-N0.5 | 178.4 | 13.0±0.2 | 8.1±0.3 | 62.3±2.8 | 0.18±0.01 | 0.10±0.00 |
| 5 | G50-N0 | NA② | 4.4±0.1 | 2.8±0.2 | 64.4±4.4 | 0.16±0.01 | 0.03±0.00 |
| 6 | G50-P0.4 | 566.7 | 15.0±0.9 | 2.7±0.0 | 16.3±1.2 | 0.07±0.00 | 0.03±0.00 |
| 7 | G50-P0.2 | 1 133.3 | 17.3±1.0 | 4.9±0.6 | 28.5±3.1 | 0.11±0.01 | 0.06±0.01 |
| 8 | G50-P0.1 | 2 266.7 | 18.4±0.2 | 7.4±0.1 | 40.6±0.9 | 0.15±0.00 | 0.09±0.00 |
| 9 | G50-P0.05 | 4 533.3 | 16.6±0.8 | 8.3±0.5 | 49.9±1.3 | 0.17±0.01 | 0.10±0.01 |
| 10 | G50-P0 | NA② | 13.6±1.9 | 8.9±0.0 | 66.7±1.5 | 0.19±0.01 | 0.11±0.00 |
| 11 | G50-S0.3 | 788.9 | 19.2±0.2 | 3.2±0.2 | 16.8±1.0 | 0.06±0.00 | 0.03±0.00 |
| 12 | G50-S0.1 | 2 366.7 | 16.3±2.5 | 3.1±0.9 | 19.4±6.5 | 0.06±0.01 | 0.03±0.01 |
| 13 | G50-S0.05 | 4 733.3 | 13.3±0.5 | 3.4±0.1 | 25.7±0.9 | 0.10±0.01 | 0.05±0.01 |
| 14 | G50-S0.025 | 9 466.7 | 12.9±0.2 | 6.2±0.4 | 48.3±2.0 | 0.14±0.01 | 0.07±0.00 |
| 15 | G50-S0 | NA2) | 8.7±0.2 | 5.3±0.4 | 61.2±4.8 | 0.16±0.01 | 0.06±0.00 |
| Note: ①G: Glucose; N: NH4Cl; P: KH2PO4; S: K2SO4. The footnote numbers indicate the concentration (g/L) of the corresponding chemicals. ② NA: Not applicable,as no additional nutrient element was included for the culture | |||||||
由于大多数的生物原料本身含有碳源和其它营养元素,要提高油脂的生产效率,需要去除相应的营养元素。相比之下,脱磷比较容易,而去除氮源和硫源较为困难且成本较高[18]。此外,磷限制还能够获得最高的油脂得率和油脂产量。通过研究发现,即使在氮源充足的条件下,磷限制对油脂的生产也是极为有效的。综上所述,磷限制更适用于微生物油脂的生产。
2.2 油脂脂肪酸成分的比较对3种营养限制条件下的R. toruloides积累的油脂脂肪酸组成图谱进行分析(表 2)。通过分析发现,所得油脂主要由棕榈酸(C16∶0)、硬脂酸(C18∶0)和油酸(C18∶1)构成,占到总脂肪酸的95%以上,可以用于生物柴油的生产[2, 19-20]。在氮限制的条件下,C16∶0的含量超过了40%,且饱和脂肪酸的含量超过了55%。当不添加氮源时,饱和脂肪酸的含量最高,达到了73%(表 2,第5行)。磷限制时,除了在较低C/P摩尔比(表 2,第6行)的条件下生产的油脂外,其余条件下的不饱和脂肪酸含量均超过了50%,其中C18∶1是油脂组成中含量最高的不饱和脂肪酸(表 2,第7~10行)。而在硫限制条件下,除较低的C/S摩尔比外(表 2,第11行),其余条件下的饱和脂肪酸的含量均超过了60%,且其脂肪酸组成与可可脂类似,可以作为后者的替代品[21]。
| Entry | Nutrient indicator① | C/X(mol/mol) | Relative fatty acid content (%) | |||||
| C14∶0 | C16∶0 | C16∶1 | C18∶0 | C18∶1 | C18∶2 | |||
| 1 | G50-N4 | 22.3 | 1.7±0.3 | 31.9±2.0 | 0.2±0.2 | 27.6±0.4 | 36.8±0.7 | 1.7±0.6 |
| 2 | G50-N2 | 44.6 | 2.4±0.3 | 36.8±4.1 | 0.5±0.0 | 18.7±2.0 | 40.6±5.3 | 0.6±0.1 |
| 3 | G50-N1 | 89.2 | 2.4±0.1 | 43.8±1.1 | 0.4±0.1 | 15.6±0.8 | 37.8±1.9 | 0.1±0.1 |
| 4 | G50-N0.5 | 178.4 | 2.4±0.2 | 40.5±1.3 | 0.7±0.0 | 13.6±0.4 | 41.5±1.9 | 0.7±0.3 |
| 5 | G50-N0 | NA② | 2.2±0.3 | 49.0±0.9 | 0.2±0.2 | 22.3±1.4 | 26.3±1.3 | 0.0±0.0 |
| 6 | G50-P0.4 | 566.7 | 1.6±0.5 | 27.3±3.4 | 0.2±0.2 | 22.6±2.3 | 40.7±3.3 | 0.9±0.4 |
| 7 | G50-P0.2 | 1 133.3 | 1.3±0.2 | 25.7±1.4 | 0.6±0.2 | 15.1±1.2 | 55.6±1.4 | 1.0±0.3 |
| 8 | G50-P0.1 | 2 266.7 | 1.3±0.1 | 26.0±0.5 | 0.7±0.0 | 9.6±0.5 | 60.6±0.1 | 0.8±0.2 |
| 9 | G50-P0.05 | 4 533.3 | 1.7±0.3 | 31.3±3.3 | 0.9±0.2 | 9.2±0.2 | 55.9±4.8 | 0.9±0.1 |
| 10 | G50-P0 | NA2) | 2.0±0.4 | 38.2±4.4 | 0.9±0.2 | 8.7±1.4 | 49.5±5.9 | 0.4±0.2 |
| 11 | G50-S0.3 | 788.9 | 1.5±0.3 | 27.7±2.6 | 0.3±0.0 | 24.6±3.1 | 45.0±5.9 | 0.9±0.2 |
| 12 | G50-S0.1 | 2 366.7 | 1.6±0.4 | 31.7±4.3 | 0.3±0.0 | 29.3±4.4 | 36.8±9.0 | 0.3±0.0 |
| 13 | G50-S0.05 | 4 733.3 | 1.5±0.1 | 29.7±0.3 | 0.4±0.3 | 34.7±1.6 | 33.4±1.9 | 0.3±0.2 |
| 14 | G50-S0.025 | 9 466.7 | 1.5±0.0 | 27.9±0.7 | 0.1±0.1 | 32.8±1.6 | 37.4±2.0 | 0.3±0.2 |
| 15 | G50-S0 | NA2) | 2.4±0.1 | 37.6±1.9 | 0.0±0.0 | 25.0±0.7 | 34.9±1.8 | 0.2±0.1 |
| 16 | B-G25-P0.1 | 1 133.3 | 2.3 | 31.0 | 1.4 | 12.5 | 51.8 | 1.1 |
| 17 | B-G50-P0.2 | 1 133.3 | 1.9 | 30.2 | 1.0 | 14.5 | 50.9 | 1.4 |
| 18 | B-G100-P0.4 | 1 133.3 | 1.6 | 27.5 | 1.0 | 16.1 | 50.4 | 0.9 |
| Note:① G: Glucose; N: NH4Cl; P: KH2PO4; S: K2SO4. The footnote numbers indicate the concentration (g/L) of the corresponding chemicals. ② NA: Not applicable,as no additional nutrient element was included for the culture | ||||||||
生物柴油的性质取决于脂肪酸的组成。研究表明,氮限制和硫限制能够促进R. toruloides富含饱和脂肪酸油脂的积累,而磷限制则有利于不饱和脂肪酸的合成。这一研究对于生产不同脂肪酸组成的油脂具有一定的指导意义,但导致脂肪酸组成不同的机理还需要进一步深入研究。
2.3 初始葡萄糖浓度对油脂积累的影响从图 3中可以看出,在相同C/P摩尔比条件下,初始葡萄糖浓度越低,葡萄糖的消耗速率越快。对于初始葡萄糖浓度为25g/L、50g/L和100g/L这3种批式补料发酵,消耗完200g/L葡萄糖所用时间分别为86h、90h和94h。发酵结束后的油脂含量分别为49.1%、48.8%和42.8%。油脂量分别为28.4g/L、25.9g/L和21.1g/L。对油脂进行脂肪酸成分分析(表 2,第16~18行),通过分析发现,在磷限制条件下,发酵罐批式补料培养与摇瓶培养R. toruloides所产油脂脂肪酸组成相近,且在不同初始葡萄糖浓度下批式补料培养所产油脂的脂肪酸组成也差别不大。综上所述,初始葡萄糖浓度越低,越有利由于胞内油脂的合成和积累,相应的油脂生产量越高。所以在采用营养较为丰富的培养基进行油脂发酵生产时,可以采用较低的初始碳源浓度,进行批式-补料发酵。此外,这些油脂的脂肪酸组成和含量表明其可作为生物柴油的原料[19]。上述研究对微生物油脂的工业化生产具有一定的指导价值。
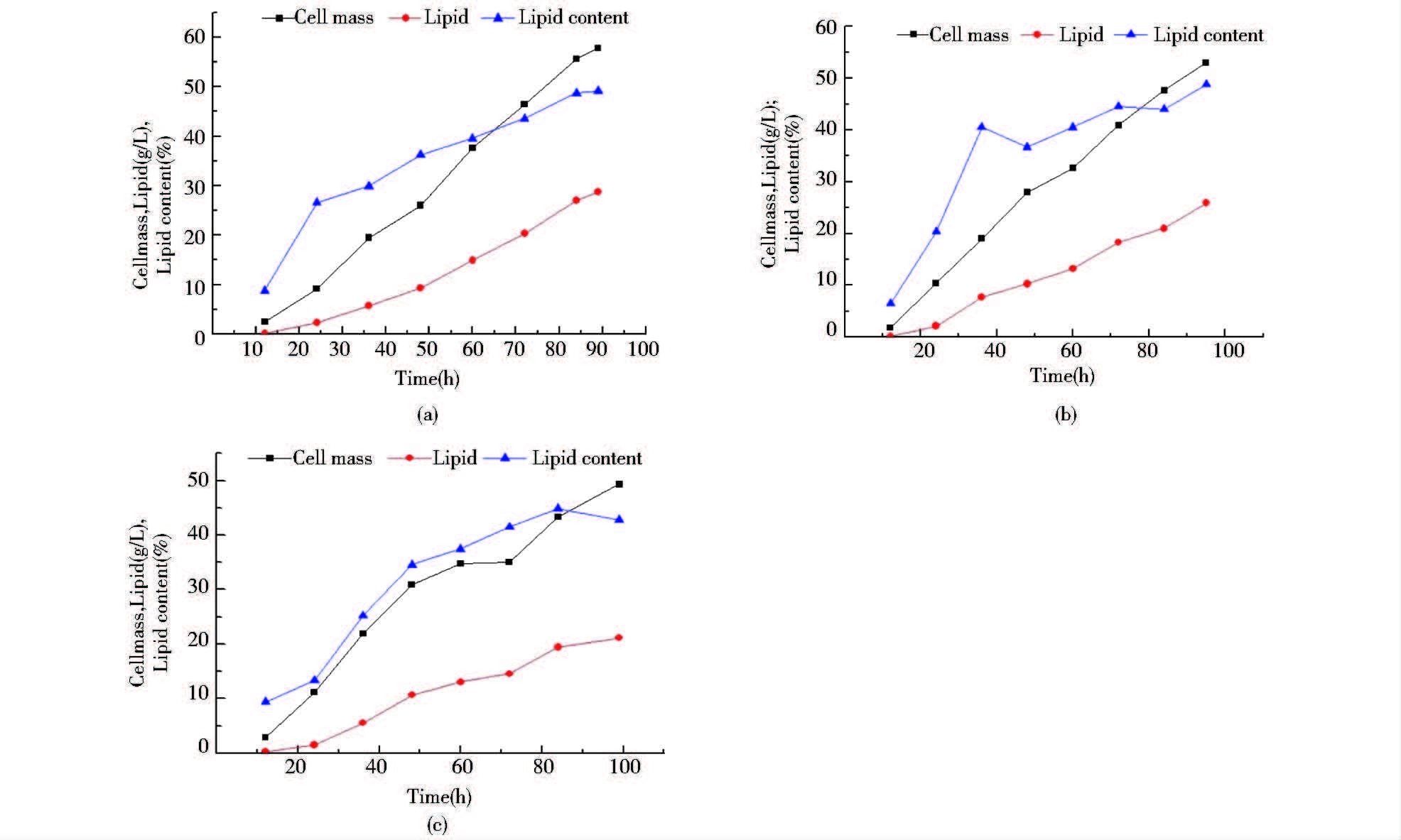
|
| 图 3 3 L发酵罐上批式补料发酵生产微生物油脂 Figure 3 Microbial lipid production on the 3-liter bioreactors through fed-batch fermentation (a) Results of lipid production by feeding glucose at the concentration of 25g/L (b) Results of lipid production by feeding glucose at the concentration of 50g/L (c) Results of lipid production by feeding glucose at the concentration of 100g/L The feeding broth were mixtures of glucose and KH2PO4 with a C/P ratio of 1 133.33 |
本研究通过对氮、磷、硫限制条件下圆红冬胞酵母油脂生产的研究,表明磷限制是油脂生产的最好策略,其生产成本低、油脂产量高。通过调节不同的C/N、C/P和C/S摩尔比可以改变脂肪酸的组成。氮限制和硫限制条件下生产的油脂富含饱和脂肪酸,而磷限制有利于不饱和脂肪酸的合成和积累。在相同的C/P摩尔比条件下,初始葡萄糖浓度越低,越有利于油脂生产。这项研究对于工业生产微生物油脂时降低生产成本,提高生产效益有重要的指导意义。
| [1] | Azapagic A. Sustainability considerations for integrated biorefineries. Trends Biotechnol , 2014, 32 (1) : 1–4. DOI:10.1016/j.tibtech.2013.10.009 |
| [2] | Meng X, Yang J M, Xu X, et al. Biodiesel production from oleaginous microorganisms. Renewable Energy , 2009, 34 (1) : 1–5. DOI:10.1016/j.renene.2008.04.014 |
| [3] | Subramaniam R, Dufreche S, Zappi M, et al. Microbial lipids from renewable resources:production and characterization. Journal of Industrial Microbiology & Biotechnology , 2010, 37 (12) : 1271–1287. |
| [4] | Wu S, Hu C, Jin G, et al. Phosphate-limitation mediated lipid production by Rhodosporidium toruloides. Bioresour Technol , 2010, 101 (15) : 6124–6129. DOI:10.1016/j.biortech.2010.02.111 |
| [5] | Wu S, Zhao X, Shen H, et al. Microbial lipid production by Rhodosporidium toruloides under sulfate-limited conditions. Bioresour Technol , 2011, 102 (2) : 1803–1807. DOI:10.1016/j.biortech.2010.09.033 |
| [6] | Braunwald T, Schwemmlein L, Graeff-Honninger S, et al. Effect of different C/N ratios on carotenoid and lipid production by Rhodotorula glutinis. Appl Microbiol Biotechnol , 2013, 97 (14) : 6581–6588. DOI:10.1007/s00253-013-5005-8 |
| [7] | Hassan M, Blanc P J, Granger M L, et al. Influence of nitrogen and iron limitations on lipid production by Cryptococcus curvatus grown in batch and fed-batch culture. Process Biochem , 1996, 31 (4) : 355–361. DOI:10.1016/0032-9592(95)00077-1 |
| [8] | Papanikolaou S, Aggelis G. Lipids of oleaginous yeasts. Part I:Biochemistry of single cell oil production. Eur J Lipid Sci Technol , 2011, 113 (5) : 1031–1051. |
| [9] | Li Y H, Zhao Z B, Bai F W. High-density cultivation of oleaginous yeast Rhodosporidium toruloides Y4 in fed-batch culture. Enzyme and Microbial Technology , 2007, 41 (3) : 312–317. DOI:10.1016/j.enzmictec.2007.02.008 |
| [10] | Hu C, Zhao X, Zhao J, et al. Effects of biomass hydrolysis by-products on oleaginous yeast Rhodosporidium toruloides. Bioresour Technol , 2009, 100 (20) : 4843–4847. DOI:10.1016/j.biortech.2009.04.041 |
| [11] | Zhao X, Wu S, Hu C, et al. Lipid production from Jerusalem artichoke by Rhodosporidium toruloides Y4. J Ind Microbiol Biotechnol , 2010, 37 (6) : 581–585. DOI:10.1007/s10295-010-0704-y |
| [12] | Huang Q, Wang Q, Gong Z, et al. Effects of selected ionic liquids on lipid production by the oleaginous yeast Rhodosporidium toruloides. Bioresour Technol , 2013, 130 : 339–344. DOI:10.1016/j.biortech.2012.12.022 |
| [13] | Zhu Z, Zhang S, Liu H, et al. A multi-omic map of the lipid-producing yeast Rhodosporidium toruloides. Nat Commun , 2012, 3 : 1112. DOI:10.1038/ncomms2112 |
| [14] | Lin X, Wang Y, Zhang S, et al. Functional integration of multiple genes into the genome of the oleaginous yeast Rhodosporidium toruloides. FEMS Yeast Res , 2014, 14 (4) : 547–555. DOI:10.1111/fyr.2014.14.issue-4 |
| [15] | Koh C M, Liu Y, Moehninsi, et al. Molecular characterization of KU70 and KU80 homologues and exploitation of a KU70-deficient mutant for improving gene deletion frequency in Rhodosporidium toruloides. BMC Microbiol , 2014, 14 : 50. DOI:10.1186/1471-2180-14-50 |
| [16] | Levering J, Broddrick J, Zengler K. Engineering of oleaginous organisms for lipid production. Curr Opin Biotechnol , 2015, 36 : 32–39. |
| [17] | Zhu Z, Ding Y, Gong Z, et al. Dynamics of the lipid droplet proteome of the Oleaginous yeast Rhodosporidium toruloides. Eukaryot Cell , 2015, 14 (3) : 252–264. DOI:10.1128/EC.00141-14 |
| [18] | Kempter A, Loges N, Hillesheim N, et al. Phosphate removal from waste water by a seeding approach using novel seeding material. Desalination and Water Treatment , 2015, 55 (10) : 2638–2646. DOI:10.1080/19443994.2014.957922 |
| [19] | Liu B, Zhao Z. Biodiesel production by direct methanolysis of oleaginous microbial biomass. Journal of Chemical Technology and Biotechnology , 2007, 82 (8) : 775–780. DOI:10.1002/(ISSN)1097-4660 |
| [20] | Knothe G. Dependence of biodiesel fuel properties on the structure of fatty acid alkyl esters. Fuel Processing Technology , 2005, 86 (10) : 1059–1070. DOI:10.1016/j.fuproc.2004.11.002 |
| [21] | Gregersen S B, Povey M J W, Kidmose U, et al. Identification of important mechanical and acoustic parameters for the sensory quality of cocoa butter alternatives. Food Research International , 2015, 76 : 637–644. DOI:10.1016/j.foodres.2015.07.022 |
 2016, Vol. 36
2016, Vol. 36




