文章信息
- 田淑翠, 牛延宁, 常忠义, 高红亮, 步国健, 金明飞.
- TIAN Shu-cui, NIU Yan-ning, CHANG Zhong-yi, GAO Hong-liang, BU Guo-jian, JIN Ming-fei.
- 常压室温等离子体(ARTP)诱变茂源链霉菌菌株
- The Streptoverticillium mobaraense Mutagenesis Using Atmospheric Pressure Plasma at Room Temperature (ARTP) Method
- 中国生物工程杂志, 2016, 36(9): 47-53
- China Biotechnology, 2016, 36(9): 47-53
- http://dx.doi.org/DOI:10.13523/j.cb.20160906
-
文章历史
- 收稿日期: 2016-03-14
2. 泰兴市东圣食品科技有限公司 泰兴 225411
2. Taixing Dongsheng Food Science and Technology Limited Company, Taixing 225411, China
谷氨酰胺转胺酶(蛋白质-谷氨酸-γ-谷氨酰胺转移酶,transglutaminase,EC2.3.2 .13 ,TG)能催化蛋白质分子内、分子间的交联,从而改善蛋白质的营养价值、质地结构、口感等功能性质,在纺织、食品、医药领域具有广泛的应用前景[1]。
20世纪80年代末,Ando等[2]首先报道了利用微生物发酵法生产TG的结果。这种方法成本低、周期短,并且生产出的微生物谷氨酰胺转胺酶(MTG)酶活完全不依赖于Ca2+,因此迅速吸引了国内外学者的关注和兴趣,并成为到目前为止大批量生产TG的最主要途径。在工业发酵领域,决定一种发酵产品顺利投产的关键性环节是对生产菌种的选育,生产MTG的菌株主要属于放线菌类的链霉菌属,茂源链霉菌(Streptoverticillium mobaraense)是常用的菌种之一,因此对于茂源链霉菌的选育非常关键。
诱变育种技术仍然是现在世界各国广泛使用的菌株选育技术,针对茂源链霉菌的诱变,报道的紫外线辐照(UV)[3]、亚硝基胍(NTG)[4]等方法都颇有成效,但UV能量较大,会杀死细胞,极易对人体造成巨大伤害;NTG有毒,有致癌的可能性,因此传统的诱变方法对实验操作者的人身安全有很大的潜在危险性。由清华大学自主研发的新型常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术是新兴的一种诱变技术,与传统诱变方法相比,对人体和环境极为安全,且具有射流温度低、活性粒子分布均匀、无需真空装置、设备简单、操作方便等特点[5],已应用于细菌[6]、酵母菌[7]等的诱变,并成功筛选得到高产菌株,但对放线菌诱变的应用鲜有报道。
本研究利用ARTP诱变茂源链霉菌,通过96孔板高通量筛选、试管复筛和摇瓶发酵最终获得一株具有良好遗传稳定性的高产突变株M-8,提高了谷氨酰胺转胺酶的产量,为谷氨酰胺转胺酶的工业化生产提供支持。
1 材料与方法 1.1 材 料 1.1.1 菌株茂源链霉菌(Streptoverticillium mobaraense)HS47,是实验室从土壤中分离后所得。
1.1.2 培养基参照本实验室所用高氏一号培养基、种子培养基和发酵培养基[8]。
高氏一号培养基(组分g/L):可溶性淀粉20; KNO31;MgSO4·7H2O 0.5;K2HPO4·3H2O 0.5;NaCl 0.5;FeSO4·7H2O 0.01;琼脂20;pH调至7.2~7.4。
种子培养基(组分g/L):甘油20;酵母膏 5;鱼粉蛋白胨25;MgSO4·7H2O 2;K2HPO4·3H2O 2; pH 调至7.4。
发酵培养基(组分g/L):甘油20;酵母膏 6;鱼粉蛋白胨25;MgSO4·7H2O 2;K2HPO4·3H2O 2; pH调至7.4。
培养基灭菌温度为121℃,时间为20min。
1.1.3 实验试剂与仪器Na-CBZ-Gln-Gly购自上海多肽公司;还原型谷胱甘肽购自生工生物工程(上海)股份有限公司;其他药品均为分析纯级产品,购自国药集团化学试剂有限公司。
Synergy HT多功能酶标仪,BioTek;常压室温等离子体诱变机,北京思清源生物科技有限公司;恒温水浴锅,上海精宏实验设备有限公司;恒温调速回旋式摇床DKY-Ⅱ,上海杜科自动化设备有限公司;721可见分光光度计,上海元析仪器有限公司。
1.2 菌株的ARTP诱变 1.2.1 孢子悬液的制备将保藏的茂源链霉菌HS47菌种从安瓿管中用1ml无菌水重悬,转接入高氏一号茄子瓶斜面培养基上进行复壮,置于28℃恒温恒湿培养箱中培养7天,传三代进行活化,刮取斜面菌苔于10ml无菌水中,过滤即得孢子悬液。用细胞计数板进行镜检计数,调整孢子浓度为108个/ml。
1.2.2 菌株的ARTP诱变在超净工作台中用移液枪移取10μl孢子悬液,均匀涂抹在直径为6mm的无菌金属垫片上,将其置于无菌平皿内移至提前开机预热20min的ARTP诱变机中,电源功率为120W,处理距离2mm,工作气流量10slpm,以氦气为工作气体,以处理时间为诱变的主要操作参数,从0s依次递增到75s。处理过后,将金属垫片放入装有1ml无菌水的EP管中,使金属垫片上的孢子液得以重悬,将重悬液稀释涂布于高氏一号平板上,置于28℃恒温恒湿培养箱中培养7天。
1.2.3 ARTP诱变致死率及突变率的计算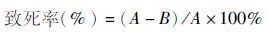 |
式中,A为诱变处理前孢子液的浓度;B为诱变处理后孢子液的浓度。
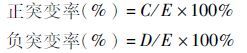 |
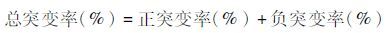 |
式中,C为所筛选的菌株样本中的正突变菌株数;D为所筛选的菌株样本中的负突变菌株数;E为所筛选的菌株样本总数。
1.3 诱变菌株的筛选整体筛选流程如下:
高通量初筛→分离纯化→第一轮试管复筛→分离纯化→第二轮试管复筛→摇瓶发酵验证→传代保种。
1.3.1 96孔板高通量初筛参照本实验室建立的方法[4]。将经ARTP诱变处理后在高氏一号平板上长势均一的单菌落用牙签刮取点种在96孔板的各个孔中(装液量:150μl发酵培养基/孔),于30℃、200r/min发酵培养96h,离心,取发酵液上清液进行酶活测定。
1.3.2 试管复筛将96孔板测定酶活较高的菌株扩大培养于试管斜面上,用1ml无菌水洗下斜面孢子,混匀后接种0.1ml孢子悬液于装有3mL发酵培养基的20ml试管中,每株做3个平行,30℃、200r/min下培养,60h时取样,测定酶活。
1.3.3 菌株分离纯化将酶活较高的菌株稀释涂布于高氏平板上生长7天后,每株菌株选取10~15株单菌落用96孔板进行筛选和酶活测定,最终选择整体酶活较高的菌株。
1.3.4 摇瓶发酵将酶活较高的菌株接种于高氏一号平板上生长7天,将菌体刮下,用2ml无菌水重悬,取1ml菌液接种于装有30ml种子培养基的250ml的三角瓶中培养,摇瓶转速为200r/min,30℃培养24h,将该种子液以10%的比例接种到装有30ml发酵培养基的250ml的三角瓶中相同条件下发酵培养,每株做3个平行,从0h开始每隔4h取样测定菌株酶活和生物量。
1.4 菌株酶活和生物量的测定 1.4.1 96孔板酶活测定方法采用恒温空气浴法[4]。
1.4.2 试管和摇瓶发酵酶活的测定参照氧肟酸比色法[9],以L-谷氨酸-γ-单羟氧肟酸作标准曲线。一个MTG酶活单位(U/ml)定义为:在37℃下,每分钟催化底物生成1μmol L-谷氨酸-γ-单羟氧肟酸所需的酶量。
1.4.3 生物量的测定以单位体积的细胞干重(DCW)表示[10]。
1.5 数据处理及分析方法用Graphpad prism5、Microsoft Excel进行数据处理和分析。
2 结果与分析 2.1 ARTP诱变时间的选择等离子体产生的活性粒子能穿过细胞壁到达细胞内,打断基因和蛋白质键,导致细胞壁部分或完全破裂,使大部分微生物死亡,只有少数微生物可以通过自身的SOS修复系统修复存活,并在这一过程中产生基因突变,因此选择合适的诱变条件能实现微生物的快速诱变[11]。在一定的电源功率、工作气流量、等离子体发射源与样品之间距离的条件下,诱变主要的可变操作参数是处理时间。因此分别对茂源链霉菌进行0s、15s、30s、45s、60s、75s的ARTP处理。
ARTP不同诱变时间下茂源链霉菌HS47的致死率曲线如图 1所示。从图中看出,随着诱变时间的增加,菌体的存活率逐渐降低。由于菌体细胞壁的保护,在45s内致死率相对较低,不到90%,但当作用时间达到75s时,ARTP的诱变作用较为剧烈,致死率达到99.9%。

|
| 图 1 不同ARTP作用时间下茂源链霉菌HS47的致死率 Figure 1 The lethality rate of S.mobaraense HS47 under different ARTP actuation duration |
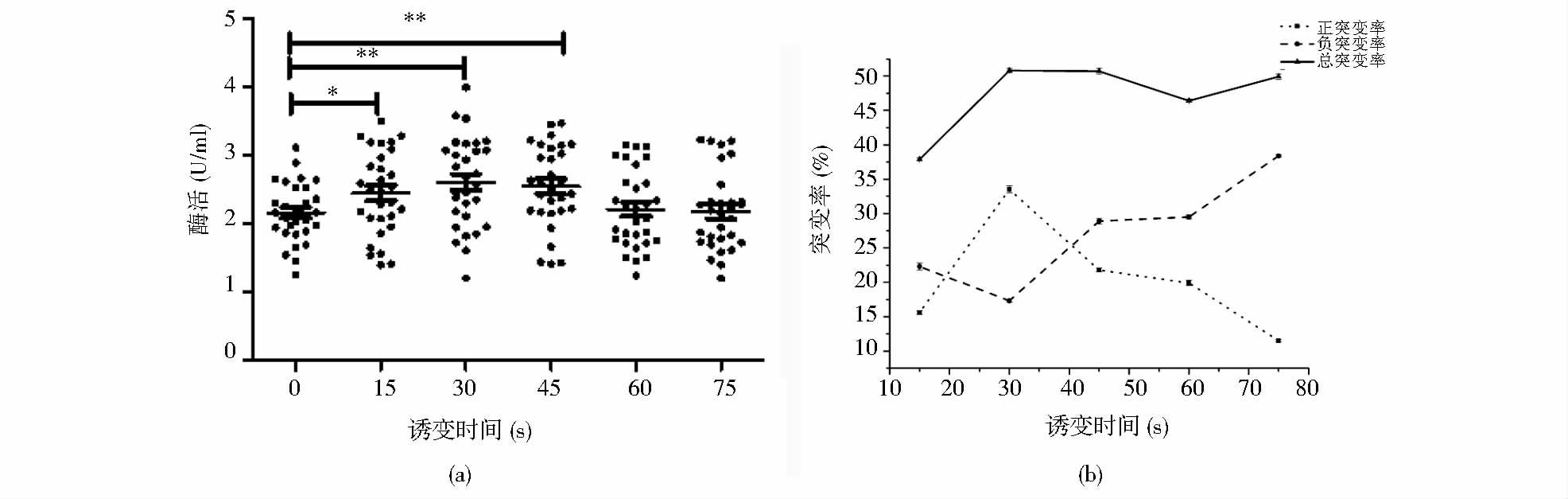
为了更全面准确的确定ARTP诱变的时间,除了菌株的致死率,菌株所产MTG的酶活及突变率也是需要考虑的因素。在对不同ARTP诱变时间的菌株进行筛选后测定酶活,结果见图 2(a)。由图可以看出,与野生菌相比,突变株的平均酶活都有所提高,其中,15s时,所筛选菌株的平均酶活与野生菌平均酶活之间差异显著;30s和45s时,所筛选菌株的平均酶活与野生菌平均酶活之间差异极显著。60s之后,由于ARTP作用时间延长,细胞的损伤严重,突变株的酶活提高不大。
|
| 图 2 不同ARTP作用时间下茂源链霉菌HS47的酶活及突变率 Figure 2 The enzyme activity and mutation rate of S.mobaraense HS47 under different ARTP actuation duration (a)The enzyme activity of S.mobaraense HS47 under different ARTP actuation duration (b)The mutation rate of S.mobaraense HS47 under different ARTP actuation duration * Significant difference (P<0.05); ** Extremely significant (P<0.01) |
以野生菌的平均酶活为参考,定义突变株中高于野生菌平均酶活20%的为正突变株,低于野生菌平均酶活20%的为负突变株。对其突变率进行统计分析,结果见图 2(b),不同诱变时间下,菌株的突变率不同,30s时,正突变率达到最高,此时,负突变率最低,总突变率最高。
在综合考虑菌株致死率、所产MTG酶活和菌株的突变率后,为提高获得MTG生产能力和生存能力较强菌株的概率,故选定ARTP处理时间为30s。
2.2 高产突变株的筛选 2.2.1 96孔板高通量初筛将ARTP作用时间30s的孢子进行大批量的稀释涂布,根据菌落生长的大小和丰满度,进行大批量的初筛培养,酶活测定结果(图 3)表明,突变株的平均酶活显著高于野生株的平均酶活,选取酶活最高的野生菌株和高于野生菌最高酶活的30株突变株进行试管复筛。
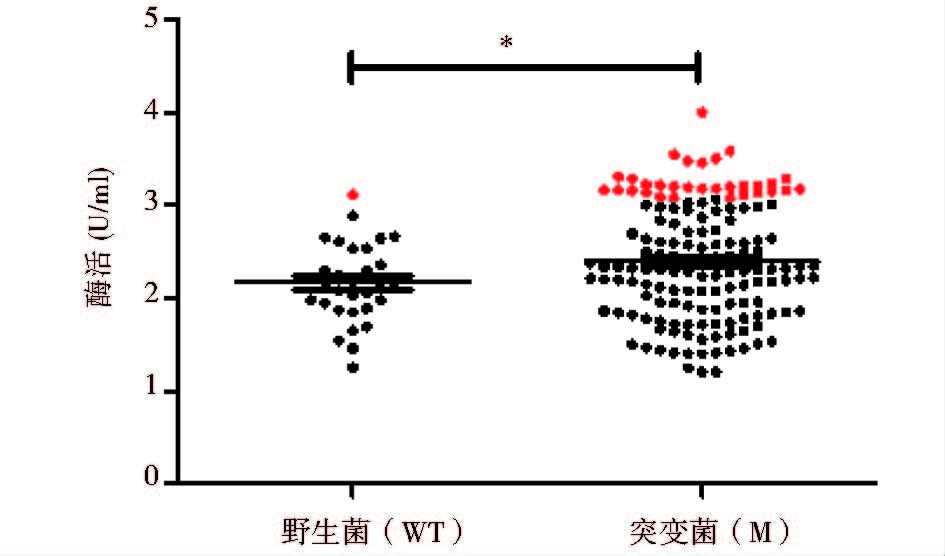
|
| 图 3 ARTP诱变菌株的96孔板初筛 Figure 3 96-well plate screening of strains after ARTP mutagenesis Red circles:The strains chosen for screening in test tube;* Significant difference (P<0.05) |
图 4(a)为第一轮试管复筛结果,筛选到18株酶活提高30%的高产菌株,10株酶活提高40%的高产菌株。由于这10株菌中还可能存在遗传不稳定或实验操作误差的可能,为了获得准确的遗传稳定的高酶活突变株,将这10株突变株和野生菌株分离纯化后进行第二轮试管复筛,结果见图 4(b),有5株菌株的酶活较出发菌株提高55%以上,其中,编号M-8的菌株酶活达到5.1U/ml,比出发菌株(2.8U/ml)提高了82%。

|
| 图 4 ARTP诱变菌株的试管复筛 Figure 4 Screening of strains after ARTP mutation in test tube (a) The first round screen of strains after ARTP mutation in test tube The solid line indicated the position where relative enzyme activity were 1.3 folds of those of the wild type strain; The dotted line indicated the position where relative enzyme activity were 1.4 folds of those of the wild type strain) (b) The second round screen of strains after ARTP mutation in test tube The solid line indicated the position where relative enzyme activity were 1.55 folds of those of the wild type strain |
为了准确得到突变株M-8的MTG酶活及探究其生长趋势,将高产突变株M-8与野生型菌株HS47同时进行摇瓶发酵培养,每隔4h测定菌株的生物量和所产MTG的酶活,结果见图 5。
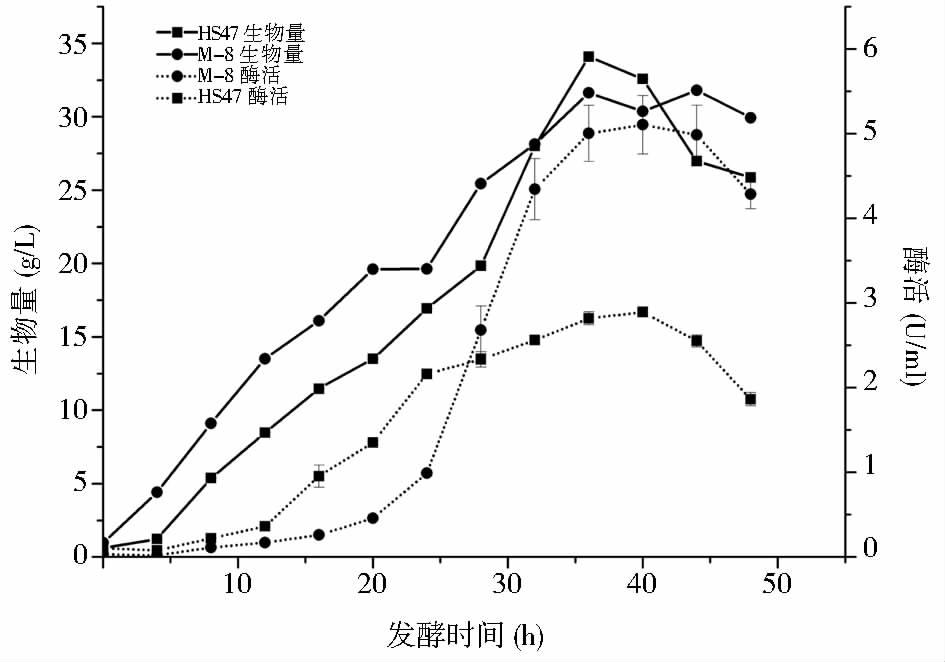
|
| 图 5 高产菌株的生长和产酶曲线 Figure 5 The growth and enzyme activity curve of the high-yield S.mobaraense |
由图 5可知,突变株与野生菌株的生长趋势基本一致。发酵前期和中期,诱变高产菌的生长速率远远高于野生菌。40h时,突变株M-8和野生菌HS47的酶活均达到最高,此时突变株酶活为5.1U/ml,比野生菌株(2.8U/ml)提高了82%,而此时,突变株的生物量略低于野生菌株,因此高产菌酶活的提高是单位菌株分泌的MTG有所增加的结果。
2.4 突变高产株的遗传稳定性为了检测突变株的遗传稳定性,对突变高产株M-8在试管斜面上连续传接8代,然后进行摇瓶发酵培养,检测发酵液中MTG酶活,结果(图 6)表明,突变株经8次传代后,产生的MTG酶活基本稳定,ARTP诱变产生的突变株M-8具有良好的遗传稳定性。

|
| 图 6 突变株M-8的传代发酵 Figure 6 Fermentation of generations of mutation strain M-8 |
有“超级黏合剂”之称的微生物谷氨酰胺转胺酶(MTG)在食品工业中得到了广泛应用,目前国内用来生产MTG的菌株为茂源链霉菌,国内该菌株的产量远远落后于代表世界先进水平的日本味之素公司的菌株产量,难以达到工业化大规模生产的要求,极大的制约了MTG商业化的应用范围。
通过基因工程改造的方法可以快速提高菌株的产量[12],但基因工程菌用于食品中存在很大的社会争议,因此国内对茂源链霉菌菌株的选育仍采用传统诱变的方法。
相对于其他传统诱变技术,除了满足操作简便、设备简单、条件温和、安全性高的基础上,ARTP诱变育种技术的显著特点是通过一次操作可获得多达20 000个以上的突变体,可以极大提高突变库的容量,达到高效育种的目的[13]。本文采用ARTP的诱变方法对一株野生型茂源链霉菌HS47进行了诱变,通过致死率和突变率的计算,优化了ARTP诱变的时间,最终选择30s的诱变时间,并加大了对这个时间的突变库的筛选。同时,ARTP诱变时间的确定可以为以后的诱变提供参考,减少了实验的盲目性,提高了实验效率。
随后对诱变后的菌株进行高通量筛选。筛选的诱变菌株遗传特性不稳定,极易发生回复突变,如果不能及时的将菌株分离纯化,就会出现菌株退化的现象,因此将初筛选出的高产菌株经过分离纯化后再进行试管复筛。结果表明,经过分离纯化,初筛选出的30株高产菌株中酶活高于野生菌酶活30%的菌株就高达18株,整体酶活结果与初筛结果体现了高度的一致性。为了进一步避免由于菌株的遗传不稳定或实验操作造成误差,也为了增加获得遗传稳定的高酶活突变株的准确率,将第一轮试管复筛中酶活高于野生菌酶活40%的10株突变株分离纯化后进行了第二轮复筛,结果表明第一轮复筛选出的高产突变菌株在第二轮筛选中仍保持高产的能力,并得到了一株MTG的高产菌株M-8,其每毫升发酵上清液MTG的酶活可达5.1U,较出发株的酶活提高了82%。通过摇瓶扩大发酵培养证实菌株M-8的生长速率比野生菌株要快,单位菌株分泌的MTG量增加使得MTG酶活有所提高。
传代发酵试验证明,菌株M-8遗传稳定性良好,从而最终证明:对茂源链霉菌进行ARTP诱变且在筛选过程中注重对菌株的分离纯化能大幅度提高其产MTG的能力,为以后高产MTG茂源链霉菌菌株的选育提供了一个良好的方法。
以本研究获得的高产突变株为出发株继续进行诱变和筛选,或对其发酵培养基进行优化都有望使MTG的产量得到进一步的提高,从而加速MTG实现工业化大规模生产、达到世界先进水平的进程。
| [1] | Santos M, Torné J M. Recent patents on transglutaminase production and applications:a brief review. Recent Patents on Biotechnology , 2009, 3 (3) : 166–174. DOI:10.2174/187220809789389180 |
| [2] | Ando H, Adachi M, Umeda K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms. Agricultural & Biological Chemistry , 1989, 53 (10) : 2613–2617. |
| [3] | 张莹, 郭琛琛, 黑东燕, 等. 复合诱变法选育谷氨酰胺转胺酶高产菌株. 食品科学 , 2014, 35 (11) : 139–142. Zhang Y, Guo C H CH, He D Y, et al. Screening and characterization of high-yield microbial transglutaminase-producing mutants induced by a novel method. Food Science , 2014, 35 (11) : 139–142. |
| [4] | 郭玮婷, 张慧, 查东风, 等. 产耐高温谷氨酰胺转胺酶菌株的快速筛选方法. 中国生物工程杂志 , 2015, 35 (8) : 83–89. Guo W T, Zhang H, Zha D F, et al. A rapid method of screening for thermostabletransglutaminase from Streptomyces mobaraensis. China Biotechnology , 2015, 35 (8) : 83–89. |
| [5] | Zhang X, Zhang X F, Li H P, et al. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool. Applied Microbiology & Biotechnology , 2014, 98 (12) : 5387–5396. |
| [6] | Lu Y, Wang L, Ma K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma (ARTP). Biochem Eng J , 2011, 55 (1) : 17–22. DOI:10.1016/j.bej.2011.02.020 |
| [7] | 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性. 生物工程学报 , 2011, 27 (3) : 461–467. Jin L H, Fang M Y, Zhang C H, et al. Operating conditions for the rapid mutation of the oleaginous yeast by atmospheric and room temperature plasmas and the characteristics of the mutants. Chinese Journal of Biotechnology , 2011, 27 (3) : 461–467. |
| [8] | 刘雅清, 侯孝仑, 郭玮婷, 等. 甲壳素促进茂源链霉菌发酵产酶. 中国生物工程杂志 , 2015, 35 (6) : 40–45. Liu Y Q, Hou X L, guo W T, et al. Enhancement of transglutaminase production in Streptoverticillium mobaraensis as achieved by treatment with chitin. China Biotechnology , 2015, 35 (6) : 40–45. |
| [9] | Grossowicz N, Wainfan E, Borek E, et al. The enzymatic formation of hydroxamic acids from glutamine. J Biol Chem , 1950, 187 (1) : 111–125. |
| [10] | 陈佳, 金明飞, 谭玉静, 等. NaCl对轮枝链霉菌产谷氨酰胺转胺酶的促进作用研究. 中国生物工程杂志 , 2013, 33 (2) : 54–58. Chen J, Jin M F, Tan Y J, et al. Enhancement of transglutaminase production in Streptoverticillium mobaraensis as achieved by treatment with NaCl. China Biotechnology , 2013, 33 (2) : 54–58. |
| [11] | Li G, Li H P, Wang L Y, et al. Genetic effects of radio-frequency, atmospheric-pressure glow discharges with helium. Appl Phys Lett , 2008, 92 (22) : 1504–1507. |
| [12] | Hui-Lin Y, Li P, Ying L. Purification and on-column activation of a recombinant histidine-tagged pro-transglutaminase after soluble expression in Escherichia coli. Bioscience Biotechnology & Biochemistry , 2009, 73 (11) : 2531–2534. |
| [13] | Wang Q, Feng L R, Wei L, et al. Mutation breeding of lycopene-producing strain blakeslea trispora by a novel atmospheric and room temperature plasma (ARTP). Applied Biochemistry & Biotechnology , 2014, 174 (1) : 452–460. |
 2016, Vol. 36
2016, Vol. 36




