文章信息
- 陈丹, 郭玉争, 班靖洋, 李璐, 王维龙, 李鼎锋, 刘勇.
- CHEN Dan, GUO Yu-zheng, BAN Jing-yang, LI Lu, WANG Wei-long, LI Ding-feng, LIU Yong.
- 汉逊酵母重组表达的人胃蛋白酶原Ⅱ校准品研制
- Development of Recombinant Human PepsinogenⅡ Calibrators Derived from Hansenula polymorpha
- 中国生物工程杂志, 2016, 36(9): 38-46
- China Biotechnology, 2016, 36(9): 38-46
- http://dx.doi.org/DOI:10.13523/j.cb.20160905
-
文章历史
- 收稿日期: 2016-01-15
胃蛋白酶原Ⅱ(pepsiongenⅡ,PGⅡ)属于天冬氨酸蛋白酶家族,是胃蛋白酶Ⅱ的前体,在酸性条件下被激活[1-3]。PGⅡ基因位于6p21.1-pter,共有9个外显子和8个内含子,成熟的mRNA编码388aa,其中1~16aa为分泌信号肽序列,17~59aa为前体序列,在酸性条件下可切割去除,60~388aa为功能性的胃蛋白酶Ⅱ序列。PGⅡ主要由胃底腺主细胞分泌,还可由幽门腺、贲门腺及十二指肠Brunner腺分泌。PGⅡ是胃黏膜细胞分化成熟的终末产物,是消化功能逐渐成熟的一种标志,它的变化可以反映胃黏膜病变及分化程度,通常与胃黏膜萎缩、肠上皮化生、异型增生及恶变有关[4-5]。通过联合胃蛋白酶原Ⅰ(PGⅠ)及检测PGⅠ/PGⅡ值可起到胃黏膜“血清学活检”的作用,对胃癌的筛查及早期诊断具有重要意义[6-8]。
目前,临床上已有多种用于PGⅡ定量的体外诊断试剂产品获批上市。这其中,作为体外诊断试剂必不可少的PGⅡ校准品,是实现PGⅡ临床检测及监督检验结果准确一致的主要工具,也是保证量值有效传递的计量实物标准。传统制备人源PGⅡ校准品的主要方式为生化分离提纯,其工艺复杂,产量低而且原料来源有限。有研究通过大肠杆菌进行人PGⅡ的重组表达,表达极不稳定。通过与麦芽糖结合蛋白(MBP)进行融合表达后,表达产物为包涵体形式,经复性后获得的重组蛋白抗原活性不足天然PGⅡ蛋白的20%[9]。而关于人PGⅡ蛋白在重组酵母系统中表达的情况未见报道。本研究则在汉逊酵母表达系统中实现了人PGⅡ蛋白的高效分泌表达,纯化获得的高纯度蛋白质经各项稳定性实验证实符合校准品的性能要求,因此,汉逊酵母重组表达的人PGⅡ蛋白可用作体外诊断试剂的校准品。
1 材料与方法 1.1 质粒与菌株汉逊酵母重组质粒载体pMOX1.1及pRMHP2.1均为本公司构建及保存。pMOX1.1载体是在汉逊酵母重组质粒pDGXMPT[10]的基础上克隆入来源于α-因子信号肽的编码序列。pRMHP2.1载体构建过程详见申请号为CN201210021524.X的发明专利[11]。大肠杆菌DH5α为本公司保存;汉逊酵母菌株26012购自美国模式菌种收集中心(ATCC)。
1.2 主要试剂PyrobestTMDNA聚合酶,限制性内切核酸酶XhoI、EcoRI、NotI、BglⅡ,连接试剂盒DNA Ligation Kit Ver. 2. 0,DNA markerDL15000及DL2000均购自宝生物工程(大连)有限公司;蛋白质marker购自天根生化科技(北京)有限公司;胶回收试剂盒和质粒小量提取试剂盒购自美国Omega生物技术公司;Zeocin及G418为美国Invitrogen公司产品;酵母基因组提取试剂盒为Qiagen公司产品;地高辛杂交检测试剂盒I为Roche公司产品;Sartorius Vivaflow200切向流超滤膜包(5K)为德国Sartorius公司产品;Ni亲和填料及G25凝胶填料均购自GE Health公司;BCA蛋白定量检测试剂盒为Thermo Scientific公司产品;胃蛋白酶原Ⅱ检测试剂盒(胶乳增强免疫比浊法)购自上海聚创生物科技有限公司;其他试剂均为国产分析纯。
1.3 PGⅡ基因的设计及合成按照汉逊酵母密码子偏爱性结合二级结构自由能最小化原则优化设计编码PGⅡ成熟蛋白(GenBank登录号:AAA60063.1,去除N端16个氨基酸的信号肽序列)的核苷酸序列,并在序列的5′端和3′端引入XhoⅠ和EcoRⅠ酶切位点及保护碱基,设计的引物序列见表 1,其中上游引物23条,下游引物23条,其中下划线标记处为XhoⅠ限制酶酶切位点,加粗标记处为EcoRⅠ酶切位点,引物由北京诺赛基因组研究中心有限公司合成。
| Primer name | Primer sequence(5′-3′) |
| PGⅡ-F01 | CCGCTCGAGAAAAGAGCTGTAGTCAAAGTTCCA |
| PGⅡ-F02 | CTCAAGAAATTCAAATCCATTCGTGAAACCATGAAAGAGAAAGGCCTGTTGG |
| PGⅡ-F03 | GAGAATTTCTGCGGACTCATAAGTATGATCCTGCCTGGAAATACCGCTTTGG |
| PGⅡ-F04 | TGACCTGTCTGTGACGTATGAACCGATGGCGTATATGGATGCAGCCTACTTT |
| PGⅡ-F05 | GGCGAGATCAGTATTGGCACTCCACCACAGAACTTCCTTGTACTGTTTGACA |
| PGⅡ-F06 | CAGGGTCGTCCAATCTGTGGGTTCCCTCTGTCTATTGTCAGTCACAAGCGT |
| PGⅡ-F07 | GCACGAGCCACAGTCGCTTCAATCCGTCTGAAAGCTCGACCTACTCAACC |
| PGⅡ-F08 | AACGGTCAGACCTTCTCGTTACAGTATGGCTCTGGCAGCTTAACTGGTTT |
| PGⅡ-F09 | CTTTGGGTACGATACCCTGACAGTGCAGAGCATTCAAGTACCCAATCAAG |
| PGⅡ-F10 | AGTTTGGTTTGAGTGAGAACGAACCGGGCACGAACTTTGTGTATGCTCAG |
| PGⅡ-F11 | TTTGATGGCATCATGGGTCTTGCCTATCCAGCACTCTCGGTTGATGAAGC |
| PGⅡ-F12 | GACGACCGCGATGCAAGGGATGGTGCAGGAAGGTGCCCTGACGTCACCGG |
| PGⅡ-F13 | TCTTCAGTGTGTACCTGTCGAATCAACAGGGCAGCTCTGGTGGCGCTGTT |
| PGⅡ-F14 | GTGTTTGGAGGCGTAGACAGCTCGTTGTATACAGGTCAGATCTACTGGGC |
| PGⅡ-F15 | ACCGGTCACCCAAGAACTGTACTGGCAGATTGGCATTGAAGAGTTCCTCA |
| PGⅡ-F16 | TTGGTGGCCAGGCGTCTGGCTGGTGCTCAGAAGGTTGTCAAGCGATTGTT |
| PGⅡ-F17 | GACACCGGGACCAGCCTTCTGACGGTACCGCAACAGTATATGTCGGCCCT |
| PGⅡ-F18 | GCTGCAAGCGACTGGCGCACAGGAAGATGAATATGGCCAGTTTCTGGTCA |
| PGⅡ-F19 | ACTGCAATAGTATCCAGAACTTACCGAGCTTGACCTTCATCATTAATGGT |
| PGⅡ-F20 | GTGGAGTTTCCGTTACCTCCGAGTTCCTATATTCTGTCGAACAATGGCTA |
| PGⅡ-F21 | CTGCACCGTTGGTGTGGAACCGACGTATCTGTCCTCTCAGAACGGCCAAC |
| PGⅡ-F22 | CACTCTGGATTCTGGGTGATGTGTTCCTGCGCAGCTATTACAGTGTCTAT |
| PGⅡ-F23 | GACCTGGGGAACAATCGTGTTGGCTTTGCCACCGCTGCGTAATGAATTCC |
| PGⅡ-R01 | GGAATTCATTACGCAGCGGTGGCAA |
| PGⅡ-R02 | AGCCAACACGATTGTTCCCCAGGTCATAGACACTGTAATAGCTGCGCAGG |
| PGⅡ-R03 | AACACATCACCCAGAATCCAGAGTGGTTGGCCGTTCTGAGAGGACAGATA |
| PGⅡ-R04 | CGTCGGTTCCACACCAACGGTGCAGTAGCCATTGTTCGACAGAATATAGG |
| PGⅡ-R05 | AACTCGGAGGTAACGGAAACTCCACACCATTAATGATGAAGGTCAAGCTC |
| PGⅡ-R06 | GGTAAGTTCTGGATACTATTGCAGTTGACCAGAAACTGGCCATATTCATC |
| PGⅡ-R07 | TTCCTGTGCGCCAGTCGCTTGCAGCAGGGCCGACATATACTGTTGCGGTA |
| PGⅡ-R08 | CCGTCAGAAGGCTGGTCCCGGTGTCAACAATCGCTTGACAACCTTCTGAG |
| PGⅡ-R09 | CACCAGCCAGACGCCTGGCCACCAATGAGGAACTCTTCAATGCCAATCTG |
| PGⅡ-R10 | CCAGTACAGTTCTTGGGTGACCGGTGCCCAGTAGATCTGACCTGTATACA |
| PGⅡ-R11 | ACGAGCTGTCTACGCCTCCAAACACAACAGCGCCACCAGAGCTGCCCTGT |
| PGⅡ-R12 | TGATTCGACAGGTACACACTGAAGACCGGTGACGTCAGGGCACCTTCCTG |
| PGⅡ-R13 | CACCATCCCTTGCATCGCGGTCGTCGCTTCATCAACCGAGAGTGCTGGAT |
| PGⅡ-R14 | AGGCAAGACCCATGATGCCATCAAACTGAGCATACACAAAGTTCGTGCCC |
| PGⅡ-R15 | GGTTCGTTCTCACTCAAACCAAACTCTTGATTGGGTACTTGAATGCTCTGC |
| PGⅡ-R16 | ACTGTCAGGGTATCGTACCCAAAGAAACCAGTTAAGCTGCCAGAGCCATACT |
| PGⅡ-R17 | GTAACGAGAAGGTCTGACCGTTGGTTGAGTAGGTCGAGCTTTCAGACGGATT |
| PGⅡ-R18 | GAAGCGACTGTGGCTCGTGCACGCTTGTGACTGACAATAGACAGAGGGAACC |
| PGⅡ-R19 | CACAGATTGGACGACCCTGTGTCAAACAGTACAAGGAAGTTCTGTGGTGGAG |
| PGⅡ-R20 | TGCCAATACTGATCTCGCCAAAGTAGGCTGCATCCATATACGCCATCGGTTC |
| PGⅡ-R21 | ATACGTCACAGACAGGTCACCAAAGCGGTATTTCCAGGCAGGATCATACTTA |
| PGⅡ-R22 | TGAGTCCGCAGAAATTCTCCCAACAGGCCTTTCTCTTTCATGGTTTCACGAA |
| PGⅡ-R23 | TGGATTTGAATTTCTTGAGTGGAACTTTGACTACAGCTCTTTTCTCGAGCGG |
以所有的46条引物互为模板和引物,进行预PCR。反应条件为:95℃ 2min预变性;95℃ 30s,65℃ 30s,72℃ 30s,5个循环;95℃ 30s,60℃ 30s,72℃ 30s,5个循环;72℃延伸10min。然后以预反应的产物为模板,以PGⅡ-F01为上游引物,PGⅡ-R01为下游引物进行常规PCR,反应条件为:95℃ 2min;95℃ 30s,55℃ 30s,72℃90s,30个循环;72℃延伸10min。PCR产物经琼脂糖凝胶电泳鉴定后纯化回收。
1.4 PGⅡ重组表达质粒的构建及鉴定经由XhoI和EcoRI双酶切胶回收后的PCR产物,与相同酶切的pMOX1.1载体进行连接并转化大肠杆菌DH5α感受态,经质粒提取和酶切鉴定后,送阳性克隆至北京诺赛基因组研究中心有限公司测序,测序正确的重组质粒命名为pMOX1.1-PGⅡ。经由NotI和BglII双酶切从pMOX1.1-PGⅡ质粒中回收PGⅡ基因表达盒,并克隆入相同酶切的pRMHP2.1载体中,通过序列测定对酶切鉴定正确的汉逊酵母重组表达质粒pRMHP2.1-PGⅡ进行验证。
1.5 PGⅡ重组表达菌株的筛选质粒的电转化:依照发明专利CN201210021524.X的方法进行汉逊酵母感受态的制备及电转化[10],电击条件为:电压2500V、电阻 150Ω、电容 50μF。电转后的菌液置37℃水浴中培养1h,于4 000r/min离心10min,弃上清液后用100μl YPD溶液将菌体重悬,涂布含0.25mg/ml Zeocin的YPD平板中,37℃倒置培养。
菌株传代及稳定:挑取Zeocin抗性平板上的单菌落,在含0.25mg/ml Zeocin的YPD 液体培养基中连续传代10次(传代比例均为1∶1 000),传代条件为:37℃、200r/min摇床培养24~36h至菌体OD值超过50。为了稳定重组菌株的性状,将传代后的菌液在不含Zeocin抗性的YPD液体培养基中再连续传代5次。稳定后的菌液涂布含8mg/ml G418的YPD平板,37℃倒置培养。
诱导表达及菌株筛选:挑取G418抗性平板上的单菌落,接入含5ml YPG液体培养基的试管中,37℃、200r/min培养24h后,将菌液转接入5ml YPM诱导培养基中(接种后的初始OD值约为1),每隔12h于菌液中补加入终浓度为0.5%的甲醇,37℃、200r/min诱导48h后,于8 000r/min离心10min,收集上清液。经SDS-PAGE电泳检测,将筛选出的高效分泌PGⅡ蛋白的重组汉逊酵母工程菌命名为26012/PGⅡ,并制备及保存甘油菌种。
1.6 重组工程菌目的基因整合拷贝数的鉴定按酵母基因组提取试剂盒操作说明书,提取重组工程菌26012/PGⅡ的基因组DNA,采用Southern blot核酸杂交的方法检测工程菌目的基因拷贝数。检测所用探针为MOX启动子探针,汉逊酵母宿主菌株26012基因组含一个拷贝的MOX启动子序列,重组质粒pRMHP2.1-PGⅡ也含一个拷贝的MOX启动子序列。因此,以汉逊酵母菌株26012基因组为对照,可检测出重组工程菌26012/PGⅡ基因组中MOX启动子的数量,继而推算出目的基因的整合拷贝数。
1.7 重组工程菌目的基因整合位置的鉴定以表 2所示的26S-F及Zeo-R为引物对,进行重组工程菌26012/PGⅡ基因组的PCR扩增。其中,26S-F引物来源于汉逊酵母宿主菌株26012基因组的26S rDNA序列,重组质粒pRMHP2.1-PGⅡ无对应序列;Zeo-R引物来源于重组质粒pRMHP2.1-PGⅡ的Zeocin序列,汉逊酵母宿主菌株26012无对应序列。因此,仅当重组质粒定点整合于宿主菌株基因组的26S rDNA位置时,方能扩增出约2.8kb的特异性条带。
| Primer name | Primer sequence(5′-3′) |
| 26S-F | GTGGCCTATCGATCCTTTAGTC |
| Zeo-R | GCCGGCAACTGCGTGCACTTC |
1.8 重组工程菌的发酵制备
按1%的接种量将PGⅡ甘油菌菌种接入含5ml YPD培养基的试管中,37℃、200r/min培养约24h后,按1%的接种量转接入4个各含2L YPD培养基的5L摇瓶中,37℃、200r/min培养约24h作为种子液(合计8L),接入200L发酵罐中,装液量为100L,BSM培养基灭菌后调pH至5.0,培养过程中调节转速和通气量,使溶氧(DO)维持在20%以上。初始培养基中的甘油耗尽后,饥饿0.5h开始流加50%(V/V)甘油补料培养基,应用“DO-Spike”法控制流加速率,即甘油补料过程中通过停止补料,计算DO迅速上升10% 所需要的时间。如果小于30s,说明没有甘油积累;如果大于30s,说明补料过快,需等DO上升10% 后再继续流加。
当菌体湿重达200g/L时,饥饿0.5h开始流加甲醇,将pH调至6.0诱导重组PGⅡ蛋白的表达。用甲醇流加控制器离线测定甲醇浓度,控制甲醇流加速率,使甲醇浓度低于5‰(V/V)。诱导24h后,用管式离心机离心收集发酵液上清。
1.9 重组PGⅡ蛋白的纯化以截留相对分子质量为5 000的超滤膜包将收集的发酵上清液浓缩至原溶液的1/10~1/5,通过流加Ni亲和层析平衡液(20mmol/L Tris,0.15mol/L NaCl)置换去除培养基成分,在4℃、8 000r/min条件下,离心30min去除不溶颗粒,离心上清液过Ni亲和层析柱,经由洗脱液(20mmol/L Tris,150mmol/L NaCl,250mmol/L咪唑)分梯度洗脱目的蛋白;目的蛋白通过G25凝胶层析置换入pH7.4的PBS缓冲液中保存,SDS-PAGE方法检测纯化过程中的蛋白质样品及最终收获的重组PGⅡ蛋白。
1.10 重组PGⅡ蛋白的检测及校准品配制纯化获得的重组PGⅡ蛋白经由BCA蛋白定量检测试剂盒进行定量,并根据定量结果将重组PGⅡ蛋白精确稀释至20μg/L及10μg/L,应用胃蛋白酶原Ⅱ检测试剂盒进行PGⅡ有效含量的定量分析。具体过程为:按试剂盒说明书,在日立HITACHI 7080型全自动生化分析仪中进行检测,试剂1用量为162μl,试剂2用量为30μl,样品量为6μl,体系混匀后,空白管调零,10s后读取吸光度值A1,37℃孵育5min后读取吸光度值A2,应用试剂盒附带的PGⅡ校准品所形成的标准曲线,待测样品的PGⅡ浓度可以从全自动生化仪上直接读出。根据PGⅡ检测试剂盒的定量检测结果,应用保密配方的类血清基质液将纯化的重组PGⅡ蛋白分别配制成6个不同浓度的校准品:0μg/L、5μg/L、10μg/L、20μg/L、30μg/L、50μg/L。
1.11 重组PGⅡ校准品稳定性实验评价重组PGⅡ校准品的稳定性实验按如下方案进行:①4℃实时保存稳定性实验,检测时间点为3个月、6个月及12个月;②37℃加速破坏性实验,检测时间点为3天、7天及14天;③4℃开盖保存实验,检测时间点为3天、7天及14天。应用PGⅡ检测试剂盒分别对不同保存条件下的各检测时间点的不同浓度重组PGⅡ校准品进行定值,通过与保存0时间点的校准品定值进行比较,计算各个时间点校准品的平均变化幅度。
为比对重组PGII校准品与商品化校准品在稳定性方面的差异,对商品化胃蛋白酶原Ⅱ检测试剂盒中的校准品开展如下实验方案:①37℃加速破坏性实验,检测时间点为7天及14天;②4℃开盖保存实验,检测时间点为7天及14天。通过计算各个时间点校准品的平均变化幅度,以判断重组PGII校准品相对于商品化校准品在稳定性方面的变化情况。
2 结 果 2.1 PGⅡ基因扩增产物的鉴定PGⅡ基因PCR产物经琼脂糖凝胶电泳分析,可见约1.2kb的特异性条带,大小与预期一致,结果见图 1。

|
| 图 1 PGⅡ基因的合成 Figure 1 Amplification of PGⅡ gene by PCR 1: PCR product of PGⅡgene; M1:DNA Marker DL2000; M2:DNA Marker DL15000 |
重组质粒pMOX1.1-PGⅡ及pRMHP2.1-PGⅡ酶切产物经琼脂糖凝胶电泳检测,酶切后的片段大小与预期大小相符,结果见图 2。经由测序验证,目的基因PGⅡ序列与设计的目标序列完全一致,表明重组质粒构建正确。
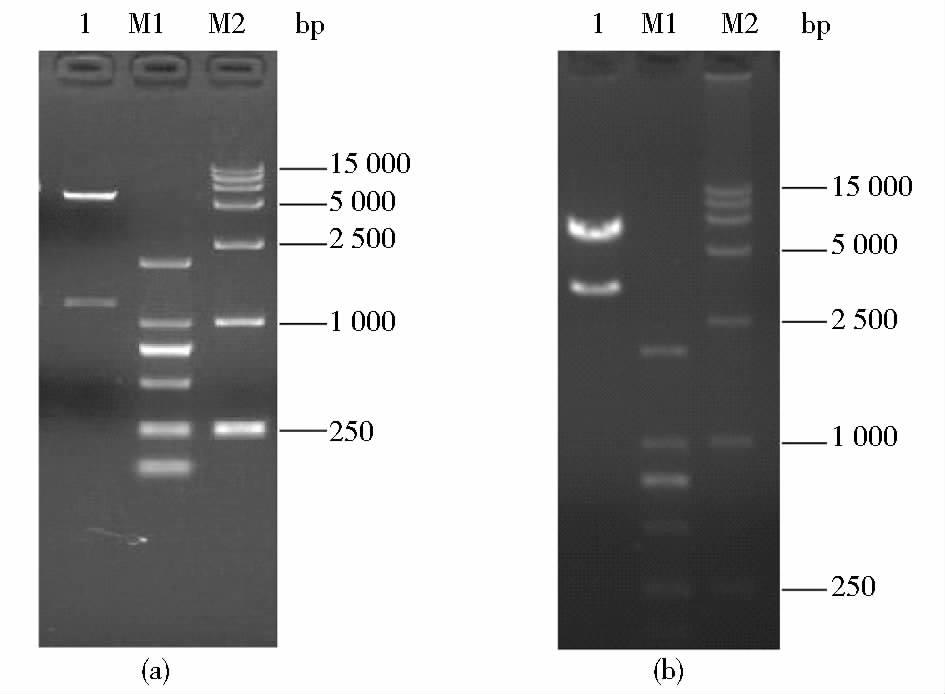
|
| 图 2 重组质粒的酶切鉴定 Figure 2 Restriction map of recombinant plasmid (a)Restriction map of recombinant plasmid pMOX1.1-PGⅡ 1: pMOX1.1-PGⅡ digested by XhoI+EcoRI; M1: DNA Marker DL2 000; M2: DNA Marker DL15 000 (b)Restriction map of recombinant plasmid pRMHP2.1-PGⅡ 2: pRMHP2.1-PGⅡ digested by NotI+BglII; M1: DNA Marker DL2 000; M2: DNA Marker DL15 000 |
重组质粒pRMHP2.1-PGⅡ电转化汉逊酵母26012宿主菌,并通过多轮次的传代与稳定后涂布高浓度的G418抗性平板。筛选后的菌株用甲醇进行诱导表达,诱导48h后,离心收集培养液上清,SDS-PAGE电泳检测结果如图 3所示,分泌表达的重组PGⅡ蛋白约为43kDa,大小与预期一致,且各重组菌株表达水平大体一致,均超过50mg/L,将其中表达水平相对较高的8号重组汉逊酵母工程菌株命名为26012/PGⅡ。

|
| 图 3 SDS-PAGE分析重组PGⅡ的表达 Figure 3 SDS-PAGE analysis of the expression level of recombinant PGⅡ 1-8:Culture supernatant of ATCC26012/pRMHP2.1-PGⅡ induced for 48h; 9: Culture supernatant of ATCC26012 induced for 48h; M: Protein MW marker |
Southern blot核酸杂交的检测结果见图 4,汉逊酵母宿主菌株26012基因组在10ng、5ng、2.5ng的上样量水平,杂交信号呈现梯度递减,说明检测体系成立。重组工程菌26012/PGⅡ基因组在0.25ng的上样量水平,其产生的杂交信号强于对应于汉逊酵母宿主菌株26012基因组10ng的上样量水平,因此,重组工程菌26012/PGⅡ目的基因整合拷贝数不低于40个。
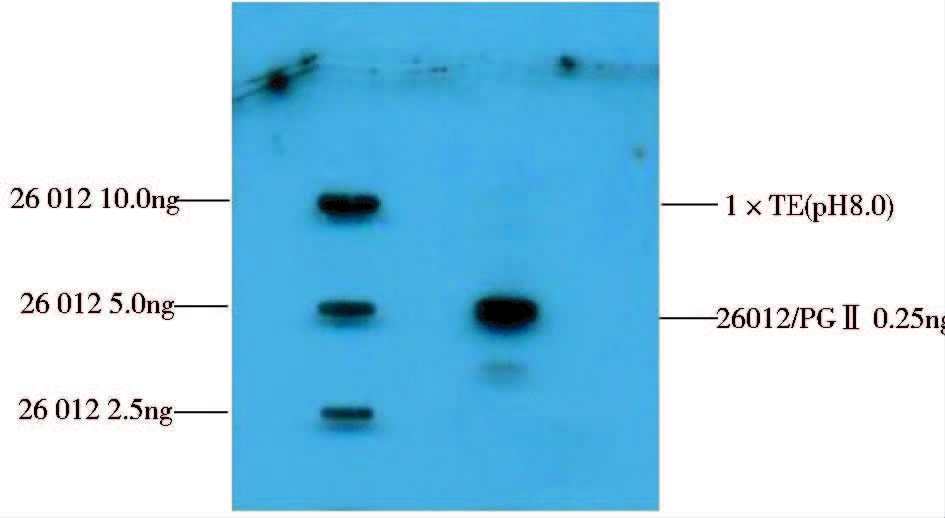
|
| 图 4 重组菌株26012/PGⅡ的拷贝数检测 Figure 4 Detection for the copy number of heterologous geneofrecombinant strain 26012/PGⅡ |
以重组工程菌26012/PGⅡ基因组DNA为模板,以26S-F及Zeo-R为引物对进行PCR扩增,经琼脂糖凝胶电泳分析,可见约2.8kb的特征性片段(图 5),大小与预期一致,说明重组质粒pRMHP2.1-PGⅡ定点整合于宿主菌株基因组的26S rDNA位置。
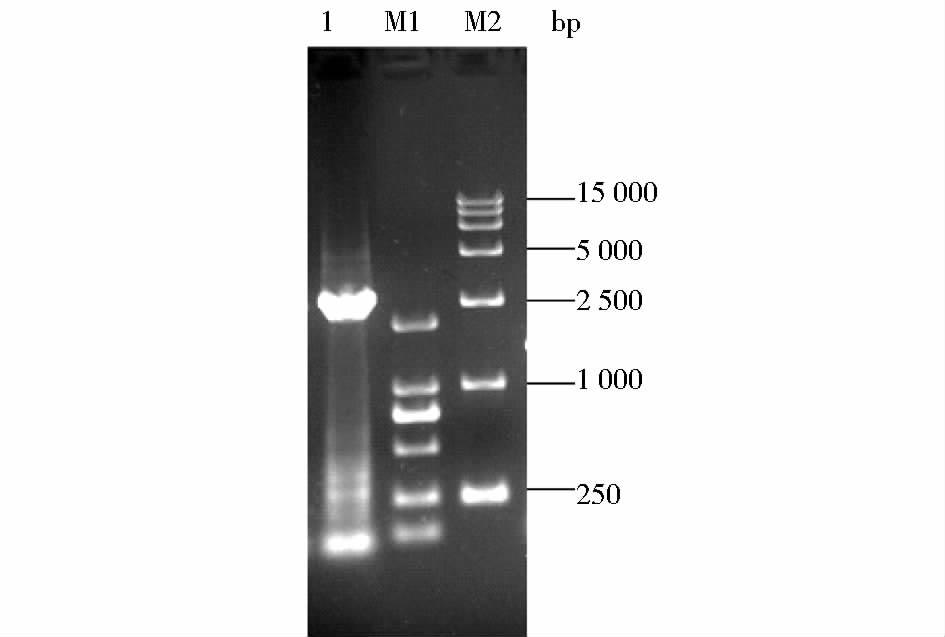
|
| 图 5 重组菌株26012/PGⅡ的目的基因整合位置的鉴定 Figure 5 Identification of the heterologous gene integrated site of recombinant strain 26012/PGⅡ 1:PCRproduct; M1:DNA Marker DL2 000; M2:DNA Marker DL15 000 |
在200L发酵罐中大规模制备重组工程菌的发酵培养液。在发酵初期,工程菌缓慢生长,溶氧逐步下降,pH小幅上升,培养16h工程菌进入对数生长期;培养至第34h,初始培养基中的甘油耗尽,溶氧上升,饥饿0.5h后开始流加甘油补料培养基,控制溶氧不低于20%。培养至第62h,菌体湿重达到234g/L,开始流加甲醇(控制整个诱导过程甲醇浓度低于5‰),将pH逐步调至6.0,以诱导PGⅡ蛋白的表达,整个发酵过程的pH、OD值、溶氧及转速变化情况见图 6。

|
| 图 6 重组菌株26012/PGⅡ发酵过程中各参数变化情况 Figure 6 Fermentation process parameters of recombinant strain 26012/PGⅡ |
纯化过程中的蛋白质SDS-PAGE检测结果见图 7,浓缩后的发酵上清液可特异性的吸附于Ni亲和层析柱上,在20mmol/L咪唑的洗脱浓度条件下,有较多的杂蛋白及少量的目的蛋白被洗脱下来,应用50mmol/L咪唑进行洗脱,可获得高纯度的PGⅡ蛋白。经由G25凝胶填料将缓冲液置换成PBS体系后,获得的重组PGⅡ蛋白纯度为93.8%(图 8)。
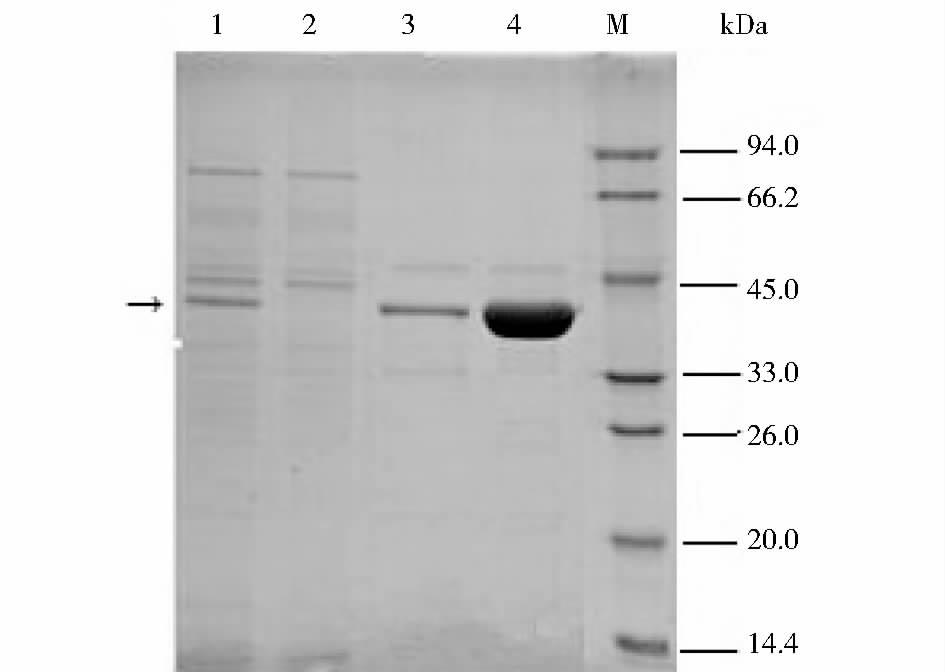
|
| 图 7 Ni柱纯化过程电泳图 Figure 7 SDS-PAGE profile for purification of PGⅡusing Ni chromatographic column 1:Culture supernatant; 2:Flow through; 3:Elution by 20mmol/L imidazole; 4:Elution by 50mmol/L imidazole; M: Protein MWmarker |
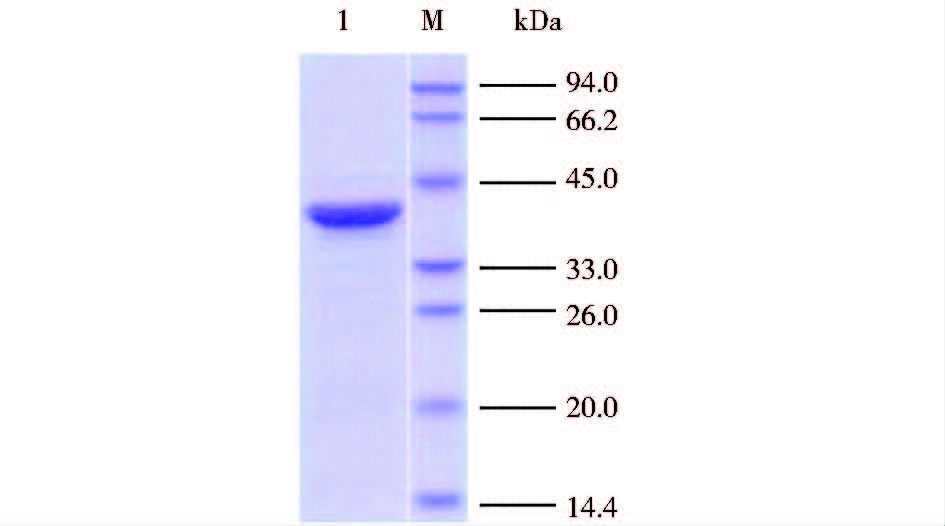
|
| 图 8 纯化后的PGⅡ蛋白检测 Figure 8 SDS-PAGE analysis of the purified PGⅡprotein 1:Purified PGⅡprotein; M: Protein MW marker |
经BCA方法定量,纯化后的重组PGⅡ蛋白浓度为1.1mg/ml。稀释55 000倍及110 000倍后,分别配制成浓度为20μg/L及10μg/L的重组PGⅡ蛋白样品。按胃蛋白酶原Ⅱ检测试剂盒说明书在日立HITACHI 7080型全自动生化分析仪中进行检测。检测结果显示,20μg/L样品的PGⅡ定值为17.5μg/L,10μg/L样品的PGⅡ定值为8.3μg/L,经计算,该重组PGⅡ蛋白的活性定值与实际蛋白质量之间的比值为0.85。
2.9 重组PGⅡ校准品的稳定性实验研究通过开展4℃实时保存稳定性实验、37℃加速破坏性实验及4℃开盖保存实验以评价不同浓度重组PGⅡ蛋白校准品的稳定性。研究结果显示(表 3),在各个不同条件下,校准品定值的平均下降幅度均不超过10%,因此,该重组PGⅡ蛋白适合用作体外诊断试剂的PGⅡ校准品。
| Real-time stability(4℃) | Accelerated stability(37℃) | On-board stability(4℃) | |||||||
| Testing day | 3months | 6 months | 12 months | 3 days | 7 days | 14 days | 3 days | 7 days | 14 days |
| Ratio to zero point(%) | 98.2 | 96.7 | 92.6 | 98.4 | 93.4 | 91.2 | 98.0 | 96.6 | 97.4 |
对商品化的校准品进行37℃加速破坏性实验及4℃开盖保存实验,结果显示,37℃加速破坏性7天及14天后,其相对于加速前的定值分别为94.2%及88.4%;4℃开盖保存7天及14天后,其相对于开盖前的定值分别为97.2%及95.2%。相比较而言,本研究的重组PGII校准品的稳定性能并不逊色于商品化的校准品。
3 讨 论胃癌是全球高死亡率的第二大疾病,我国又是个胃病重灾国,每年新发胃癌症患者约40万人,死亡人数近30万人,发病率和死亡率均为世界平均水平的2倍多。这与我国极低的早期胃癌诊断率有关,不足5% 的早期诊断率与日本等国50% 以上的诊断率有很大差距。而早期胃癌的5年生存率可达90% 以上,因此,胃癌的早期诊断、早期治疗对于提高胃癌的疗效、降低死亡率具有十分重要的意义[12-13]。在胃癌标志物研究方面,大量数据显示,通过检测PGⅠ及PGⅡ的含量可起到胃黏膜“血清学活检”的作用,由卫生部疾病预防控制局编著的《癌症早诊早治项目技术方案》(2011年版)也明确将PGⅠ和PGⅡ作为胃镜前检测和胃癌筛查的判断标准。
依据国家食品药品监督管理局发布的《体外诊断试剂校准品、质控品研究技术指导原则》,作为体外诊断试剂必不可少的校准品,是实现临床检测及监督检验结果准确一致的主要工具,也是保证量值有效传递的计量实物标准。对于PGⅡ校准品的制备而言,传统提取方法制备的天然人PGⅡ来源受限且产量极低,而大肠杆菌重组表达的PGⅡ蛋白表达不稳定,活性差。本研究则应用具备自主知识产权的汉逊酵母表达载体pRMHP2.1实现了PGⅡ蛋白的高效分泌表达。构建获得的pRMHP2.1-PGⅡ质粒具备如下特性:①联合Zeocin及G418的双重抗性筛选标记,有利于高拷贝菌株的筛选;②携带汉逊酵母自主复制序列HARS1[14],可在细胞中自主复制,以多拷贝串联的形式形成多联体,有利于实现外源基因的多拷贝整合;③携带汉逊酵母26S DNA的序列[15],该序列在酵母染色体上有30~50个拷贝重复,可实现外源基因的定点整合及高拷贝整合;④携带密码子偏爱性优化的PGⅡ基因,优化的密码子对应于高丰度的tRNA[16],有利于保证PGⅡ编码基因的翻译速率及准确率,使宿主细胞能以最快的速率大量合成目的蛋白;⑤携带MOX强诱导型启动子[17],在乙醇、高浓度的葡萄糖及甘油条件下能阻遏PGⅡ基因表达,在甲醇及低浓度甘油及葡萄糖条件下能解除阻遏,高水平表达外源的PGⅡ蛋白。
对于PGⅡ校准品的制备,重组PGⅡ蛋白的高效表达是个必要但不充分的条件,如何获得高纯度、高活性及具备良好稳定性能的PGⅡ蛋白同样是必不可少的条件。本研究中,经由Ni柱亲和层析及梯度洗脱的方法获得了纯度达93.8%的重组PGⅡ蛋白,该蛋白质的活性定值与实际蛋白质量之间的比值达0.85,显示了重组蛋白与天然蛋白结构相近。此外,依据《体外诊断试剂校准品、质控品研究技术指导原则》及结合目前市售PGⅡ校准品的有效期情况,通过将重组PGⅡ蛋白稀释成6个梯度浓度后进行不同保存条件下的稳定性能研究:①实时稳定性研究,也就是使产品置于制造商规定的条件下建立或验证产品保存期的试验。目前市售校准品保存条件为4℃,效期1年。因此,本研究在4℃条件下,考察了保存3个月、6个月、12个月及18个月(尚在进行中)的稳定性能。②加速稳定性研究,即在加严的环境条件下来增加化学和/或物理降解的速率,从而进行保存期的预测。主要考虑到实时稳定性时间跨度过长,特殊情况下,可以通过加速破坏性试验进行替代说明,一般认为,在37℃加速破坏1周可大致模拟4℃实时保存1年的稳定性情况。③开盖稳定性研究,是为了确定产品使用过程中的稳定性,如打开包装后的稳定性或开盖后放置于全自动生化分析仪中的情况等,应充分考虑到产品在这些使用过程中可能的各种环境因素,考察产品在一定时间内的开盖稳定性。综合以上稳定性研究结果,配制后的重组PGⅡ校准品在4℃实时保存1年、37℃加速破坏2周及4℃开盖保存2周后,校准品定值的平均下降幅度都不超过10%,其稳定性能不逊色于商品化的校准品。因此,汉逊酵母重组表达的PGⅡ蛋白可用作体外诊断试剂的校准品。
| [1] | Plebani M. Pepsinogens in health and disease. Crit Rev Clin Lab Sci , 1993, 30 (3) : 273–328. DOI:10.3109/10408369309084670 |
| [2] | Korstanje A, den Hartog G, Biemond I, et al. The serological gastric biopsy:a non-endoscopical diagnostic approach in management of the dyspeptic patient:significance for primary care based on a survey of the literature. Scand J Gastroenterol , 2002, S236 : 22–26. |
| [3] | Sipponen P, Härkönen M, Alanko A, et al. Diagnosis of atrophic gastritis from a serum sample. Minerva Gastroenterol Dietol , 2003, 49 (1) : 11–21. |
| [4] | Broutet N, Plebani M, Sakarovitch C, et al. Pepsinogen A, pepsinogen C, and gastrin as markers of atrophic chronic gastritis in European dyspeptics. Br J Cancer , 2003, 88 (8) : 1239–1247. DOI:10.1038/sj.bjc.6600877 |
| [5] | Foster C, Aktar A, Kopf D, et al. Pepsinogen C:a type 2 cell-specific protease. Am J Physiol Lung Cell Mol Physiol , 2004, 286 (2) : L382–387. DOI:10.1152/ajplung.00310.2003 |
| [6] | Kodoi A, Yoshihara M, Sumii K, et al. Serum pepsinogen in screening for gastric cancer. J Gastroenterol , 1995, 30 (4) : 452–460. DOI:10.1007/BF02347560 |
| [7] | Miki K, Morita M, Sasajima M, et al. Usefulness of gastric cancer screening using the serum pepsinogen test method. Am J Gastroenterol , 2003, 98 (4) : 735–739. DOI:10.1111/j.1572-0241.2003.07410.x |
| [8] | Miki K, Urita Y. Using serum pepsinogens wisely in a clinical practice. J Dig Dis , 2007, 8 (1) : 8–14. DOI:10.1111/cdd.2007.8.issue-1 |
| [9] | Aoki T, Tomaki E, Satoh M, et al. Purification of recombinant human pepsinogens and their application as immunoassay standards. Biochem Mol Biol Int , 1998, 45 (2) : 289–301. |
| [10] | 孟凡红, 金贞姬, 张娟, 等. 重组人血清白蛋白在汉逊酵母中的表达与纯化. 中国生物工程杂志 , 2006, 26 (12) : 11–17. Meng F H, Jin Z J, Zhang J, et al. Expression and purification of recombinant human serum albumin in Hansenula polymorpha. China Biotechnology , 2006, 26 (12) : 11–17. |
| [11] | 李鼎锋, 于跃, 霍烛, 等. 用汉逊酵母表达系统产生HPV18 L1蛋白的方法:中国, 201210021524. X.201307-24. Li D F, Yu Y, Huo Z, et al. Method for Producing HPV18 L1 Protein in Hansenula polymorpha. Chinese, 201210021524.X.201307-24. |
| [12] | Kim N, Jung H C. The role of serum pepsinogen in the detection of gastric cancer. Gut Liver , 2010, 4 (3) : 307–319. DOI:10.5009/gnl.2010.4.3.307 |
| [13] | Massarrat S, Stolte M. Development of gastric cancer and its prevention. Arch Iran Med , 2014, 17 (7) : 514–520. |
| [14] | Sohn J H, Choi E S, Kim C H, et al. A novel autonomously replicating sequence (ARS) for multiple integration in the yeast Hansenula polymorpha DL-1. J Bacteriol , 1996, 178 (15) : 4420–4428. |
| [15] | Saraya R, Gidijala L, Veenhuis M, et al. Tools for genetic engineering of the yeast Hansenula polymorpha. Methods MolBiol , 2014, 1152 (1152) : 43–62. |
| [16] | Quax T E, Claassens N J, Söll D, et al. Codon bias as a means to fine-tune gene expression. Mol Cell , 2015, 59 (2) : 149–161. DOI:10.1016/j.molcel.2015.05.035 |
| [17] | Mattanovich D, Branduardi P, Dato L, et al. Recombinant protein production in yeasts. Methods MolBiol , 2012, 824 : 329–358. |
 2016, Vol. 36
2016, Vol. 36




