文章信息
- 张宇萌, 童梅, 陆小冬, 米月, 莫婷, 刘金毅, 姚文兵.
- ZHANG Yu-meng, TONG Mei, LU Xiao-dong, MI Yue, MO Ting, LIU Jin-yi, YAO Wen-bing.
- 大肠杆菌可溶性表达抗TNF-α Fab的工艺优化
- Expression of Soluble Anti-TNF-α Fab in E.coli: Optimization for Technological Process
- 中国生物工程杂志, 2016, 36(9): 31-37
- China Biotechnology, 2016, 36(9): 31-37
- http://dx.doi.org/DOI:10.13523/j.cb.20160904
-
文章历史
- 收稿日期: 2016-03-09
2. 北京三元基因药业股份有限公司 北京 102600
2. Beijing Tri-Prime Gene Pharmaceutical Co. Ltd., Beijing 102600, China
类风湿性关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,表现为外周关节的慢性、非特异性炎症反应,RA是一种高致残性疾病,约50%的患者在发病两年内出现骨关节破坏症状,最终导致关节畸形和功能丧失。组织内高水平的炎性细胞因子参与了RA病情的发生和发展,其中关键因子为肿瘤坏死因子α (TNF-α),它介导了炎症及滑膜组织增生等病理过程。因此抑制TNF-α可起到控制炎症、阻断病情发展的作用。目前已经上市的用于中和TNF-α的单克隆抗体有英夫利昔、依那西普、阿达木单抗、戈利木单抗和赛妥珠单抗,其中赛妥珠单抗为聚乙二醇(PEG)修饰的人源化Fab片段,具有分子质量小、容易进入治疗靶位、免疫原性低及血浆半衰期长等优点[1-2]。因此,制备高质量的抗TNF-α Fab对于抗RA类疾病的药物研究至关重要。
Fab具有分子质量小、无需糖基化且抗原结合力强等优点,因此尤其适合通过大肠杆菌表达。大肠杆菌表达系统相比真核细胞表达系统具有成本低廉、大规模发酵容易、条件易于自动化控制等优点,通过大肠杆菌表达重组蛋白是一种高效、经济的途径[3-4]。大肠杆菌周质空间中蛋白酶含量低、杂蛋白含量少,因此Fab在周质空间中的表达有利于分离纯化和减少蛋白酶对目的蛋白的降解。经传统的破菌方法得到的菌体提取物往往含有大量杂蛋白及核酸类物质,给分离纯化带来了困难,本实验探究了较为温和的溶液萃取方法,试图减少胞内蛋白的释放,并通过优化萃取方案提高Fab产率[5-6]。亲和层析介质Protein L对抗体κ轻链上的可变区有很强的结合力,因此适用于Fab的纯化[7-9],但由于亲和层析柱载体颗粒粒径小、配体化学稳定性差、价格昂贵等原因,Protein L亲和柱需要联合其他类型的层析方法以保护亲和柱,本实验设计了Q Sepharose Fast Flow强碱性阴离子交换柱净化,Phenyl Sepharose Fast Flow疏水柱及Protein L亲和柱纯化的纯化方案[10-13],通过离子柱的净化及疏水柱纯化,成功除去了大颗粒物质及大部分杂蛋白,提高了Protein L亲和柱的使用寿命。
1 材料与方法 1.1 材 料 1.1.1 质粒及菌株Fab表达载体为pET23b,重组载体由本实验室构建。pET23b购自北京天恩泽基因科技有限公司。空白菌株为大肠杆菌BL21(DE3),购自天根生化科技有限公司。
1.1.2 试剂及仪器Fab标准品,羊抗人Fab二抗及HRP标记的羊抗人Fab二抗均购自Sigma公司,增强型HRP-DAB底物显色试剂、可溶性单组分TMB显色液、IPTG均购自天根生化科技有限公司,MK3型酶标仪购自Thermo公司,BioFloⅢ型发酵罐(5L)购自New Brunswick公司,MP220型pH计购自Mettler Toledo公司,AKTA purifier、Q Sepharose Fast Flow填料、Phenyl Sepharose Fast Flow填料、HiTrap Protein L 1ml/5ml预装柱均购自GE Healthcare公司,96孔酶标板购自Corning公司,半干转膜仪购自南京金斯瑞生物科技有限公司。
1.1.3 培养基种子培养基(g/L):胰蛋白胨10、酵母提取物5、NaCl 10。
发酵培养基(g/L): KH2PO·3H2O 4.1、(NH4)2SO4 1.0、Na2HPO4·12H2O 6.5、NaH2PO4·2H2O 2.8、NH4Cl 0.1、葡萄糖10、酵母提取物10、胰蛋白胨16。
补料培养基(g/L):葡萄糖750、MgSO4·7H2O 20、KH2PO4·3H2O 6.75、(NH4)2SO4 5、Na2HPO4·12H2O 3、NH4Cl 0.1。
氮溶液(V/V):28% 氨水。
1.2 方 法 1.2.1 重组质粒的构建抗TNF-α Fab周质表达形式为OmpA+轻链-OmpA+重链,目的基因插在pET23b质粒5′NdeⅠ和3′EcoRⅠ位点之间,构建重组质粒(图 1),抗性为抗卡那霉素,以上序列经生工生物工程(上海)有限公司测序证明正确。工程菌保存于15%甘油中,冻存于-20℃。

|
| 图 1 抗TNF-α Fab重组质粒示意图 Figure 1 Construction of anti-TNF-α Fab in pET23b |
种子液发酵:甘油菌以1∶1 000接种于LB培养基中(Amp终浓度为100μg/ml),37℃、200r/min摇床培养16h。
发酵罐发酵:以1∶100比例将种子液接种于发酵培养基中,初始温度为37℃,pH为7.0,搅拌转速设定为250~300r/min,闭环反馈调节,当溶氧下降到40%以下时,转速由250r/min上升至300r/min。5.5~6h,pH和溶氧明显上升,提示初始加入的葡萄糖被菌体消耗完毕,菌体开始利用含氮有机物作为碳源,产生的氨气使发酵液pH上升,此时开始补料,使用自动补料方式,pH下降到6.98时停止补料,pH上升到7.05时开始补料。当OD600大于15时(6~6.5h),开始补加α-乳糖(20g/L)作为诱导剂进行诱导,加入速率为5g/(L·h),流加结束后加入IPTG(1mmol/L)进行进一步诱导,诱导时间为18h,总发酵时间为24h[14-15]。发酵结束后,发酵液经低温离心,5 000r/min、30min、4℃,称量菌体湿重并计算菌体体积得率。
1.2.3 周质空间提取工艺及优化由于周质空间内的Fab为无信号肽形式,因此如何提高周质空间内Fab的提取效率至关重要,本研究采用溶液萃取法,使用乙酸钠溶液(含EDTA,NaCl)进行萃取,适量的EDTA能够抑制金属酶活性,同时可降低细胞壁稳定性,适量的NaCl能使萃取液具有一定的离子强度,菌体加入萃取液后,于摇床内37℃、200r/min进行萃取。本研究总结了能够影响萃取效率的因素,包括乙酸钠浓度、EDTA浓度、NaCl浓度、萃取液pH、萃取时间和萃取液质量体积比(菌体湿重与萃取液之比,g/25ml),进而以提高单位菌体量内Fab质量为目的对以上因素进行筛选,通过Minitab设计因素筛选试验(表 1),筛选出主要影响因素,再通过Minitab进行Box-Behnken设计(表 2),通过绘制主要因素的响应曲面,确定最佳萃取液组成。使用ELISA检测不同萃取液中Fab的质量,由于不同处理组的菌体量相同,因此得到的Fab质量为单位质量(单位质量= Fab浓度×萃取液体积)。后续菌体萃取均按照筛选出的最佳萃取液组成进行。
| 乙酸钠浓度/(mmol/L) | EDTA浓度(mmol/L) | NaCl浓度(mmol/L) | 萃取液pH | 萃取液质量体积比 | 萃取时间(h) | |
| 高水平 | 100 | 50 | 80 | 9 | 5∶1 | 48 |
| 低水平 | 20 | 10 | 20 | 4 | 10∶1 | 16 |
| 因子 | 水平 | ||||
| 1 | 2 | 3 | 4 | 5 | |
| 缓冲液pH | 4 | 5 | 6 | 9 | 10 |
| 萃取液质量体积比 | 3∶1 | 2∶1 | 1∶1 | 1∶2 | 1∶3 |
| 萃取时间(h) | 15 | 21 | 27 | 40 | 46 |
1.2.4 柱层析纯化
Q Sepharose Fast Flow阴离子交换柱净化:萃取液进行低温离心,8 500r/min,1h,取上清液,并调节萃取液pH为7.0,此时目的蛋白带正电荷,因此不与强碱性阴离子交换柱Q Sepharose Fast Flow的阳离子活性基团结合。平衡缓冲液为20mmol/L Na2HPO4 pH 7.0,流速为20ml/min,收集流穿。
Phenyl Sepharose Fast Flow疏水柱纯化:Q柱流穿液中加入硫酸铵固体(240g/L),因为高盐浓度能够提高目的蛋白的疏水性进而实现目的蛋白挂柱。平衡缓冲液为1.6mol/L (NH4)2SO4、1mol/L Na2HPO4,pH 7.0;洗脱缓冲液为20mmol/L Na2HPO4 pH 7.0;流速为10ml/min,收集洗脱峰。
Protein L亲和柱纯化:Protein L能够在中性环境中特异性结合Fab的κ轻链而在酸性环境中释放,因而选用Protein L进行Fab亲和层析。平衡缓冲液为20mmol/L Na2HPO4,pH 7.0;洗脱缓冲液为20mmol/L Na2HPO4,pH 2.5;流速为1ml/min(柱体积为1ml)或5ml/min(柱体积为5ml)。收集洗脱峰,并用1mol/L NaOH调节pH为7.0,分装保存于-20℃。
1.2.5 Western blotSDS-PAGE电泳条件为80V、20min,120V、90min,电泳结束后将胶在半干转膜仪上进行转膜7.5min,结束后用TBST洗涤硝酸纤维膜3次,每次5min;使用5% BSA溶液37℃封闭1h,用TBST洗涤硝酸纤维膜3次,每次5min;使用HRP标记的羊抗人Fab二抗(5% BSA溶解,1∶5 000)室温孵育2h,用TBST洗涤硝酸纤维膜3次,每次5min;增强型HRP-DAB底物显色试剂显色。
1.2.6 双抗体夹心ELISA将150μg/ml羊抗人Fab二抗包被于96孔酶标板内,于4℃包被16h,经PBST洗涤3次,每次5min;加入封闭液(5% BSA)37℃封闭1h,PBST洗涤3次,每次5min;将待测样品及Fab标准品进行稀释,每孔加入100μl,37℃孵育2h,PBST洗涤5次,每次5min;加入HRP标记的羊抗人Fab二抗(5% BSA溶解,1∶5 000)室温孵育1h后PBST洗涤5次,每次5min;每孔加入100μl可溶性单组分TMB显色液显色20~30min,2mol/L硫酸溶液终止反应,酶标仪检测OD450值。
1.2.7 抗体亲和力检测稀释人TNF抗原至0.625μg/ml、0.31μg/ml和0.156μg/ml 3个浓度,并包被于酶标板,于4℃包被16h。用PBST洗涤反应孔3次。加5%BSA于反应孔中37℃封闭1h。用PBST洗涤3次,将Fab抗体用PBS 2倍梯度稀释,起始浓度5μg/ml,共10个浓度,37℃孵育2h。用PBST洗涤5次,加入HRP-羊抗人Fab二抗(5% BSA溶解,1∶5 000),室温下孵育1h,用PBST洗涤5次。加TMB底物溶液室温孵育20min,2mol/L硫酸溶液终止反应,酶标仪检测OD450值。亲和力计算公式为Ka=(n-1)/2×(n[Ab]-[Ab]t)。
2 结 果 2.1 抗TNF-α Fab工程菌发酵、周质空间提取工艺及优化发酵罐发酵过程中,前6h菌体快速生长,6h左右OD600值约为15,随着诱导的进行,菌体密度也在缓慢增加(图 2)。最终菌体得率为25~33g/L(湿重)。目的蛋白理论分子质量为47.8kDa,菌体经溶液萃取后使用Western blot检测,结果与理论值相符(图 3,Fab在低温保存过程中会分解为轻重链单体,同时两条轻链有形成同型二聚体的现象,因此Western blot图中的阳性对照会有多条条带),表明成功实现了目的基因的表达。
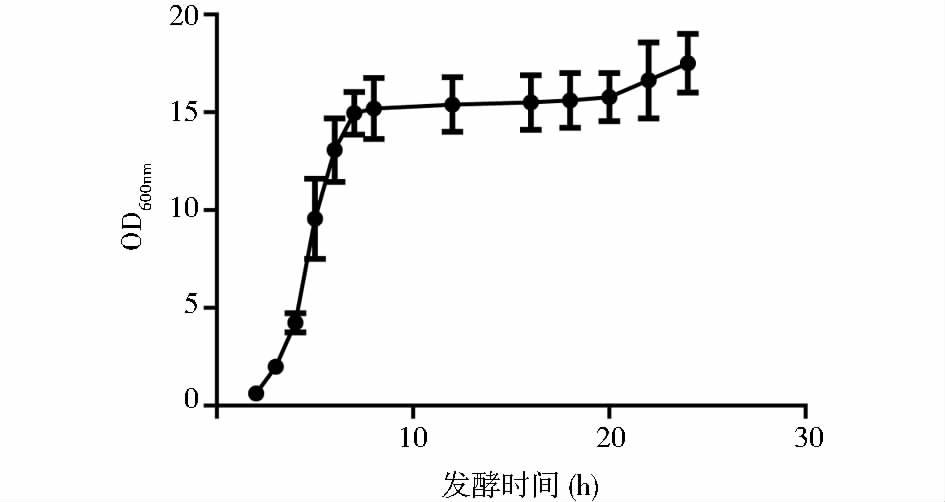
|
| 图 2 发酵过程OD600监测 Figure 2 OD600 monitoring in fermentation process |
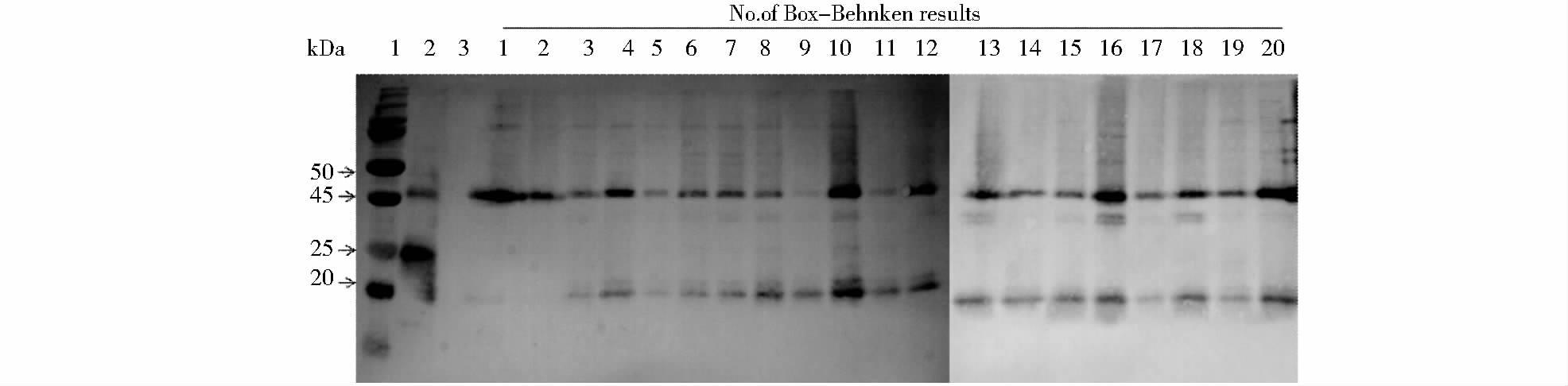
|
| 图 3 Box-Behnken试验样品Western blot检测(非还原) Figure 3 Western blot of samples of Box-Behnken experiment (non-reduced) 1:Marker;2:Positive control (Fab);3:Negative control (BSA);1-20 (No. of Box-Behnken results): Samples of Box-Behnken experiment |
因素筛选实验中以Fab单位质量为主效应,望大。其中NaAc浓度、EDTA浓度、萃取液pH、萃取液质量体积比、萃取时间等因子中,随着水平的提高,得到的Fab单位质量(μg)也随之提升(图 4)。其中对主效应影响最大的因子为萃取液pH、萃取液质量体积比、萃取时间,因为NaAc浓度、EDTA浓度、NaCl浓度对主效应影响较小。初步确定NaAc浓度为100mmol/L,EDTA浓度为50mmol/L,NaCl浓度为20mmol/L。后续实验拟设置这3种主要影响因子的多个水平,利用Box-Behnken实验设计,绘制响应曲面,探究这三种因子的最佳水平组合。从Box-Behnken实验设计的结果(表 3)看,1号、10号、13号、16号处理中Fab浓度较高,与对应的Western blot检测结果(图 3)相吻合。

|
| 图 4 因素筛选实验主效应图 Figure 4 Main effects of factor screening experiment |
| 编号 | 萃取液pH | 萃取液质量体积比 | 萃取时间(h) | Fab浓度(μg/ml) |
| 1 | 9 | 2∶1 | 21 | 15 |
| 2 | 9 | 1∶2 | 40 | 4 |
| 3 | 6 | 1∶1 | 27 | 4 |
| 4 | 5 | 2∶1 | 40 | 7 |
| 5 | 5 | 1∶2 | 21 | 2 |
| 6 | 6 | 1∶1 | 27 | 5 |
| 7 | 6 | 1∶1 | 15 | 4 |
| 8 | 6 | 1∶1 | 27 | 3 |
| 9 | 6 | 1∶1 | 46 | 1 |
| 10 | 6 | 3∶1 | 27 | 16 |
| 11 | 6 | 1∶3 | 27 | 2 |
| 12 | 6 | 1∶1 | 27 | 4 |
| 13 | 10 | 1∶1 | 27 | 13 |
| 14 | 4 | 1∶1 | 27 | 5 |
| 15 | 6 | 1∶1 | 27 | 5 |
| 16 | 9 | 2∶1 | 40 | 15 |
| 17 | 9 | 1∶2 | 21 | 4 |
| 18 | 6 | 1∶1 | 27 | 7 |
| 19 | 5 | 1∶2 | 40 | 2 |
| 20 | 5 | 2∶01 | 21 | 6 |
从响应曲面中可以看出,当萃取液质量体积比为1∶1,萃取液pH为9.0,萃取时间为32h时可以得到最大的单位质量(图 5)。

|
| 图 5 单位质量与萃取液pH、萃取时间及萃取液质量体积比的响应曲面 Figure 5 Response surface of unit mass versus pH,extraction time and mass volume ratio (a) Response surface of unit mass(μg) versus pH,extraction time (b) Response surface of unit mass(μg) versus pH,extraction time and mass volume ratio |
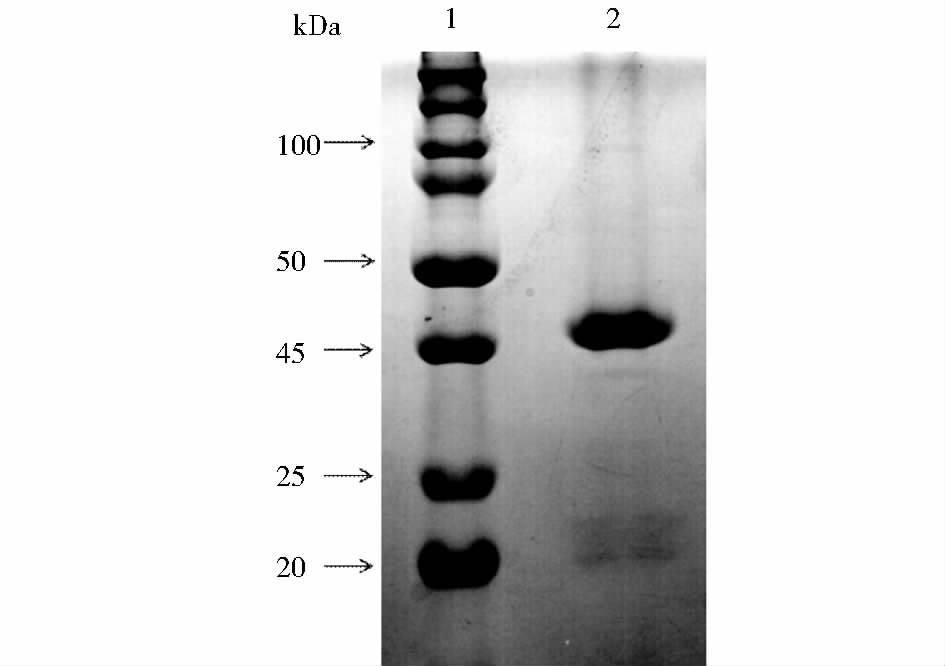
采用最优萃取条件进行萃取,萃取液经高盐处理后使用Q Sepharose Fast Flow阴离子交换柱净化,目的蛋白按照预期无法挂柱而存在于流穿中,此步操作可以除去细菌大颗粒物质起到净化作用,同时保护了Phenyl Sepharose Fast Flow疏水柱,加入硫铵后的离子柱流穿经疏水柱纯化,收集洗脱峰。最后疏水柱洗脱峰经Protein L进行亲和层析,收集洗脱峰(图 6)。综上,Fab体积得率可达23.5mg/L,总收率大于24%,纯度大于90%(图 7、图 8)。
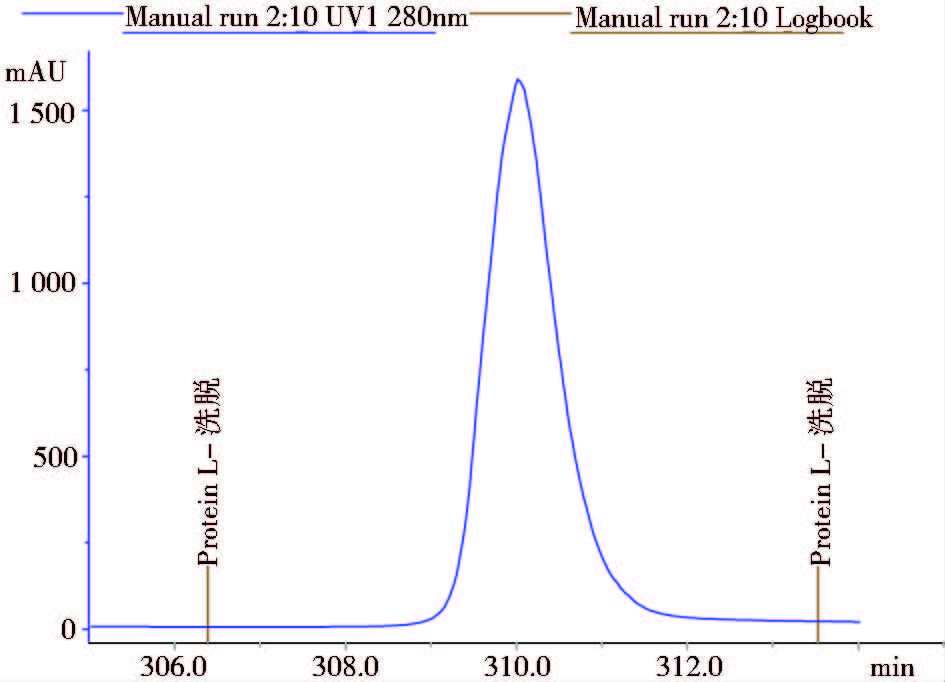
|
| 图 6 Protein L纯化的洗脱峰 Figure 6 Elution peak of Protein L |
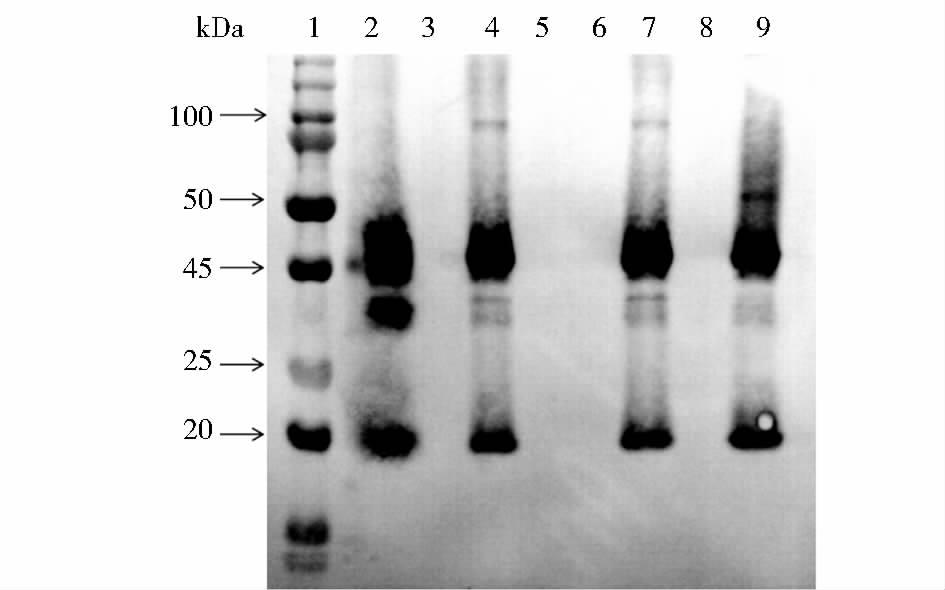
|
| 图 7 Q Sepharose Fast Flow离子柱,Phenyl Sepharose Fast Flow疏水柱及Protein L亲和柱纯化的Western blot检测(非还原) Figure 7 Western blot of Q Sepharose Fast Flow,Phenyl Sepharose Fast Flow and Protein L (non-reduced) 1:Marker;2:Positive control (Fab);3:Negative control (BSA);4:Flow through of Q Sepharose Fast Flow;5:Elution of Q Sepharose Fast Flow;6:Flow through of Phenyl Sepharose Fast Flow;7:Elution of Phenyl Sepharose Fast Flow;8:Flow through of Protein L;9:Elution of Protein L |
|
| 图 8 Protein L纯化考马斯亮蓝染色(非还原) Figure 8 Coomassie blue staining of Protein L affinity chromatography (non-reduced) 1:Marker;2:Elution of Protein L |
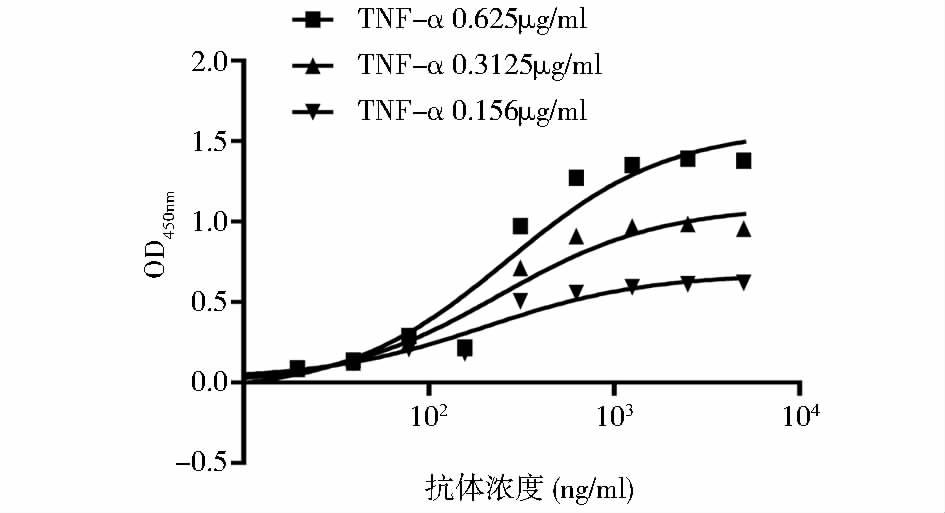
抗体产物的亲和力使用ELISA方法进行检测。将人TNF-α以3种不同浓度进行包被,抗TNF-α Fab从5μg/ml 向下倍比稀释10个浓度,得到抗TNF-α Fab与人TNF-α的亲和力曲线(图 9)。随着Fab的浓度升高,与TNF-α的结合也增加,亲和常数为1.7 × 10-9 mol/L,结果显示,抗TNF-α Fab与TNF-α具有较好的亲和力。
|
| 图 9 抗体亲和力曲线 Figure 9 Curves of antibody affinity |
目前用于类风湿性关节炎治疗的TNF-α抑制剂绝大多数采用哺乳动物细胞表达,但哺乳动物细胞培养条件复杂,对环境要求高,生产成本也随之提高,因而经济高效的原核表达途径成为首选。但是大肠杆菌周质空间较小,蛋白质含量较低,因而如何提高大肠杆菌周质蛋白载量、优化目的蛋白提取工艺及纯化工艺成为了该类药物研发的关键。
大肠杆菌周质表达为表达可溶性蛋白的常见方法,但由于缺乏周质空间特异性提取技术,使周质空间可溶性蛋白表达受到限制。传统的细胞破碎法有高压匀浆法、超声波振荡法、冻融法、渗透压冲击法、化学试剂法等,但这些方法由于具有自身因素限制,往往会导致菌体胞内蛋白完全或部分释放,导致菌体裂解液黏度过大、杂蛋白较多等,给下游纯化带来困难,因此探索一种大肠杆菌周质空间的提取技术对于重组蛋白的研究与开发至关重要。本研究探索了溶液萃取法,即使用乙酸钠溶液进行萃取,同时加入适量的EDTA抑制金属酶活性且降低细胞壁外膜的稳定性,加入适量的NaCl使萃取液具有一定的离子强度,菌体加入萃取液后,于摇床内37℃、200r/min进行萃取。本实验使用了试验设计(DOE),进行了因素筛选实验及Box-Behnken实验,最终确定了最优萃取条件。但后续需要更多的实验证明该条件下的萃取液不含或部分含有胞内蛋白。
本实验纯化方案能够实现抗TNF-α Fab体积得率达23.5mg/L、总收率大于24%、纯度大于90%的预期目标。但是由于轻重链表达速率的差异及抗TNF-α Fab非特异性的疏水性结合,且亲和层析介质Protein L对于Fab的κ轻链上的可变区有很强的结合力,因此在Protein L的洗脱中不可避免地含有部分轻链单体及抗TNF-α Fab二聚体,但含量小于10%。后续需设计凝胶层析纯化步骤以除去抗TNF-α Fab二聚体及轻链,保证抗TNF-α Fab质量可控性。
综上所述,本实验成功探索了大肠杆菌周质表达抗TNF-α Fab的萃取工艺,确立了有效的纯化方案,为抗TNF-α Fab工业化生产奠定了基础。
| [1] | Tanaka Y. Current concepts in the management of rheumatoid arthritis. Korean J Intern Med , 2016, 31 (2) : 210–218. DOI:10.3904/kjim.2015.137 |
| [2] | Tanaka Y. Intensive treatment and treatment holiday of TNF-inhibitors in rheumatoid arthritis. Curr Opin Rheumatol , 2012, 24 (3) : 319–326. DOI:10.1097/BOR.0b013e3283524e4c |
| [3] | Makrides S C. Strategies for achieving high-level expression of genes in Escherichia coli. Microbiology , 1996, 60 (3) : 512–538. |
| [4] | Olins P O, Lee S C. Recent advances in heterologous gene expression in Escherichia coli. Curr Opin Biotechnol , 1993, 4 (5) : 520–525. DOI:10.1016/0958-1669(93)90071-4 |
| [5] | 夏金兰, 王晶, 张倩, 等. 嗜酸氧化亚铁硫杆菌ATCC23270周质蛋白的选择性提取及差异表达. 中南大学学报(自然科学版) , 2009, 40 (4) : 845–850. Xia J L, Wang J, Zhang Q, et al. Selective extraction and differential electrophoregrams analysis of periplasmic proteins of Acidithiobacillus ferrooxidans ATCC23270. Journal of Central South University(Science and Technology) , 2009, 40 (4) : 845–850. |
| [6] | Kang H J, Kim H J, Cha S H, et al. Isolation of human anti-serum albumin Fab antibodies with an extended serum-half life. Immunology Letters , 2016, 169 : 33–40. DOI:10.1016/j.imlet.2015.11.013 |
| [7] | Lakhrif Z, Pugnière M, Henriquet C, et al. A method to confer protein L binding ability to any antibody fragment. MAbs , 2016, 8 (2) : 379–388. DOI:10.1080/19420862.2015.1116657 |
| [8] | Graille M, Stura E A, Housden N G, et al. Complex between Peptostreptococcus magnus protein L and a human antibody reveals structural convergence in the interaction modes of Fab binding proteins. Structure , 2001, 9 (8) : 679–687. DOI:10.1016/S0969-2126(01)00630-X |
| [9] | 王清, 蒋葵, 李俊, 等. 抗人大肠癌P-gp Fab抗体的制备、纯化及初步鉴定. 生物技术 , 2013, 23 (3) : 65–70. Wang Q, Jiang K, Li J, et al. Production,purification and identification of the Fab antibody against human colorectal cancer P-gp. Biotechnology , 2013, 23 (3) : 65–70. |
| [10] | Mayolo-Deloisa K, Lienqueo M E, Andrews B, et al. Hydrophobic interaction chromatography for purification of monoPEGylated RNase A. J Chromatogr A , 2012, 1242 : 11–1716. DOI:10.1016/j.chroma.2012.03.079 |
| [11] | Mirani M R, Rahimpour F. Thermodynamic modelling of hydrophobic interaction chromatography of biomolecules in the presence of salt. J Chromatogr A , 2015, 1422 : 170–177. DOI:10.1016/j.chroma.2015.10.019 |
| [12] | Murphy P J, Stone O J, Anderson M E. Automated hydrophobic interaction chromatography column selection for use in protein purification. J Vis Exp , 2011, 55 (21) : 3060–3065. |
| [13] | Arakawa T, Kita Y, Ejima D, et al. Solvent modulation of column chromatography. Protein Pept Lett , 2008, 15 (6) : 544–555. DOI:10.2174/092986608784966994 |
| [14] | Faust G, Janzen N H, Bendig C, et al. Feeding strategies enhance high cell density cultivation and protein expression in milliliter scale bioreactors. Biotechnology , 2014, 9 (10) : 1293–1303. |
| [15] | Velmurugan N, Kim H S, Jeong K J, et al. Enhanced production of human FccRⅡa receptor by high cell density cultivation of Escherichia coli. Protein Expression and Purification , 2011, 79 (1) : 60–65. DOI:10.1016/j.pep.2011.04.004 |
 2016, Vol. 36
2016, Vol. 36




