文章信息
- 韩晗, 包旦奇, 杨飞芸, 刘坤, 杨天瑞, 杨杞, 李国婧, 王瑞刚.
- HAN Han, BAO Dan-qi, YANG Fei-yun, LIU Kun, YANG Tian-rui, YANG Qi, LI Guo-jing, WANG Rui-gang.
- 中间锦鸡儿CiCHIL克隆及其黄酮代谢功能研究
- The Cloning and Function Analysis in Flavonoid Pathway of CiCHIL from Caragana intermedia
- 中国生物工程杂志, 2016, 36(9): 11-20
- China Biotechnology, 2016, 36(9): 11-20
- http://dx.doi.org/DOI:10.13523/j.cb.20160902
-
文章历史
- 收稿日期: 2016-05-03
锦鸡儿属(Caragana Fabr.)植物隶属于豆科(Leguminosae)。主要分布在东京30°~140°、北纬28°~56°的温带亚洲地带,我国为其中心分布地区[1]。该属植物分布比较广泛,在许多沙漠地区形成了独特的景观,这对保持和维护当地生态环境具有重要作用。另外,其作为饲用 、药用 、炭薪林等又具有重要的经济价值[2]。中间锦鸡儿的化学成分主要包括黄酮、芪类、苯丙素、生物碱等[3]。黄酮类化合物属于酚类物质。在植物适应陆地生活的过程中,黄酮类化合物做出了重要贡献。其来源是苯基丙氨酸通过苯丙烷途径形成的,苯丙烷代谢途径中产生的化合物接下来又产生了其他多种多样为植物体必需的物质。例如,在浆果未成熟期为浆果和种皮着色的浓缩丹宁酸(condensed tannin)、浆果成熟时期为浆果着色的花青素、参与植物代谢的黄酮类化合物及形成维管细胞的木质素(lignin)等[4]。除了药用和保健价值外,对大多维管植物而言,黄酮类化合物在植物的信号转导、生殖、授粉、抵御病虫害及生长发育等方面均起着重要作用[5-8]。在豆科植物中存在着一种独有的苯丙烷代谢通路——异黄酮代谢通路,异黄酮类(isoflavone)物质对植物与环境间的互作有非常重要的影响,如驱虫及为植物与固氮微生物共生传递信号等[9-12]。在苯丙烷代谢途径产生的诸多天然化合物中,查耳酮异构酶(chalcone isomerase,CHI)是其中一个分支点的关键酶,催化查耳酮(naringenin chalcone)到黄烷酮(naringenin)的反应,还有一些独特的CHI可以催化异甘草素(isoliquiritigenin chalcone)到甘草素(liquiritigenin)的反应。
CHI被誉为“完美的酶”,催化了一个具有旋光性的分子内环化反应[13],最早在真菌和细菌中出现的CHI只是一团无规则的大分子,并没有任何的催化结构和功能[14-15]。一个重要的里程碑式的进化是在这团大分子上出现了一个裂缝,于是出现了“type III”类的CHI [16]。CHI基因家族在二级结构上的改变带来了它的第二个进化阶段,致使形成了第二类CHI亚家族——CHI-like(CHIL),这个类型的CHI仍然缺乏大量合成黄烷酮的能力,但是在已进化出的裂隙周围,CHIL蛋白进化出了与底物形状更加匹配的裂隙 [16]。拟南芥中的一个CHIL基因已经证实可以提高黄酮类化合物的含量[17]。下一个进化阶段来到了“type I”型的CHI亚家族,它包含可以催化查耳酮到黄烷酮反应的所有氨基酸残基位点。最终的进化阶段是“type II”类型的CHI亚家族,它不仅可以催化查耳酮到黄烷酮的反应,还可以催化异黄酮代谢途径的反应,仅由豆科植物所有 [18]。
CHI基因家族的蛋白质结构域分析表明,CHI蛋白分别具有5个α螺旋和3个β折叠,CHI蛋白有4个重要的氨基酸位点,分别是48位的苏氨酸、106位的酪氨酸、113的天冬酰胺、190位的苏氨酸,由酶促反应动力学研究表明,这4个氨基酸位点对酶与底物专一稳定的结合及进行酶促反应有非常重要的意义[19]。
近期对拟南芥中CHIL的研究表明,CHIL基因可与CHI互作,并促进黄酮类化合物的合成,是黄酮代谢通路上的一个独特的增强子[17]。但在豆科植物中,许多CHI基因家族的功能还是未知的,为此,本实验以中间锦鸡儿为材料,根据SSH文库中的序列,对CiCHIL进行了基因克隆,构建过表达载体,筛选纯合过表达株系检测其总黄酮含量,并用UV-B处理中间锦鸡儿,研究中间锦鸡儿受UV-B诱导的情况及过表达CiCHIL基因可以增强植物对紫外胁迫的耐受性,以期为CiCHIL具有提高黄酮类化合物含量的功能提供理论依据。
1 材料与方法 1.1 植物材料及处理方法中间锦鸡儿种子采自内蒙古自治区呼和浩特市和林格尔县,拟南芥Columbia-0(Col-0)野生型由实验室保存。挑选饱满无虫的中间锦鸡儿于蛭石和营养土(2∶1)的培养钵内培养,培养条件:25℃,16h光照/8h黑暗。
选取1月龄的长势一致的中间锦鸡儿用于UV-B辐射处理,分别提取处理0h、0.5h、1h、3h、6h、9h、12h的中间锦鸡儿地上部分总RNA(本文的中间锦鸡儿和拟南芥RNA提取均采用TRIZOL法提取),中间锦鸡儿总RNA提取后反转录合成cDNA,稀释40倍作为荧光定量反应模板,以CkEF1α(KC679842)作为内参基因进行荧光定量,检测CiCHIL基因在UV-B处理不同时间点时的表达情况。SYBR GREEN I荧光染料法检测中间锦鸡儿幼苗在UV-B处理下基因的表达水平。每个样品三个技术重复,实验结果用2-ΔΔCT法分析数据。在荧光定量反应测定过表达拟南芥株系表达量的实验中,cDNA稀释16倍作为模板,AtEF1α(AT5G60390)作为内参基因,实验结果用2-ΔCT法分析数据。
拟南芥野生型和CiCHIL拟南芥过表达株系种子消毒后播种在装有蛭石与营养土混合的钵子内(蛭石∶营养土=2∶1),22℃培养,光照条件为16h光照/8h黑暗,20天后进行紫外胁迫,紫外处理强度为0.32W/m2;取样部位距离辐射源20cm;处理时间为0h、16h。分析UV-B胁迫下过表达和野生型的膜透性,根据Sun等的方法测定[20],取100mg新鲜拟南芥样品,加入去离子水至于25ml试管中,去离子水加15ml,真空泵抽气20min,静置1h,摇匀,测得初电导。测毕,100℃水浴30min,随后冷却,室温测得终电导。相对电导率(%)=(初电导-空白)×100/(终电导-空白)。
1.2 cDNA末端快速扩增 (RACE)cDNA末端用TaKaRa的3′-Full RACE Core Set试剂盒获得,具体步骤见说明书。以每个基因各自的EST片段设计RACE的Outer和Inner引物,以处理好的cDNA为模板,用试剂盒提供的引物和设计的Outer及Inner引物进行巢式PCR,扩增cDNA末端。扩增得到的cDNA末端用TaKaRa的pMD19-T Vector Cloning Kit连接到pMD19载体,转化到全式金公司生产的DH5α感受态中,涂布到事先涂有IPTG和X-Gal的含有氨苄青霉素的平板上,37℃过夜培养(12~16h)。用M13通用引物做菌落PCR,阳性克隆摇菌送测序。
所有引物用Primer5设计,测序结果用Vector NTI 10拼接。将测序得到的片段和库中已知的片段用Vector NTI软件进行序列拼接,NCBI Blast进行序列比对。
1.3 蛋白质比对蛋白质的比对选取了大豆中研究得较为清楚的3条序列,分别为GmCHI1A、GmCHI1B1、GmCHI1B2,以及在Tair中以CiCHIL蛋白比对结果最为相近的拟南芥中的一个AtCHIL。用DNAMAN对上述5个CHI蛋白进行蛋白质序列比对。
1.4 系统进化树分析在系统进化树的分析中,氨基酸序列是从大豆基因组数据库中获得的(Soybean Genome Database www.phytozome.net),以chalcone isomerase为关键词进行搜索,分别以下列各个物种作为查询对象:石松门植物,江南卷柏(Selaginella moellendorffii);非豆科被子植物,拟南芥(Arabidopsis thaliana)、杨树(Populus trichocarpa)、番茄(Solanum lycopersicum)、玉米(Zea mays)、水稻(Oryza sativa),豆科植物苜蓿(Medicago truncatula)和菜豆(Phaseolus vulgaris)。其中两条大豆的基因是已经被报道的两条基因[19]。
1.5 Western blot对T3代过表达拟南芥叶进行总蛋白质提取,取样量为1g,液氮研磨用于样品制备。研磨后的样品低温超声破碎10s,冻存-80℃冰箱用于Western blot检测。将总蛋白质上样于12%聚丙烯酰胺凝胶进行还原性SDS-PAGE电泳。从电泳槽中取出PAGE胶切下分离胶,按照分离胶大小剪裁40张滤纸,用100%甲醇浸泡5min。NC膜用蒸馏水浸泡20min,在转膜仪中依照滤纸(20张)→分离胶→NC膜→滤纸(20张)顺序放置,40V电压转膜1h。脱脂奶粉配制封闭液,脱色摇床上封闭1h。用PBS-T缓冲液在脱色摇床上充分清洗。滴加一抗二抗(购于BBI Life Science Corporation,01035,HK),终浓度均为1μg/ml,在脱色摇床上各震荡1h。将NC膜取出曝光,辣根过氧化物酶水解底物产生荧光,进行曝光。
1.6 总黄酮含量测定总黄酮含量测定方法参照分光光度法[21],将生长情况相同的哥伦比亚野生型拟南芥和过表达株系各3株种在同一个钵子内,每个株系做3个生物学平行。成对取1月龄的野生型和过表达植株,液氮研磨,-80℃冻存。取液氮磨好的样品0.5g与1g石英砂混合研磨,溶于70%甲醇,50℃、100W、1h超声破碎。避光4℃过夜静置,离心取上清液0.44μm微孔滤膜过滤收集,BECKMAN COULTER DU800 nucleic acid/protein analyzer测总黄酮含量。
芦丁对照品购于贵州迪大生物科技有限责任公司,配制芦丁母液。将5μg芦丁标准品定容于5ml 70%甲醇溶液中,再稀释至不同的浓度梯度,分别为0.05μg/ml、0.15μg/ml、0. 25μg/ml、0.35μg/ml、0.45μg/ml用于制作标准曲线。显色剂为10%Al(NO3)3、5%NaNO2、4%NaOH、1%AlCl3。向0.8ml各浓度的芦丁标样中加入0.08ml 5%NaNO2,混匀,静置6min。然后加0.08ml 10%Al(NO3)3,混匀,静置6min。再加0.8ml 4%NaOH,0.24ml蒸馏水补齐2ml体系,混匀,静置15min,检测吸光值。对照只将0.8ml标样换为70%甲醇溶液,用Excel表制作标准曲线。实验组实验步骤与标准曲线制作实验步骤相同,对照相同。
2 结果与分析 2.1 CiCHIL序列3′RACE和cDNA及gDNA克隆从SSH文库中得到CiCHIL基因片段,通过NCBI Blast进行比对,发现该基因序列为非全长cDNA序列,故参照RACE试剂盒(TaKaRa公司)说明书扩增该基因的3′端[图 1(a)],用1%琼脂糖凝胶电泳检测扩增产物,经NCBI Blast比对验证,拼接后得到的序列是完整的cDNA序列,其中包含完整的CiCHIL的开放阅读框(ORF),得到一条941bp的全长cDNA序列,其中ORF长630bp。

|
| 图 1 CiCHIL基因的3′RACE和cDNA、gDNA全长扩增结果 Figure 1 PCR products of 3′RACE,the full length cDNA and gDNA of CiCHIL (a) 3′RACE amplified fragment M: 2kb DNA ladder (b) The amplified full-length cDNA M: 2kb DNA ladder (c) The amplified full-length gDNA M: 5kb DNA ladder |
以中间锦鸡儿单株cDNA和gDNA为模板,依据拼接得到的全长ORF序列设计基因特异引物F-CiCHIL和R-CiCHIL,利用高保真酶Prime STAR进行PCR扩增,得到了开放阅读框CiCHIL开放阅读框基因的全长cDNA[图 1(b)]和全长gDNA[图 1(c)]。回收cDNA目的片段进行连接转化后测序,cDNA阳性克隆与拼接序列完全相同并包含完整的ORF。回收gDNA片段进行连接转化后测序,并对测序后结果进行分析。
2.2 CiCHIL基因序列分析测序表明,克隆得到的CiCHIL基因的cDNA全长为941bp,其中ORF长630bp,5′UTR长164bp,3′UTR长147bp。起始密码子为ATG,终止密码子为TGA,共编码209个氨基酸,其中包括一段12个腺苷酸组成的Poly A尾,共含有4个外显子和3个内含子(图 2)。

|
| 图 2 CiCHIL的cDNA、gDNA及推导的蛋白质序列 Figure 2 The cDNA,gDNA and deduced protein sequence of CiCHIL The non-coding region was indicated as lowercase letters,the underline letters indicated the introns |
将CiCHIL蛋白的序列与大豆的3个CHI蛋白和拟南芥的1个CHI蛋白序列进行比对(图 3),在CHI的4个重要氨基酸残基的位置上,48位的苏氨酸、106位的酪氨酸、113的天冬酰胺、190位的苏氨酸,CiCHIL吻合其中的1个。

|
| 图 3 CiCHIL蛋白与大豆和拟南芥CHI的序列比对 Figure 3 The alignment of CiCHIL along with other CHI from Glycine max and Arabidopsis thaliana Square indicate critical active site residues. They are Thr48,Tyr106,Asn113 and Thr190 |
为了解CiCHIL与其他CHI的关系,将CiCHIL与其他物种不同亚家族的CHI基因进行系统进化分析(图 4)。用MEGA5软件构建系统进化树。得出以下结论,系统进化树中两个拟南芥的CHI功能都已研究清楚,其中CiCHIL与AtCHIL聚类在一起,序列比对结果表明这两个基因相似度也较高,这也是CiCHIL基因的命名依据。在对AtCHIL研究的文献中表明,AtCHIL可以合成黄烷酮,也可以恢复AtCHIL突变体中某些黄酮类化合物缺失的表型。由此预测CiCHIL的功能可能与合成黄酮类化合物有关。进化树中大豆的两个CHI基因的分类已有报道,分别是聚类在CHI3亚家族中的GmCHI3A1(G.max Gly ma.13G262500)和豆科植物特有的亚家族中的GmCHI1(G.max Gly ma.20G251500)。该系统进化树自下到上为CHI基因家族的进化方向,进化树最下面的一个菜豆(P. vulgaris)的CHI基因(Phvul.001G037700.1)是进化较为远源的一个CHI3亚家族的基因。从CHI3亚家族开始,CHI基因家族从低等到高等,功能逐渐具体及多样化。
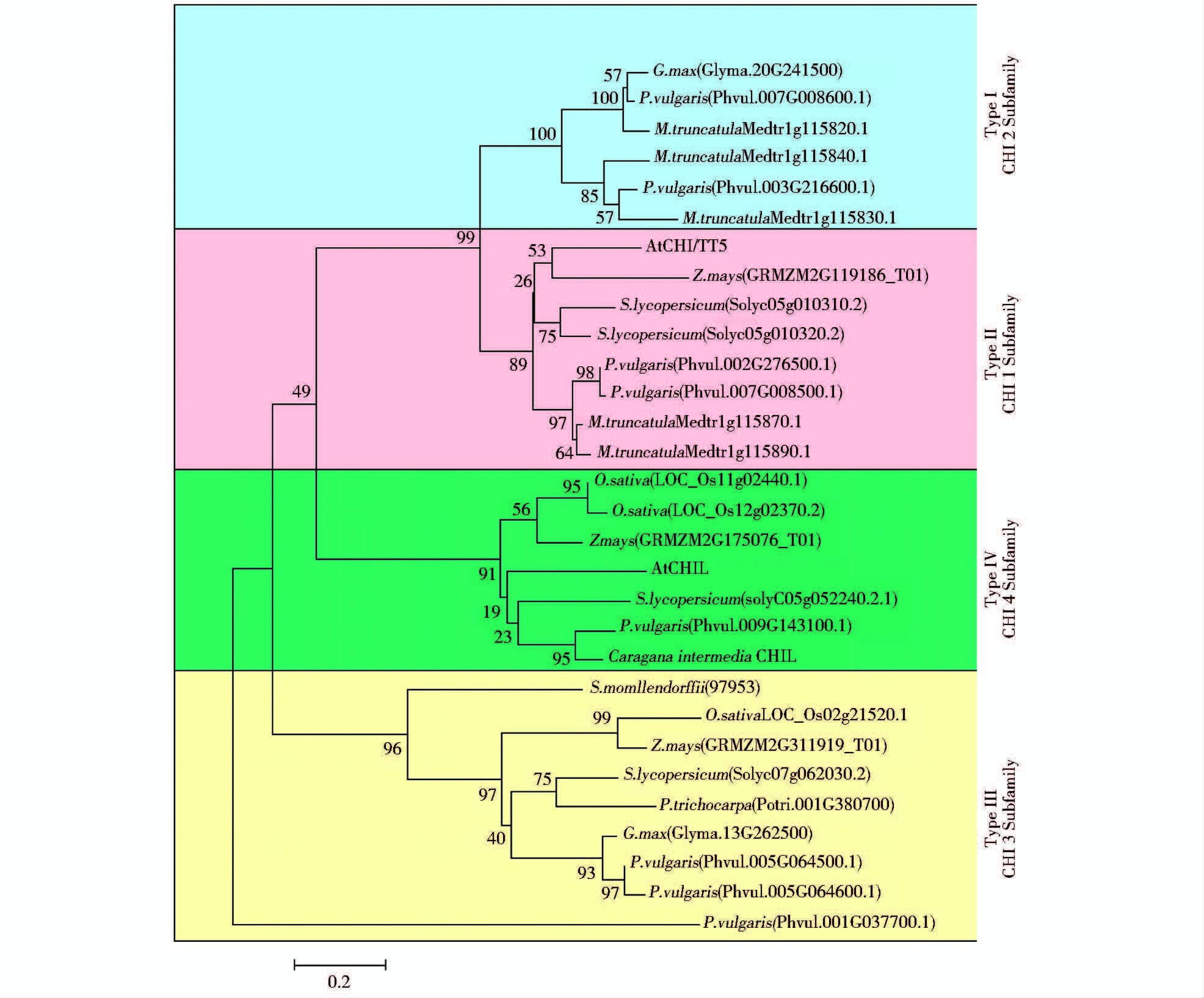
|
| 图 4 CiCHIL与其他CHI的系统进化分析 Figure 4 The phylogenetic tree of CiCHIL and CHI from other species The phylogenetic tree is constructed by the neighbor-joining method. Bootstrap values based on 1 000 replications |
为了检测CiCHIL能否提升植物体内黄酮类化合物含量,用浸花法将重组质粒pCanG-HA-CiCHIL转入拟南芥野生型(Col-0),依照孟德尔遗传定律,用卡那霉素筛选转基因植物,得到T3代纯合体。用荧光定量PCR检测目的基因CiCHIL在各转基因株系中的表达量(图 5),由于目的基因为异源表达,于是用2-ΔCT算法。在这8个株系中,16-6表达量最高、5-1表达量最低,选取5-6和16-6两个表达量高的过表达株系进行之后的表型实验。
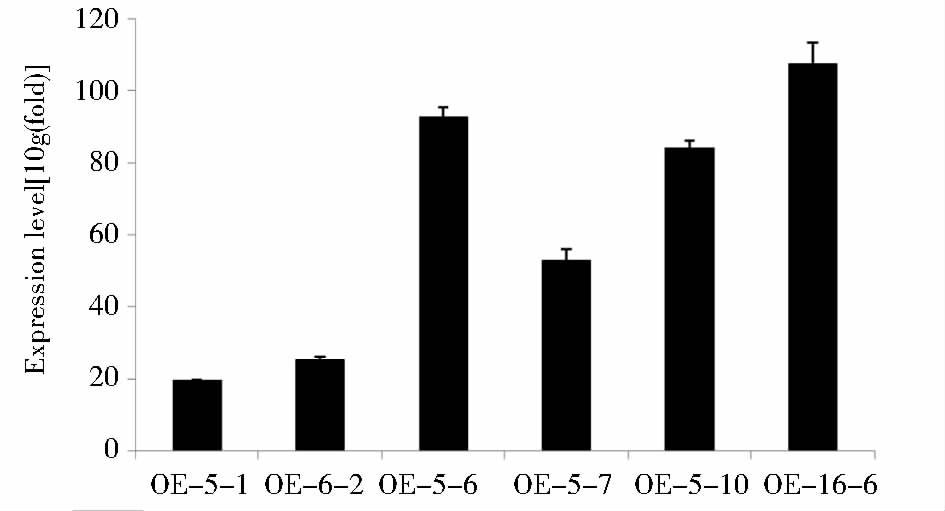
|
| 图 5 实时荧光定量PCR检测过表达株系CiCHIL的表达水平 Figure 5 The expression level of CiCHIL in transgenic lines by real-time quantitative PCR Reference gene was AtEF1α The result was calculated by 2-ΔCT |
为了检测拟南芥过表达株系中CiCHIL蛋白是否能够正常表达,提取拟南芥野生型、5-6、16-6过表达株系的总蛋白质,将蛋白粗提液进行Western blot。从图 6可见,在25kDa左右有一条清晰的条带,即为所检测的CiCHIL蛋白条带。说明在这两个株系中CiCHIL蛋白都有稳定表达。
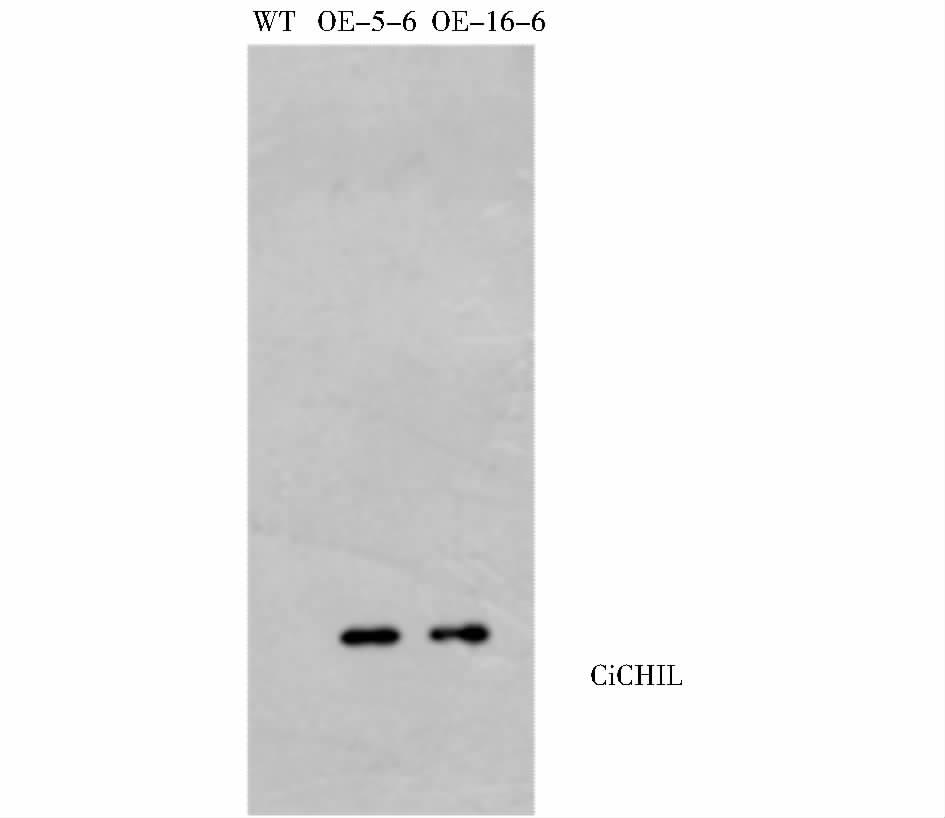
|
| 图 6 Western blot检测过表达株系中CiCHIL的蛋白表达量 Figure 6 Western blot analysis of CiCHI protein levels in overexpression lines |
为了检测CiCHIL能否提高黄酮类化合物含量,将CiCHIL过表达拟南芥移栽到温室环境下,转基因拟南芥具有正常的植株形态、生长特性和育性。总黄酮含量测定结果显示,转基因株系的总黄酮含量均显著高于野生型(图 7)。表明CiCHIL基因可以显著提高拟南芥的总黄酮含量,对黄酮代谢通路及苯丙烷代谢途径具有影响。

|
| 图 7 CiCHIL能够促进黄酮类化合物在植物体内的积累 Figure 7 Overexpression of CiCHIL promoted the accumulation of flavonoid in Arabidopsis Total flavonoids content in overexpression lines use spectrophotometric method |
为了检测CiCHIL是否像多数CHI基因一样对UV-B有响应,利用实时定量荧光定量PCR技术检测了CiCHIL基因在UV-B处理下的表达情况(图 8)。
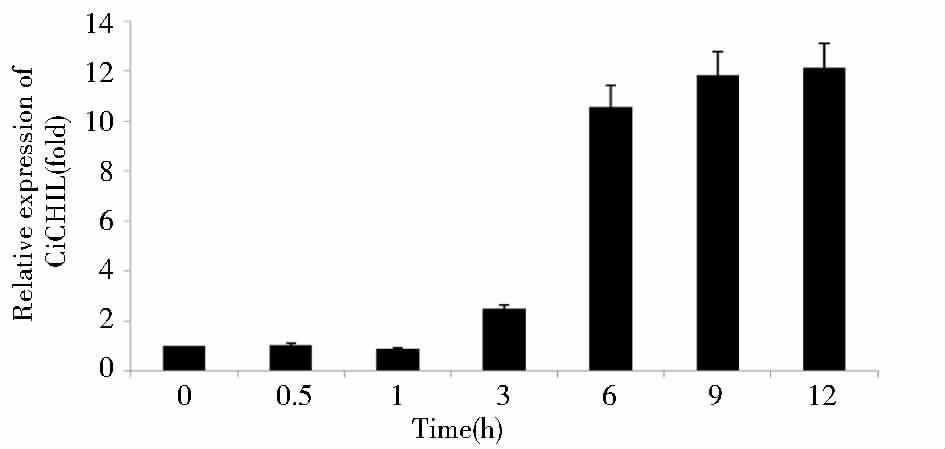
|
| 图 8 UV-B处理下CiCHIL转录水平的变化 Figure 8 The transcriptional change of CiCHIL to UV-B |
结果表明,在UV-B照射之下,0~3h,基因表达处于本底表达水平;处理4h时表达量开始升高,推测植物此时受到紫外损伤,植物体中针对损伤做出了一系列的应激反应,导致CiCHIL表达量上升;到12h时CiCHIL的表达量到达12.15倍,说明CiCHIL的表达受到UV-B的诱导。
2.9 紫外胁迫下过表达CiCHIL对膜质的影响为了探究紫外胁迫下,过表达CiCHIL是否对保护植物膜脂具有促进作用。我们对野生型和过表达株系的膜透性进行检测。正常条件下各株系无明显差别,但在胁迫16h后,野生型的相对电导率明显增加,过表达株系的增加量较野生型少。处理后,野生型相对电导率增加了6.02倍,增加到58.97%,过表达株系OE-5-6、OE-16-6相对电导率分别增加了3.97倍、3.11倍,分别增加到38.72%、40.42%。

|
| 图 9 UV-B处理对野生型和过表达株系相对电导率的影响 Figure 9 Effect of UV-B treatment on relative electrical conductivity in WT and transgenic plants |
近年来,越来越多的证据表明CHI基因家族的成员具有提高植物黄酮含量的功能,但对CHIL基因亚家族的功能报道较少,除拟南芥中的一个CHIL基因成功克隆并被证明可以提高黄酮类化合物含量外[17],豆科植物的CHIL基因亚家族的功能尚未明确。本研究克隆了中间锦鸡儿中的一个CHIL基因,得到序列之后首先对该基因进行序列分析,包括核苷酸序列分析和蛋白质序列分析。之前的报道表明,CHI基因家族编码的蛋白质中有4个比较重要的氨基酸位点,分别是48位的苏氨酸、106位的酪氨酸、113的天冬酰胺、190位的苏氨酸,这4个氨基酸位点影响酶与底物的结合及催化反应。由于进化程度不同,每一个CHI基因在这4个位点上的保守程度也不尽相同,对于进化程度较高的type II类的CHI基因来说,上述4个氨基酸位点均为保守,但是对于进化程度较低,如本文的研究对象CiCHIL,属于保守程度差的type IV类CHI基因,只有一个位点保守。
从系统进化树中我们可以看出,进化树从下到上显示出CHI基因家族的进化轨迹,从4个重要氨基酸位点不保守到保守,与底物结合能力越来越强,可催化底物数量不断上升。在这之前的研究表明,拟南芥中的一个CHIL基因可以提高黄酮类化合物含量[17],本研究的结论可以证明CiCHIL基因也可以在拟南芥中表达并最终提高过表达拟南芥的总黄酮含量,这与之前的报道吻合。除此之外,在对其过表达株系的检测中,除检测过表达与对照相比总黄酮含量变化外,也检测了一些可能与其相关的单一黄酮类化合物含量的变化情况,如山柰酚和甘草素,实验结果表明这两者并没有什么变化。进一步的实验方向是检测其他的黄酮类化合物,如柚皮苷、槲皮素等。此外,在拟南芥中,相比于其他黄酮代谢途径上相关酶类的突变体种皮透明的表型,AtCHIL(At5G05270)突变体表皮颜色与野生型相同,对已获得的AtCHIL突变体种子,可以将CiCHIL过表达到突变体形成恢复株系,对其进行观察,检测 CiCHIL在突变体中恢复前后总黄酮及各个黄酮类化合物含量的变化情况。
从CHI基因家族的进化历史来看,CHIL处于CHI基因家族的第二个进化阶段,而CHIL基因家族为陆生植物特有,从而揭示出CHIL基因亚家族可能与植物适应陆地生活环境有关,其中包括对紫外线的适应。之前很多报道都表明黄酮类化合物具有保护植物免受紫外伤害的证据,在苯丙烷生物合成途径上许多基因的启动子上都含有光响应原件及相应的MYB/MYC类转录因子的识别位点[22-24]。最直接的证据就是在拟南芥的突变体中,CHS和CHI的突变体都有对紫外过敏的表型[25]。
紫外线根据波长可分为3种,即短波紫外线UV-C(波长为200~280nm)、中波紫外线UV-B(波长为280~320nm)和长波紫外线UV-A(波长为320~400nm)。紫外线波长越短,对生物危害越大。UV-A对生物危害极小,UV-C对生物危害很大但会被臭氧层吸收,所以,对生物体造成影响的主要是UV-B。UV-B作为一种危害性胁迫,可以激发植物体产生一系列的防御性反应。例如,在细胞水平上,这些反应增加大量的黄酮及其他能够吸收紫外光的化合物,能够降低入侵到植物的大部分紫外光,减轻植物被紫外伤害的程度,同时也增加大量类胡萝卜素,以保护植物光合体系[26-27]。为了检测CiCHIL是否受UV-B的诱导,将中间锦鸡儿做UV-B处理,分别在7个时间点取样,检测该基因的表达量。结果可知,CiCHIL对UV-B有响应,在植物一直暴露在UV-B的情况下,CiCHIL的表达量一直不断上升。而高强度的紫外辐射则影响电子传递链,产生大量的ROS,降解DNA,攻击植物蛋白质,造成植物损伤,引起膜脂相变破坏细胞膜,致使植物的膜透性增加[28]。在检测紫外对植物造成的损伤时,常用膜透性这一生理指标表示植物的受害程度[20]。本研究中,在对野生型进行处理之后,膜透性增加6倍,而对过表达进行相同处理后,膜透性增加3~4倍。表明CiCHIL的拟南芥过表达株系较野生型具有更强的抵御和修复紫外损伤的能力,提高了植物对紫外胁迫的适应能力。
| [1] | 杨昌友, 李楠, 马晓强. 锦鸡儿属植物区系成份分析. 植物研究 , 1990, 10 (4) : 93–99. Zhang C Y, Li N, Ma X Q. The floristic analysis of genus caragana. Bulletin of Botanical Research , 1990, 10 (4) : 93–99. |
| [2] | Hansson A C, Aifen Z, Andren O. Fine-root production and mortality in degraded vegetation in horqin sandy rangeland in inner mongolia,China. Arid Soil Research and Rehabilitation , 1995, 9 (1) : 1–13. DOI:10.1080/15324989509385869 |
| [3] | 高海峰.白皮锦鸡儿黄酮及其抗菌和抗氧化活性.石河子:石河子大学,农学院,2011. Gao H F.Flavonoida from Caragana leucophloea and Their Antimicrobial and Antioxidant Activities.Shihezi:Shihezi University,College of Agricultural,2011. http://cdmd.cnki.com.cn/article/cdmd-10759-1011247352.htm |
| [4] | Hichri I, Barrieu F, Bogs J, et al. Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway. Journal of Experimental Botany , 2011, 62 (8) : 2465–2483. DOI:10.1093/jxb/erq442 |
| [5] | Aoki T, Akashi T, Ayabe S. Flavonoids of leguminous plants:structure, biological activity,and biosynthesis. J Plant Res , 2000, 113 (4) : 475–488. DOI:10.1007/PL00013958 |
| [6] | Peer W A, Murphy A S. Flavonoids and auxin transport:modulators or regulators?. Trends Plant Sci , 2007, 12 (12) : 556–563. DOI:10.1016/j.tplants.2007.10.003 |
| [7] | Ferrer J L, Austin M B, Stewart C Jr, et al. Structure and function of enzymes involved in the biosynthesis of phenylpropanoids. Plant Physiol Biochem , 2008, 46 (3) : 356–370. DOI:10.1016/j.plaphy.2007.12.009 |
| [8] | Winkel-Shirley B. How work on diverse plant species has contributed to an understanding of flavonoid metabolism. Plant Physiol , 2001, 127 (4) : 1399–1404. DOI:10.1104/pp.010675 |
| [9] | Ferguson J B, Mathesius U. Signalling interactions during nodule development. Journal of Plant Growth Regulation , 2013, 22 (1) : 47–72. |
| [10] | Lozovaya V V, Lygin A V, Zernova O V, et al. Isoflavonoid accumulation in soybean hairy roots upon treatment with Fusarium solani. Plant Physiol Biochem , 2004, 42 (7-8) : 671–679. DOI:10.1016/j.plaphy.2004.06.007 |
| [11] | Phillips D A, Kapulnik Y. Plant isoflavonoids, pathogens and symbionts. Trends Microbiol , 1995, 3 (2) : 58–64. DOI:10.1016/S0966-842X(00)88876-9 |
| [12] | Subramanian S, Stacey G, Yu O. Endogenous isoflavones are essential for the establishment of symbiosis between soybean and Bradyrhizobium japonicum. Plant J , 2006, 48 (2) : 261–273. DOI:10.1111/tpj.2006.48.issue-2 |
| [13] | Jez J M, Bowman M E, Noel J P. Role of hydrogen bonds in the reaction mechanism of chalcone isomerase. Biochemistry , 2002, 41 (16) : 5168–5176. DOI:10.1021/bi0255266 |
| [14] | Gensheimer M, Mushegian A. Chalcone isomerase family and fold:no longer unique to plants. Protein Sci , 2004, 13 (2) : 540–544. DOI:10.1110/ps.03395404 |
| [15] | Jez J M, Bowman M E, Dixon R A, et al. Structure and mechanism of the evolutionarily unique plant enzyme chalcone isomerase. Nat Struct Biol , 2000, 7 (9) : 786–791. DOI:10.1038/79025 |
| [16] | Ngaki M N, Louie G V, Philippe R N, et al. Evolution of the chalcone-isomerase fold from fatty-acid binding to stereospecific catalysis. Nature , 2012, 485 (7399) : 530–533. |
| [17] | Jiang W, Yin Q, Wu R, et al. Role of a chalcone isomerase-like protein in flavonoid biosynthesis in Arabidopsis thaliana. J Exp Bot , 2015, 66 (22) : 7165–7179. DOI:10.1093/jxb/erv413 |
| [18] | Ralston L, Subramanian S, Matsuno M, et al. Partial reconstruction of flavonoid and isoflavonoid biosynthesis in yeast using soybean type I and type Ⅱ chalcone isomerases. Plant Physiol , 2005, 137 (4) : 1375–1388. DOI:10.1104/pp.104.054502 |
| [19] | Dastmalchi M, Dhaubhadel S. Soybean chalcone isomerase:evolution of the fold, and the differential expression and localization of the gene family. Planta , 2015, 241 (2) : 507–523. DOI:10.1007/s00425-014-2200-5 |
| [20] | 王玉. UV-B胁迫下番茄叶绿体单脱氢抗坏血酸还原酶基因的功能分析.济南:山东农业大学,生命科学学院,2014. Wang Y. Functional Analysis of the LeMDAR in Tomato under UV-B Stress.Jinan:Shan Dong Agricutural University,College of Life Science,2014. http://cdmd.cnki.com.cn/Article/CDMD-10434-1014346415.htm |
| [21] | 张兰杰, 辛广, 张维华. 双波长分光光度法测定黑玉米花粉中总黄酮的含量. 食品科学 , 2006, 27 (2) : 230–231. Zhang J L, Xin G, Zhang W H. Assaying total flavonoid in black corn pollen by double-wavelength spectrophotometry. Food Science , 2006, 27 (2) : 230–231. |
| [22] | Solano R, Nieto C, Avila J, et al. Dual DNA binding specificity of a petal epidermis-specific MYB transcription factor (MYB. Ph3) from Petunia hybrida. EMBO J , 1995, 14 (8) : 1773–1784. |
| [23] | Yoshioka S, Taniguchi F, Miura K, et al. The novel Myb transcription factor LCR1 regulates the CO2-responsive gene Cah1, encoding a periplasmic carbonic anhydrase in Chlamydomonas reinhardtii. Plant Cell , 2004, 16 (6) : 1466–1477. DOI:10.1105/tpc.021162 |
| [24] | Xu F, Cheng H, Cai R, et al. Molecular cloning and function analysis of an anthocyanidin synthase gene from Ginkgo biloba, and its expression in abiotic stress responses. Mol Cells , 2008, 26 (6) : 536–547. |
| [25] | Li J, Ou-Lee T M, Raba R, et al. Arabidopsis flavonoid mutants are hypersensitive to UV-B irradiation. Plant Cell , 1993, 5 (2) : 171–179. DOI:10.1105/tpc.5.2.171 |
| [26] | Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiol Biochem , 2010, 48 (12) : 909–930. DOI:10.1016/j.plaphy.2010.08.016 |
| [27] | Rizhsky L, Liang H J, Mittler R. The combined effect of drought stress and heat shock on gene expression in tobacco. Plant Physiology , 2002, 130 (3) : 1143–1151. DOI:10.1104/pp.006858 |
| [28] | Hirakura K, Hano Y, Fukai T. Structures of three new natural Diels-Alder type adducts, kuwanons P and X,and mulberrofuran J,from the cultivated mulberry tree. Chem Pharm Bull , 1985, 33 (3) : 1088–1096. DOI:10.1248/cpb.33.1088 |
| [29] | Ross S A, Rodríguez-Guzmán R, Radwan M M, et al. Sorocenols G and H, anti-MRSA oxygen heterocyclic Diels-Alder-type adducts from Sorocea muriculata roots. J Nat Prod , 2008, 71 (10) : 1764–1767. DOI:10.1021/np800446g |
| [30] | Sheeba, Pratap Singh V, Kumar Srivastava P, et al. Differential physiological and biochemical responses of two cyanobacteria Nostoc muscorum and Phormidium foveolarum against oxyfluorfen and UV-B radiation. Ecotoxicol Environ Saf , 2011, 74 (7) : 1981–1993. DOI:10.1016/j.ecoenv.2011.07.006 |
 2016, Vol. 36
2016, Vol. 36




