文章信息
- 马博远, 张光明, 王航瑶, 许洪章, 彭猛, 王园园.
- MA Bo-yuan, ZHANG Guang-ming, WANG Hang-yao, XU Hong-zhang, PENG Meng, WANG Yuan-yuan.
- 光照混菌培养应用研究进展
- Research Progress on Application of Photosynthetic Microbial Mixed Culture
- 中国生物工程杂志, 2016, 36(8): 113-122
- CHINA BIOTECHNOLOGY, 2016, 36(8): 113-122
- http://dx.doi.org/DOI:10.13523/j.cb.20160815
-
文章历史
- 收稿日期: 2016-05-03
光合细菌(photosynthetic bacteria, PSB)是一类能够以糖类、低级脂肪酸、乙醇类或氨基酸等有机物为底物,在厌氧光照、好氧光照、好氧黑暗的条件下生长繁殖的微生物,在处理有机废水、生产新能源、生产高价值物质等方面具有良好的效果[1-2]。但是,PSB纯菌株对环境条件的要求较高,在培养过程中对环境的适应性较差,容易受到杂菌的污染,为保持PSB优势菌种的地位常需要投入大量的新鲜菌液[1],使得操作复杂,又增加成本,极大地阻碍了其在实际生产中的运用[2]。
在自然条件下,大多数微生物以混合的状态存在,它们对生态环境的维持和生命活动的正常运转起着重要的作用[3-4]。研究表明,两种或多种混合菌株培养有时能达到纯菌株培养难以达到的效果[5-8]。
因此,许多学者从PSB的特点和应用本身出发,通过研究PSB与其他微生物,包括藻类、各种细菌等的混合培养,来提高其环境适应性,提高相应的物质产率,探索新的应用领域,拓展PSB的应用前景。目前国内外关于光照条件下光合细菌与其他微生物混合培养的研究报道已经很多,领域包括水体净化、生物制氢和高价值物质生产,但是尚缺乏相应的综述来总结现有的成果。本文对光照混菌培养体系在水体净化、生物制氢和高价值物质生产三个方面的应用现状进行了总结,分析了混合培养效果的主要影响因素,提出了现存不足,并对本技术的发展前景作出展望。
1 光照混菌培养的特点 1.1 菌株之间的协同共生作用光照混菌培养中不同菌株之间存在各种互利协同共生的相互作用[9],这是与纯培养最本质的差异,可使代谢效率或物质的产率有较大程度的提高。有些菌株可以影响与之共存的菌株基因表达,从而提高或降低特定的酶的活性。将Bacillus thuringiensis/cereus L2与Rhocobacter sphaeroides混合培养,前者通过降低后者过氧化氢酶的活性,使后者对类胡萝卜素的降解率降低,从而显著提高体系处理污水的效率和类胡萝卜素的产率[10]。
在养殖废水处理中使用PSB、芽孢杆菌、硝化细菌和乳酸菌四种菌体的混养体系,芽孢杆菌抗逆性强的特性可以弥补PSB易失活的不足,确保养殖水体有机物、氨氮水平的迅速降低;另外PSB、硝化细菌对NO2--N浓度的降低可以消除芽孢杆菌可能引起的NO2--N浓度的反弹上升[11]。
1.2 使纯培养中单一的反应进行彻底有些菌株的共存可以弥补对方代谢上的缺陷,例如利用对方的副产物继续代谢,使纯培养中无法进行彻底的反应进行彻底,从而减少底物资源浪费、同时提高产率。在以淀粉为底物的产氢实验中,如果只使用厌氧活性污泥,那么代谢终产物挥发性脂肪酸(volatile fatty acids, VFA)无法被进一步利用,造成浪费。而在光照混菌体系中,厌氧活性污泥代谢淀粉生成的葡萄糖可为Rhodobacter sp (NRRL B-1727)利用,进一步代谢葡萄糖产生氢气和挥发性脂肪酸,挥发性脂肪酸最终还可以被该光合细菌利用,产生氢气[12]。
2 光照混菌培养的应用研究 2.1 净化水体 2.1.1 净化养殖废水水产养殖水体流动性差、更换频率低,养殖池底常常沉积大量的残留饵料、水产动物排泄物和尸体。这种情况下,水中NH4+-N和NO2--N的浓度升高,溶解氧浓度降低,严重时会造成生物大量死亡[11, 13]。常用于养殖水体净化的方法包括过滤、泡沫分离、铺设水底管道等,这些方法的净化效率相对较高[14]。但消耗大量的能源和水资源,同时会对水体中固有的生物群落造成破坏[15]。相比之下,使用光照混菌体系的生物方法经济有效,且不易破坏固有生物群落。
光照混菌培养可适用于多种水产养殖废水的处理,用于和PSB混合培养净化养殖废水的微生物主要有小球藻、枯草芽孢杆菌、乳酸菌和硝化细菌。其中枯草芽孢杆菌应用较多,超过三分之二的研究都选用枯草芽孢杆菌作为混养菌株。采用的PSB主要是红假单胞菌属,如表 1所示。
| PSB种类 | 混合培养微生物种类 | 废水类型 | COD去除率(%) | NH4+-N去除率(%) | NO2--N去除率(%) | 参考文献 |
| 无 | 枯草芽孢杆菌 | 池塘养殖水 | 44.98 | 78 | 无 | [21] |
| PSB(编号PSB-2) | 纳豆菌(编号BNA) | 模拟养殖水 | 无 | 接近60 | 接近100 | [6] |
| 荚膜红假单胞菌 | 地衣芽孢杆菌 | 模拟养殖水 | 40.13 | 35.38 | 81.05 | [22] |
| 无 | 纳豆芽孢杆菌、硝化细菌、乳酸菌 | 中心试验塘养殖水 | 无 | 77.48 | 83.01 | [11] |
| 无 | 纳豆芽孢杆菌、硝化细菌、乳酸菌 | 罗氏沼虾试验塘养殖水 | 无 | 78.60 | 74.77 | [11] |
| 无 | 纳豆芽孢杆菌、硝化细菌、乳酸菌 | 翘嘴红鲌试验塘养殖水 | 无 | 76.71 | 72.77 | [11] |
| 红假单胞菌 | 小球藻 | 大菱鲆育苗池养殖水 | 无 | NH4+-N增速显著减缓 | NO2--N增速显著减缓 | [18] |
| 无 | 芽孢杆菌 | 乌鳢养殖水 | 65 | 50 | 无 | [13] |
| 荚膜红假单胞菌 | 枯草芽孢杆菌 | 刺参养殖水 | 较对照组显著下降 | 48 | 60 | [17] |
| Rhodopseudomonas poultries AS1.2352 | 小球藻 | 人工污水 | 52 | 80 | 无 | [5] |
| 无 | 枯草芽孢杆菌 | 污染水沟水 | 58.73 | 86.13 | 71.96 | [20] |
净化养殖水体的同时,光合细菌混养体系还对所养殖水产品的生长有促进作用[16]。PSB本身含有丰富的营养物质,可以作为鱼、虾等的蛋白质饲料来源,同时有效地抑制鱼类病害[7]。芽孢杆菌和PSB在以合适的浓度投喂刺参养殖水体时,特定生长率、成活率显著提高[17]。小球藻可降低池水的透明度,有利于在育苗期间仔鱼的隐蔽和活动,减少应激反应,从而利于其生长[18]。
2.1.2 净化河湖水体随着我国城市化进程的不断加快,城市污水处理能力难以满足实际的需求,并且二者的差距有逐渐拉大的趋势,导致大量的城市污水未经任何处理就排入河流、湖泊乃至海洋[19]。高浓度的氮、磷元素会导致水体的富营养化,造成水华和赤潮,高COD会威胁水生生物的生存。常用于净化河湖水体的方法中,生物法具有经济、高效的优点,邹文娟等[20]发现PSB和枯草芽孢杆菌的混养体系对城市河道受污染原水的NH4+-N和COD去除率分别为86.13%和58.73%,均优于两种菌株分别的纯培养,证明光照混菌培养对净化河湖水体的高效性。
从光照混菌培养体系对净化水体的整体效果(表 1)来看,COD去除率分布在40%~65%,NH4+-N去除率分布在30%~90%,且超过半数的研究中NH4+-N去除率超过70%,NO2--N去除率分布在60%~100%。可见光照混菌培养体系对净化养殖废水和河湖水体的效果良好,具有广阔的应用前景。
2.2 生物制氢氢气的热值高达122 kJ/g,是烃类燃料的2.75倍,且燃烧的时候只生成水,基本不产生污染,是高效、绿色的新能源[23]。以葡萄糖为底物制氢的化学反应为式(1),如使用化学合成的方法,必须提供600℃和34.5 MPa的外部条件[24],消耗大量的能源并加重对环境的破坏;而生物方法只需要提供室温和常压的环境[24],因此具有很大的优势。
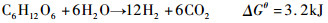 |
(1) |
近年来生物制氢方法中PSB与其他微生物混合培养产氢的研究备受关注。从表 2中可以看出,研究中所使用的PSB主要为红假单胞菌属和红细菌属,与之混合培养的微生物主要为乳酸杆菌、丁酸梭菌、产乙醇菌和大肠杆菌,底物主要为葡萄糖、淀粉、纤维素和实际废水。
| PSB种类 | 混合培养微生物种类 | 底物 | 产氢速率(ml-H2/L·h) | 产氢量(mol-H2/mol-葡萄糖) | 参考文献 |
| Rhodobacter sphearoides RV | Lactobacillus | 葡萄糖4.5 g/L | 41.27a | 7.1 | [7] |
| Rhodopseudomonas faecalis RLD-53 | Clostridium butyricum | 葡萄糖9 g/L | 20.83 | 1.98 | [24-25] |
| Rhodopseudomonas faecalis RLD-53 | Ethanoligenens harbinense B49 | 葡萄糖6 g/L | 17.2 | 3.10 | [26] |
| Rhodopseudomonas faecalis RLD-53 | Clostridium butyricum | 葡萄糖6 g/L | 33.85 | 4.134 | [27] |
| Rhodobacter sphaeroides DSM 158 | Clostridium butyricum DSM 10702 | 葡萄糖5 g/L | - | 0.86 | [28] |
| Rhodobacter sphaeroides | Clostridium butyricum | 葡萄糖4 g/L | - | 4.9±0.3 | [29] |
| Rhodobacter sphaeroides | Clostridium butyricum | 葡萄糖10 g/L | 15.9 | - | [30] |
| Rhodobacter sphaeroides O.U.001 (ATCC 49419) | Clostridium acetobutylicum DSM 792 | 葡萄糖3 g/L | 10.7±0.4 | 6.22 | [31] |
| Rhodobacter sphaeroides KKU-PS5 | Lactobacillus delbrueckii ssp. Bulgaricus TISTR 895 | 葡萄糖5 g/L | 9.1±0.2 | 9.65±0.23 | [23] |
| Rhodobacter sphaeroides NRRL-B 1727 | Anaerobic sludge | 水解小麦淀粉5.0 g/L | 11.3 | 3.4 | [32] |
| Rhodobacter sphaeroides | Clostridium acidisoli | 蔗糖11.43 g/L | - | 5.08 | [33] |
| Rhodobacter sphaeroid NRLL-1727 | Anaerobic sludge | 小麦淀粉12.8 g/L | 1.40a | 0.36 | [34] |
| Rhodobacter sphearoides RV | Anaerobic sludge | 小麦淀粉4.3 g/L | 6.70a | 1.45 | [35] |
| Mixture of Rhodobacter sp (NRRL B-1727) Rhodobacter sp (DSMZ-158) Rhodopseudomonas palustris (DSMZ-127)Rhodobacter sp. RV | Anaerobic sludge | 小麦淀粉4.1 g/L | 3.86a | 1.16 | [8] |
| Mixture of Rhodobacter sp (NRRL B-1727) Rhodobacter sp (DSMZ-158) Rhodopseudomonas palustris (DSMZ-127) Rhodobacter sp. RV | Anaerobic sludge | 小麦淀粉3.9 g/L | 7.12a | 1.03 | [36] |
| Rhodobacter sp. M-19 | Clostridium butyricum | 淀粉50 g/L | 16.50a | 6.6 | [37] |
| Mixture of Rhodobacter sp (NRRL B-1727) Rhodobacter sp (DSMZ-158) Rhodopseudomonas palustris (DSMZ-127) Rhodobacter sp. RV | Anaerobic sludge | 小麦淀粉20 g/L | 5.5 (ml-H2/h) | 0.43 | [38] |
| Rhodobacter sp (NRRL B-1727) | Anaerobic sludge | 小麦淀粉10 g/L | 18.1 (ml-H2/h) | 1.32 | [12] |
| Rhodobacter sp. RV | Clostridium beijerinkii DSW-791 | 小麦淀粉5.0 g/L | 5.95 | 0.6 | [39] |
| Rhodobacter sphaeroides | Clostridium butyricum | 淀粉5 g/L | - | 4.9±0.5 | [40] |
| Rhodobacter sphaeroides N7 | Clostridium butyricum | 淀粉5 g/L | - | 1.23±0.3 | [41] |
| Mixed R. capsulatus DSM 1710 and R. sphaeroides NMBL-01 | Clostrudium acetobutylicum ATCC 824 and Escherichia coli HD701 | 白高粱淀粉 | - | 8.4 | [42] |
| Rhodopseudomonas palustris CGA009 | Clostridium cellulovorans 743B | 纤维素 | 5±0.5 | 1.5±0.1 | [43] |
| Rhodobacter sphaeroides MDC6521 | Escherichia coli BW 25113 | 酒糟 | 5.16 (mmol/ L·d) | - | [44] |
| Mixed photosynthetic consortium | Anaerobic consortium | 酒糟废水 | - | 271ml | [45] |
| Mixed photosynthetic consortium | Anaerobic consortium | 生活污水 | - | 248ml | [45] |
| a Calculated according to the data given in the relevant article | |||||
2.2.1 产氢流程
将产氢反应按照底物的不同分类,可以大体上分为淀粉类底物(多糖类底物)反应和葡萄糖类底物(单糖类底物)反应,如图 1所示。
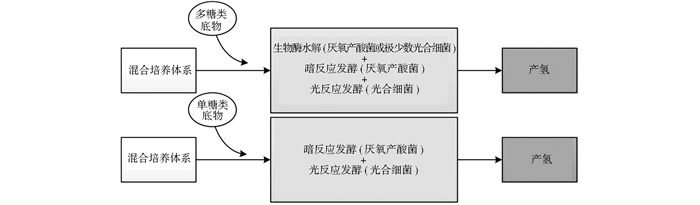
|
| 图 1 光照混菌培养产氢流程图 Figure 1 Procedure of hydrogen production by photosynthetic microbial mixed culture |
淀粉类底物的代谢流程可以概括为式(2):
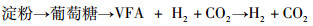 |
(2) |
淀粉基本不能被PSB代谢,所以第一步主要是由厌氧菌(厌氧活性污泥、乳酸菌、丁酸梭菌等)完成,通过酶解淀粉生成葡萄糖或者麦芽糖,作为第二步的反应底物。第二步反应开始产生氢气;该过程有两种情况,如果所用PSB可以代谢葡萄糖,则厌氧菌和PSB共同利用葡萄糖产氢,否则第二步产氢主体只有厌氧菌。在已知的文献中,这两种情况都存在,相比之下能代谢葡萄糖产氢的PSB用得更多[24]。第二步反应产生的VFA作为第三步的底物,由PSB代谢生成氢气和二氧化碳。
Ozmihci等[12]发现产氢过程中存在停滞期,认为葡萄糖和VFA共同存在于培养液内时,PSB只消耗葡萄糖,不消耗VFA,在葡萄糖基本上消耗完之后,PSB才能开始代谢已经大量积累的VFA,而且葡萄糖对整个反应起"抑制性副产物"的反作用。但是,研究者[32-33]在实验中并未发现有VFA的大量积累,即二、三阶段同时进行,并认为其他存在VFA积累现象是由培养过程中pH不适宜PSB生长造成的。事实上,Ozmihci等[12]的研究中体系pH始终保持在6以上,这样的环境总体上来说不会明显抑制PSB的活性。
以上矛盾可以从菌株之间相互作用差异解释:两者研究中大部分环境条件差异较小,实验方式也基本相同,所选PSB也都是Rhodobacter sphaeroides,最大的差异在于与PSB共培养的微生物,以及接种比和接种量等[12, 32]。不同的菌株与PSB混养时存在的相互作用应当有所差异,例如某种菌株可能会对PSB代谢VFA带来促进作用,而某种菌株可能会产生相对应的抑制作用,但是这样的推测仍需进一步的验证。
2.2.2 产氢效果目前为止光照混养体系产氢的最高产氢量是9.65 mol-H2/mol-葡萄糖。在Rhodobacter sphaeroides KKU-PS5和Lactobacillus delbrueckii ssp. bulgaricus TISTR 895混合培养中,LAB/PNSB为1/12 (w/w),初始菌体浓度为0.15 g/L,初始pH、光强和Mo浓度分别为7.92、8.37 klux和0.44 mg/L时,累积产氢量为3396±66 ml-H2/L,产氢速率为9.1 ml-H2/L·h,产氢量为9.65±0.23 mol-H2/mol-葡萄糖,这一产氢量超过了理论最大产氢量的80%[23]。
Lu等[43]研究了以纤维素为底物的Clostridium cellulovorans 743B和Rhodopseudomonas palustris CGA009混合培养产氢,在30 ℃、6000lux、纤维素浓度为5 g/L时总产氢量达到75.7 ml,比Clostridium cellulovorans 743B纯培养的最高产氢量增加81.3%。植物纤维素作为我国农业生产中产量巨大的废弃物,如玉米秸秆,可以作为混合培养的底物,从而被有效资源化。
除了光照混菌培养体系外,还有将光合细菌和暗发酵微生物分离开的暗-光两阶段发酵产氢方式。相比之下,后者的研究更多一些[24],因为通过两阶段可以使两种菌分别达到自身的最佳生长或产氢条件,从而最大程度上发挥暗反应菌和光反应菌的产氢能力。但是,这种方法存在一定缺陷,为了使得光反应的条件适宜PSB生长,暗发酵的产物必须经过相对复杂的预处理,包括离心、pH调节、稀释、氩气流除氧和灭菌消毒等,不仅占地大,且增加了整体的成本[26]。
从光照混菌培养体系的产氢效果(表 2)来看,最大产氢速率分布在3.86~41.27 ml-H2/L·h,最大产氢量分布在0.36~9.65 mol-H2/mol-葡萄糖,整体的产氢效果较好。此外,光照混菌培养的方法工艺简单,成本较低,且具有污染物资源化的优势,应用前景较好。
2.3 生产高价值物质 2.3.1 产聚羟基脂肪酸酯(PHA)聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA)是微生物自身合成用作储存能量的高分子生物聚酯,既具有与传统塑料相似的理化性质,又具有良好的生物降解性和生物相容性,是化工合成塑料的绿色替代品[46]。目前,根据培养方式不同可以将生物合成PHA的方法分为纯细菌发酵法、活性污泥法和光照混合菌藻培养法。纯细菌培养法相对最成熟,但是对底物和菌种的纯度要求高,使得其成本远远高于传统化工塑料[46]。活性污泥法不需要纯菌,也可以使用各种有机废水作为底物,但是这种方法对溶解氧的需求较为苛刻。光照混合菌藻培养法中PSB可以利用光能来代谢并合成PHA,不需要曝气,极大地简化了操作[47]。
PSB和藻类混合培养产PHA由Fradinho等[47]在2013年首次提出。其整体产PHA流程由"富集菌株"和"合成PHA"两阶段组成,第一阶段使用"充盈-饥饿"模式(feast and famine regime),让池塘底泥中PSB在底物乙酸充足的阶段积累PHA,底物消耗殆尽之后PSB为了维持生存开始利用藻类产生的氧气消耗自身合成的PHA。通过如此充盈-饥饿-充盈-饥饿往复循环,能产PHA的PSB菌株存活下来,达到富集菌株的目的。第二阶段通过连续添加底物乙酸来使菌群连续不断地产生PHA而不被消耗,达到生产PHA的目的。研究中菌体最高PHA含量为20%,每mol乙酸的PHA产量和好氧体系相当[47]。
Fradinho等[48]还对光周期进行了优化,使PHA产量升高至0.94 mol-PHB/mol-乙酸,高于活性污泥法的0.70~0.78 mol-PHB/mol-乙酸[49]。通过改变底物组成,使用混合乙酸、丙酸和丁酸作为底物,生产出韧性更好的PHA,其中3-羟基戊酸比例为51% [50]。
2.3.2 产类胡萝卜素类胡萝卜素是光合细菌、藻类和植物细胞中参与光合作用的色素,因具有抗癌症、心脏病等用途而备受关注[9]。光合细菌本身的类胡萝卜素含量与其他微生物相比并不是最高[7],但通过混合培养可以大幅度提高光合细菌的类胡萝卜素产率。
研究者[9]发现Bacillus thuringiensis/cereus L2可以用于与Rhodobacter sphaeroides以废水为底物混合培养,促进PSB的生长和产类胡萝卜素。在Bacillus thuringiensis/cereus L2最佳浓度40 μl(大约6.4×105 CFU)时,COD、PSB生物量、类胡萝卜素浓度和类胡萝卜素产量分别提高178%、67%、214%和70%。
光照混菌培养生产高价值物质的相关研究整体上不是很多,但从其效果来看,产率比纯菌株培养有了明显的提高,同时可以实现有机废水资源化。光合细菌所产高价值物质除以上PHA和类胡萝卜素外,还包括辅酶Q10(Coenzyme Q10,CoQ10)和4-氨基乙酰丙酸(4-aminolevulinic acid,4-ALA)等,但是目前光照混菌培养对产CoQ10和4-ALA的研究仍相对欠缺,所以从菌株相互作用机制出发,将光照混菌培养应用于这两种物质的研究应当是光照混菌培养生产高价值物质领域的一个发展方向。
3 影响因素PSB和其他微生物的混合培养,需要在相对合适的环境条件(温度、光照、pH等)与营养条件(碳源、氮源)下进行。微量元素、接种量和接种比、细胞固定化也对培养效果影响很大[51]。通常,PSB对环境的要求比其他混合培养的微生物苛刻,所以各种条件都优先考虑PSB的适宜范围。图 2综合了这些影响因素的选择范围。
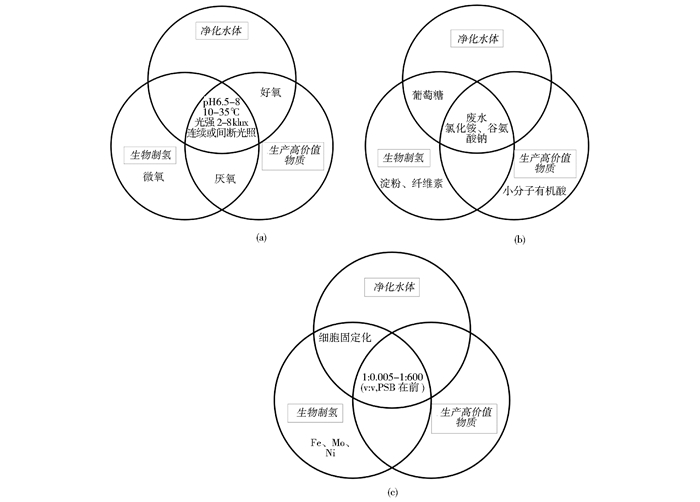
|
| 图 2 光照混菌培养影响因素.环境因素(a),营养因素(b),其它(c) Figure 2 Factors of photosynthetic microbial mixed culture (a) Environmental factors (b) Nutrient factors (c) Others |
影响光照混菌培养的环境因素包括光配方、氧、pH和温度四个方面,如图 2a所示。
PSB利用光能生长代谢,在水质净化、产氢、产PHA及产类胡萝卜素几种应用中,光照强度对混合培养体系都存在显著的影响。光周期显著影响混养体系产PHA过程,例如暗-光交替的光照模式比连续光照对于富集产PHA菌株更有效[48]。光源类型也会影响PSB的活性[35]。对于混养体系中除过PSB以外的微生物,光照与否一般不影响其生长代谢。
溶解氧一方面能抑制PSB固氮酶和氢酶的活性,不利于产氢;但适当溶解氧能促进微生物的呼吸作用,充分代谢消耗有机物。研究表明,氧的存在不利于光照混菌体系产氢及产PHA[25, 47],但是也有研究者认为微量的氧有助于提高产氢量[51]。
溶液的pH值可引起微生物细胞膜电荷的变化,也会影响生物酶活性,当pH低于5时PSB会受到严重的影响。pH是随反应进行而发生变化的动态量,因此pH通常是实际应用中限制PSB生长代谢最重要因素之一。糖类的代谢产生大量的VFA,一般情况下会短时间内将pH降至相对较低的水平,研究中为了维持pH使用过加入缓冲溶液、调整接种量和接种比、定期抽提VFA或加入NaOH溶液等方法[31, 36]。
培养环境的温度直接影响生物酶活性,过高或过低都对微生物的正常生长繁殖有负面影响,所以尽可能地要将其控制在各种微生物生长繁殖最适宜的范围内。
3.2 营养因素影响光照混菌培养的营养因素主要包括碳源和氮源,如图 2b所示。不同种类碳源主要在代谢机制上对混养体系产生影响。例如产PHA的应用中,不同种类的VFA作为底物时所产PHA的种类也不同,且底物中乙酸的存在还可以促进混合菌藻体系对丙酸和丁酸的吸收代谢[48]。氮源对微生物自身结构的生长和酶的合成都是不可或缺的。底物浓度对微生物的培养影响很大,过高或过低都会通过使pH波动较大而产生抑制效果[36, 52]。
3.3 其它除环境因素和营养因素外,微量元素、接种量和接种比、细胞固定化等也会对光照混菌培养产生影响,如图 2c所示。
铁、镍、钼等微量元素通过参与生物酶的合成直接影响微生物代谢。在培养基内适当添加微量元素对PSB的生长代谢有明显促进作用[51, 53]。
由于微生物之间的相互作用,接种量和接种比直接影响混养体系的生长代谢,大量的研究专注于混合菌株的接种量和接种比。在净化水体的研究中,唐婷等[6]报道有人采用正交试验得出PSB接种量20%、纳豆菌接种量2%时,能使PSB活菌数在最短的时间内达到最大值。同时发现两种菌的混合比例为1∶1 (v∶v)时,混合菌剂添加量与亚硝酸盐的降解作用成正相关。罗勇胜等[22]采用响应曲面得出PSB和芽孢杆菌的最佳配比用量为1.74×104 CFU/ml和6.2×104 CFU/ml。在混养体系产氢的应用中,调整两种混合培养菌株的接种比,可以影响VFA的产生速率和消耗速率[25, 28, 38]。过度的VFA积累会造成pH快速下降,增加维持pH的成本。为了避免VFA的过度积累,合适的菌株配比非常重要。
细胞固定化的方式使微生物的生长环境更加稳定[54],在产氢和处理养殖废水当中使用较多[3]。
在光照混菌培养的研究中,最关注的影响因素是接种量、接种比和pH。接种量和接种比作为实验研究的基础,对以后的研究有决定性作用,一般通过不同梯度对比来确定。pH是光合细菌培养最重要的环境因素之一,更是混合培养过程中最难控制的因素,pH控制得好坏直接影响应用效果。
4 结论光合细菌与其他微生物混合培养体系中,菌株之间的相互协同共生作用能促进微生物的生长繁殖,光合细菌的光能代谢过程可以将纯培养中单一的反应进行彻底,进一步提高产率。光照混菌培养工艺简单、成本较低,在水体净化、生物制氢、高价值物质生产等方面的应用具有相当好的效果。对混合培养影响最大的因素是菌株接种量、接种比和培养基pH,对这些条件调整控制得好坏直接影响最终的应用效果。但该体系目前仍存在一些问题:对大多数菌株间的相互作用机制的研究尚不够深入,无法从原理层面进行菌株的筛选和组合;多数的研究仍处于小试阶段,为实现工业生产,应当扩大研究规模;实际废水作为培养基使用较少,从绿色环保的角度看,应当重视对实际废水作为底物的研究,尽量实现污染物资源化。
| [1] | 卢海凤, 张光明, 赵微. 光合细菌污水资源化技术. 北京: 中国建筑工业出版社, 2014 : 1 -12. Lu H F, Zhang G M, Zhao W. Photosynthetic Bacteria Wastewater Treatment Technology. Beijing: China Building Industry Press, 2014 : 1 -12. |
| [2] | 马楠, 刘华波, 王辉. 应用于废水处理的光合细菌混合培养条件的优化. 安徽农业科学 , 2011, 39 (15) : 9151–9153. Ma N, Liu H B, Wang H. Optimization of cultural conditions for mixed photosynthetic bacteria used for wastewater treatment. Journal of Anhui Agri Sci , 2011, 39 (15) : 9151–9153. |
| [3] | 文娅, 赵国柱, 周传斌, 等. 生态工程领域微生物菌剂研究进展. 生态学报 , 2011, 31 (20) : 6287–6294. Wen Y, Zhao G Z, Zhou C B, et al. Research progress of microbial agents in ecological engineering. Acta Ecologica Sinica , 2011, 31 (20) : 6287–6294. |
| [4] | 李春笋, 郭顺星. 微生物混合发酵的研究及应用. 微生物学通报 , 2004, 31 (3) : 156–161. Li C S, Guo S X. Studies and applications on microbial mixed fermentation. Microbiology China , 2004, 31 (3) : 156–161. |
| [5] | 王冰, 周集体, 杨宝灵, 等. 光合细菌-藻类共固定深度净化污水的研究. 大连民族学院学报 , 2014, 16 (3) : 249–252. Wang B, Zhou J T, Yang B L, et al. Deep treatment of wastewater by co-immobilized photosynthetic bacteria and algae. Journal of Dalian Nationalities University , 2014, 16 (3) : 249–252. |
| [6] | 唐婷, 陈济琛, 田燕丹, 等. 光合细菌与纳豆菌的混合培养及混合处理养殖水的研究. 福建农业学报 , 2015, 30 (4) : 367–372. Tang T, Chen J S, Tian Y D, et al. Study on the mixed culture of photosynthetic bacteria with Balillus natto and its effects on aquaculture water. Fujian Journal of Agriculture Sciences , 2015, 30 (4) : 367–372. |
| [7] | Asada Y, Tokumoto M, Aihara Y, et al. Hydrogen production by co-cultures of Lactobacillus and a photosynthetic bacterium, Rhodobacter sphaeroides RV. International Journal of Hydrogen Energy , 2006, 31 (11) : 1509–1513. DOI:10.1016/j.ijhydene.2006.06.017 |
| [8] | Argun H, Kargi F, Kapdan I K. Hydrogen production by combined dark and light fermentation of ground wheat solution. International Journal of Hydrogen Energy , 2009, 34 (10) : 4305–4311. DOI:10.1016/j.ijhydene.2009.03.033 |
| [9] | 徐德阳, 王莉莉, 杜春梅. 微生物共培养技术的研究进展. 微生物学报 , 2015, 55 (9) : 1089–1096. Xu D Y, Wang L L, Du C M. Progress in microbial co-culture—— A review. Acta Microbiologica Sinica , 2015, 55 (9) : 1089–1096. |
| [10] | Liu S, Zhang G, Li X, et al. Enhancement of Rhodobacter sphaeroides growth and carotenoid production through biostimulation. Journal of Environmental Sciences , 2015, 33 : 21–28. DOI:10.1016/j.jes.2015.01.005 |
| [11] | 何义进.微生态制剂降解养殖水体氨氮及亚硝酸盐的研究.南京:南京农业大学, 2007. He Y J. Study on ammonia and nitrite reducing in the pond using microorganism. Nanjing:Nanjing Agriculture University, 2007. http://cdmd.cnki.com.cn/article/cdmd-10307-2008197449.htm |
| [12] | Ozmihci S, Kargi F. Effects of starch loading rate on performance of combined fed-batch fermentation of ground wheat for bio-hydrogen production. International Journal of Hydrogen Energy , 2010, 35 (3) : 1106–1111. DOI:10.1016/j.ijhydene.2009.11.048 |
| [13] | 姜海明, 杨腾腾, 冯磊, 等. 芽孢杆菌与光合细菌对乌鳢养殖水的净化作用研究. 湖北农业科学 , 2010, 49 (6) : 1428–1430. Jiang H M, Yang T T, Feng L, et al. The purification of Bacillus subtilis and photosynthetic bacteria on cultured snakehead water. Hubei Agricultural Sciences , 2010, 49 (6) : 1428–1430. |
| [14] | 王玮, 陈军, 刘晃, 等. 中国水产养殖水体净化技术的发展概况. 上海海洋大学学报 , 2010, 19 (1) : 41–49. Wang W, Chen J, Liu H, et al. The overview of aquaculture water purification technology in China. Journal of Shanghai Ocean University , 2010, 19 (1) : 41–49. |
| [15] | 黄雪娇, 杨冲, 罗雅雪, 等. 光合细菌在水污染治理中的研究进展. 中国生物工程杂志 , 2014, 34 (11) : 119–124. Huang X J, Yang C, Luo Y X, et al. Research progress of photosynthetic bacteria in water pollution goverance. China Biotechnology , 2014, 34 (11) : 119–124. |
| [16] | 刘芳, 王敏, 杨慧, 等. 净化养殖水体紫色非硫光合细菌的筛选与鉴定. 中国生物工程杂志 , 2008, 28 (8) : 91–95. Liu F, Wang M, Yang H, et al. Screening and identification of purple non-sulfur photosynthetic bacteria purifying aquaculture water. China Biotechnology , 2008, 28 (8) : 91–95. |
| [17] | 李君华, 刘佳亮, 曹学彬, 等. 芽孢杆菌与光合细菌协同作用对养殖刺参的影响. 渔业现代化 , 2013, 40 (1) : 7–12. Li J H, Liu J L, Cao X B, et al. Effects of Bacillus subtilis and photosynthetic bacteria on cultured sea cucumber Apstichopus japonicas. Fishery Modernization , 2013, 40 (1) : 7–12. |
| [18] | 朱建新, 曲克明, 刘慧, 等. 小球藻和光合细菌在大菱鲆育苗中对水质调节作用的研究. 海洋水产研究 , 2008, 29 (6) : 116–121. Zhu J X, Qu K M, Liu H, et al. Study on Chlorella pyrenoidosa and photosynthetic bacteria as water quality modulator in turbot larvae culture. Marine Fisheries Research , 2008, 29 (6) : 116–121. |
| [19] | Jin L Y, Zhang G M, Tian H F. Current state of sewage treatment in China. Water Research , 2014, 66 : 85–98. DOI:10.1016/j.watres.2014.08.014 |
| [20] | 邹文娟, 许晓慧, 王国武, 等. 光合细菌和枯草芽孢杆菌在污水处理中的应用. 广东农业科学 , 2010, 37 (9) : 199–201. Zou W J, Xu X H, Wang G W, et al. Application in sewage treatment of Photosynthetic bacteria and Bacillus subtillus. Guangdong Agricultural Scienses , 2010, 37 (9) : 199–201. |
| [21] | 于振海, 郑玉珍, 卢红, 等. 光合细菌和枯草芽孢杆菌对养殖水质的净化作用. 淡水渔业 , 2015, 45 (3) : 109–112. Yu Z H, Zheng Y Z, Lu H, et al. Purification effect of photosynthetic bacteria and Bacillus subtilis on aquaculture water qualitys. Freshwater Fisheries , 2015, 45 (3) : 109–112. |
| [22] | 罗勇胜, 李卓佳, 杨莺莺, 等. 光合细菌与芽孢杆菌协同净化养殖水体的研究. 农业环境科学学报 , 2006, 25 (S1) : 206–210. Luo Y S, Li Z J, Yang Y Y, et al. Synergism of photo-synthetic bacteria (PSB) and Bacillus sp. in purification of wastewater from aquatic farm. Journal of Agro-Environment Science , 2006, 25 (S1) : 206–210. |
| [23] | Laocharoen S, Reungsang A, Plangklang P. . bulgaricus TISTR 895 to enhance bio-hydrogen production of Rhodobacter sphaeroides KKU-PS5. Biotechnology for Biofuels , 2015, 8 (1) : 1. DOI:10.1186/s13068-014-0179-6 |
| [24] | Argun H, Kargi F. Bio-hydrogen production by different operational modes of dark and photo-fermentation:an overview. International Journal of Hydrogen Energy , 2011, 36 (13) : 7443–7459. DOI:10.1016/j.ijhydene.2011.03.116 |
| [25] | Liu B F, Ren N Q, Tang J, et al. Bio-hydrogen production by mixed culture of photo-and dark-fermentation bacteria. International Journal of Hydrogen Energy , 2010, 35 (7) : 2858–2862. DOI:10.1016/j.ijhydene.2009.05.005 |
| [26] | Xie G J, Feng L B, Ren N Q, et al. Control strategies for hydrogen production through co-culture of Ethanoligenens harbinense B49 and immobilized Rhodopseudomonas faecalis RLD-53. International Journal of Hydrogen Energy , 2010, 35 (5) : 1929–1935. DOI:10.1016/j.ijhydene.2009.12.138 |
| [27] | Ding J, Liu B F, Ren N Q, et al. Hydrogen production from glucose by co-culture of Clostridium butyricum and immobilized Rhodopseudomonas faecalis RLD-53. International Journal of Hydrogen Energy , 2009, 34 (9) : 3647–3652. DOI:10.1016/j.ijhydene.2009.02.078 |
| [28] | Fang H H, Zhu H, Zhang T. Phototrophic hydrogen production from glucose by pure and co-cultures of Clostridium butyricum and Rhodobacter sphaeroides. International Journal of Hydrogen Energy , 2006, 31 (15) : 2223–2230. DOI:10.1016/j.ijhydene.2006.03.005 |
| [29] | Laurinavichene T, Tsygankov A. Hydrogen photoproduction by co-culture Clostridium butyricum and Rhodobacter sphaeroides. International Journal of Hydrogen Energy , 2015, 40 (41) : 14116–14123. DOI:10.1016/j.ijhydene.2015.08.086 |
| [30] | Lee J Y, Lee E J. Effects of pH and carbon sources on biohydrogen production by co-culture of Clostridium butyricum and Rhodobacter sphaeroides. Journal of Microbiology and Biotechnology , 2012, 22 (3) : 400–406. DOI:10.4014/jmb |
| [31] | Zagrodnik R, Laniecki M. The role of pH control on biohydrogen production by single stage hybrid dark-and photo-fermentation. Bioresource Technology , 2015, 194 : 187–195. DOI:10.1016/j.biortech.2015.07.028 |
| [32] | Laurinavichene T, Tsygankov A. Hydrogen photoproduction by co-culture Clostridium butyricum and Rhodobacter sphaeroides. International Journal of Hydrogen Energy , 2015, 40 (41) : 14116–14123. DOI:10.1016/j.ijhydene.2015.08.086 |
| [33] | Sun Q, Xiao W, Xi D, et al. Statistical optimization of biohydrogen production from sucrose by a co-culture of Clostridium acidisoli and Rhodobacter sphaeroides. International Journal of Hydrogen Energy , 2010, 35 (9) : 4076–4084. DOI:10.1016/j.ijhydene.2010.01.145 |
| [34] | Ozmihci S, Kargi F. Comparison of different mixed cultures for bio-hydrogen production from ground wheat starch by combined dark and light fermentation. Journal of Industrial Microbiology & Biotechnology , 2010, 37 (4) : 341–347. |
| [35] | Argun H, Kargi F. Effects of light source, intensity and lighting regime on bio-hydrogen production from ground wheat starch by combined dark and photo-fermentations. International Journal of Hydrogen Energy , 2010, 35 (4) : 1604–1612. DOI:10.1016/j.ijhydene.2009.12.033 |
| [36] | Argun H, Kargi F, Kapdan I K. Effects of the substrate and cell concentration on bio-hydrogen production from ground wheat by combined dark and photo-fermentation. International Journal of Hydrogen Energy , 2009, 34 (15) : 6181–6188. DOI:10.1016/j.ijhydene.2009.05.130 |
| [37] | Yokoi H, Mori S, Hirose J, et al. H2 production from starch by a mixed culture of Clostridium butyricum and Rhodobacter sp. M-19. Biotechnology Letters , 1998, 20 (9) : 895–899. DOI:10.1023/A:1005327912678 |
| [38] | Kargi F, Ozmihci S. Effects of dark/light bacteria ratio on bio-hydrogen production by combined fed-batch fermentation of ground wheat starch. Biomass and Bioenergy , 2010, 34 (6) : 869–874. DOI:10.1016/j.biombioe.2010.01.031 |
| [39] | Argun H, Kargi F. Bio-hydrogen production from ground wheat starch by continuous combined fermentation using annular-hybrid bioreactor. International Journal of Hydrogen Energy , 2010, 35 (12) : 6170–6178. DOI:10.1016/j.ijhydene.2010.03.132 |
| [40] | Sagnak R, Kargi F. Hydrogen gas production from acid hydrolyzed wheat starch by combined dark and photo-fermentation with periodic feeding. International Journal of Hydrogen Energy , 2011, 36 (17) : 10683–10689. DOI:10.1016/j.ijhydene.2011.05.167 |
| [41] | Laurinavichene T V, Laurinavichius K S, Tsygankov A A. Integration of purple non-sulfur bacteria into the starch-hydrolyzing consortium. International Journal of Hydrogen Energy , 2014, 39 (15) : 7713–7720. DOI:10.1016/j.ijhydene.2014.03.088 |
| [42] | Morsy F M. CO2-free biohydrogen production by mixed dark and photofermentation bacteria from sorghum starch using a modified simple purification and collection system. Energy , 2015, 87 : 594–604. DOI:10.1016/j.energy.2015.05.044 |
| [43] | Lu H, Lee P K. Effects of cellulose concentrations on the syntrophic interactions between Clostridium cellulovorans 743B and Rhodopseudomonas palustris CGA009 in coculture fermentation for biohydrogen production. International Journal of Hydrogen Energy , 2015, 40 (35) : 11800–11808. DOI:10.1016/j.ijhydene.2015.05.135 |
| [44] | Sargsyan H, Trchounian K, Gabrielyan L, et al. Novel approach of ethanol waste utilization:Biohydrogen production by mixed cultures of dark-and photo-fermentative bacteria using distillers grains. International Journal of Hydrogen Energy , 2016, 41 (4) : 2377–2382. DOI:10.1016/j.ijhydene.2015.11.082 |
| [45] | Chandra R, Nikhil G N, Mohan S V. Single-stage operation of hybrid dark-photo fermentation to enhance biohydrogen production through regulation of system redox condition:Evaluation with real-field wastewater. International Journal of Molecular Sciences , 2015, 16 (5) : 9540–9556. DOI:10.3390/ijms16059540 |
| [46] | 郭子瑞, 黄龙, 陈志强, 等. 活性污泥合成聚羟基脂肪酸酯工艺过程研究进展. 哈尔滨工业大学学报 , 2016, 48 (2) : 1–8. Guo Z R, Huang L, Chen Z Q, et al. Advances in polyhydroxyalkanoates synthesis by activated sludge. Journal of Harbin Institute of Technology , 2016, 48 (2) : 1–8. |
| [47] | Fradinho J C, Domingos J M, Carvalho G, et al. Polyhydroxyalkanoates production by a mixed photosynthetic consortium of bacteria and algae. Bioresource Technology , 2013, 132 : 146–153. DOI:10.1016/j.biortech.2013.01.050 |
| [48] | Fradinho J C, Oehmen A, Reis M A. Effect of dark/light periods on the polyhydroxyalkanoate production of a photosynthetic mixed culture. Bioresource Technology , 2013, 148 : 474–479. DOI:10.1016/j.biortech.2013.09.010 |
| [49] | Serafim L S, Lemos P C, Oliveira R, et al. Optimization of polyhydroxybutyrate production by mixed cultures submitted to aerobic dynamic feeding condition. Biotechnology and Bioengineering , 2004, 87 (2) : 145–160. DOI:10.1002/(ISSN)1097-0290 |
| [50] | Fradinho J C, Oehmen A, Reis M A. Photosynthetic mixed culture polyhydroxyalkanoate (PHA) production from individual and mixed volatile fatty acids (VFAs):Substrate preferences and co-substrate uptake. Journal of Biotechnology , 2014, 185 : 19–27. DOI:10.1016/j.jbiotec.2014.05.035 |
| [51] | 赵微, 张光明. 光合细菌处理废水过程中生物产氢技术研究进展. 中国生物工程杂志 , 2012, 32 (12) : 130–135. Zhao W, Zhang G M. Progress of biological hydrogen production in photosynthetic bacteria wastewater treatment. China Biotechnology , 2012, 32 (12) : 130–135. |
| [52] | 廖强, 王永忠, 朱恂, 等. 初始底物浓度对序批式培养光合细菌产氢动力学影响. 中国生物工程杂志 , 2007, 27 (11) : 51–56. Liao Q, Wang Y Z, Zhu X, et al. Effect of initial substrate concentration on kinetics of hydrogen production by photosynthetic bacteria in batch culture. China Biotecnology , 2007, 27 (11) : 51–56. |
| [53] | 赵微, 张光明. 微量元素对废水中光合细菌生长的影响. 哈尔滨工业大学学报 , 2012, 44 (2) : 52–55. Zhao W, Zhang G M. Effects of trace elements on photosynthetic bacteria growth in wastewater. Journal of Harbin Institute of Technology , 2012, 44 (2) : 52–55. |
| [54] | 李扬, 李茹莹, 季民. 固定化技术在促进光合细菌产氢中的应用. 中国生物工程杂志 , 2014, 34 (7) : 96–101. Li Y, Li R Y, Ji M. Application of immobilization technology on enhancing hydrogen production by photosynthetic bacteria. China Biotechnology , 2014, 34 (7) : 96–101. |
 2016, Vol. 36
2016, Vol. 36




