文章信息
- 陈冰, 孔令姣, 雷金霞, 沈露, 张彩, 王金华.
- CHEN Bing, KONG Ling-jiao, LEI Jin-xia, SHEN Lu, ZHANG Cai, WANG Jin-hua.
- BMP9经Smad信号通路调控iSCAP成骨/成牙本质分化
- BMP9 Induces Osteogenic/odontogenic Differentiation of ISCAP through the Smad Pathway
- 中国生物工程杂志, 2016, 36(8): 16-22
- CHINA BIOTECHNOLOGY, 2016, 36(8): 16-22
- http://dx.doi.org/DOI:10.13523/j.cb.20160803
-
文章历史
- 收稿日期: 2016-04-26
- 修回日期: 2016-05-26
年轻恒牙牙外伤常导致牙根发育不足,或因炎症引起牙齿松动,而牙周炎作为一种广泛存在的牙科疾病亦可导致牙槽骨吸收而引起牙齿松动脱落,这些都严重影响到人们的生活质量[1-2]。如何通过组织再生工程解决骨重建和牙根再发育问题是近年来的研究热点之一[3]。
牙体组织来源的间充质干细胞有牙髓干细胞、牙周膜干细胞、牙囊干细胞、脱落乳牙干细胞、牙乳头干细胞等[4]。根尖区组织的牙乳头干细胞(stem cells from the apical papilla,iSCAP)可以从牙胚或年轻恒牙的根尖牙髓与牙乳头之间的干细胞富集区获得,因牙乳头来源于外胚层组织,所以iSCAP不仅具有间充质干细胞的特点,如自我克隆能力强、增殖能力强、多向分化能力,而且在牙本质形成和牙根再生方面的作用可能优于同类牙体组织来源干细胞[5-6]。间充质干细胞的分化和克隆依赖于细胞因子和信号通路的共同作用,寻求有效的生长因子,诱导iSCAP细胞成骨/成牙本质向分化,促进牙根再发育和骨组织修复重建是研究重点和难点。
骨形态发生蛋白(bone morphogenetic protein,BMP)作用广泛,不仅促进干细胞多向分化,而且在胚胎发育各方面如骨骼、血管、神经形成方面均发挥重要功能。而作为BMPs中成骨诱导能力最强的因子,BMP9是否同样具有较强的成牙本质能力,课题组前期对此问题作了初步研究,体内外实验结果证明BMP9可以有效地促进根尖牙乳头干细胞成骨/成牙本质向分化,诱导矿化基质形成,在体内可以形成大量异位牙本质样结构[7]。这表明BMP9可作为促进牙根再生和骨重建工程中的成骨/成牙本质向分化的重要细胞因子,具有相当大的研究价值。然而,关于BMP9介导iSCAP成骨/成牙本质分化的具体机制目前还不清楚。
BMP有Ⅰ型和Ⅱ型两种跨膜受体,受体的胞内结构区段具有激酶活性,可以使下游相关Smads蛋白磷酸化。而胞内结构区段缺失的BMPⅠ型受体只能与配体结合,却无法使Smads蛋白磷酸化,从而不能激发进一步信号转导,这样的受体称为显性负性突变型受体(dominant negative receptor,dn-receptor)。文献报道,利用显性负性突变技术得到的受体dnALK1、dnALK2,经腺病毒包装后作用于间充质干细胞,可以抑制BMP9诱导的成骨分化和体内异位成骨[8-9]。因此,本课题首先希望证实BMP9-Smad信号转导通路是否在BMP9诱导iSCAP细胞成骨/成牙本质分化过程中存在,再利用dnALK1受体竞争性结合BMP9蛋白而抑制BMP9活性,观察其对BMP9诱导iSCAP细胞成骨/成牙本质分化的影响,检测BMP-Smad信号通路中Smad1/5/8蛋白、Runt相关转录因子2(Runx2)和下游靶基因的变化,探索BMP9-Smad信号转导通路在BMP9诱导iSCAP细胞成骨/成牙本质分化中的作用。
1 材料与方法 1.1 材料小鼠永生化根尖牙乳头干细胞iSCAP、HEK293细胞均由美国芝加哥大学医学中心分子和肿瘤实验室何通川教授惠赠,HCT116细胞由重庆医科大学大学检验医学院罗进勇教授惠赠,HEK293细胞由本室保存。BMP9的腺病毒(Ad-BMP9)、对照腺病毒(Ad-GFP)由本室保存,显性负性突变体dnALK1(Ad-dnALK1)和对照腺病毒(Ad-RFP)均由重庆医科大学大学检验医学院罗进勇教授惠赠。DMEM培养基和胎牛血清(Gibco公司),磷酸化Smad1/5/8一抗(CellSignaling公司),总的Smad1/5/8一抗和OPN、OCN一抗(Santa Cruz公司),ALP染色和定量检测试剂盒(上海碧云天公司),茜素红S染色液(北京索莱宝公司),RNA提取试剂盒、PCR反转录试剂盒、PCR荧光定量试剂盒均为TaKaRa公司产品。
1.2 方法 1.2.1 条件培养基的制备将HCT116细胞复苏接种于直径为10cm的无菌培养皿中,经传代培养两次,待细胞生长至一定密度后,同时加入polybreen和Ad-BMP9病毒,待病毒感染HCT116细胞4~6h后,换为双无培养基(不含血清和青霉素-链霉素),24h后镜下观察荧光,若感染效率在70%~80%时表明可收取浓度较高的BMP9条件培养基。24 h和48 h分别吸取培养基,离心后留取上清,即为BMP9条件培养基,它可在4℃存放一到两周,80℃存放一月。
1.2.2 Western blot将iSCAP细胞接种到100cm培养皿中, 大约2~3h后细胞贴壁,随后加入处理因素,提取目的蛋白,测量样品蛋白浓度后,按比例加入SDS-PAGE上样缓冲液(5X)处理,随后转膜、封闭,孵育一抗二抗后进行显影,保存图像。
1.2.3 iSCAP细胞ALP活性定量检测与染色将iSCAP细胞接种到24孔板中, 细胞密度大约为30%~40%。2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染iSCAP细胞36h后,加入适量BMP9条件培养基后,于第7天进行ALP活性定量检测和染色(按试剂盒说明书步骤操作)。
1.2.4 茜素红染色将iSCAP细胞接种到24孔板中, 细胞密度大约为30%~40%。2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染细胞36h后,加入适量BMP9条件培养基后,继续培养14天进行茜素红染色。具体步骤如下:去除旧培养基,用PBS将细胞表面的培养基清洗干净,并吸弃残余液体;每孔加入4%多聚甲醛200μl, 将细胞固定20min;PBS清洗细胞后,每孔加入0.4%茜素红溶液300μl,需浸没细胞表面,静置10min;用PBS洗尽细胞表面残余染液, 显微镜下采集各组细胞染色后图像,再用扫描仪记录24孔板染色状况。
1.2.5 RT-PCR将iSCAP细胞接种到24孔板中, 细胞密度大约为30%~40%。2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染iSCAP细胞36h后,加入适量BMP9条件培养基后,于第3天、第5天、第7天提取目的细胞RNA,经反转录获得cDNA后进行RT-PCR。所用引物序列见表 1。
| 基因 | 引物序列5′~3′ |
| GAPDH | 上游引物GGCTGCCCAGAACATCAT |
| 下游引物CGGACACATTGGGGGTAG | |
| Runx2 | 上游引物GGTGAAACTCTTGCCTCGTC |
| 下游引物AGTCCCAACTTCCTGTGCT | |
| OPN | 上游引物CACTCCAATCGTCCCTACAGT |
| 下游引物CTGGAAACTCCTAGACTTTGACC | |
| OCN | 上游引物CTGACCTCACAGATCCCAAGC |
| 下游引物TGGTCTGATAGCTCGTCACAAG | |
| DMP1 | 上游引物CTGAAGAGAGGACGGGTGATT |
| 下游引物CGTGTGGTCACTATTTGCCTG |
1.2.6 统计分析
数据均用SSPS17.0软件包分析处理,组间比较使用单因素方差分析,两组间比较使用t检验,均有统计学意义。
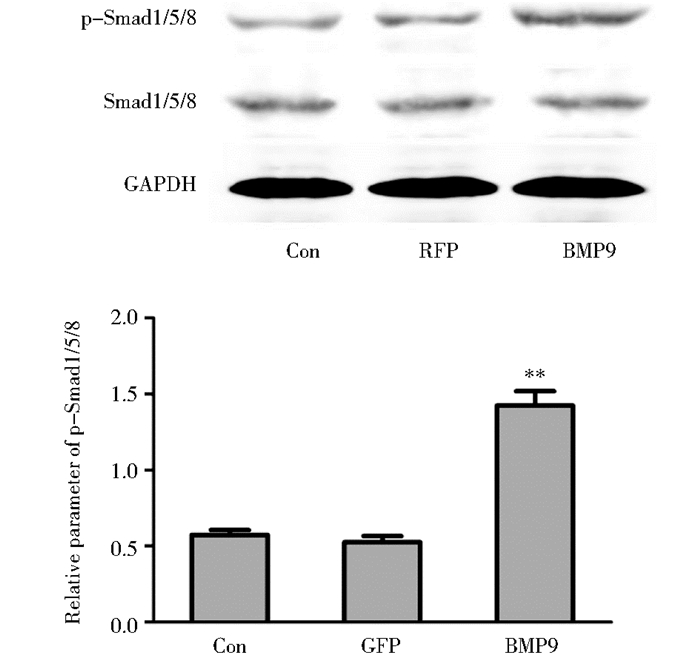
2 结果 2.1 BMP9可激活iSCAP细胞中的Smad信号通路课题前期已通过细胞实验和动物实验证实BMP9可诱导iSCAP细胞成骨/成牙本质分化,本实验为了确认Smad信号通路在BMP9诱导iSCAP细胞分化过程中存在,分别利用Ad-BMP9重组腺病毒和Ad-GFP重组腺病毒感染iSCAP细胞36h,分别提取目的蛋白,经Western免疫印迹检测发现,三组的Smad1/5/8的总蛋白表达水平基本相同,但BMP9组的磷酸化Smad1/5/8(p-Smad1/5/8)蛋白表达水平相对于其余两组明显增加(图 1),提示BMP9可使iSCAP细胞中的Smad1/5/8磷酸化水平升高,激活iSCAP细胞中Smad信号通路。
|
| 图 1 Western检测各组磷酸化Smad1/5/8蛋白的表达 Figure 1 Western blot analysis result of phosphorylation of Smad1/5/8 Con:Control; ** P < 0.01 compare BMP9 group with GFPgroup |
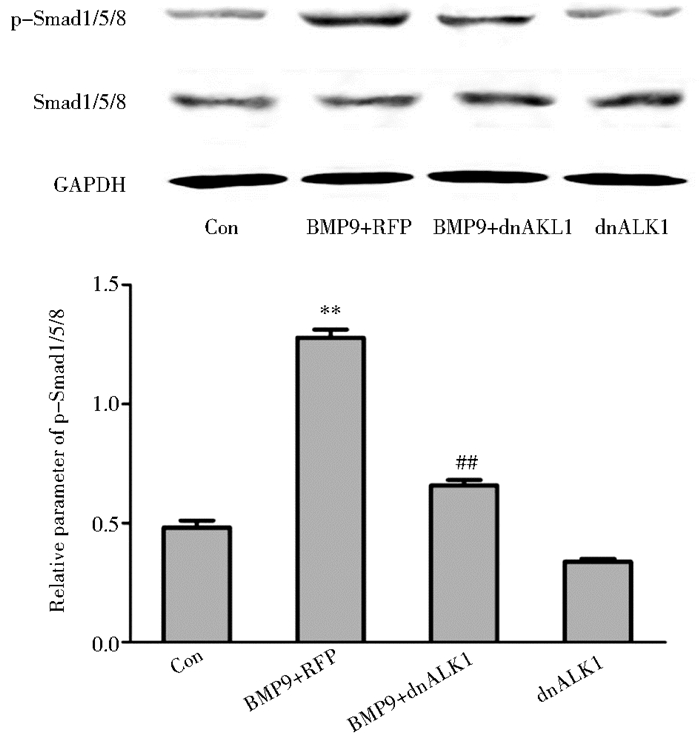
为了进一步证实Smad信号通路在BMP9诱导的细胞成骨/成牙本质分化中的作用,将iSCAP细胞接种到直径10cm培养皿中, 细胞密度大约为30%~40%。2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染细胞36h后,加入适量含BMP9条件培养基,作用30min后提取各组细胞总蛋白和磷酸化蛋白,经Western免疫印迹发现组间磷酸化Smad1/5/8蛋白(p-Smad1/5/8)表达差异明显,其中BMP9+dnALK1组的p-Smad1/5/8含量明显低于BMP9+RFP组,但高于对照组和单独dnALK1组,而各组Smad1/5/8总蛋白水平不变(图 2),结果显示dnALK1有效并明显降低了BMP9诱导的磷酸化Smad1/5/8的表达,但不影响Smad1/5/8总蛋白的表达。
|
| 图 2 Western检测各组磷酸化Smad1/5/8蛋白的表达 Figure 2 Western blot analysis result of BMP9-induced phosphorylation of Smad1/5/8 Con:Control; ** P < 0.01 vs. BMP9+dnALK1 group:## P < 0.01 vs. dnALK1 only group |
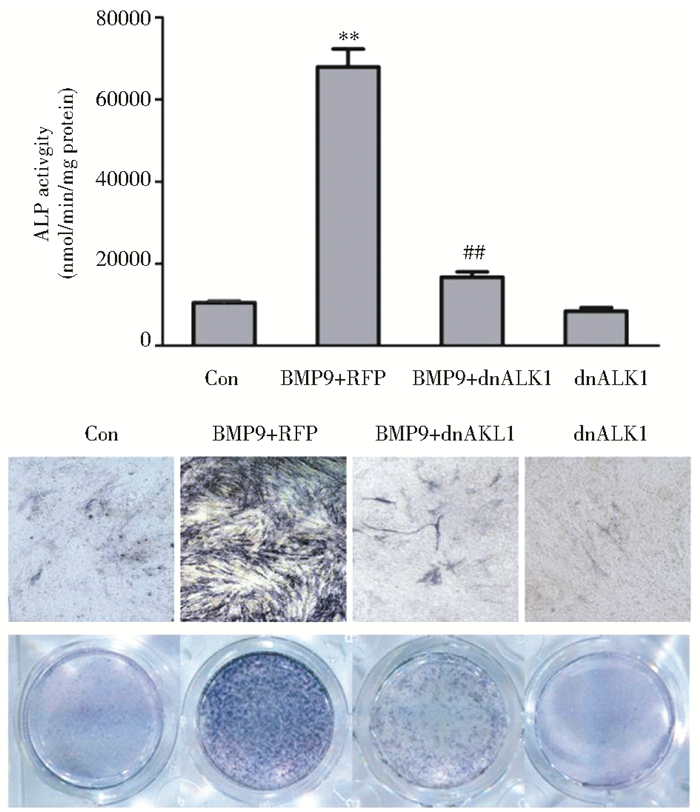
将iSCAP细胞接种到24孔细胞培养板中,2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染细胞36h后,加入适量BMP9培养基,继续培养,于第7天进行ALP定量测定和染色,发现BMP9+ dnALK1组的ALP活性与BMP9+RFP组相比明显降低,提示dnALK1可竞争性结合BMP9蛋白从而抑制BMP9诱导的iSCAP早期成骨/成牙本质分化(图 3)。
|
| 图 3 ALP活性检测与染色 Figure 3 ALP activity detected by quantitative assay and histochemical staining at day 7 Con:Control; ** P < 0.01 vs. BMP9+dnALK1 group; ## P < 0.01 vs. dnALK1 only group |
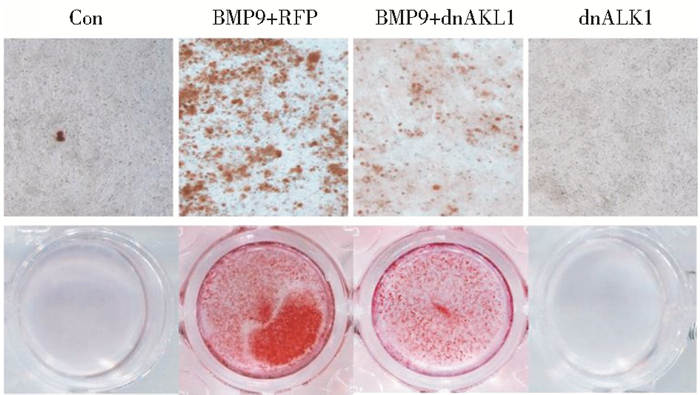
将iSCAP细胞接种到24孔细胞培养板中, 2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染细胞36h后,加入适量BMP9培养基,继续培养14天(在培养后期因细胞密度过大,应随时注意观察,补液时应轻柔加入低血清培养基)进行茜素红染色,结果发现BMP9+RFP组形成的的钙盐沉积颗粒明显少于BMP9+dnALK1组,提示dnALK1可竞争性结合BMP9蛋白,从而抑制BMP9诱导iSCAP细胞晚期成骨/成牙本质分化(图 4)。
|
| 图 4 茜素红染色 Figure 4 Calcium deposition were determined by Alizarin Red S staining assay at day 14 |
将iSCAP细胞接种到直径10cm培养皿中, 2~3h后细胞贴壁,随后分别加入polybreen、重组腺病毒Ad-dnALK1和重组腺病毒Ad-RFP,连续感染细胞36h后,加入适量BMP9培养基,继续培养,于3天、5天和7天后提取细胞RNA,通过RT-PCR检测相关基因的表达,结果发现BMP9+dnALK1组中的成骨重要转录因子Runx2和成骨/成牙本质相关基因OPN、OCN、DMP1的表达明显低于BMP9+RFP组,提示dnALK1可抑制BMP9诱导的成骨/成牙本质相关基因表达。BMP9+RFP组的相关基因表达趋势也与前期结果一致,说明与Ad-BMP9腺病毒作用于iSCAP细胞方式相比,BMP9条件培养基直接作用于iSCAP细胞的效果也很明显(图 5)。
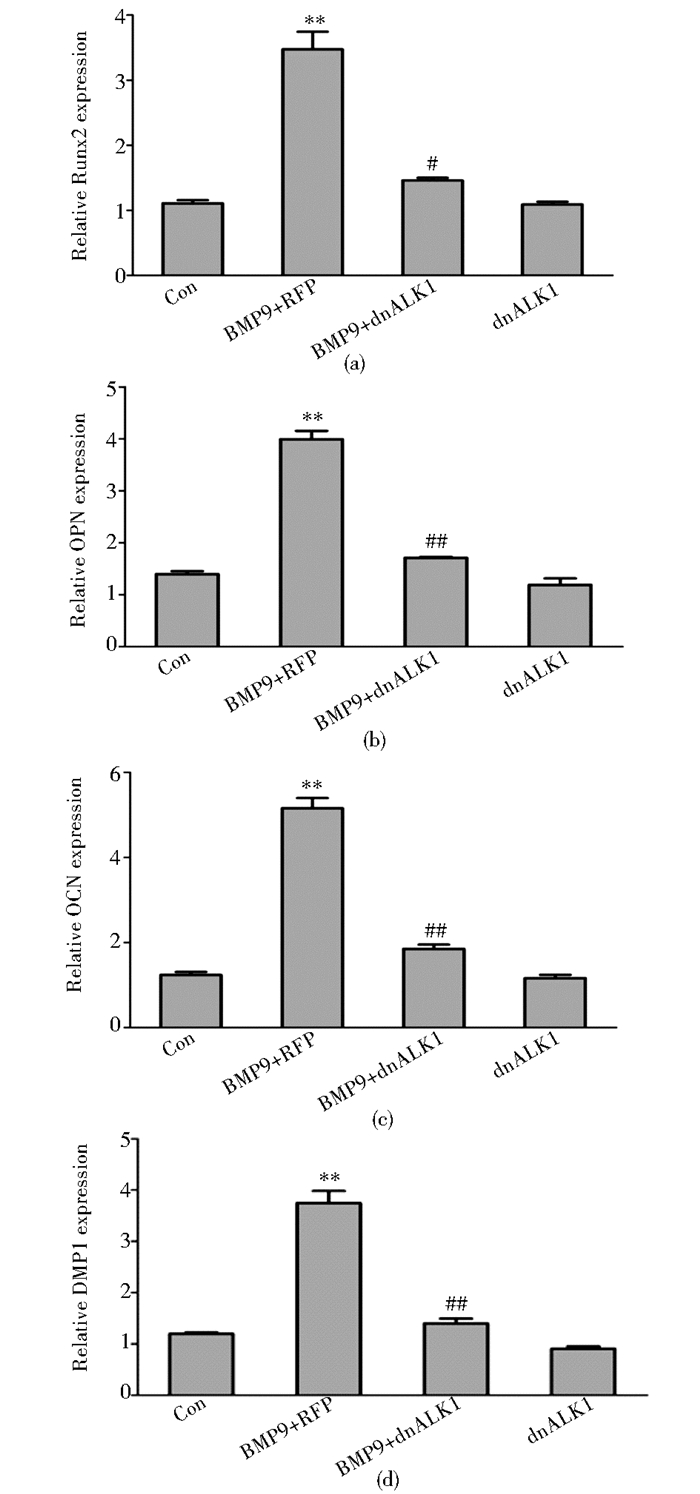
|
| 图 5 RT-PCR检测Runx2, OPN, OCN, DMP1 mRNA的表达 Figure 5 Expression of target gene Runx2, OPN, OCN, DMP1 osteogenesis/odontogenesis related genes was analyzed with RT-PCR at day 7 (a) Runx2 mRNA (b) OPN mRNA (c) OCN mRNA (d) DMP1 mRNA *P < 0.05 ** P < 0.01 vs. BMP9+dnALK1 group; # P < 0.05 ## P < 0.01 vs. dnALK1 only group |
牙根再发育和骨组织修复重建中,具有多向分化潜能和自我更新能力的根尖牙乳头干细胞可作为种子细胞之一,那么寻求有效的生长因子,诱导SCAP细胞成骨/成牙本质向分化是研究重点和难点[5-6]。课题组前期实验结果证明BMP9可以有效地促进根尖牙乳头干细胞成骨/成牙本质向分化[7]。然而,关于BMP9介导牙源性干细胞iSCAP成骨/成牙本质分化的具体机制目前还不清楚。Smad信号通路是BMP诱导间充质干细胞的经典信号通路之一,在BMPs调控信号通路发挥生物学功能过程中,BMPⅠ型受体起着重要的门户作用,其胞内段具有激酶活性,可以激活胞内相关因子,如受体调节型蛋白R-Smad(Smad1、2、3、5、8),磷酸化的R-Smad与共同结合型蛋白Co-Smad发生相互作用形成复合物,随后异位到核内与相关转录因子结合,共同调控相关下游靶基因表达,抑制型Smad蛋白I-Smad(Smad6、7)则从负反馈水平调节Smad信号通路[8, 10]。有文献报道,ALK1,ALK2,ALK5,endoglin是BMP9的特异性Ⅰ型受体,其中,ALK1和ALK2与BMP9诱导成骨相关,而不同的细胞其膜受体种类分布水平可能有差异[9-10]。目前,对于BMP9诱导牙源性干细胞成牙本质方面的研究较少。因此,本课题选择从最经典的Smad信号通路开始,研究其对于BMP9介导iSCAP细胞成骨/成牙本质向分化的调控作用[10]。
首先,为了探讨BMP9调控iSCAP细胞的成骨/成牙本质向分化机制,本实验利用BMP9病毒感染iSCAP细胞,Western免疫印迹检测结果显示,BMP9可上调Smad1/5/8的磷酸化水平从而激活Smad信号通路,因此推测Smad信号通路可能在BMP9诱导iSCAP细胞成骨/成牙分化过程中存在。为了证实此推测,本课题利用显性负性突变受体dnALK1重组腺病毒和BMP9条件培养基共同作用于iSCAP细胞,通过Western免疫印迹实验观察dnALK1抑制BMP9作用对Smad信号通路产生的影响,结果发现p-Smad1/5/8蛋白的表达明显降低,但Smad1/5/8总蛋白没有变化,表明Smad信号通路在BMP9诱导细胞成骨/成牙本质分化过程中起着重要作用,同时提示ALK1是iSCAP细胞中BMP9诱导成骨/成牙本质的重要特异性受体之一,dnALK1在膜受体水平抑制了BMP9的作用,降低了Smad1/5/8的磷酸化水平,在一定程度上阻滞BMP9-Smad信号通路的传导。有研究表明,dnALK1可抑制C3H10细胞中BMP9靶基因-抑制型I-Smad(Smad6和Smad7)的表达,这从负反馈水平说明BMP9对Smad信号通路的调控作用[9]。此外,RT-PCR实验证实dnALK1抑制BMP9蛋白活性后,Runx2基因表达明显下降,Runx2是成骨分化过程中的重要特异性转录因子,Runx2的C末端的核基质定位信号(NMTS)可协助Smad1/5/8和Smad4的复合物与核内转录位点结合,共同调控相关基因表达和细胞分化,这表明dnALK1可以下调BMP9-Smad通路下游转录因子Runx2的表达[11]。实验结果提示,Smad信号通路在BMP9诱导iSCAP成骨/成牙本质过程中存在并发挥功能。有文献报道,BMP9既可以直接磷酸化Smad,亦可能通过MAPK间接激活Smad,因此,Smad依赖型通路和非Smad依赖型通路的交叉串话对BMP9诱导iSCAP细胞分化机制的影响,需进一步研究[12]。
随后,课题组运用dnALK1腺病毒和BMP9条件培养基共同处理iSCAP细胞,观察dnALK1对BMP9诱导iSCAP细胞成骨/成牙本质分化的影响。结果表明在dnALK1的作用下,BMP9诱导的碱性磷酸酶活性和钙盐沉积颗粒均大幅度减小,提示dnALK1可抑制BMP9诱导的iSCAP细胞早期及晚期成骨/成牙本质分化。成牙本质细胞和成骨细胞均能够在一定条件下形成硬组织,也可以表达许多成骨/成牙本质相关相同基因,如Runx2、OPN、OCN、DMP1等[13]。Runx2是间充质干细胞成骨分化的标志物,OPN、OCN是中晚期成骨重要标志物,DMP-1是形成牙本质和矿化过程中的重要非胶原基质蛋白且在骨组织和牙本质中大量表达[14-15]。RT-PCR实验证实dnALK1抑制BMP9蛋白活性后,BMP9诱导的上述成骨/成牙本质基因Runx2、OPN、OCN、DMP1表达均明显下调,说明dnALK1可以抑制BMP9诱导iSCAP细胞成骨/成牙本质向分化。
综上所述,本实验初步证实Smad信号通路在BMP9诱导iSCAP成骨/成牙本质过程中存在并发挥重要作用,这为根尖牙乳头干细胞应用于临床牙根再发育和骨再生提供了一定的基础实验依据。研究结果也证明dnALK1能有效拮抗BMP9的活性,AlK1是BMP9-Smad信号通路中的重要受体,这与相关文献报道结果一致,但dnALK1对其他交叉信号通路的影响程度还需要进一步研究[9, 16]。此外,后期还应从体内实验水平验证dnALK1对BMP9诱导iSCAP成骨/成牙本质向分化的抑制作用。随着成品化BMP9蛋白产生,BMP9将会有更广阔的临床应用前景,但其机制和生物学功能等方面还需要进一步研究和探讨。
致谢 诚挚感谢重庆医科大学口腔医学市级重点学科建设基金的资助。| [1] | Brüllmann D, Schulze R K, d'Hoedt B. The treatment of anterior dental trauma. Dtsch Arztebl Int , 2010, 108 (34-35) : 565–565. |
| [2] | Freire-Maia F B, Auad S M, Abreu M H, et al. Oral health-related quality of life and traumatic dental injuries in young permanent incisors in Brazilian schoolchildren:A multilevel approach. PLoS One , 2015, 10 (8) : e0135369–e0135369. DOI:10.1371/journal.pone.0135369 |
| [3] | Ramseier C A, Rasperini G, Batia S, et al. Advanced regenerative technologies for periodontal tissue repair. Periodontol , 2012, 59 (1) : 185–202. DOI:10.1111/prd.2012.59.issue-1 |
| [4] | Sonoyama W, Liu Y, Fang D, et al. Mesenchymal stem cell-mediated functional tooth regeneration in swine. PLoS One , 2006, 1 : e79. DOI:10.1371/journal.pone.0000079 |
| [5] | Huang G T, Sonoyama W, Liu Y, et al. The hidden treasure in apical papilla:The potential role in pulp/dentin regeneration and bioroot engineering. J Endod , 2008, 34 (6) : 645–651. DOI:10.1016/j.joen.2008.03.001 |
| [6] | Abe S, Yamaguchi S, Watanabe A, et al. Hard tissue regeneration capacity of apical pulp derived cells (APDCs) from human tooth with immature apex. Biochem Biophys Res Commun , 2008, 371 (1) : 90–93. DOI:10.1016/j.bbrc.2008.04.016 |
| [7] | Wang J, Zhang H, He T C, et al. BMP9 effectively induces osteo/odontoblastic differentiation of the reversibly immortalized stem cells of dental apical papilla (iSCAPs). Stem Cells Dev , 2014, 23 (12) : 1405–1416. DOI:10.1089/scd.2013.0580 |
| [8] | Beederman M, Lamplot J D, He T C, et al. BMP signaling in mesenchymal stem cell differentiation and bone formation. J Biomed Sci Eng , 2013, 6 (8A) : 32–52. |
| [9] | Luo J, Tang M, He T C, et al. TGF/BMP type I receptors ALK1 and ALK2 are essential for BMP9-induced osteogenic signaling in mesenchymal stem cells. J Biol Chem , 2010, 285 (38) : 29588–29598. DOI:10.1074/jbc.M110.130518 |
| [10] | Lamplot J D, Qin J, He T C, et al. BMP9 signaling in stem cell differentiation and osteogenesis. Am J Stem Cells , 2013, 2 (1) : 1–21. |
| [11] | Liu T M, Lee E H. Transcriptional regulatory cascades in runx2-dependent bone development. Tissue Engineering Part B:Reviews , 2012, 19 (3) : 254–263. |
| [12] | Zhao Y F, Xu J, Wang W J, et al. Activation of JNKs is essential for BMP9-induced osteogenic differentiation of mesenchymal stem cells. BMB Rep , 2013, 46 (8) : 422–427. DOI:10.5483/BMBRep.2013.46.8.266 |
| [13] | Fisher L W, Fedarko N S. Six genes expressed in bones and teeth encode the current members of the sibling family of proteins. Connect Tissue Res , 2003, 44 (Suppl 1) : 33–40. |
| [14] | Deshpande A S, Fang P A, Zhang X, et al. Primary structure and phosphorylation of dentin matrix protein 1(DMP1) and dentin phosphophoryn (DPP) uniquely determine their role in biomineralization. Biomacromolecules , 2011, 12 (8) : 2933–2945. DOI:10.1021/bm2005214 |
| [15] | Narayanan K, Srinivas R, Ramachandran A, et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proc Natl Acad Sci U S A , 2001, 98 (8) : 4516–4521. DOI:10.1073/pnas.081075198 |
| [16] | Chen G, Deng C, Li Y P. TGF-beta and BMP signaling in osteoblast differentiation and bone formation. Int J Biol Sci , 2012, 8 (2) : 272–288. DOI:10.7150/ijbs.2929 |
 2016, Vol. 36
2016, Vol. 36




