文章信息
- 王瑞钊, 潘才惠, 王颖, 肖文海, 元英进.
- WANG Rui-zhao, PAN Cai-hui, WANG Ying, XIAO Wen-hai, YUAN Ying-jin.
- 高产β-胡萝卜素酿酒酵母菌株的设计与构建
- Design and Construction of highβ-carotene Producing Saccharomyces cerevisiae
- 中国生物工程杂志, 2016, 36(7): 83-91
- CHINA BIOTECHNOLOGY, 2016, 36(7): 83-91
- http://dx.doi.org/DOI:10.13523/j.cb.20160712
-
文章历史
- 收稿日期: 2016-01-04
- 修回日期: 2016-03-14
2. 天津化学化工协同创新中心合成生物学平台 天津 300072
2. SynBio Research Platform, Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), School of Chemical Engineering and technology, Tianjin University, Tianjin 300072, China
酿酒酵母作为一种模式生物,被美国食品与药物管理局普遍认为是安全的(GRAS)。由于其简便的遗传可操作性、阐述清楚的生理和调控特性及成熟的大规模培养技术,在食品工业中被广泛使用[1-2]。在酿酒酵母体内引入代谢路径,需要精确地控制相关基因的拷贝数目和表达强度。大多数研究通过游离型2μ质粒提高基因的拷贝数目,或通过更换基因的启动子来改变表达强度[3]。例如,Ro等[4]利用LEU2-d营养缺陷的2μ质粒提高青蒿二烯的产量;Sun等[5]证明相同基因在不同强度启动子下的表达水平各不相同。酵母基因组Delta位点整合恰好可以同时满足以上要求。Delta位点是广泛存在于酵母基因组中的反转座子的长末端重复序列[6],有400多个[7]。传统的Delta位点整合利用酵母单交换原理,将表达基因整合到某个Delta位点,并生成多余的一个Delta位点[8-12]。而利用酵母同源组装中的双交换使整合基因插入Delta位点的内部,不再生成多余的Delta位点,从而避免了长串联序列发生重组导致整合基因拷贝数目发生变化的可能性。除此之外,由于Delta位点在酵母染色体上的位置分散广布,不同位置上插入相同基因后表达强度差异显著。Bai Flagfeldt等[13]曾验证在酵母染色体的不同位置,包括不同Delta位点上整合单一拷贝的RFP基因,红色荧光蛋白的表达强度也会有明显的差异;而更多的研究人员利用Delta位点的数量优势,选择一次性整合整个代谢路径或代谢路径中的某个基因来增加拷贝数目,以期获得代谢产物的积累[14-16]。因此,在酿酒酵母体内,Delta位点对调控相关基因的表达效果有着重要作用。
β-胡萝卜素被广泛用于食品着色、饲料添加、营养增补和医药化妆品领域,有着极其重要的研究和市场价值[17-18]。2010年,胡萝卜素相关市场价值12亿美元,并且有望在2018年达到14亿美元[19]。然而,由于β-胡萝卜素主要来自石油类物质的化学合成,出于安全考虑,近年来化学合成的β-胡萝卜素在食品添加和医用化妆品领域的应用受到很大限制[20]。因此,利用合成生物学手段在微生物体内合成β-胡萝卜素有着重要的意义和广阔的应用前景[21]。Verwaal等[22]通过在酿酒酵母基因组上整合红发夫酵母(Xanthophyllomyces dendrorhous)的GGPP合成酶基因(crtE)、八氢番茄红素去饱和酶基因(crtI)、双功能八氢番茄红素合成酶和番茄红素环化酶基因(crtYB),并增加一份crtI拷贝,过表达体内的tHMG1基因,使得β-胡萝卜素的产量达到了5.9mg/g DCW;浙江大学的于洪巍课题组[23]通过分布组装的策略,使用Gal型诱导启动子控制tHMG1、crtE、crtI和crtYB基因表达,并增加crtI与crtYB的拷贝,总的类胡萝卜素含量达到了72.57mg/L,其中β-胡萝卜素的产量达到了7.4mg/g DCW。但是在酿酒酵母体内合成β-胡萝卜素,因为受限于产物积累的代谢压力[24]、碳源供给及利用的不平衡[25]和基因之间表达强度不适配[22]等问题,导致产量并不理想。Delta位点因为其位置和数目效应,在调控基因表达强度方面体现了巨大的优势,因此利用Delta位点整合外源胡萝卜素合成基因,有望实现产量的最大化。
本文通过引入红发夫酵母的crtE、crtI和crtYB等外源基因,并过表达tHMG1和BTS1-ERG20融合蛋白,实现以酿酒酵母为底盘生产β-胡萝卜素(图 1)。为利用Delta位点的数目和位置效应,增加外源基因的拷贝数,提高β-胡萝卜素的产量,将crtE、crtI、crtYB等外源基因整合到酵母基因组的Delta位点。通过96孔细胞培养板模拟摇瓶发酵条件,快速筛选出β-胡萝卜素产量较高的菌株。Özaydin等[26]报道ypl062w的突变或敲除,会增加乙酰-CoA的表达,进而增加整个MVA途径的通量,从而提高下游目标产物的产量。因此,为进一步提高β-胡萝卜素的产量,在筛选出来的菌株中敲除酵母染色体ypl062w位点,并在此位点过表达tHMG1和BTS1-ERG20融合蛋白。最终经摇瓶发酵验证,β-胡萝卜素的产量达到162.1mg/L(21.6mg/g DCW),是目前已知的摇瓶发酵条件下工程酿酒酵母菌株β-胡萝卜素含量的最高值[22-23, 25, 27-28]。
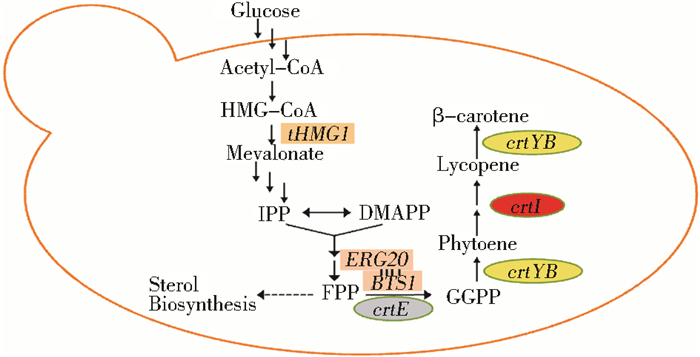
|
| 图 1 酿酒酵母体内β-胡萝卜素合成路径的构建 Figure 1 Construction ofβ-carotene biosynthesis pathway in S.cerevisiae |
大肠杆菌感受态细胞DH5α购自Biomed公司,TransStart FastPfu高保真DNA聚合酶购自TransGen公司;T4 DNA连接酶、96孔细胞培养板购自Thermo Scientific公司;限制性内切核酸酶PstI-HF、BamHI-HF、EcoRI-HF、PmeI、NotI-HF和BsaI-HF购自NEB公司;质粒小提试剂盒、酵母质粒小提试剂盒、普通DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根公司;番茄红素和β-胡萝卜素标品购自Sigma公司;甲醇、乙腈和二氯甲烷购自Fisher公司;丙酮购自天津市元立化工有限公司;二甲基亚砜(DMSO)、PEG3350、鲑鱼精DNA、各类氨基酸粉末购自鼎国昌盛公司;乙酸锂购自北方天医化学试剂厂;去氨基酸酵母氮源(YNB)购自Genview公司。
1.2 菌株、质粒和培养基宿主菌E.coli DH5α{endA1; hsdR17; gyrA96;thi-1; relA1; supE44; recA1;ΔlacU169(Φ80lacΔZM15)}和酿酒酵母菌株BY4741[29](MATa,his3Δ1,leu2Δ0,met15Δ0,ura3Δ0)购自Euroscarf公司,酵母表达载体pRS425K为本实验室构建,详见表 1、表 2。
| Strains | Chassis | Description | Source |
| BY4741 | — | MATa,his3Δ1,leu2Δ0,met15Δ0,ura3Δ0 | Purchased |
| SyBE_Sc118001-SyBE_Sc118028 | BY4741 | Delta∷ura3_PTEF1-CrtE-TPDX1-PTDH3-CrtI-TMPE1-PFBA1-CrtYB-TTDH2 | This study |
| SyBE_Sc118029 | BY4741 | pRS416-PTEF1-CrtE-TPDX1-PTDH3-CrtI-TMPE1-PFBA1-CrtYB-TTDH2 | This study |
| SyBE_Sc118030 | SyBE_Sc118012 | Delta::ura3_PTEF1-CrtE-TPDX1-PTDH3-CrtI-TMPE1-PFBA1-CrtYB-TTDH2,Δypl062w∷his3_PTDH3-BTS1-ERG20-TPGI1-PTEF1-tHMG1-TTEF2 | This study |
| Plamids | Description | Source |
| pRS425K | replace AmpKX with KanMX in pRS425 | This lab |
| pRS416-β-carotene cluster | pRS416:PTEF1-CrtE-TPDX1-PTDH3-CrtI-TMPE1-PFBA1-CrtYB-TTDH2 | This lab |
| Module1 | pRS425K:δ1-URA3-TFBA1 | This study |
| Module2 | pRS425K: TFBA1-PTEF1 | This study |
| Module3 | pRS425K: TTDH2-δ2 | This study |
| Module4 | pRS425K: ypl062w up-his3-TPGK1 | This study |
| Module5 | pRS425K: TPGK1-PTDH3-TPGI1 | This study |
| Module6 | pRS425K: TPGK1-PTDH3-BTS1-ERG20-TPGI1 | This study |
| Module7 | pRS425K: TPGI1-PTEF1-tHMG1-TTEF2 | This study |
| Module8 | pRS425K: TTEF2-ypl062w down | This study |
LB培养基(10g/L氯化钠、10g/L胰蛋白胨、5g/L酵母提取物;固体培养基添加1.5%琼脂粉)用于大肠杆菌的培养;YPD培养基(40g/L葡萄糖、20g/L胰蛋白胨、10g/L酵母提取物;固体培养基添加2%琼脂粉)用于酿酒酵母的培养;SC-ura培养基(20g/L葡萄糖、6.7g/L YNB、2g/Ldrop-out去除尿嘧啶的氨基酸混合物;固体培养基添加2%琼脂粉)和SC-ura-his培养基(20g/L葡萄糖、6.7g/L YNB、2g/Ldrop-out去除尿嘧啶和组氨酸的氨基酸混合物;固体培养基添加2%琼脂粉)用于酵母转化子筛选和培养。
1.3 酿酒酵母表达载体的构建以BY4741基因组DNA为模板,通过特异性引物PCR扩增FBA1、TDH2、PGK1、PGI1、TEF2终止子,TEF1、TDH3启动子,ypl062w up(ypl062w基因起始密码子上游225bp)、ypl062w down(ypl062w基因终止密码子下游220bp)、his3 ORF和tHMG1、ERG20、BTS1等基因;通过引物将δ1-hisG-ura3-hisG、δ2从pdδUB[30]扩增下来。通过OE-PCR扩增得到δ1-ura3-FBA11t片段并以NotI酶切后连接到pRS425K,命名为Module1;FBA1t-TEF1p片段用PstI、PmeI酶切后连接到pRS425K,命名为Module2;TDH2t-δ2片段以BsaI、BamHI酶切后连接到pRS425K,命名为Module3;ypl062w up-his3-PGK1t片段以NotI酶切后连接到pRS425K,命名为Module4;PGK1t-TDH3p-PGI1t片段以PstI、BamHI酶切后连接到pRS425K,TDH3p-PGI1t之间为双向回文的BsaI序列,方便后续基因的插入,命名为Module5;BTS1和ERG20之间以GGGS linker连接,并用BsaI酶切后插入到Module5,形成PGK1t-TDH3p-BTS1-ERG20-PGI1t模块,命名为Module6;PGI1t-TEF1p-tHMG1-TEF2t片段以PstI、BamHI酶切后连接到pRS425K,命名为Module7;TEF2t、ypl062w down以NotI酶切后连接到pRS425K,命名为Module8;TEF1p-CrtE-PDX1t-TDH3p-CrtI-MPE1t-FBA1p-CrtYB-TDH2t从pRS416-β-carotene cluster[31]上用EcoRI酶切得到。
1.4 表达模块整合基因组和转化子筛选以上模块测序正确后,用相应的酶切下Module1、Module2、β-carotene cluster、Module3,采用乙酸锂转化法[32]转化酿酒酵母菌株BY4741[图 2(a)],在SC-ura平板上30℃恒温倒置培养2~3天,至长出重组克隆,筛选出颜色呈深黄色的全部正确克隆28个,同样转化pRS416-β-carotene cluster作为对照。将这些单菌落在SC-ura固体培养基上画线分纯,30℃恒温倒置培养至长出单菌落,挑取全部单菌落到SC-ura液体培养基,30℃、200r/min培养至OD600约为4,存甘油菌。这些菌株分别命名为SyBE_Sc118001-028。对照pRS416-β-carotene的菌株命名为SyBE_Sc118029。
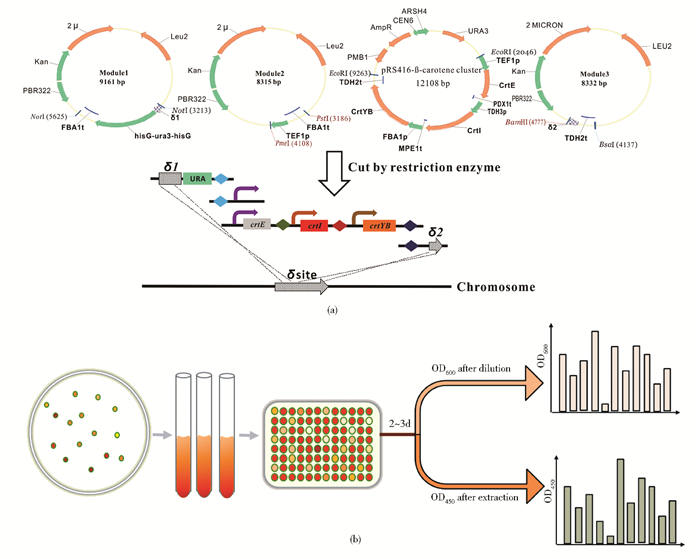
|
| 图 2 Delta位点整合外源基因示意图(a)和初筛原理示意图(b) Figure 2 Schematic diagram of integratingβ-carotene genes into chromosome (a) and Schematic diagram of primary screening forβ-carotene-producing strains (b) |
在经过发酵验证的菌株中,选取SyBE_Sc118012菌株进行上游的改造。将Module4、Module5、Module6、Module7用相应的酶切下,转化SyBE_Sc118012,在SC-ura-his平板上30℃恒温倒置培养2~3天,至长出重组克隆,挑取单菌落到SC-ura-his液体培养基,30℃、220r/min培养至OD600约为4,取菌液12 000r/min离心2min,弃上清液收集菌体提取基因组,基因组PCR验证过表达模块,出现大小正确的目标条带,则证明筛选到了正确的阳性克隆,得到人工酵母菌株SyBE_Sc118030。具体菌株描述见表 1。
1.5 人工酵母菌株发酵 1.5.1 96孔板发酵进行初筛验证将SyBE_Sc118001-029挑取单菌落后接入试管中,30℃培养至OD600为7~8。96孔无菌细胞培养板上每孔加入200μl Sc-ura培养基, 将上述菌株按同一OD=0.5接入,每个菌4个平行。在Thermo-Shaker上30℃、900r/min培养72h,取20μl菌液稀释10倍到新的96孔无菌细胞培养板内,利用SpectraMax M2 Molecular Devices测定最终OD600。剩余菌液离心后,吸去上清液,加入200μl DMSO,55℃在Thermo-Shaker上摇晃5~10min,反复几次后直至细胞接近无色,9 000r/min离心后取上清液至新的96孔板中。因为β-胡萝卜素的最大吸收波长为450nm[33],因此选择在450nm波长下测定其光密度。原理示意图见图 2(b)。
1.5.2 摇瓶发酵考虑到96孔板通氧及培养体积的限制会导致菌体生长及β-胡萝卜素生产受限,因此在摇瓶进行发酵验证。将SyBE_Sc118001-SyBE_Sc118029菌株接种于3ml种子培养基中,在30℃、220r/min培养24h,以初始菌体浓度OD600=0.2转接于新鲜的3ml种子培养基中,于30℃、220r/min条件下培养12h,以初始菌体浓度OD600=0.1分别接种于50ml YPD(40g/L葡萄糖、20g/L胰蛋白胨、10g/L酵母提取物)中。培养条件为220r/min、30℃培养120h,发酵结束时测定菌株浓度OD600。
后期整合的菌株SyBE_Sc118030同样进行相同条件的摇瓶发酵验证。
1.6 β-胡萝卜素的提取与检测β-胡萝卜素的提取[23]:取1ml菌液于1.5ml离心管中,4℃、8 000r/min离心2min,吸去上清液,用冷的无菌水洗一次,8 000r/min离心2min,去掉上清液,加入1ml 3mol/L HCl充分悬浮细胞,沸水浴3min,立即置于冰上2min,离心吸除HCl,冷的无菌水洗一遍,离心后弃除无菌水,用1ml丙酮在涡旋振荡器上充分震荡5min,反复摇晃几次,再次震荡3min直至细胞无色。12 000r/min离心5min,将萃取液过0.22μm有机滤膜,整个过程需要在黑暗中避光进行,利用HPLC检测产物浓度。
β-胡萝卜素采用HPLC(Waters2489 UV/Vis Detector, Waters Corp.,USA)测定,色谱柱为SUPELCOSILTM LC-18(3.3cm×4.6mm, 3μm, Thermo),测定波长为450nm,流动相为甲醇:乙腈:二氯甲烷(40:9:1),流速为0.5ml/min,柱温设置为25℃。
2 结果与分析 2.1 生产β-胡萝卜素酿酒酵母的构建基因crtE、crtI和crtYB是实现在酿酒酵母中表达β-胡萝卜素的异源基因。其中,基因crtE可以很大程度提高GGPP的积累,有利于β-胡萝卜素的合成[22];而crtI催化的反应是β-胡萝卜素合成的限速步骤[22,23],因此选用酵母中碳源充足情况下表达强度最强的TDH3启动子[5, 34],最大限度地增加该蛋白质的表达量,以期减少中间产物的积累,使代谢流更多的合成最终的β-胡萝卜素。将δ1-URA3-TFBA11、TFBA11-PTEF1、PTEF1-CrtE-TPDX1-PTDH3-CrtI-TMPE1-PFBA1-CrtYB-TTDH2、TTDH2-δ2等片段同时转入酿酒酵母BY4741,以实现β-胡萝卜素合成基因crtE、crtI、crtYB在酿酒酵母基因组上多拷贝Delta位点的整合[图 2(a)]。由于β-胡萝卜素存在紫外吸收峰,因此转化子中呈黄色的即为正确组装的克隆。
2.2 生产β-胡萝卜素酿酒酵母细胞的初筛挑选28株黄色的转化子,与对照菌株SyBE_Sc118029一起接种到96孔微孔板中进行发酵。以OD450表征DMSO提取的产物量、OD600表征细胞的浓度、OD450/OD600表征单位细胞浓度条件下β-胡萝卜素的产量。实验结果表明,同一底盘Delta整合后的菌株,在微孔板发酵条件下,OD450/OD600值为0.09~1.62,确实体现了生长和产量的差异性[图 3(a)],这可能是由于在Delta位点上基因整合的位置和数目的随机性对代谢产物产量的影响。
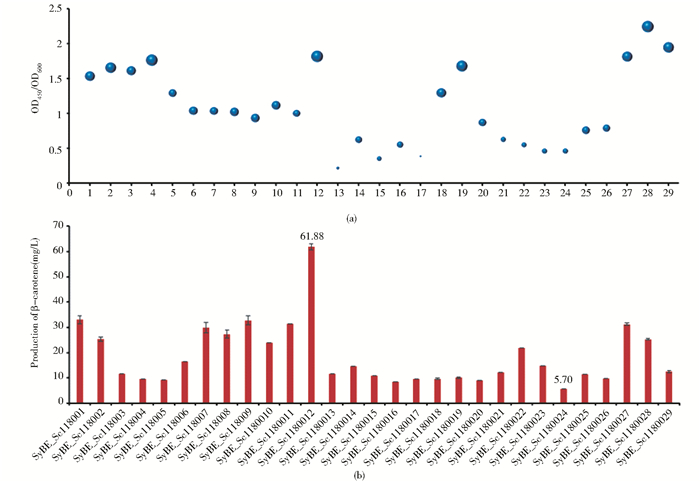
|
| 图 3 96孔板初筛菌株动态分布图(a)和摇瓶验证人工酵母菌株(b) Figure 3 β-carotene-production distribution in 96 well plate(a) andβ-carotene production confirmation in shake flask(b) |
考虑到微孔板在通氧以及培养体积上的限制,为了更准确的得到SyBE_Sc118001-029菌株的发酵产量,因此对其进行摇瓶发酵培养。为了提高TDH3启动子的表达强度,将碳源控制在较高浓度,因此初始葡萄糖浓度选择40g/L。发酵结束后测定β-胡萝卜素的产量,如图 3B所示,微孔板和摇瓶发酵的结果相吻合,产量从5.70mg/L到61.88mg/L动态分布,产量差异超过10倍。其中,SyBE_Sc118012在摇瓶发酵条件下,产量达到了61.88mg/L。本实验以β-胡萝卜素代谢路径的构建为例,其结果证明在Delta位点整合表达基因时,由于Delta位点的数目多样性和位置差异性,出现了代谢产物的产量差异,而这种波动范围更有利于研究酵母代谢过程中基因表达强度和产物最终产量的适配性。
2.4 前体供应优化对β-胡萝卜素产量的强化为了获得更高β-胡萝卜素产量的人工酵母底盘细胞,SyBE_Sc118012被挑选出来,继续做上游内源路径的优化。酿酒酵母MVA途径以乙酰-CoA为底物,经过一系列酶的催化合成β-胡萝卜素的前体GGPP。GGPP的积累量会直接影响β-胡萝卜素的产量,因此tHMG1的过表达增加了GGPP前体FPP的积累;BTS1-ERG20融合蛋白的表达降低了代谢途径中FPP的消耗,将合成的FPP更多地拉向GGPP的积累。同时在酿酒酵母中,糖类的合成和代谢是十分复杂的网络,受到多种多样的基因调控,尤其是一些还未被阐释的功能蛋白基因起着很重要的代谢平衡作用。ypl062w基因编码的蛋白质就是其中之一,它的功能在酿酒酵母中还未被完全阐述。但是ypl062w突变后的菌株表现出糖原水平较低的特征[31]。因此推测MVA途径最原始前体乙酰-CoA更多的用来参与糖类的代谢而不是糖原的合成[26]。所以,我们通过PCR targeting的方法[36],在ypl062w敲除的基础上,实现了内源限速酶基因tHMG1、BTS1-ERG20的整合[图 4(a)]。在相同的摇瓶发酵条件下,HPLC检测可以明显看出由原始菌株BY4741到经过每步优化的菌株β-胡萝卜素产量有明显的提高。其中,原始菌株SyBE_Sc118012中番茄红素的比例占到了全部类胡萝卜素的36%,β-胡萝卜素占到43.4%,改造后的菌株SyBE_Sc118030中番茄红素的含量几乎为0,几乎实现了前体代谢产物的全部转化[图 4(b)],最终SyBE_Sc118030的β-胡萝卜素产量提高了1.65倍,达到了162.1mg/L(21.6mg/g DCW), 是目前已知的β-胡萝卜素产量最高的工程酿酒酵母菌株[图 4(c)]。
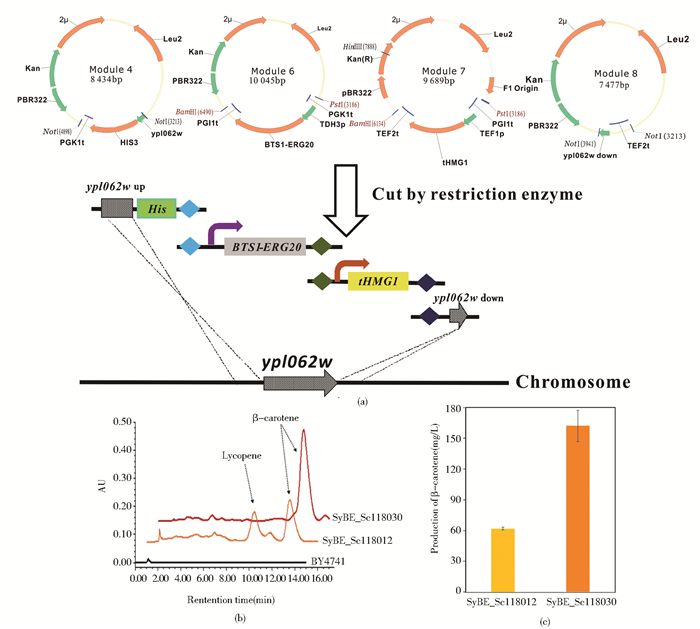
|
| 图 4 敲除ypl062w并整合上游基因示意图(a)、HPLC图谱(b)和摇瓶发酵验证β-胡萝卜素产量(c) Figure 4 Schematic diagram of integrating tHMG1 and BTS1-ERG20 at the ypl062w site(a), HPLC chrotomagraphy(b) andβ-carotene production in shake flask(c) |
(1)为了增加基因拷贝数,同时克服多拷贝质粒容易丢失的问题,选用基因组上多拷贝位点Delta作为整合位点,可以增加外源基因在人工酿酒酵母中的表达强度,从而达到增加β-胡萝卜素产量的目的。
(2)Delta位点因为其整合过程中数目和位置的差异,会出现底盘菌株代谢产量的差异性,对获得差异显著、表型不一的酵母底盘和研究酵母代谢过程中基因表达强度及产物最终产量的适配性有着重要的启发和指导意义。
(3)改造内源代谢路径,通过原始底盘菌株基因的敲除和代谢路径限速酶基因的过表达可以明显提高目标产物β-胡萝卜素的产量。
(4)对于四萜类物质合成,利用胡萝卜素类物质的颜色差异,在96孔微孔板中可以快速筛选GGPP积累较高的底盘菌株。96孔板可以简单模拟试管、摇瓶发酵环境,在高通量筛选过程中因为其方便快捷的特性逐渐占据重要位置。
| [1] | Vickers C E, Bongers M, Liu Q, et al. Metabolic engineering of volatile isoprenoids in plants and microbes. Plant, Cell & Environment , 2014, 37 (8) : 1753–1775. |
| [2] | Siddiqui M S, Thodey K, Trenchard I, et al. Advancing secondary metabolite biosynthesis in yeast with synthetic biology tools. Fens Yeast Res , 2012, 12 (2) : 144–170. DOI:10.1111/j.1567-1364.2011.00774.x |
| [3] | Da S N, Srikrishnan S. Introduction and expression of genes for metabolic engineering applications in Saccharomyces cerevisiae. Fems Yeast Res , 2012, 12 (2) : 197–214. DOI:10.1111/j.1567-1364.2011.00769.x |
| [4] | Ro D, Ouellet M, Paradise E, et al. Induction of multiple pleiotropic drug resistance genes in yeast engineered to produce an increased level of anti-malarial drug precursor, artemisinic acid. Bmc Biotechnol , 2008, 8 (21) : 83. |
| [5] | Sun J, Shao Z, Zhao H, et al. Cloning and characterization of a panel of constitutive promoters for applications in pathway engineering in Saccharomyces cerevisiae. Biotechnol Bioeng , 2012, 109 (8) : 2082–2092. DOI:10.1002/bit.24481 |
| [6] | Fink G, Farabaugh P, Roeder G, et al. Transposable elements (Ty) in yeast. Cold Spring Harb Symp Quant Biol , 1981, 45 (Pt 2) : 575–580. |
| [7] | Dujon B. The yeast genome project:what did we learn. Trends Genet , 1996, 12 (7) : 263–270. DOI:10.1016/0168-9525(96)10027-5 |
| [8] | Parekh R N, Shaw M R, Wittrup K D. An integrating vector for tunable, high copy, stable integration into the dispersed Ty delta sites of Saccharomyces cerevisiae. Biotechnol Prog , 1996, 12 (1) : 16–21. DOI:10.1021/bp9500627 |
| [9] | Lee F W, Da S N. Improved efficiency and stability of multiple cloned gene insertions at the delta sequences of Saccharomyces cerevisiae. Appl Microbiol Biotechnol , 1997, 48 (3) : 339–345. DOI:10.1007/s002530051059 |
| [10] | Lee F W, Da S N. Sequential delta-integration for the regulated insertion of cloned genes in Saccharomyces cerevisiae. Biotechnol Prog , 1997, 13 (4) : 368–373. DOI:10.1021/bp970055d |
| [11] | Yamada R, Taniguchi N, Tanaka T, et al. Cocktail delta-integration:a novel method to construct cellulolytic enzyme expression ratio-optimized yeast strains. Microb Cell Fact , 2010, 9 : 32. DOI:10.1186/1475-2859-9-32 |
| [12] | Kato H, Matsuda F, Yamada R, et al. Cocktailδ-integration of xylose assimilation genes for efficient ethanol production from xylose in Saccharomyces cerevisiae. J Biosci Bioeng , 2013, 116 (3) : 333–336. DOI:10.1016/j.jbiosc.2013.03.020 |
| [13] | Bai Flagfeldt D, Siewers V, Huang L, et al. Characterization of chromosomal integration sites for heterologous gene expression in Saccharomyces cerevisiae. Yeast , 2009, 26 (10) : 545–551. DOI:10.1002/yea.v26:10 |
| [14] | 郭睿, 丁明珠, 元英进. 产青蒿二烯的人工酵母细胞的构建及发酵优化. 化工学报 , 2015, 66 (1) : 378–385. Guo R, Ding M, Yuan Y. Construction of artificial yeast cell for producing amorphadiene, and optimization of fermentation. CIESC Journal , 2015, 66 (1) : 378–385. |
| [15] | Shi S, Liang Y, Zhang M, et al. A highly efficient single-step, markerless strategy for multi-copy chromosomal integration of large biochemical pathways in Saccharomyces cerevisiae. Metab Eng , 2016, 33 : 19–27. DOI:10.1016/j.ymben.2015.10.011 |
| [16] | Jin Z, Wong A, Foo J L, et al. Engineering Saccharomyces cerevisiae to produce odd chain-length fatty alcohols. Biotechnol Bioeng , 2016, 113 (4) : 842–851. DOI:10.1002/bit.25856 |
| [17] | Namitha K K, Negi P S. Chemistry and biotechnology of carotenoids. Crit Rev Food Sci , 2010, 50 (8) : 728–760. DOI:10.1080/10408398.2010.499811 |
| [18] | Mayne S T. Beta-carotene, carotenoids, and disease prevention in humans. Faseb J , 1996, 10 (7) : 690–701. |
| [19] | Ye V M, Bhatia S K. Pathway engineering strategies for production of beneficial carotenoids in microbial hosts. Biotechnol Lett , 2012, 34 (8) : 1405–1414. DOI:10.1007/s10529-012-0921-8 |
| [20] | Yang J, Guo L. Biosynthesis of beta-carotene in engineered E.coli using the MEP and MVA pathways. Microb Cell Fact , 2014, 13 (1) : 1–11. DOI:10.1186/1475-2859-13-1 |
| [21] | Wang C, Kim J, Kim S. Synthetic biology and metabolic engineering for marine carotenoids:new opportunities and future prospects. Mar Drugs , 2014, 12 (9) : 4810–4832. DOI:10.3390/md12094810 |
| [22] | Verwaal R, Wang J, Meijnen J P, et al. High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous. Appl Environ Microb , 2007, 73 (13) : 4342–4350. DOI:10.1128/AEM.02759-06 |
| [23] | Xie W, Liu M, Lv X, et al. Construction of a controllableβ-carotene biosynthetic pathway by decentralized assembly strategy in Saccharomyces cerevisiae. Biotechnol Bioeng , 2014, 111 (1) : 125–133. DOI:10.1002/bit.25002 |
| [24] | Verwaal R, Jiang Y, Wang J, et al. Heterologous carotenoid production in Saccharomyces cerevisiae induces the pleiotropic drug resistance stress response. Yeast , 2010, 27 (12) : 983–998. DOI:10.1002/yea.v27.12 |
| [25] | Yan G, Liang H, Duan C, et al. Enhanced production ofβ-carotene by recombinant industrial wine yeast using grape juice as substrate. Curr Microbiol , 2012, 64 (2) : 152–158. DOI:10.1007/s00284-011-0047-6 |
| [26] | Özaydin B, Burd H, Lee T S, et al. Carotenoid-based phenotypic screen of the yeast deletion collection reveals new genes with roles in isoprenoid production. Metab Eng , 2013, 15 : 174–183. |
| [27] | Xie W, Ye L, Lv X, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in Saccharomyces cerevisiae. Metab Eng , 2015, 28 : 8–18. DOI:10.1016/j.ymben.2014.11.007 |
| [28] | Reyes L H, Gomez J M, Kao K C. Improving carotenoids production in yeast via adaptive laboratory evolution. Metab Eng , 2014, 21 : 26–33. DOI:10.1016/j.ymben.2013.11.002 |
| [29] | Brachmann C B, Davies A, Cost G J, et al. Designer deletion strains derived from Saccharomyces cerevisiae S288C:a useful set of strains and plasmids for PCR-mediated gene disruption and other applications. Yeast , 1998, 14 (2) : 115–132. DOI:10.1002/(ISSN)1097-0061 |
| [30] | Shao Z, Zhao H, Zhao H. DNA assembler, an in vivo genetic method for rapid construction of biochemical pathways. Nucleic Acids Res , 2008, 37 (2) : e16. DOI:10.1093/nar/gkn991 |
| [31] | 元英进, 贾斌, 林秋卉, 等.多片段DNA的酵母快速组装方法:中国, CN 201310389392 A.2015-03-18. Yuan Y, Jia B, Lin Q, et al.Fast Aseembly in Yeast Via Multiple DNA Fragments:China, CN 201310389392 A.2015-03-18. |
| [32] | Gietz R D, Schiestl R H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc , 2007, 2 (1) : 31–34. DOI:10.1038/nprot.2007.13 |
| [33] | 惠伯棣. 类胡萝卜素化学及生物化学. 北京: 中国轻工业出版社, 2005 : 68 -199. Hui B L. Carotenoid Chemistry and Biochemistry. Beijing: China Light Industry Press, 2005 : 68 -199. |
| [34] | Partow S, Siewers V, Bjørn S, et al. Characterization of different promoters for designing a new expression vector in Saccharomyces cerevisiae. Yeast , 2010, 27 (11) : 955–964. DOI:10.1002/yea.v27:11 |
| [35] | Giaever G, Chu A M, Ni L, et al. Functional profiling of the Saccharomyces cerevisiae genome. Nature , 2002, 418 (6896) : 387–391. DOI:10.1038/nature00935 |
| [36] | Nikawa J, Kawabata M. PCR-and ligation-mediated synthesis of marker cassettes with long flanking homology regions for gene disruption in Saccharomyces cerevisiae. Nucleic Acids Res , 1998, 26 (3) : 860–861. DOI:10.1093/nar/26.3.860 |
 2016, Vol. 36
2016, Vol. 36




