文章信息
- 庞倩, 马榆, 李诚, 刘韫滔, 刘书亮, 王小红, 刘爱平.
- PANG Qian, MA Yu, LI Cheng, LIU Yun-tao, LIU Shu-liang, WANG Xiao-hong, LIU Ai-ping.
- 基于CDR2和CDR3区随机突变筛选抗黄曲霉毒素B1单域重链抗体的研究
- Screening of Anti-aflatoxin B1 Single Domain Heavy Chain Antibody Based on Random Mutation of CDR2 and CDR3 Regions
- 中国生物工程杂志, 2016, 36(7): 21-26
- CHINA BIOTECHNOLOGY, 2016, 36(7): 21-26
- http://dx.doi.org/DOI:10.13523/j.cb.20160704
-
文章历史
- 收稿日期: 2016-01-29
- 修回日期: 2016-04-07
2. 华中农业大学食品科学技术学院 武汉 430070
2. College of Food Science and technology, Huazhong Agricultural University, Wuhan 430070, China
近年来,随着食品检测领域的不断发展,基于抗原-抗体特异性反应的免疫分析技术因操作简便、反应迅速、灵敏等优点得到广泛应用[1]。其中以酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)和胶体金免疫试纸条的应用最为广泛,能方便快捷地检测出食品中的病原微生物和某些真菌毒素及其次生代谢产物[2]。抗体是免疫分析技术的核心试剂,目前,多采用单克隆抗体和多克隆抗体,其特异性强,但制备复杂、价格较昂贵[3-5]。基因工程抗体是继多克隆抗体和单克隆抗体之后的第三代抗体,在食品科学领域具有广阔的应用前景[6-7]。其具有筛选范围广、生产周期短、生产成本低等特点[8]。
纳米抗体(nanobodies,Nbs)因具有高表达性、水溶性、稳定性等优点从基因工程抗体中脱颖而出[7-10],是骆驼体内天然存在的一种缺失轻链的重链抗体,克隆其可变区得到的只是由重链可变区组成的单域抗体[11],是最小的功能性抗原结合片段,这个单域抗体也称为单链重域抗体VHH(variable domain of heavy chain of heavy chain antibody,VHH),晶体结构直径2.5nm、长4nm [12]。Nbs在基因工程改造中相比于传统的IgG具有更加明显的优势,天然条件下,与抗原结合的亲和力保留得更好[13]。
黄曲霉毒素B1(aflatoxin B1,AFB1)被国际癌症研究机构列为I类致癌物质[14],广泛污染各类农产品、食品及动物饲料,对人畜危害大,因此对其分析检测极其重要[15-16]。本研究以已报道的天然噬菌体抗体库中的基因为参考[17-18],分别在其CDR2和CDR3区引入部分随机突变,构建噬菌体抗体库,利用phage-ELISA筛选定向进化的VHH基因,并将之与pET-22b载体连接后在大肠杆菌(Escherichia coli,E. coli)中表达,以期为建立AFB1免疫学检测方法提供优良抗体,并为类似小分子污染物的抗体筛选提供新思路。
1 材料与方法 1.1 材料 1.1.1 菌种、噬菌粒pCAN TAB5E噬菌粒载体、E. coli TG1、E. coli DH5α、E. coli BL21(DE3)、pET-22b质粒均由实验室保存。
1.1.2 主要仪器与试剂ST 16R台式高速冷冻离心机:Thermo公司;JY 92-IIN超声波细胞粉碎仪:宁波新芝生物科技股份有限公司;Gel Doc XR+凝胶成像系统、Chem Doc TM XRS+:Bio-Rad公司;UV-1800分光光度计:上海美谱达仪器有限公司。
包被抗原AFB1O-OVA:实验室自制;SanPrep柱式PCR产物纯化试剂盒、兔源抗组氨酸多克隆抗体:生工生物工程(上海)股份有限公司;限制性内切酶(NcoI、XhoI)、Taq DNA聚合酶、T4 DNA连接酶、dNTP:TaKaRa公司;WesternBright ECL化学发光底物:Advansta公司。其他常规试剂均为国产分析纯。
1.2 方法 1.2.1 VHH抗体库的构建参考文献[17-18]设计并合成初始序列VHH-1,其氨基酸序列如图 1所示,以贯序突变法经PCR反应分别在CDR2和CDR3区引入部分随机突变(图 1,下划线处)。对扩增得到的VHH和pCAN TAB5E噬菌粒载体进行SfiI和NotI双酶切,经T4 DNA连接酶构建重组噬菌粒,电转化E. coli TG1,电击转化条件为:电压2.3kV,电阻200Ω,时间4.5ms。将转化液37℃、150r/min振荡培养1.5h。取培养液100μl,用2-YT液体培养基做梯度倍比稀释,涂布SOB-AG平板,37℃培养过夜,计数平板上的单菌落,推算库容。随机挑取单菌落进行菌落PCR鉴定。将剩余转化菌液扩大培养,加入M13KO7辅助噬菌体,37℃水浴轻摇30min,然后于37℃,250r/min振荡培养30min。离心沉淀菌体细胞,用2-YT-AK液体培养基(含100μg/ml氨苄青霉素和50μg/ml卡那霉素的2-YT液体培养基)重悬,37℃振荡培养过夜,离心取上清液,加入PEG/NaCl冰浴1h,离心并重悬沉淀,经0.45μm滤膜过滤即得初级噬菌体抗体库。

|
| 图 1 VHH-1的氨基酸序列 Figure 1 Amino acid sequence of synthesized VHH-1 |
以100μl 50μg/ml AFB1O-OVA(溶于碳酸盐缓冲液,CBS,pH 9.6)包被96孔酶标板,4℃过夜,弃包被液,以PBST(含0.05%吐温20的磷酸盐缓冲液)洗板3次,甩干。每孔加200μl 5%脱脂牛奶(溶于PBST)封阻,37℃,2h。PBST洗板3次,甩干。加入100μl噬菌体抗体库(与封闭液混匀,预先在37℃孵育1h),37℃孵育2h,PBST洗板10次,甩干。加入100μl 0.1mol/L三乙胺,37℃轻柔振荡洗脱6min,立即加入等体积1mol/L Tris-HCl缓冲液(pH 7.4)中和洗脱液。取10μl测定滴度,剩余感染E. coli TG1(OD600nm=0.6~0.8),37℃培养1h。再次加入M13KO7辅助噬菌体,重复上述富集程序4次。
1.2.3 噬菌粒的救援从第4轮测定淘选物滴度的平板上随机挑取15个单菌落接种于LB-AG液体培养基(含2%无水葡萄糖和100μg/ml氨苄青霉素的LB液体培养基),37℃振荡培养12h。按体积分数1%接种量接种于LB-AG培养基,37℃振荡培养至OD600nm=0.6~0.8。加入M13KO7辅助噬菌体,按1.2.1中步骤纯化噬菌体。
1.2.4 phage-ELISA测定已纯化噬菌体以100μl 5μg/ml AFB1O-OVA(溶于CBS)包被96孔酶标板,4℃过夜。弃包被液,以PBST洗板3次,甩干。每孔加200μl 5%脱脂牛奶(溶于PBST)封阻,37℃,2h。PBST洗板3次,甩干。加入100μl噬菌体抗体库(与封闭液混匀,预先在37℃孵育1h),37℃孵育2h,PBST洗板10次,甩干。以PBST稀释辣根过氧化物酶标记的抗E-tag抗体,100μl/孔,37℃孵育1h。弃E-tag抗体液,用PBST洗涤6次,甩干。按100μl/孔加入邻苯二铵显色液,37℃孵育15min。按50μl/孔加入终止液,酶标仪在492nm处读值。
1.2.5 重组载体pET-22b-VHH的构建以最大OD值阳性孔中对应的噬菌粒为模版,分别采用带有NcoI和XhoI酶切位点的5′和3′引物扩增VHH基因片段。将VHH基因片段与载体pET-22b进行NcoI和XhoI双酶切,经T4 DNA连接酶构建重组质粒。将连接产物转化至E. coli DH5α,在SOB-AG(含2%无水葡萄糖和100μg/ml氨苄青霉素)平板上培养,挑取单菌落进行菌落PCR鉴定,将疑似正确的克隆菌株测序验证。
1.2.6 pET-22b-VHH载体的表达将鉴定正确的克隆菌株培养,提取质粒pET-22b-VHH,转化至E. coliBL21(DE3),以菌落PCR验证阳性克隆。挑取单个阳性克隆菌落接种至LB-AG培养基,110r/min,37℃培养,待OD600nm至0.6~0.8时,加入终浓度为1mmol/L的异丙基-B-D硫代半乳糖苷(IPTG)诱导,16℃培养12h后将诱导菌液离心,弃上清液。以PBS洗3次,重悬菌体,采用SDS-PAGE和Western blot分析VHH抗体表达情况。
1.2.7 VHH效价和灵敏度测定按1.2.6步骤大量诱导VHH表达,离心获得的湿菌重悬于20ml的结合缓冲液(binding buffer,BD缓冲液,50mmol/L NaH2PO4,300mmol/L NaCl,pH 8.0),以8 000r/min离心5min后重悬于20ml BD缓冲液,在冰浴条件下超声破碎菌体(30min,2s开启,2s切断,功率105W),于4℃,10 000r/min离心10min,上清液组分以His标签纯化树脂亲和纯化,并采用SDS-PAGE和Western blot分析纯化效果。
以间接非竞争ELISA测定VHH效价,即100μl 1μg/ml AFB1O-OVA(溶于CBS)包被96孔酶标板,4℃过夜。弃包被液,以PBST洗板3次,甩干。每孔加200μl 5%脱脂牛奶(溶于PBST)封阻,37℃,2h。PBST洗板3次,甩干。加入100μl梯度稀释的VHH,37℃,1h。PBST洗板3次,甩干。加入以PBST稀释的鼠抗组氨酸抗体,100μl/孔,37℃,1h。PBST洗板3次,甩干。加入辣根过氧化物酶标记的羊抗鼠酶标二抗,100μl/孔,37℃孵育1h。弃二抗液,用PBST洗涤5次,甩干。按100μl/孔加入邻苯二铵显色液,37℃孵育15min。加入50μl/孔终止液,酶标仪在492nm处读值。
参考间接非竞争ELISA的步骤,以竞争ELISA测定VHH灵敏度。将100μl VHH替换为90μl合理稀释的VHH和10μl甲醇稀释的AFB1标准液。
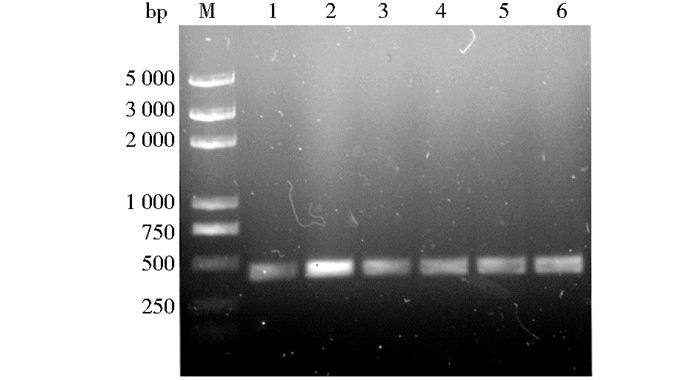
2 结果与分析 2.1 VHH抗体库的构建和初步鉴定经8次电转化,平板计数可得抗体库的容量为3.7×106。随机挑取单克隆进行菌落PCR验证,均能扩增出大小约为405bp的片段(图 2)。为检测噬菌体抗体库的多样性,随机挑取9个单克隆菌株进行测序,测序结果表明抗体库基因型丰富。
|
| 图 2 单克隆菌落PCR验证 Figure 2 PCR verification of monoclonal colonies Lane 1-6:Monoclonal clonies with different number; M:Trans2K plus DNA marker |
本研究采用AFB1O-OVA包被抗原对噬菌体抗体库进行4轮亲和富集,并在每一轮富集筛选后对所得噬菌体抗体库进行滴度测定,结果见表 1。由表 1可知,经亲和富集后,抗体库滴度提高约900倍,说明特异性重组噬菌体得到有效的富集和筛选。
| 淘选轮数 | 噬菌体投入量(CFU) | 噬菌体输出量(CFU) | 回收率(%) | 富集度 |
| 1 | 2×1011 | 7.2×104 | 3.6×10-7 | 1 |
| 2 | 2×1011 | 5.4×105 | 2.7×10-6 | 7.5 |
| 3 | 2×1011 | 1.3×107 | 6.5×10-5 | 24.1 |
| 4 | 2×1011 | 6.5×107 | 3.25×10-4 | 5 |
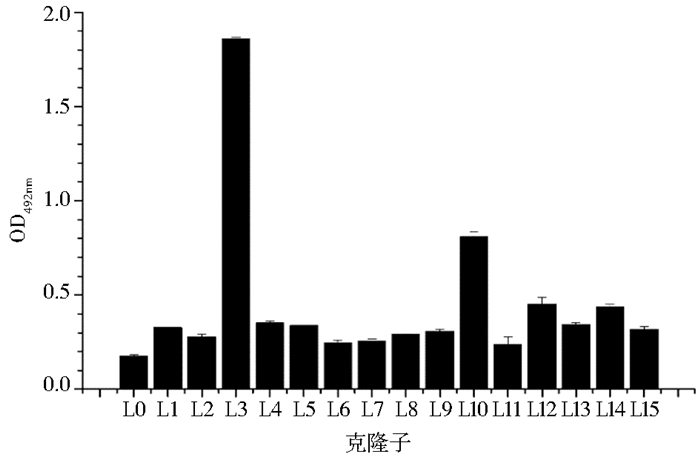
对抗体库进行4轮筛选后,从测定滴度的平板上随机挑选15个单克隆进行救援和纯化,并利用phage-ELISA鉴定噬菌体颗粒,结果见图 3。由图 3可知,15个纯化后的噬菌体中有4个(L3、L10、L12和L14)与AFB1-OVA结合能力稍强,尤以L3更甚。
|
| 图 3 克隆筛选结果 Figure 3 The ELISA results of colony screening |
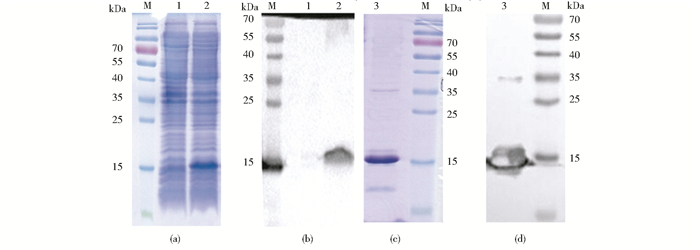
以L3对应噬菌粒为模版,PCR扩增所含VHH基因片段,测序并获得其编码氨基酸序列(图 4)。构建重组质粒pET-22b-VHH,并转化至表达菌株E. coli BL21(DE3),诱导VHH抗体表达。采用SDS-PAGE和Western blot对表达情况进行分析,结果见图 5。由图 5可知,含重组质粒pET-22b-VHH的E. coli BL21(DE3)经IPTG诱导后,在15% SDS-PAGE胶上明显出现大小约为15kDa的蛋白质条带[图 5(a)],且采用兔源抗组氨酸多克隆抗体进行Western blot反应时,仅在15kDa左右显示条带[图 5(b)],符合VHH预估分子质量大小,VHH可溶性表达成功。

|
| 图 4 筛选后部分VHH的氨基酸序列 Figure 4 Amino acid sequences of part of screened VHH |
|
| 图 5 VHH纯化前SDS-PAGE(a)、Western blot(b)和纯化后SDS-PAGE(c)、Western blot(d)分析 Figure 5 Fig.5 SDS-PAGE (a), Western blot (b) and SDS-PAGE (c), Western blot (d) analysis of VHH before and after purification M:Protein marker; Lane 1:Non-induced E.coli BL21(DE3) with plasmid pET-22b-VHH; Lane 2:Induced E.coli BL21(DE3) with plasmid pET-22b-VHH; Lane 3:Purified VHH |
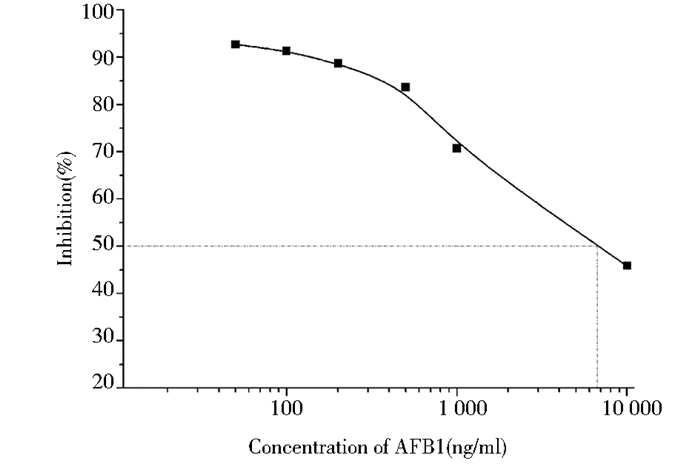
采用His标签纯化树脂纯化VHH,由SDS-PAGE[图 5(c)]分析可知,经过纯化得到目标蛋白VHH(约15kDa),但还有少许杂蛋白存在。由Western blot[图 5(d)]可知,分子质量大小约为35kDa的杂蛋白可能是VHH二聚体,仍表现出与组氨酸抗体的结合性,而小于目标蛋白的杂蛋白未表现出与组氨酸抗体的结合性。以间接非竞争ELISA对纯化后的抗AFB1 VHH与AFB1的结合力进行分析。结果表明,在AFB1O-OVA包被浓度为1μg/ml,VHH浓度约为155.2μg/ml时,OD492nm约为1.0。选择最佳的包被抗原和VHH工作浓度分别为1μg/ml和155μg/ml,以不同浓度AFB1为竞争抗原,进行间接竞争ELISA。结果表明,当AFB1浓度约为10μg/ml时,抑制率约为50%,即VHH灵敏度约为10μg/ml (图 6)。
|
| 图 6 VHH灵敏度分析 Figure 6 The sensitivity of VHH |
噬菌体抗体库是当前制备抗体的一种常用技术手段,噬菌体抗体库分为天然库和免疫库,天然库多样性好,且选择出的抗体基因活性和V区CDR3的代表性也比其他类型的抗体库较好[19],但是一般亲和力低。而免疫库的制备需要相应的动物材料。本研究结合已经报道的诸多抗AFB1 VHH天然抗体库序列,合成一条高同源性且经密码子优化(适合E.coli表达)的初始序列VHH-1,然后构建表达载体pET-22b-VHH-1并在E.coli BL21(DE3)中诱导表达,ELISA检测表明该VHH抗体结合力很低(IC50>50μg/ml),需要提高抗体亲和力。
目前,提高抗体亲和力主要采用体外亲和力成熟技术,包括两种方法。一种是突变抗体的互补决定区基因,一种是链更替(chain shuffling)。突变抗体可变区基因的方法主要有:①随机引物PCR突变;②Error-Prone PCR;③应用对外源基因产生高突变的大肠杆菌菌株进行突变[20-21]。由于与抗原相互作用的部位主要集中在抗体的CDR区,尤其是CDR2区和CDR3区,故本研究我们采用随机引物PCR突变的方法,在已合成VHH基因的CDR2区和CDR3区引入部分随机突变,构建噬菌体抗体库并进行筛选。
文库的容量和多样性直接决定了淘选结果,包括淘选出所需特异性克隆的数量和亲和力[21]。可通过改进技术条件和进行多次克隆[22-23]提高库容量,但库容量的提高也有限。限于条件,本文通过多次电击转化的方式,只成功构建约107的抗体库。经过4轮phage-ELISA筛选出针对AFB1的VHH克隆15个,由图 4中部分克隆子氨基酸序列可知,CDR2区和CDR3区氨基酸变化较大,不易分析出关键作用氨基酸位点。克隆子L3结合能力相对较高,但其IC50约为10μg/ml,与已报道的单克隆抗体或多克隆抗体等存在较大差距,仍需进一步优化。目前关于抗AFB1 VHH的文献报道很少,有研究者[18]构建相应的天然抗体库进行筛选,但并未对相应抗体进行性质分析。仅He等[23]从免疫库中筛选到抗AFB1 VHH,其IC50低达0.76ng/ml。有趣的是,L3的氨基酸序列与其仅存在4个氨基酸差异(图 4,红色方框标记)。但对L3进行相应的氨基酸定点突变后,并未获得较好的结果,具体原因仍在分析探索中,有可能是表达系统的差异引起的。
| [1] | 郭婷, 张宇昊, 马良. 纳米抗体的特性及其应用研究进展. 食品科学 , 2013, 34 (3) : 294–297. Guo T, Zhang Y H, Ma L. Properties and application prospects of nano-antibody in food industry. Food Science , 2013, 34 (3) : 294–297. |
| [2] | 冯敬敬. 盐酸克伦特罗ELISA检测方法的建立及其纳米抗体的筛选. 天津: 天津大学, 化工学院, 2012 : 173 . Feng G G. Establishment of ELISA for Clenbuterol and Screening of Nanoantibody. Tianjian: Tianjian University, School of Chemical Engineering and Technology, 2012 : 173 . |
| [3] | 吴石金, 孙培龙. 简明免疫学原理. 北京: 化学工业出版社, 2008 : 11 -12. Wu J S, Sun J L. Concise Immunology Principle. Beijing: Chemical Industry Press, 2008 : 11 -12. |
| [4] | 冯仁青, 郭振泉. 现代抗体技术及其应用. 北京: 北京大学出版社, 2006 : 55 -76. Feng R Q, Guo Z Q. Modern Antibody Technique and Its Application. Beijing: Beijing University Press, 2006 : 55 -76. |
| [5] | Marla D, Swain a, George P, et al. Immunodiagnostic reagents using llama single domain antibody-alkaline phosphatase fusion proteins. Analytical Biochemistry , 2011, 417 (2) : 188–194. DOI:10.1016/j.ab.2011.06.012 |
| [6] | 朱莉莉, 李建东, 梁米芳. 基因工程抗体分泌影响因素研究进展. 中国医药生物技术 , 2008, 3 (3) : 229–231. Zhu L L, Li J D, Liang M F. Advances in factors that affect engineered antibody secretion. Chin Med Biotechnol , 2008, 3 (3) : 229–231. |
| [7] | 姜忍忍, 许超, 周小理, 等. 纳米抗体的应用及其研究新进展. 生命的化学 , 2013, 33 (3) : 307–315. Jiang R R, Xu C, Zhou X L, et al. Application and the research progress of nanobodies. Chemistry of Life , 2013, 33 (3) : 307–315. |
| [8] | Yau K Y F, Lee H, Hall J C, et al. Emerging trends in the synthesis and improvement of hapten-specific recombinant antibodies. Biothechnology Advances , 2003, 21 (7) : 599–637. DOI:10.1016/S0734-9750(03)00104-6 |
| [9] | 秦海艳, 毛晓燕, 乔玉玲, 等. 单链抗体的研究进展. 现代生物医学进展 , 2011, 11 (4) : 795–797. Qin H Y, Mao X Y, Qiao Y L, et al. Progress in single-chain antibody. Progress in Modern Biomedicine , 2011, 11 (4) : 795–797. |
| [10] | 朱磊, 张大鹏. 天然小分子抗体研究进展. 药学学报 , 2012, 47 (10) : 1281–1286. Zhu L, Zhang D P. Advances in the study of natural small molecular antibody. Acta Pharmaceutica Sinica , 2012, 47 (10) : 1281–1286. |
| [11] | 刘微, 张敏, 郭春燕, 等. 骆驼纳米抗体在医疗领域研究进展. 动物医学进展 , 2013, 34 (3) : 101–105. Liu W, Zhang M, Guo C Y, et al. Progress on camel nanobodies in medical field. Progress in Veterinary Medicine , 2013, 34 (3) : 101–105. |
| [12] | 杨珂, 王冬. 纳米抗体及其应用. 细胞与分子免疫学杂志 , 2008, 24 (4) : 425–427. Yang K, Wang D. Introduction and application of nano-antibody. Chinese Journal of Cellular and Molecular Immunology , 2008, 24 (4) : 425–427. |
| [13] | 蔡家麟, 夏立亮, 潘欣, 等. 重链抗体的结构特点及其应用前景分析. 生命科学 , 2013, 25 (9) : 853–857. Cai J L, Xia L L, Pan X, et al. Structure properties of heavy chain antibody and its future application. Chinese Bulletin of Life Sciences , 2013, 25 (9) : 853–857. |
| [14] | International Agency for Research Cancer (IARC).Aflatoxins.In:Some Naturally Occurring Substances:Food Items and Constituents, Heterocyclic Aromatic Amines and Mycotoxins.Lyon, France:IARC, 1993:245-395. |
| [15] | 韩春卉, 江涛, 李燕俊, 等. 黄曲霉毒素B1酶联免疫试剂盒稳定性研究. 食品科学 , 2013, 34 (14) : 315–318. Han C H, Jiang T, Li Y J, et al. Stability of Aflatoxin B1 ELISA kit. Food Science , 2013, 34 (14) : 315–318. |
| [16] | 郑海燕, 魏帅, 郭波莉, 等. 挤压膨化降解糙米中黄曲霉毒素B1. 食品科学 , 2014, 35 (14) : 35–39. Zheng H Y, Wei S, Guo B L, et al. Reduction of Aflatoxin B1 in brown rice by extrusion cooking. Food Science , 2014, 35 (14) : 35–39. |
| [17] | 涂追.基于单域重链抗体的天然噬菌体文库的构建及抗DON适配体的淘选.江西:南昌大学, 食品学院, 2010. Tu Z.Construction of Natural Phage Display Library of VHH and Screening of Aptamer Against DON.Jiangxi:Nanchang University, School of Food Science & Technology, 2010. http://cdmd.cnki.com.cn/article/cdmd-11902-1011048567.htm |
| [18] | Osborne J, Jermutus L, Duncan A. Current methods for the generation of human antibodies for the treatment of autoimmune diseases. Drug Discov Today , 2003, 8 (18) : 845. DOI:10.1016/S1359-6446(03)02803-4 |
| [19] | 阎岩, 白文涛, 徐志凯, 等. 重链可变区基因随机CDR3 ScFv噬菌体抗体库的构建及筛选. 细胞与分子免疫学杂志 , 2000, 16 (2) : 171–173. Yan Y, Bai W T, Xu Z K, et al. Construction and screening of ScFv phage repertoire with random CDR3 of VH gene. Chinese Journal of Cellular and Molecular Immunology , 2000, 16 (2) : 171–173. |
| [20] | Hoogenboom H R, de Bruine A P, Hufton S E, et al. Antibody phage display technology and its applications. Immunotechnology , 1998, 4 (1) : 1–20. DOI:10.1016/S1380-2933(98)00007-4 |
| [21] | 涂追, 许杨, 刘夏, 等. 驼源天然单域重链抗体库的构建与鉴定. 中国生物工程杂志 , 2011, 31 (4) : 31–36. Tu Z, Xu Y, Liu X, et al. Construction and biopanning of camelid Naǐve Single-domain antibody phage display library. China Biotechnology , 2011, 31 (4) : 31–36. |
| [22] | Lloyd C, Lowe D, Edwards B, et al. Modelling the human immune response:performance of a 1011 human antibody repertoire against a broad panel of therapeutically relevant antigens. Protein Engineering Design and Selection , 2009, 22 (3) : 159–168. |
| [23] | He T, Wang Y, Li P, et al. Nanobody-based enzyme immunoassay for aflatoxin in agro-products with high tolerance to cosolvent methanol. Analytical chemistry , 2014, 86 (17) : 8873–8880. DOI:10.1021/ac502390c |
 2016, Vol. 36
2016, Vol. 36




