文章信息
- 李成媛, 张晶晶, 钱凯, 缪亚娜, 蔡燕飞, 杨剑峰, 何杨, 金坚.
- LI Cheng-yuan, ZHANG Jing-jing, QIAN Kai, MIAO Ya-na, CAI Yan-fei, YANG Jian-feng, HE Yang, JIN Jian.
- 人血清白蛋白-干扰素α2b融合蛋白在CHO细胞中的表达
- Expression of Human Serum Albumin-interferonα2b Fusion Protein in Chinese Hamster Ovary Cells
- 中国生物工程杂志, 2016, 36(7): 7-14
- CHINA BIOTECHNOLOGY, 2016, 36(7): 7-14
- http://dx.doi.org/DOI:10.13523/j.cb.20160702
-
文章历史
- 收稿日期: 2016-01-13
- 修回日期: 2016-04-04
2. 温州大学生命与环境科学学院 温州 325035;
3. 苏州大学唐仲英血液学研究中心 苏州 215123;
4. 苏州大学附属第一医院 苏州 215006
2. College of Life and Environmental Science, Wenzhou University, Wenzhou 325035, China;
3. Cyrus Tang Hematology Center and Ministry of Education Engineering Center of Hematological Disease, Soochow University, Suzhou 215123, China;
4. Jiangsu Institute of Hematology, the First Affiliated Hospital of Soochow University, Suzhou 215006, China
干扰素(interferon, IFN)是一类具有广泛生物学活性的蛋白质,具有增强机体免疫、抗病毒、抗肿瘤等多种功能活性的细胞因子类药物[1]。其中IFNα2b在治疗病毒性疾病中有广泛的应用,可以很好地治疗乙型肝炎和丙型肝炎,在防御2003年我国爆发的严重急性呼吸道综合征(SARS)疫情中发挥了重要的作用。但IFNα2b的分子质量较小,容易在体内被肾小球过滤代谢,使其在体内不稳定,体内的半衰期仅有2h[2]。乙型肝炎和丙型肝炎等疾病的治疗周期较长,长时间的反复给药给患者带来极大痛苦[3]。因此,开发一种长效性的治疗药物具有广阔的应用前景。
白蛋白是人体血清中的主要载体蛋白,占血清总蛋白含量的60%左右。将药物蛋白与白蛋白融合,可以大幅延长药物半衰期,且融合蛋白因其生物相容性好、免疫原性低、半衰期长等优点而得到广泛应用[4]。毕赤酵母作为高效的真核表达体系,据美国生物科技国家中心(NCBI)统计,在2013年年底已经超过1 000个外源蛋白顺利表达[5]。在白蛋白的融合技术应用中,Novartis公司推出的Albuferon药物是干扰素α(IFNα)与HSA的融合药物蛋白,并在毕赤酵母中进行表达[6]。但在德国进行临床研究时,有两个志愿者得了肺水肿疾病,其中一个患者因此死亡,因此该药物也被终止。进一步对Albuferon研究显示,毕赤酵母对药物的糖基化修饰与人体的糖基化修饰差异性和空间修饰差异性是导致该药物毒副作用的可能原因[7]。中国仓鼠卵巢细胞(Chinese hamster ovary, CHO)表达系统作为高级的哺乳动物细胞表达系统,已经得到FDA认可。经其表达的药物蛋白的糖基化修饰和空间结构折叠等与人体天然蛋白相似、药物蛋白分泌性表达且自身分泌内源蛋白少[8]。因此,药物在CHO细胞的表达得到了广泛的应用[9]。
本研究将IFNα2b连接到HSA的C端,构建融合蛋白HSA-IFNα2b,有效的将IFNα2b的半衰期从20h提高至120h[10]。再将HSA-IFNα2b融合蛋白,利用CHO表达系统的优势,在CHO表达系统中首次对IFNα2b和HSA融合蛋白进行表达研究。期望获得高效表达融合蛋白HSA-IFNα2b的CHO细胞系,为融合蛋白药物提供新的表达思路。
1 材料与方法 1.1 实验材料 1.1.1 质粒与菌株质粒pPIC9K/HSA-IFNα2b、大肠杆菌DH5α由本实验室保藏,pMH3质粒和中国仓鼠卵巢细胞(CHO-S)由AmProtein公司赠送。
1.1.2 药品与试剂质粒提取试剂盒、胶回收试剂盒、PCR产物回收试剂盒等购自天根(北京)生化科技公司;T4 DNA连接酶、限制性内切核酸酶NotI、EcoRI、DNA聚合酶等购自Ferments公司;DMEM/F12贴壁培养基、1640培养基和胎牛血清(FBS)购Gibco公司;无血清基础培养基M4、流加培养基F4等购自苏州康聚生物技术公司;G418购自Sigma公司;尿微量白蛋白(检测)试剂盒购自上海名典试剂有限公司。抗体购自Abcam公司。干扰素α2b标准品购自上海华新生物高技术有限公司;其余化学试剂均为分析纯。
1.2 方法 1.2.1 重组质粒构建以pPIC9K/HSA-IFNα2b为模板进行PCR扩增。引物序列如下,former primer: gcgaattccaccatggagacagacacactcctgctatgggtactgctgctctgggttccaggttccactggtgatgcacacaagagtgaggttgctc;reverse primer:ctatgcggccg ctcattccttacttcttaaactttc。获得的基因片段经EcoRI和NotI酶切,用DNA胶回收试剂盒回收目标片段。回收的基因片段与pMH3质粒片段用T4 ligase连接16h。连接好的质粒转化到DH5α,并在LB固体培养基(Ampicillin, 50mg/L)中培养16h后挑选单菌落,筛选获得的阳性质粒经PCR验证和测序验证正确后用于下一步的实验。
1.2.2 重组细胞构建与高克隆表达细胞株的筛选取对数生长期的悬浮CHO细胞,PBS离心重悬浮三次(1 000r/min,5min)后,将细胞密度调整在2×106~3×106cells/ml。将验证正确的质粒20μg、10μg鲑鱼精DNA(提高转染效率)和200μl细胞悬浮液混匀,加入2mm预冷的无菌电极杯中。在500V、500μs电击转化后冰浴1min,反复4次,将电转液均分至两个各加入10ml的D/F全培养基(含10%FBS)的10cm平皿中,放入细胞培养箱中培养24h。
细胞电转贴壁1天后,换成压力培养基(D/F12全培养基+G418 1.5mg/ml)培养3天。3天后有大量细胞死亡,换成D/F全培养基继续培养7~8天,并隔天换新鲜培养基。少量细胞在D/F12培养基长时间培养后形成单独的细胞群。在96孔板中加入100μl的D/F12全培养基,将贴壁细胞挑至96孔板培养7~8天。吸取5μl上清液,通过点杂交(dot-blot)方法检测表达量高的亚克隆,再消化转移到24孔板中继续培养。在24孔板继续培养5~6天后,取上清液通过Dot-blot检测表达量。将高表达的细胞扩增至T75培养瓶中,进行后期悬浮驯化和批次实验。再一次将克隆筛选的产量较高的两株取约100个细胞铺在10cm的dish中贴壁培养,按照以上流程筛选二次和三次或第四次克隆筛选,当产量没有差别时,即筛选获得稳定表达的重组细胞。
Dot-blot检测:5μl细胞培养上清液点到NC膜上,37℃烘箱内放置10min,5%脱脂奶粉37℃摇床封闭2h,TBST冲洗掉封闭液,鼠抗人HSA(HRP)抗体(1μg/ml)37℃孵育1h,TBST漂洗3次,每次10min,ECL显色成像。
Western blot检测:在电泳条件为150V、80min条件下,取离心收集的发酵上清液,跑10%的SDS-PAGE胶,转至NC膜后,使用5%脱脂牛奶37℃封闭2h,分别用IFNα2b(ab9388,Abcam)单抗和HSA (ab31898,Abcam)多抗杂交,TBST漂洗3次,用羊抗小鼠的二抗孵育。TBST漂洗3次,每次15min,ECL显色成像。
1.2.3 CHO细胞悬浮驯化、批次实验及重组细胞稳定性验证将稳定表达株扩增到T75培养瓶,消化收集后将细胞密度调至1.0×106cells/ml,加入装液量为30ml M4培养基的150ml摇瓶中,于100r/min、37℃的摇床中培养。待细胞密度超过2.5×106cells/ml后,离心并调节细胞密度至2.0×106cells/ml。如此反复,当细胞密度达到隔天倍增,且细胞状态良好,则细胞悬浮驯化成功。
批次实验:装液量150ml摇瓶中加入M4培养基30ml,每瓶培养基中再加入600μl的200g/L葡萄糖,并调整初始细胞密度为1.0×106cells/ml。在100r/min,37℃摇床中培养,每天测量细胞密度,台盼蓝染色计算死亡率,尿微量白蛋白试剂盒检测白蛋白含量,通过分子质量比例计算融合蛋白产量。最后选取生长和表达高的亚克隆细胞用于后续实验。
重组细胞稳定性验证实验:选择批次筛选结果较好的亚克隆细胞株,在150ml的摇瓶中,装液量为30ml的M4基础培养基,培养条件为110r/min、37℃。调节细胞密度2.0×106cells/ml,第二天细胞密度为4.0×106cells/ml左右,弃去多余细胞,添加培养基使细胞密度调为2.0×106cells/ml。因隔天细胞数量倍增,即认为隔天的细胞相差一代。每天检测细胞密度和活率,连续分瓶培养12代。选择第0代(起始细胞株)、第4代、第8代和第12代,将这不同代数的细胞株分别做批次实验。
1.2.4 重组CHO细胞的扩种和3L摇瓶流加实验重组CHO细胞的扩种:选择批次表达量最高的克隆进行摇瓶流加表达。准备500ml摇瓶,加入50ml M4培养基,细胞密度为1.0×106cells/ml接种,当细胞密度达到4.0×106cells/ml左右时,将细胞全部转到3L玻璃摇瓶中,并补加M4培养基至细胞密度为2.0×106cells/ml。
3L摇瓶流加实验:3L摇瓶中通过补加M4培养基使细胞密度一直保持在2.0×106cells/ml。观察每天细胞状态,记录细胞密度,直至3L摇瓶中总体积扩至1L左右;待细胞密度长至4.0~6.0×106cells/ml时,开始补加F4流加培养基, 使糖浓度保持在3.0g/L。F4流加培养基自身含糖量为33g/L,当细胞密度达到8×106cells/ml时,将摇瓶转移至34℃表达。使用尿微量白蛋白试剂盒测定发酵上清液中蛋白质的表达量。
1.2.5 重组蛋白的分离纯化HSA-IFNα2b的纯化方法如下:发酵液5 000r/min离心15min,收集发酵上清液,并用0.22μm的滤膜过滤除菌。经A液[50mmol/L磷酸缓冲液(NaPB) pH 7.2,100mmol/L NaCl]平衡Blue Sepharose柱,将样品上样。淋洗平衡后以30% B液(50mmol/L NaPB,pH7.2,2mol/L NaCl)和100% B液先后洗脱,再用C液(2mol/L NaCl,1mol/L Arg,pH7.2)强洗,收集C液洗脱液。Phenyl Sepharose疏水层析先经C液平衡,将C液洗脱液上样,淋洗平衡后,使用D液(100% 50mmol/L NaPB, pH7.2)洗脱,收集D液洗脱液即为纯化所需的蛋白质。
1.2.6 纯化后重组蛋白的活性测定将WISH细胞(人羊膜细胞)在1640全培养基(含10% FBS)中贴壁生长(细胞培养条件均为5% CO2,37℃),贴壁面积达到70%~90%时,消化收集细胞,用1640全培养基将细胞配成密度为2.5×105cells/ml的悬液,并以每孔100μl铺板于96孔板中,贴壁培养6~8h,然后将含标准品和供试品的1640培养基(含7% FBS)加入到96孔板中,每孔100μl。培养24h后弃培养基。把水泡性口炎病毒(VSV)用1640测活培养基(含3%FBS)稀释至100细胞培养半数感染量(cell culture infective dose 50%, CCID50), 每孔100μl培养24h。弃培养基,每孔加染色液50μl,室温放置30min,用流水缓慢冲去染色液,吸干残留水分后,每孔加脱色液100μl,室温放置3~5min,混匀后用酶标仪检测吸光度(以630nm为参比波长,以570nm为测定波长)[11]。
2 结果 2.1 重组质粒pMH3/HSA-IFNα2b的构建以pPIC9K/HSA-IFNα2b为模板进行PCR扩增获得HSA-IFNα2b的基因片段,经NotI、EcoR I双酶切后连接至pMH3。质粒pMH3/HSA-IFNα2b电转至DH5α并涂布于LB平板中,在平板上随机挑选其中4个克隆,经菌落PCR鉴定,4个克隆在2 300bp(目的基因片段2 256bp)处有阳性条带[图 1(b)]。将2号克隆质粒进行双酶切鉴定,结果与预期的相符[图 1(c)]。将2号重组质粒送至上海生工测序,结果与理论序列一致(测序结果未给出)。证明经筛选获得的2号重组质粒构建成功。
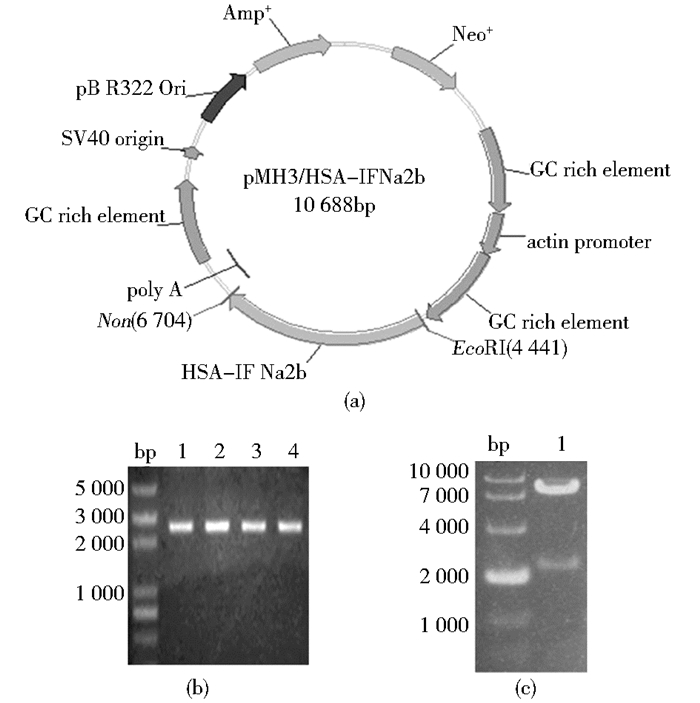
|
| 图 1 重组质粒的构建 Figure 1 Construction of the recombinant plasmid (a) Schematic of the recombinant plasmid of pMH3-HSAIFNα2b (b) Identification of recombinant plasmid pMH3-HSAIFNα2b by PCR Lanes 1, 2, 3, 4: samples of PCR product of different clones (c) Identification of recombinant plasmid pMH3-HSAIFNα2b by enzyme digestion Lane 1, sample of enzyme digestion |
将构建成功的重组质粒电转至CHO-S感受态细胞中,将重组细胞铺在10cm的平皿中。将培养基换成含G418抗生素的压力培养基培养,因G418可以和真核生物的核糖体作用抑制蛋白的合成,从而将细胞杀死[12]。有大量细胞因死亡而漂浮起来。在压力培养基培养3天后细胞死亡99%以上,留下存活的细胞在平皿中都是单个的细胞。撤去G418压力培养8天后,将细胞群转移至96孔板中,并进行Dot-blot筛选,检测表达量高的亚克隆,再消化转移到24孔板中继续培养6天后,再进行Dot-blot筛选,从第一次克隆筛选[图 2(a)、(b)]到第三次克隆筛选[图 3(a)、(b)],阳性克隆株越来越多,表达量逐渐均一,且明显增高。第三次筛选获得的克隆株亚克隆差异不大,说明筛选获得的克隆株为稳定的重组细胞株。选取第三次克隆筛选表达量较高的5株细胞B1、D1、A2、D2和C6[图 3(b)],取表达2天后的上清液进行Western blot检测。其中使用IFNα2b单抗[图 3(c)]和使用HSA多抗杂交[图 3(d)]均有免疫原性,表明筛选得到的细胞株可成功表达IFNα2b和HSA的融合蛋白,筛选获得的细胞株为表达预期蛋白质的细胞株。

|
| 图 2 重组CHO细胞的第一次和第二次克隆筛选 Figure 2 The first cycle and second cycle to select the recombinant CHO cell (a) The first cycle to select high expression sub-clones from 96-microplate and 24-microplate (b) By Dot blot (c) The second cycle to select high expression sub-clones from 96-microplate and 24-microplate (d) By Dot blot |

|
| 图 3 重组CHO细胞产物验证 Figure 3 CHO cells recombinant product verification (a)The third cycle to select high expression sub-clones from 96-microplate and 24-microplate (b) By Dot-blot (c) Western blotting with anti-IFNα2b antibody (d) Western blotting with anti-HSA antibody |
前期细胞均为贴壁培养,使细胞由贴壁到悬浮状态,必须经悬浮驯化的过程,取3次克隆中表达较高的5株细胞B1、D1、A2、D2和C6[图 3(b) ],以下依次命名为clone1、clone2、clone3、clone4、clone5,按照1.2.3中提到的方法进行悬浮驯化,5株细胞悬浮培养到20天,传代9~11次后,均可以达到细胞数隔天倍增,表明悬浮驯化成功。
对于悬浮驯化成功的细胞株,通过批次实验来筛选获得细胞状态好、表达量最高的细胞株。装液量150ml摇瓶中加入M4培养基30ml,每瓶培养基中再加入600μl的200g/L葡萄糖,并调整初始细胞密度为1.0×106cells/ml。培养至第6天,5株细胞的细胞密度达7.1×106~7.9×106cells/ml[图 4(a)]。其中,表达量最高的细胞株是clone3,表达量约为65mg/L[图 4(b)],且细胞状态最好,最终以clone3细胞株作为以后实验的出发重组细胞株。
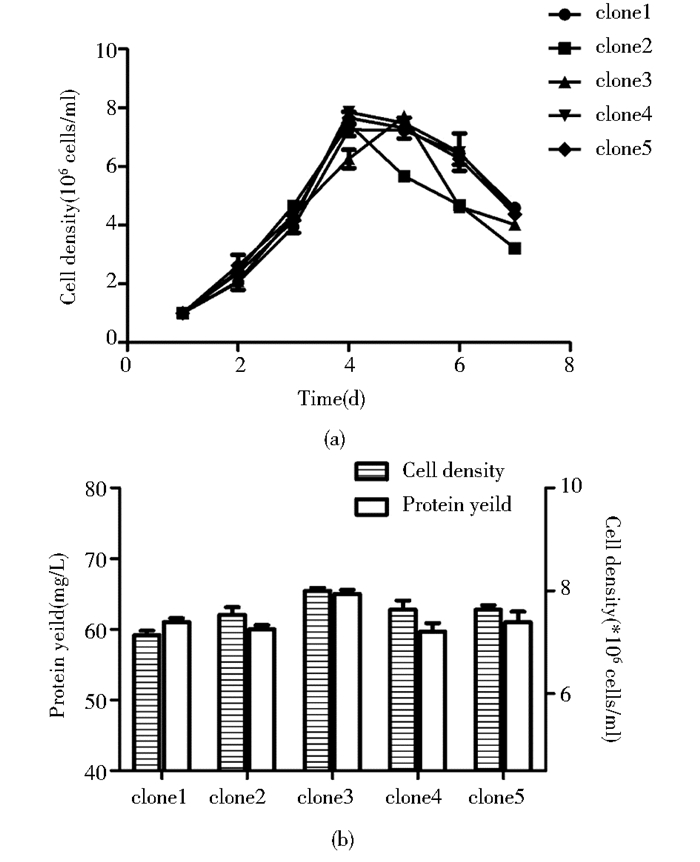
|
| 图 4 悬浮状态下重组细胞株筛选 Figure 4 Under suspension of recombinant cell lines screened (a)The time course of different clone (b) Select recombinant CHO cells by protein yield |
将经过批次筛选获得的稳定细胞株做细胞株的稳定性实验。选取clone3重组细胞株悬浮驯化中不同代数(0代、4代、8代、12代)细胞进行批次培养。批次培养至第6天,测定细胞密度和重组蛋白表达量。实验结果显示(图 5),不同代数细胞之间的蛋白质表达差异没有明显误差,间接说明经过4个循环的细胞株筛选后,获得的细胞株为单克隆细胞株。连续培养8代以上,蛋白质的表达量和生长情况没有明显的差异。
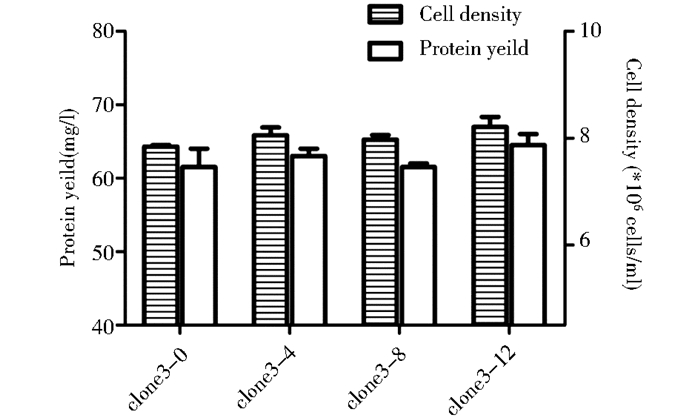
|
| 图 5 重组细胞株稳定性实验 The stability of recombinant CHO cells |
为小规模的制备融合蛋白HSA-IFNα2b在3L的玻璃锥形摇瓶中发酵获取蛋白质。100r/min、37℃的摇床初始的装液量为50ml,细胞密度为2.0×106cells/ml。每天取样检测细胞密度,并补加M4培养基将细胞密度调节至2.0×106cells/ml。发酵6天后,摇瓶中补加的总体积为1L。装液量达到了最大值,停止补加M4培养基,继续在37℃的摇床培养2天,细胞密度能够高达8.2×106cells/ml[图 6(a)],此后每天补加F4培养基至糖浓度达3g/L。培养条件不变,将培养温度降至34℃,此后细胞密度几乎不再发生变化。在第7天降温的目的是降低细胞的生长速率,维持高细胞密度表达目标蛋白;高密度细胞在降温之后,蛋白质能快速积累,在15天后蛋白质表达量达到最高121mg/L[图 6(b)]。细胞死亡率从第13天开始出现,之后呈现快速的死亡状态,15天的死亡率达到30%时结束发酵。
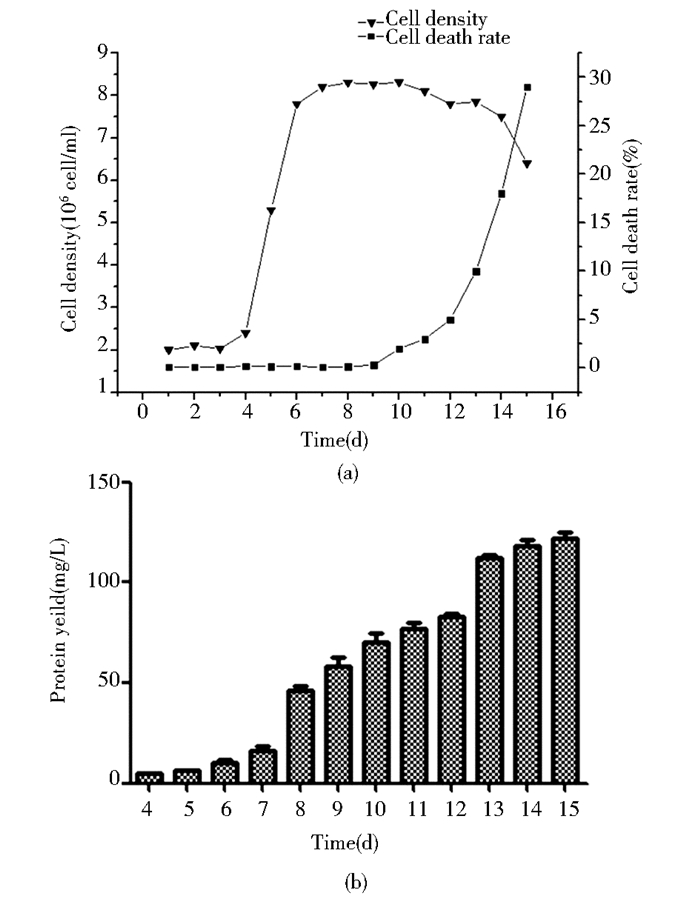
|
| 图 6 重组细胞株的3L摇瓶流加实验 Figure 6 Fermentation process in 3L flask of recombinant CHO cells (a)Cell density and mortality increase with the flow of time (b) Fusion protein yield increase with the flow time |
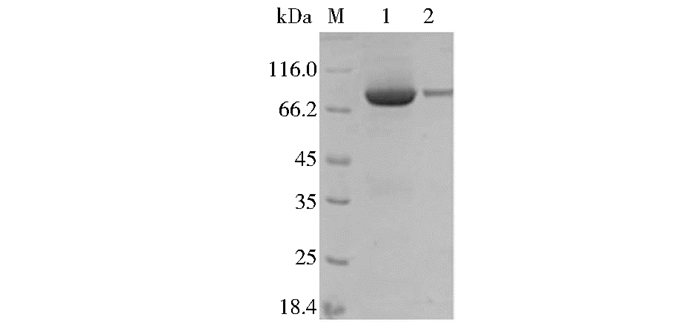
按照1.2.5中纯化方法,收集每步纯化回收的蛋白质样品,用Bradford蛋白质定量试剂盒测定每步纯化总蛋白质含量,使用尿微量白蛋白测定融合蛋白含量,结果HSA-IFNα2b融合蛋白纯化过程的总回收率为22.3%,纯化过程中的具体参数如表 1所示。纯化后的蛋白质分别上样量为10μg和1μg,经SDS-PAGE分析(图 7),蛋白质均在86kDa左右出现单一条带(理论分子质量为85 869.0Da),结果显示获得的蛋白质的纯度达到96.8%(表 1),可用于后续的活性检测。
| Purification step | Volume(ml) | HSA-IFNα2b (mg/L) | Recovery (%) | Purity (%) |
| Culture supernatant | 125 | 95.2 | 100.0 | 100.0 |
| Blue Sepharose | 24 | 202.5 | 32.1 | 71.5 |
| Phenyl Sepharose | 16 | 210 | 22.3 | 96.8 |
|
| 图 7 SDS-PAGE纯度检测 Figure 7 Purification process parameters and SDS-PAGE purity test Purity analysis by SDS-PAGE; Lane 1: The purified protein 10μg; Lane 2: The purified protein 1μg |
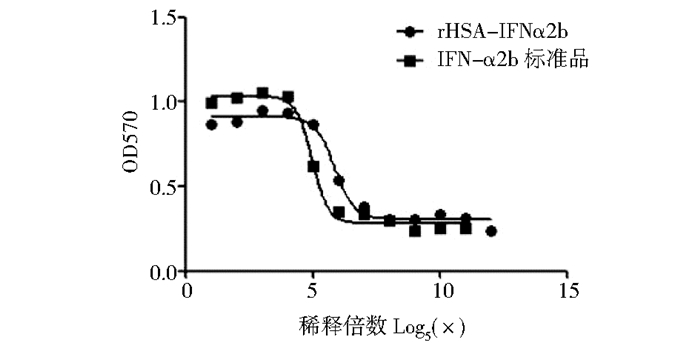
对照的单体药物标准品(IFNα2b)为哈药集团生物工程有限公司提供,比活性为3.0×106IU/ml,待检样品的浓度为210mg/L。标准品用检测培养液稀释200倍,将供试品用检测培养基稀释浓度到10mg/L,再用5倍稀释法稀释12个梯度。分别设置3组平行组,按照纯化后重组蛋白活性测定的实验步骤检测样品的活性。纯化后得到的HSA-IFNα2b的比活为4.1×106IU/mg(图 8),为单体药物的比摩尔活性的32%。
|
| 图 8 HSA-IFNα2b抗病毒曲线 Figure 8 Anti-virus activity of HSA-IFNα2b |
CHO细胞在生物制药中有诸多优势,首先在过去20年中由CHO生产的药物蛋白有很好的安全利用性[12],因此以CHO作为宿主细胞表达药物蛋白容易被药物审核机构,如FDA审批通过;其次CHO细胞具有完善的药物表达修饰体系,如翻译后的糖基化修饰、唾液酸化修饰等,生产的蛋白质较其它表达系统与人体天然的药物蛋白更加相似,同时CHO细胞可以在无血清培养基中表达,这为药物的质量控制和大规模生产带来极大的便利和实惠[13]。
CHO细胞表达蛋白悬浮培养的大规模制备成为应用的趋势,本实验前期筛选高克隆表达细胞株阶段均为贴壁培养,直接收集细胞由贴壁培养到悬浮培养发现,细胞会出现形状不规则、大规模的细胞成团及大量死亡现象,这可能是细胞不适应悬浮状态。因此到细胞悬浮状态需要有驯化过程。
本实验中纯化得到的HSA-IFNα2b的比活为4.16×106 IU/mg,为单体药物的比摩尔活性的32%,这可能是融合蛋白的IFNα2b分子受到大分子质量的白蛋白的空间位阻影响,IFNα2b与细胞表面受体结合动力系数增大[14],使得重组蛋白的活性有显著的减小。
本实验在CHO细胞中成功构建了高效稳定表达HSA-IFNα2b的细胞株,是HSA-IFNα2b在哺乳动物细胞中的首次表达,并将细胞株成功悬浮驯化。经批次筛选获得表达稳定细胞株,同时经3L大摇瓶的发酵放大,获得表达量较高并且生物活性较好的目标蛋白,对以后哺乳动物细胞表达融合蛋白的研究有重要的借鉴意义。
| [1] | 吴玉厚, 吴冰洁, 周国利, 等. 干扰素研究进展. 生物学教学 , 2007, 32 (7) : 2–4. Wu Y H, Wu B J, Zhou G L, et al. Research progress of interferon. Biology Teaching , 2007, 32 (7) : 2–4. |
| [2] | Osborn B L, Olsen H S, Nardelli B, et al. Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-alpha fusion protein in cynomolgus monkeys. Journal of Pharmacology and Experimental Therapeutics , 2002, 303 (2) : 540–548. DOI:10.1124/jpet.102.037002 |
| [3] | 田硕, 徐晨, 姚文兵. 长效干扰素研究进展. 中国生物工程杂志 , 2010, 30 (5) : 122–127. Tian S, Xu C, Yao W B. The advance in long effect interferon reserch. China Biotechnology , 2010, 30 (5) : 122–127. |
| [4] | Basinska T. Adsorption studies of human serum albumin, human gamma-globulins, and human fibrinogen on the surface of p (S/PGL) microspheres. J Biomater Sci Polym Ed , 2001, 12 (12) : 1359–1371. DOI:10.1163/156856202753419277 |
| [5] | Gao M, Shi Z. Process control and optimization for heterologous protein production by methylotrophic Pichia pastoris. Chinese Journal of Chemical Engineering , 2013, 21 (2) : 216–226. DOI:10.1016/S1004-9541(13)60461-9 |
| [6] | Balan V, Sulkowski M, Nelson D, et al. 456 safety. Journal of Hepatology , 2004, 40 (04) : 135. |
| [7] | Chemmanur A T, Wu G Y. Drug evaluation:albuferon-alpha-an antiviral interferon-alpha/albumin fusion protein. Current Opinion in Investigational Drugs , 2006, 7 (8) : 750–758. |
| [8] | Kim J K, Kim Y G, Lee G M. CHO cells in biotechnology for production of recombinant proteins:current state and further potential. Applied Microbiology and Biotechnology , 2011, 93 (3) : 917–930. |
| [9] | Okumura T, Masuda K, Watanabe K, et al. Efficient enrichment of high-producing recombinant Chinese hamster ovary cells for monoclonal antibody by flow cytometry. Journal of Bioscience & Bioengineering , 2015, 120 (3) : 340–346. |
| [10] | Otagiri M. A molecular functional study on the interactions of drugs with plasma proteins. Drug Metabolism and Pharmacokinetics , 2005, 20 (5) : 309–323. DOI:10.2133/dmpk.20.309 |
| [11] | 钱凯, 雷楗勇, 关波, 等. 人血清白蛋白和干扰素α2b融合蛋白在毕赤酵母中表达及质量控制. 食品与生物技术学报 , 2012, 31 (12) : 1269–1274. Qian K, Lei J Y, Guan B, et al. Expression and quality control of the recombinant human serum albumin and interferon-alpha2b fusion protein in Pichia pastoris. Journal of Food Science and Biotechnology , 2012, 31 (12) : 1269–1274. |
| [12] | Vicens Q, Westhof E. Crystal structure of geneticin bound to a bacterial 16S ribosomal RNA a site oligonucleotide. Journal of Molecular Biology , 2003, 326 (4) : 1175–1188. DOI:10.1016/S0022-2836(02)01435-3 |
| [13] | Dietmair S, Hodson M P, Quek L E, et al. Metabolite profiling of CHO cells with different growth characteristics. Biotechnology & Bioengineering , 2012, 109 (6) : 1404–1414. |
| [14] | Shuo T, Qinshan L, Wenbin Y, et al. Construction and characterization of a potent, long-lasting recombinant human serum albumin-interferonα1 fusion protein expressed in Pichia pastoris. Protein Expression and Purification , 2013, 90 (2) : 124–128. DOI:10.1016/j.pep.2013.05.002 |
 2016, Vol. 36
2016, Vol. 36




