文章信息
- 宋丽杰, 王丽, 杨传红, 赖晃文, 王捷.
- SONG Li-jie, WANG Li, YANG Chuan-hong, LAI Huang-wen, WANG Jie.
- Cas9蛋白对亲骨转移人乳腺癌细胞株生物学性质和超微结构的影响
- Effect of Cas9 Protein on Biological and Ultrastructural Characteristics of the Human Bone-seeking Breast Cancer Cell Line
- 中国生物工程杂志, 2016, 36(7): 1-6
- CHINA BIOTECHNOLOGY, 2016, 36(7): 1-6
- http://dx.doi.org/DOI:10.13523/j.cb.20160701
-
文章历史
- 收稿日期: 2016-01-21
- 修回日期: 2016-02-04
2. 广州军区广州总医院 广州 510010
2. Department of Medical Research, General Hospital of Guangzhou Military Command, Guangzhou 510010, China
Cas9蛋白是原核生物CRISPR(clustered regularly interspaced short palindromic repeat)系统的一个重要组成部分[1]。CRISPR/Cas9技术作为一种新型的基因编辑技术,因其简便性、高效性等优点,近几年来广泛的应用于各种原核生物、真核生物的基因编辑中[2]。Cas9蛋白在向导RNA(gRNA)的引导下,可特异性地结合在目的基因片段上并对该片段进行切割,从而起到基因编辑的作用[3]。Cas9为细菌蛋白,且相对分子质量很大,常用的来自产脓链球菌(Streptococcus pyogenes SF370)的Cas9蛋白的氨基酸就多达1 368[4]个。在CRISPR/Cas9介导的基因编辑过程中,虽然已对Cas9密码子进行优化,但Cas9对其他物种细胞的增殖、迁移和超微结构的影响有待深入研究。MDA-MB-231BO细胞是人亲骨转移乳腺癌细胞株,常用于乳腺癌骨转移分子机制的研究[5]。本研究拟利用慢病毒载体介导Cas9基因转染MDA-MB-231BO细胞,通过实时无标记动态细胞分析、细胞划痕和透射电镜,评价Cas9对亲骨转移人乳腺癌细胞株生物学性质和超微结构的影响,为CRISPR/Cas9基因编辑技术研究乳腺癌靶向骨转移的分子机制提供实验基础。
1 材料与方法 1.1 材料 1.1.1 细胞亲骨转移人乳腺癌细胞株MDA-MB-231BO,由美国德州大学圣安东尼健康科学中心Yoneda教授惠赠;人肾上皮细胞系293T细胞,购买于美国模式培养物集存库(ATCC)。
1.1.2 主要试剂Cas9蛋白表达载体CP-LvC9NU-02购买于美国GeneCopoeia公司;Lenti-Pac HIV慢病毒表达包装试剂盒购买于美国GeneCopoeia公司;Cas9单克隆抗体购买于Abcam公司;GAPDH单克隆抗体购买广州晶欣生物科技有限公司;辣根过氧化物酶HRP标记的羊抗鼠IgG(二抗)购买于CST公司;BCA试剂盒购买于Beyotime公司;即用型免疫组织化学Elivision plus试剂盒(鼠/兔)购买于迈新公司;G418购买于Gibco公司;DMEM高糖培养基购自于吉诺生物医药技术有限公司;胎牛血清购自于Gibco公司。
1.2 方法 1.2.1 细胞的培养MDA-MB-231BO细胞和293T细胞用含10%胎牛血清的DMEM培养基,在37℃、5% CO2饱和湿度细胞培养箱内培养,常规方法更换培养基、消化传代。
1.2.2 Cas9慢病毒的包装及转染Cas9慢病毒表达质粒大小为13 049bp,其中Cas9蛋白基因大小为4 170bp;携带有绿色荧光(eGFP)筛选标记及G418抗性筛选基因,并且含有核定位信号(NLS), 能够将合成的Cas9蛋白引导至细胞核发挥作用。按照Lenti-Pac HIV慢病毒表达包装试剂盒说明书制备Cas9慢病毒悬液。在24孔板上铺板培养MDA-MB-231BO细胞,每孔105个细胞,添加0.5ml含10%胎牛血清的DMEM培养基,在5% CO2条件下37℃培养过夜。当细胞汇合度达到70%~80%时,弃掉旧的培养基,每孔加入0.5ml制备的病毒悬液,并在培养基内添加Polybrene,至终浓度为8μg/ml。将24孔板置于4℃培养2h后,再于37℃、5% CO2饱和湿度细胞培养箱内培养过夜。第二天更换正常培养基继续培养。
1.2.3 表达Cas9蛋白的MDA-MB-231BO-Cas9细胞筛选慢病毒转染72h后,以含有800μg/ml G418的培养基替换旧的培养基进行药筛,每3~4天更换一次培养基,筛选2周至细胞不再死亡时停止药筛。荧光显微镜下观察GFP+细胞,并使用流式细胞仪测定GFP+细胞百分比。
1.2.4 Western blot检测Cas9蛋白的表达细胞经消化处理后,用细胞裂解液提取细胞总蛋白质,BCA法测定蛋白浓度。取30μg蛋白质进行SDS-PAGE凝胶电泳,电泳完成后切胶将蛋白质转移至PVDF膜。将膜用3%脱脂奶粉的TBST室温摇动封闭2h后,加入TBST稀释的Cas9单克隆抗体(1∶200稀释),4℃孵育过夜。加入TBST稀释的二抗(1∶2 000),37℃孵育1h。在化学发光仪中滴加发光液进行发光显色。同时,以GADPH为内参。
1.2.5 细胞免疫化学检测Cas9蛋白的表达将已消毒的盖玻片置于24孔板中,取对数生长期的细胞以1×105个/孔接种于培养板进行细胞爬片,37℃、5% CO2条件下培养24h后,用PBS清洗细胞3次,4%多聚甲醛固定30min。然后用3%的过氧化氢水溶液阻断内源性过氧化物酶10min,滴加Cas9单克隆抗体(1∶200稀释), 37℃孵育2h。免疫组织化学Elivision plus试剂盒(鼠/兔)A试剂(聚合物增强剂)孵育20min,PBS清洗3次后,加试剂盒B液(二抗),37℃孵育30min。最后,于显微镜下进行DAB显色,苏木素复染1min后,利用中性树胶封片,显微镜下观察细胞。
1.2.6 实时无标记动态细胞分析技术检测细胞的增殖首先在E-plate检测板中每孔加入200μl培养基,放入实时无标记细胞功能分析仪(ACEA Biosciences)中进行调试,然后取对数生长期的细胞以6 000个/孔接种于E-plate检测板,放置30min后放入实时无标记细胞功能仪中于37℃、5%CO2饱和湿度条件下培养190h,通过无线WIFI即可获取细胞动态生长数据。
1.2.7 细胞划痕实验取对数生长期的细胞以5×105个/孔接种于6孔板,于37℃、5% CO2饱和湿度细胞培养箱内培养24h,当细胞汇合度达到80%~90%后,用200μl的无菌枪头在孔内单层细胞上沿直径垂直划线,尽量保持各孔内的创伤口宽度一致,用PBS洗3次后,加入无血清培养基,放入37℃、5% CO2饱和湿度条件下培养,于0h、48h取样拍照,并利用Image J软件测量细胞的愈合率(细胞愈合率=1-未愈合划痕面积/初始划痕面积)
1.2.8 透射电镜观察细胞超微结构取1×107个细胞常规消化离心,倒掉上清液,用PBS清洗细胞3次,离心的细胞团用3%戊二醛于4℃固定2h以上。PBS漂洗2h后,再用1%四氧化锇固定2h,接着将细胞团分别放置于50%、70%乙醇各2min,80%、90%、100%丙酮各10min进行脱水。将纯丙酮与包埋剂按1∶1混合,浸透细胞团1h左右,接着利用纯包埋剂浸透细胞,37℃温箱过夜。第二天,将浸透充分的细胞团于胶囊板中包埋,70℃聚合48h。在解剖显微镜下将组织块表面修整之后,在超薄切片机上进行1μm切片,HE染色之后,在光镜下定位,使需观察的部位确保在超薄切片上。最后在超薄切片机上进行50nm切片,捞至铜网上,透射电镜染色后即可进行电镜观察。
1.2.9 统计学分析采用SPSS13.0统计软件进行t检验分析,每组实验重复3次,P < 0.05为有显著性差异。
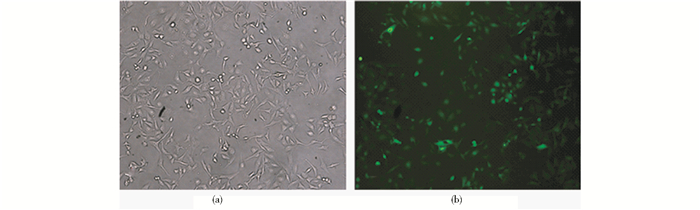
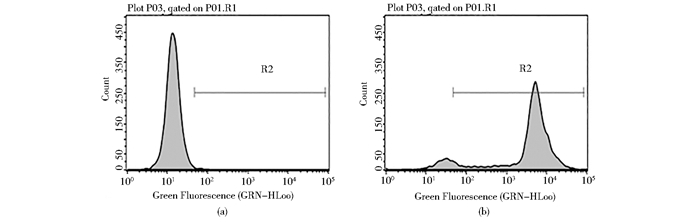
2 结果 2.1 表达Cas9蛋白的MDA-MB-231BO-Cas9细胞筛选用含有800μg/ml G418的培养基筛选细胞2周后,荧光显微镜下可明显看到GFP+细胞(图 1)。通过流式细胞术检测,GFP+细胞百分比高达90%(图 2),证明慢病毒表达质粒已成功转染MDA-MB-231BO细胞。
|
| 图 1 荧光显微镜下的MDA-MB-231BO-Cas9细胞(100×) Figure 1 MDA-MB-231BO-Cas9 cells under the fluorescence microscope (a)Cells under the normal light microscope (b) Cells under the fluorescence microscope |
|
| 图 2 流式细胞术检测GFP+细胞 Figure 2 Fig.2 GFP+ cells detected by flow cytometry analysis (a)MDA-MB-231BO cells (b) MDA-MB-231BO-Cas9 cells |
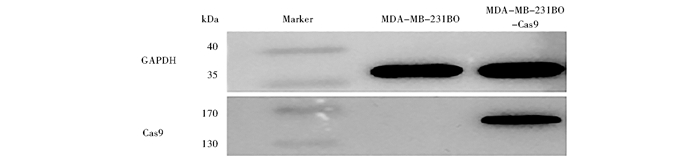
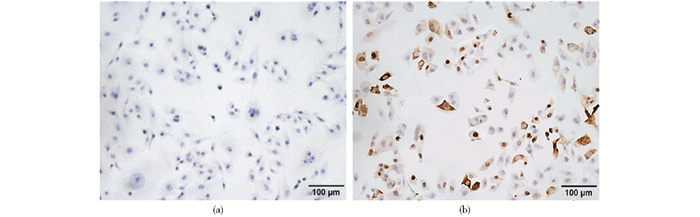
Cas9蛋白属于原核生物CRISPR/Cas系统的一部分,在真核生物中并不存在Cas9蛋白。Western blot结果表明,未转染Cas9慢病毒表达质粒的MDA-MB-231BO细胞并不表达Cas9蛋白,而转染Cas9慢病毒表达质粒的细胞明显表达Cas9蛋白(图 3)。Cas9蛋白首先在细胞质中合成,然后在核定位信号的引导下进入细胞核,所以在细胞质及细胞核中均能检测到Cas9蛋白的表达(图 4)。
|
| 图 3 Western blot检测细胞Cas9蛋白表达 Figure 3 Wxpression of Cas9 protein detected by Western blot |
|
| 图 4 细胞免疫化学检测Cas9蛋白表达(200×) Figure 4 Expression of Cas9 protein detected by immunocytochemistry (a) MDA-MB-231BO cells (b) MDA-MB-231BO-Cas9 cells |
通过实时无标记动态细胞分析技术检测细胞增殖曲线(图 5),结果提示MDA-MB-231BO-Cas9细胞的增殖速率与MDA-MB-231BO细胞相比无显著差异(P>0.05),表明Cas9蛋白对MDA-MB-231BO细胞的生长无影响。
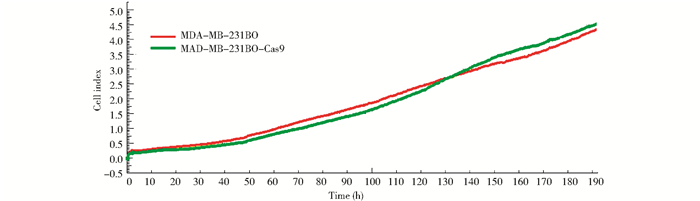
|
| 图 5 MDA-MB-231BO细胞和MDA-MB-231BO-Cas9细胞的增殖曲线 Figure 5 Growth curves of MDA-MB-231BO cells and MDA-MB-231BO-Cas9 cells |
细胞划痕实验是一种简捷测定细胞迁移运动和修复能力的方法,能在一定程度上模拟体内细胞迁移的过程,可以用来检测贴壁生长肿瘤细胞的侵袭转移能力。图 6显示0h和48h时,MDA-MB-231BO细胞和MDA-MB-231BO-Cas9细胞的划痕愈合速率并无差异(P>0.05),提示Cas9基因转染对MDA-MB-231BO细胞的迁移能力并无影响。
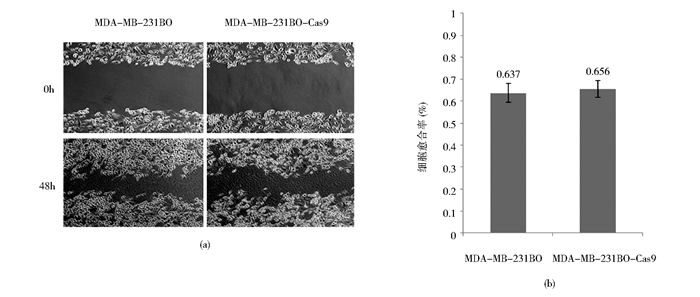
|
| 图 6 细胞划痕实验检测细胞的迁移能力 Figure 6 The ability of cell migration detected by the wound-healing assay (a)The ability of migration of MDA-MB-231BO cells and MDA-MB-231BO-Cas9 cells (b) The wound healing rate of MDA-MB-231BO cells and MDA-MB-231BO-Cas9 cells(n=5, t=0.775, 0.2 < P < 0.5) |
通过透射电镜观察,MDA-MB-231BO细胞和MDA-MB-231BO-Cas9细胞均呈现了肿瘤细胞的特征:细胞核巨大,畸形,核形不规则,并且出现多个核仁,核内异染色质增多,细胞内有丰富的线粒体、高尔基体和发达的粗面内质网,证明肿瘤细胞代谢活跃(图 7)。与MDA-MB-231BO细胞相比,MDA-MB-231BO-Cas9细胞的细胞核及细胞器并未出现异常现象,提示Cas9蛋白的表达对MDA-MB-231BO的超微结构没有影响。
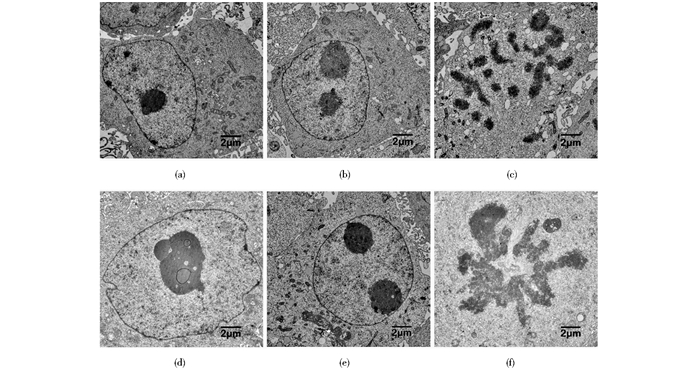
|
| 图 7 细胞的超微结构(EM×10 000) Figure 7 The ultrastructures of cells (EM×10 000) (a)MDA-MB-231BO cell with one nucleolus at the interphase stage (b) MDA-MB-231BO cell with two nucleoli at the interphase stage (c) MDA-MB-231BO cell at the mitosis stage (d)MDA-MB-231BO-Cas9 cell with one nucleolus at the interphase stage (e) MDA-MB-231BO-Cas9 cell with two nucleoli at the interphase stage (f) MDA-MB-231BO-Cas9 cell at the mitosis stage |
Cas9蛋白来源于原核生物的Ⅱ型CRISPR系统,与crRNA和tracrRNA共同组成了细菌和古细菌的一种适应性免疫系统,用来抵御入侵的病毒及外源DNA。Cas9蛋白在向导RNA的引导下与靶DNA结合并对其进行切割从而引起基因突变。Cas9蛋白具有两个独立的核酸酶位点:一个是HNH核酸酶位点,可以断裂与gRNA互补的那条链;另一个是类似于RuvC核酸酶位点,可以断裂另一条非互补链[6]。Cas9蛋白作为第三代人工核酸酶,突破了模式生物的限制,可以在更多的物种中进行高效的遗传操作,并且建立的gRNA文库可以高通量地对基因进行功能性筛选,现已成功地应用于多种基因疾病的治疗。但是Cas9为细菌蛋白,且相对分子质量很大,其在其他物种的细胞中作用是否会产生毒性尚不清楚。本实验通过慢病毒载体介导Cas9基因转染MDA-MB-231BO细胞,成功筛选出了稳定表达Cas9蛋白的乳腺癌细胞株,且实时无标记动态细胞分析技术和细胞划痕实验证明转染Cas9基因对细胞的增殖及迁移没有影响,电镜下观察MDA-MB-231BO-Cas9细胞的细胞器及染色质,与MDA-MB-231BO细胞相比均无异样。实验采取实时无标记动态细胞分析技术检测细胞的增殖情况,与传统的MTT和CCK-8实验相比,不但可以实时、连续、定量跟踪细胞形态和增殖分化改变,而且无标记、无创伤,可以在细胞的正常培养状态下进行,获得的数据更加真实可靠;并且本实验首次采用电镜技术观察Cas9对细胞的细胞器及染色质的影响,为本研究提供细胞超微结构的证据。虽然本实验证明Cas9蛋白的表达对人类肿瘤细胞的生物学性质没有影响,但癌细胞本身就是一类特殊的细胞,其细胞超微结构已经发生了很大变化,若Cas9应用于人类正常细胞会不会引起细胞的癌变有待进一步的研究。虽然Cas9在细胞水平对其生物学性质并没有影响,但若应用于人类基因疾病治疗时是否会引起人类机体的免疫反应不得而知。随着Cas9蛋白结构的进一步揭示[7],有研究者开始对Cas9蛋白进行改造,以获得分子质量更小的功能性蛋白[8];还有的研究者开始寻找新的更合适的Cas家族核酸酶来完成基因编辑这一工作,如Cpf1[9]。总之,CRISPR-Cas9系统若用于基因缺陷疾病的治疗,不仅需要安全的Cas9蛋白,而且需要更安全有效、特异性强的体内载体的开发。
| [1] | Van D O J, Jore M M, Westra E R, et al. CRISPR-based adaptive and heritable immunity in prokaryotes. Trends in Biochemical Sciences , 2009, 34 (8) : 401–407. DOI:10.1016/j.tibs.2009.05.002 |
| [2] | Hsu P D, Lander E S, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering. Cell , 2014, 157 (6) : 1262–1278. DOI:10.1016/j.cell.2014.05.010 |
| [3] | Ran F A, Hsu P D, Wright J, et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols , 2013, 8 (11) : 2281–2308. DOI:10.1038/nprot.2013.143 |
| [4] | Mali P, Esvelt K M, Church G M. Cas9 as a versatile tool for engineering biology. Nature Methods , 2013, 10 (10) : 957–963. DOI:10.1038/nmeth.2649 |
| [5] | Wang J, Wang L, Xia B, et al. BSP gene silencing inhibits migration, invasion, and bone metastasis of MDA-MB-231BO human breast cancer cells. PLoS One , 2013, 8 (5) : e62936–e62942. DOI:10.1371/journal.pone.0062936 |
| [6] | Sander J D, Joung J K. CRIRISPR-Cas systems for editing, regulating and targeting genomes. Nature Biotechnology , 2014, 32 (4) : 347–355. DOI:10.1038/nbt.2842 |
| [7] | Nishimasu H, Ran F A, Hsu P D, et al. Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell , 2014, 156 (5) : 935–949. DOI:10.1016/j.cell.2014.02.001 |
| [8] | Ran F A, Cong L, Yan W X, et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature , 2015, 520 (7546) : 186–191. DOI:10.1038/nature14299 |
| [9] | Zetsche B, Gootenberg J S, Abudayyeh O O, et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell , 2015, 163 (3) : 759–771. DOI:10.1016/j.cell.2015.09.038 |
 2016, Vol. 36
2016, Vol. 36




