文章信息
- 杨杨, 杨江科, 熊炜, 梁建芳, 段魏魏, 晁群芳.
- YANG Yang, YANG Jiang-ke, XIONG Wei, LIANG Jian-fang, DUAN Wei-wei, CHAO Qun-fang.
- Aeromonas sp. XJ-6双加氧酶基因的克隆、表达及对酪氨酸的降解
- Cloning and Expression of Dioxygenase Gene from Aeromonas sp. XJ-6 and Promoting Degradation of Tyr
- 中国生物工程杂志, 2016, 36(5): 59-67
- China Biotechnology, 2016, 36(5): 59-67
- http://dx.doi.org/DOI:10.13523/j.cb.20160509
-
文章历史
- 收稿日期: 2015-11-30
- 修回日期: 2016-01-03
2. 武汉轻工大学生物工程与制药学院 武汉 430023
2. School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China
芳香族化合物是指分子中含有苯环的有机化合物,如多环芳香烃(polycyclic aromatic hydrocarbons,PAHs)。因其苯环稳定性、不易分解、致癌而被列为重点污染物之一[1]。利用微生物降解苯环是治理此类污染最经济、有效的途径之一。迄今已分离出多种降解PAHs的细菌,Aeromonas属于较新研究的菌种[2],但其开环过程中所涉及的酶少有研究。王蕾等[3]在焦化废水底泥中分离筛选出1株高效芘降解菌株Aeromonas sahnonicida,对芘的降解率达到35.40%。Sáágua等[4]通过Aeromonas sp.和Pseudomonas vesicularis对焦化厂污泥中的PAHs进行生物修复,21天后PAHs的总浓度减少了63%。
随着对PAHs降解菌的深入研究和降解基因库的不断丰富,解析苯环开环途径所涉及的酶,将使该类化合物的生物修复成为可能[5, 6]。双加氧酶是苯环开环过程中非常关键的酶类。在有氧条件下,细菌通常启动双加氧酶对苯环进行攻击,把2个氧原子加到底物中形成双加氧乙烷,之后进一步氧化成顺式双氢乙醇,双氢乙醇可以继续氧化为儿茶酸、原儿茶酸和龙胆酸等中间代谢物,接着苯环断开,产生琥珀酸、延胡索酸、乙酸、丙酮酸和乙醛。降解中的产物被微生物用来合成自身的生物能,同时产生水和CO2[7]。
目前,NCBI数据库和PIR-PSD数据库中记载的Aeromonas sp. 双加氧酶,仅提示对Tyr和Phe有降解作用,尚未发现对此双加氧酶酶活测定的具体文献记载。在前期工作中本实验室从石油污染土壤中以芘为唯一碳源逐级驯化筛选了一株Aeromonas sp. XJ-6。在此基础上,本研究拟对该菌双加氧酶基因进行克隆、表达和蛋白质纯化,并探究该酶对Tyr等苯环的开环功能,为芳香烃化合物的生物降解提供良好的基因资源。
1 材料与方法 1.1 材 料 1.1.1 菌株与质粒原核表达质粒pET-28a、大肠杆菌(Escherichia coli)DH5α和表达宿主E.coli BL21(DE3)由本实验室保藏。
1.1.2 主要试剂芘(>98%)购自阿拉丁试剂公司。限制性内切核酸酶EcoR Ⅰ、Xho Ⅰ,T4 DNA连接酶购自大连宝生物工程公司。胶回收试剂盒、细菌质粒提取试剂盒选用Omega产品。Bradford蛋白浓度测定试剂盒选用Sloarbio产品。PCR引物由武汉金开瑞生物有限公司合成;Tyr购自Biosharp公司;其余试剂为国药、分析纯或色谱纯。
1.1.3 培养基MS无机盐培养基MgSO4 0.2g、KH2PO4 1g、NH4NO3 1g、CaCl2 0.02g、FeCl3·6H2O微量、H2O 1 000ml。LB培养基:1.0g蛋白胨、0.5g酵母提取物、1.0g NaCl定容至100ml。固体培养基需另加琼脂粉1.5g。
1.2 方 法 1.2.1 芘降解菌气单胞菌的驯化与筛选称取5g石油污染土壤样品,接种于芘终浓度为50mg/L的50ml无机盐筛选培养基中。30℃、150r/min 恒温振荡培养5天。以5天为一个周期,定时定量转接、逐步提高芘浓度(50mg/L、100mg/L、150mg/L和200mg/L),至芘终浓度为200mg/L,完成菌株的整个驯化筛选过程[8]。吸取100μl完成驯化的菌液,倍比稀释法涂布于芘/无机盐筛选固体培养基上,30℃培养,直至菌体长成。挑取水解圈最大的单菌落,HPLC测定该菌株XJ-6对芘的降解率,再结合16S rRNA分子技术对菌株XJ-6进行鉴定[9]。
1.2.2 双加氧酶基因的克隆根据Aeromonas可能的双加氧酶基因序列(GenBank登录号:WP 052814551.1),设计上、下游引物。AhDOF:5′-CTTCCAGGCACTGTTCGAATC-3′;AhDOR:5′-CAGGGTT GCCAGTTTCATAG-3′。PCR扩增获得双加氧酶基因片段,通过A/T克隆将该片段连接至pMD-19T后,送样测序。确认其为双加氧酶基因序列后,添加EcoR Ⅰ和Xho I酶切位点至上、下游引物。DioEcoF:5′-GAATTCCTGCCGGAGCAGGCCATC-3′;DioXhoR:5′-CTCGAGTTATTTGCCGAGCGTCTC-3′。提取Aeromonas sp. XJ-6全基因组DNA作为扩增模板,通过上述引物进行PCR。PCR反应条件:盖温99℃,94℃预变性5min,94℃变性50s,54℃退火50s,72℃延伸90s,工作时间30个循环。
1.2.3 重组质粒的构建及测序分析PCR产物与质粒载体pET-28a使用EcoR Ⅰ/Xho Ⅰ进行双酶切,将纯化的目的基因片段和载体按适当比例以T4连接酶酶连过夜。酶连产物转化至E.coli DH5α感受态中。筛选阳性重组子,提取质粒进行PCR和双酶切验证,并测序[10]。经鉴定正确的重组质粒命名为pET-28a-dio6(GenBank登录号:KT952519),通过网站和软件对dio6进行序列分析。
1.2.4 IPTG诱导双加氧酶的表达与纯化将正确的重组质粒转化入E.coli BL21(DE3)感受态内,培养至对数期,加入IPTG(终浓度为0.1mmol/L)16℃低温诱导16h[11]。菌液离心后,沉淀使用20mmol/L咪唑蛋白缓冲液(NaCl终浓度为20mmol/L、Tris-HCl 终浓度为10mmol/L)悬浮菌体。利用低温超高压连续流细胞破碎机对菌悬液进行破碎至清亮,离心收集上清液,经0.22μm滤膜过滤后使用AKTAprime蛋白质纯化仪进行蛋白纯化[12, 13]。将纯化的蛋白质液透析后进行SDS-PAGE分析。配制12%的分离胶和5%的浓缩胶,电泳后使用考马斯亮蓝进行染色。以pET-28a/BL21破碎上清液作为对照。
1.2.5 苯环氨基酸降解实验的HPLC检测采用Bradford法及紫外分光光度法对蛋白质含量进行测定,实验浓度均控制在0.6mg/ml。选用Tyr作为双加氧酶底物,配制530μl的总体系:2mmol/L Tyr溶液50μl,超纯水250μl,纯化蛋白质液230μl。以不加纯化蛋白质液,蛋白质缓冲液补齐的体系为对照。总体系在4℃/室温,持续反应8h[14]。待反应完成后,经0.22μm滤膜过滤,并用截留分子质量10 000的超滤离心管除去实验组中和蛋白质,收集下管中液体,通过HPLC测定底物降解情况[15, 16]。HPLC操作参数:Agilent Hypersil C18柱 (4.0mm×250mm,5μm);柱温30℃;检测波长280nm;流动相为甲醇和超纯水(1∶9);流速0.3ml/min;进样量10μl。
1.2.6 TLC、HPLC对酶学性质的初步研究以Tyr为底物,分别研究酶液添加量(0μl、10μl、30μl、60μl、90μl、130μl、170μl、210μl),作用温度(25℃、30℃、35℃、40℃、45℃、50℃)及终浓度1mmol/L的常见金属离子(Mg2+、Mn2+、Zn2+、Cu2+、Fe2+、Ca2+)对双加氧酶dio6催化反应的影响[17]。反应总体系为1ml,按相应比例添加超纯水补齐,混匀反应2h。超滤离心管除蛋白酶,根据氨基酸TLC茚三酮显色方法的原理初步检测Tyr降解情况[18],再结合HPLC精确比对各个单因素对酶促反应的影响。TLC展开剂由正丁醇∶冰乙酸∶水∶1%茚三酮体积比为2∶0.6∶0.5∶0.1组成。HPLC操作参数按方法“1.2.5 ”所示。
1.2.7 LC-MS验证酶促反应参考“1.2.5 ”配制反应体系:60μl酶液;50μl酪氨酸溶液,超纯水补至1ml。30℃反应2h,除蛋白质终止反应,冷藏送至华中科技大学分析测试中心进行LC-MS,检测降解产物[19, 20]。采用Agilent 1100液相色谱/质谱联用仪,HPLC操作参数按方法“1.2.5”所示。质谱分析条件:LC-MS进样方式;离子源ESI;负离子检测模式;25~500m/z的扫描范围;离子源温度260℃;雾化气流速30psi;干燥气流速8L/min;毛细管电压3 500V;毛细管出口电压109V;扫描方式auto MS/MSn。
2 结果与分析 2.1 菌种的初步鉴定经HPLC测定菌株XJ-6在5天内对芘的降解率达到36%。提取XJ-6基因组DNA,PCR扩增该菌株的16S rRNA基因,对获得到的长约1.5kb的PCR扩增产物进行测序,序列通过NCBI的BLAST程序比对。结果表明,该菌株与气单胞菌属的Aeromonas caviae strain CECT 4221(NR 104824.1)的16S rRNA基因相似性为99%。可以确定该菌属于气单胞菌属(Aeromonas sp.),GenBank登录号:KT952518。
2.2 重组质粒的构建本研究以Aeromonas sp. XJ-6基因组为模板,扩增出一条约为1 194bp的特异性条带。通过T4连接酶将具有相同黏性末端的dio6片段和表达载体pET-28a连接起来,构建重组质粒pET-28a-dio6[图 1(a)]。通过PCR和EcoR Ⅰ/Xho Ⅰ双酶切表明功能基因片段dio6成功插入[图 1(b)]。进一步测序结果说明构建的重组表达载体pET-28a-dio6阅读框正确,GenBank登录号:KT952519。
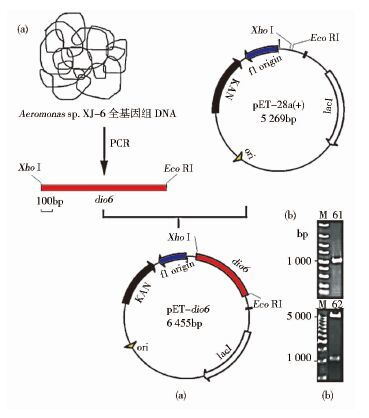
|
| 图 1 双加氧酶dio6基因的克隆及重组质粒的构建 Figure 1 Cloning of dioxygenase gene dio6 and constructing the recombinant plasmid (a)The processing of the recombinant plasmid construction (b)Agarose gel checking the dio6 PCR product and the recombinants digested by EcoR I/Xho I,M:DNA marker |
为了更好地明确来自不同菌种的双加氧酶之间的遗传关系,通过NCBI检索了若干条常见芳香烃类化合物降解菌的双加氧酶的蛋白质序列,利用BioEdit和MEGA 4.1软件对dio6和双加氧酶蛋白序列进行系统进化树构建(图 2),结果显示,dio6和Aeromonas caviae的双加氧酶亲缘关系较近,又与Achromobacter sp.和Sphingomonas sp.的双加氧酶聚于一类。其中,PIR-PSD(http://pir.georgetown.edu/)记载Aeromonas caviae的双加氧酶对Tyr和苯丙氨酸具有开环作用。以dio6为基础序列,通过Blast同源性搜索,获取和dio6具有一定同源性的Aeromonas双加氧酶氨基酸序列与双加氧酶dio6进行同源比对(图 3),发现片段之间的相似性大于93%,其中与Aeromonas caviae双加氧酶(GenBank登录号:WP 052814551.1)序列的相似性为99%。

|
| 图 2 dio6与18株降解多环芳烃细菌双加氧酶蛋白序列的NJ树 Figure 2 NJ phylogenetic tree of dio6 dioxygenase protein sequence compared with 18 reference sequences from PAHs kinds degradation bacterial |

|
| 图 3 dio6与5种气单胞菌双加氧酶氨基酸序列的比对结果 Figure 3 The sequence alignment between dio6 and five Aeromonas dioxygenase amino acid |
重组菌pET-28a-dio6/BL21低温诱导表达16h后,pET-28a-dio6/BL21较pET-28a/BL21的破碎菌液上清液在44.9kDa出现明显蛋白质表达条带[图 4(b)],表明双加氧酶在E.coli BL21(DE3)中成功表达。蛋白质粗提液经AKTAprime蛋白纯化仪过柱,有his标签的蛋白质被吸附到亲和柱上形成洗脱峰[图 4(a)]。收集洗脱峰的纯化蛋白质液,透析后SDS-PAGE检测纯化结果,和预期一致没有杂带[图 4(c)]。
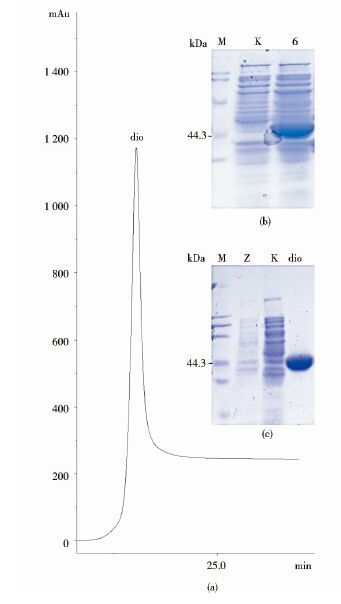
|
| 图 4 SDS-PAGE验证蛋白质表达 Figure 4 SDS-PAGE to verify protein expression (a)dio:The purified protein was eluted peaks,1 200mAu (b)M:Broad protein marker;K:pET-28a/BL21after crushing broth;6:pET-28a-dio6/BL21 after crushing broth (c)Z:Uninduced recombinant plasmid;dio:The purified protein was eluted peaks,44.9kDa |
总体系分别选用4℃和室温,同时进行酶促反应。通过HPLC,比对Tyr降解前后的峰面积来判断双加氧酶dio6对含苯环氨基酸Tyr的降解情况。如图 5所示,在相应反应温度下进行8h的酶促反应后,Tyr自身会发生部分降解,添加蛋白质液会促进其降解,说明双加氧酶dio6对含苯环的Tyr具有降解作用。对底物Tyr自身降解进行显著性测验后,将后续的反应时间控制在2h,减少Tyr自身降解对实验的影响。

|
| 图 5 双加氧酶dio6对Tyr降解程度比对结果 Figure 5 Dioxygenase dio6 had degraded degree of Tyr of alignment results Enzymatic reaction at 4℃,0a as control;0b,2b:Enzymatic reaction at room temperatures,0b as control |
反应一定时间后,采用微量移液枪严格控制点样量。图 6(a)、(b),说明在以下酶量范围内,Tyr均有部分降解。在60μl酶量的反应体系中,底物降解量最大[图 6(c)]。随着添加酶量的增多,底物降解量呈现递减的趋势,说明酶液添加量对双加氧酶dio6降解Tyr影响较大。
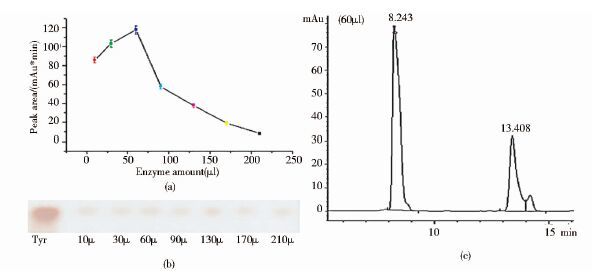
|
| 图 6 TLC结合HPLC测定酶量对酶促反应的影响 Figure 6 TLC and HPLC have to determine the effect of enzyme amount on the enzymatic reaction (a)The method of HPLC was used to detect degradation of Tyr (b)The method of TLC was used to detect degradation of Tyr (c)Analysis of the reaction system was 60μl reaction system by HPLC |
在各个温度下反应2h后,各体系中Tyr均有部分降解[图 7(a)、(b)]。当反应温度为25~30℃[图 7(c)]时,底物降解量逐渐增多。而温度高于35℃后,Tyr的降解量虽然减少但变化不大。综上所述,30℃为较合适的反应温度。
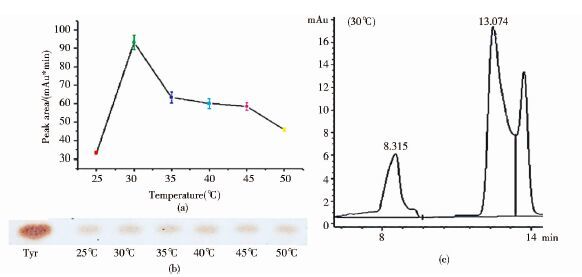
|
| 图 7 TLC结合HPLC测定温度对酶促反应的影响 Figure 7 TLC and HPLC have to determine the effect of temperature on the enzymatic reaction (a)HPLC has detected degradation of Tyr (b)TLC has detected degradation of Tyr (c)Analysis of the reaction system was 30℃ reaction system by HPLC |
通过在反应体系中添加金属离子,研究不同金属离子对双加氧酶dio6催化Tyr降解反应的影响。反应一定时间后,在不同金属离子反应体系中,Tyr均有一定降解[图 8(a)、(b)]。其中,Mg2+、Ca2+略微抑制酶促反应,Mn2+、Zn2+、Cu2+、Fe2+、Ca2+促进底物降解,其中Mn2+对双加氧酶dio6的影响最大[图 8(c)]。

|
| 图 8 TLC结合HPLC测定不同金属离子对酶促反应的影响 Figure 8 TLC and HPLC have to determine the effect of different metal ions on enzymatic reactions (a)HPLC has detected degradation of Tyr (b)TLC has detected degradation of Tyr (c)Analysis of the reaction system was added Mn2+ by HPLC |
Tyr-双加氧酶dio6反应体系在负离子检测方式下进行扫描,得到底物和产物的分子离子峰。在以Tyr为对照的色谱图中,LC-MS分析结果进一步证实(图 9),保留时间(RT)在13min时,m/z为181.19是Tyr[图 9(b)]。当保留时间(RT)在8min时出现的色谱峰和分子离子峰为产物峰,m/z为115.7,即延胡索酸[图 9(c)]。由于乙酰乙酸稳定性差,LC-MS结果中并未出现对应的分子离子峰,仅有一些可能的碎片峰。证明了双加氧酶dio6可以催化Tyr降解并且是通过尿黑酸途径。

|
| 图 9 LC-MS检测Tyr降解产物 Figure 9 LC-MS detection Tyr degradation products a) Detection Figure by HPLC,Fumaric acid(RT:8min);Tyr(RT:13min) (b)The molecular ion peak is Try([M+H+]++180.9) at reaction system (c)The molecular ion peak is fumaric acid([M+H+]++115.7) at reaction system |
将dio6氨基酸序列与NCBI blastp、PIR-PSD(http://pir.georgetown.edu/)和PBD(http://www.rcsb.org/pdb/static.do?PDBp=general_information/pdb_statistics/index.html)比对分析表明,dio6与已知但尚未刊载的Aeromonas caviae双加氧酶和Aeromonas caviae尿黑酸-1,2-双加氧酶均有较高的相似性。由于Aeromonas XJ-6对芘具有较强的降解作用,其酶系统中的双加氧酶是苯环开环的关键酶,基于此我们克隆了一个对苯环具有开环作用的双加氧酶dio6。由繁入简的进行研究,实验结果表明该酶能高效地降解Tyr,填补了此类双加氧酶在功能上研究的空缺(PIR-PSD)。尿黑酸双加氧酶的底物不仅可为尿黑酸,也可为Tyr和Phe等芳香族氨基酸。目前,仅有对来自于人类的尿黑酸-1,2-双加氧酶的少量研究 [19, 20],而对Aeromonas sp.的尿黑酸-1,2-双加氧酶的研究依然为空白,本实验在一定程度上可以为扩宽尿黑酸双加氧酶的研究提供参考。 在进行双加氧酶反应参数的优化过程中,利用TLC的简便性再结合HPLC定量上的精确性,实现在筛选过程中短时间内、批量性判断底物Tyr的降解情况,准确比对出不同反应条件对酶催化反应的影响,在一定程度上提高了实验效率。通过HPLC可以精确地测定出底物的降解情况,优于测定底物降解率的分光光度法。基于LC-MS提供的数据,参考前人对Tyr降解路线的总结[23],模拟推测出了dio6对Tyr的降解过程(图 10)。然而,在对双加氧酶dio6更广泛的功能研究仍需长期不断的探索。
4 结 论(1)本研究筛选得到的一株对芘具有较强降解作用的Aeromonas sp. XJ-6,可以为多环芳烃的降解提供菌种资源。
(2)成功地克隆了一个Aeromonas sp. 双加氧酶基因dio6,并实现了其高效表达。验证了双加氧酶dio6可以高效地降解Tyr,可以为降解芳香烃化合物提供良好的参考。双加氧酶dio6在一定程度上可以代替尿黑酸-1,2-双加氧酶,实现对尿黑酸的高效降解,对解决人类的尿黑酸症有积极的意义。
(3)采用LC-MS技术检测了该酶降解Tyr主要产物的成分,获得了该酶降解芳香族化合物的可能途径。
| [1] | 林颖, 蔡容华. 芳香族化合物生物降解的研究进展. 福建轻纺,2006, 2 (201) : 6 –10. Lin Y, Cai R H. Biodegradation of aromatic compounds research advances. The Light&TextiIe Industries of Fujian,2006, 2 (201) : 6 –10. |
| [2] | Yao L, Teng Y, Luo Y, et al. Biodegradation of polycyclic aromatic hydrocarbons(PAHs) by Trichoderma reesei FS10-C and effect of bioaugmentation on an aged PAH-contaminated soil. Bioremediation Journal,2015, 19 : 9 –17. |
| [3] | 王蕾, 聂麦茜, 杨学福, 等. 高效芘降解细菌的筛选、鉴定及其基本特性研究. 西安建筑科技大学学报(自然科学版),2011, 43 (6) : 859 –863. Wang L, Nie M Q, Yang X F, et al. Study on the efficient pyrene degrading bacteria screening,Identification and basic characteristics. Journal of Xi'an University of Architecture & Technology(Natural Science Edition),2011, 43 (6) : 859 –863. |
| [4] | Sàágua M C, Baeta-Hall L, Anselmo A M. Microbiological characterization of a coke oven contaminated site and evaluation of its potential for bioremediation. World Journal of Microbiology & Biotechnology,2002, 18 : 841 –845. |
| [5] | 殷波, 顾继东. 环境污染物萘、蒽、菲、芘的好氧微生物降解. 热带海洋学报,2005, 24 (4) : 14 –21. Yin B, Gu J D. Environmental pollutants naphthalene,anthracene,phenanthrene,pyrene aerobic microbial degradation. Journal of Tropical Oceanography,2005, 24 (4) : 14 –21. |
| [6] | Silva A S, Jacques R J, Andreazza R, et al. Properties of catechol-1,2-dioxygenase in the cell free extract and immobilized extract of Mycobacterium fortuitum. Brazilian Journal of Microbiology,2013, 44 (1) : 291 –297. |
| [7] | 曹晓星, 田蕴, 胡忠, 等. PAHs降解基因及降解酶研究进展. 生态学杂志,2007, 26 (6) : 917 –924. Cao X X, Tian Y, Hu Z, et al. Research progress in PAHs degradation genes and enzymes. Chinese Journal of Ecology,2007, 26 (6) : 917 –924. |
| [8] | Alley J F, Brown L R. Use of sublimation to prepare solid microbial media with water-insoluble substrates. Applied Environmental Microbiology,2000, 66 (1) : 439 –442. |
| [9] | 李哲斐, 孙然, 简利茹, 等. 一株耐碱性芘降解菌的筛选及特性研究. 西北农业学报,2011, 20 (12) : 140 –144. Li Z H, Sun R, Jian L R, et al. Isolation and characterization of alkali resistance PAHs-degradation bacteria. Acta Agriculturae Boreali-occidentalis Sinica,2011, 20 (12) : 140 –144. |
| [10] | 付敏杰, 聂尧, 穆晓清, 等. 新型异亮氨酸双加氧酶及其重组大肠杆菌合成羟基异亮氨酸. 化工进展,2014, 33 (11) : 3037 –3044. Fu M J, Nie Y, Mu X Q, et al. A novel isoleucine dioxygenase and its expression in recombinant Escherichia coli for synthesis of 4-hydroxyisoleucine. Chemical Industry and Engineering Progress,2014, 33 (11) : 3037 –3044. |
| [11] | Larentis A L, Argondizzo A P, Esteves Gdos S, et al. Cloning and optimization of induction conditions for mature PsaA(pneumococcal surface adhesin A) expression in Escherichia coli and recombinant protein stability during long-term storage. Protein Expression and Purification,2011, 78 (1) : 38 –47. |
| [12] | Sarker S, Ghorashi S A, Swarbrick G M, et al. An efficient approach for recombinant expression and purification of the viral capsid protein from beak and feather disease virus (BFDV) in Escherichia coli. Journal of Virological Methods,2015, 215-216 : 1 –8. |
| [13] | Feng M J, Fu T M, Liu X, et al. Purification,crystallization and preliminary Crystallographic analysis of SMU. Crystallization Communications,2010, 67 (pt 1) : 76 –78. |
| [14] | Mo X M, Li Y, Tang A G, et al. Simultaneous determination of phenylalanine and tyrosine in peripheral capillary blood by HPLC with ultraviolet detection. Clinical Biochemistry,2013, 46 (12) : 1074 –1078. |
| [15] | Khan F, Kumari M, Cameotra S S. Biodegradation of the allelopathic chemical m-Tyrosine by Bacillus aquimaris SSC5 involves the homogentisate central pathway. PLoS One,2013, 8 (10) : 1 –10. |
| [16] | 曲冬梅, 弓爱君, 高鹤永, 等. 反相高效液相色谱法直接检测芳香族氨基酸. 氨基酸和生物资源,2004, 26 (1) : 71 –73. Qu D M, Gong A J, Gao H Y, et al. Direct detection of aromatic amino acids by RP-HPLC. Amino Acids & Biotic Resources,2004, 26 (1) : 71 –73. |
| [17] | 刘涛, 张长铠, 薛勇, 等. L68菌株邻苯二酚-2,3-双加氧酶纯化及性质. 食品与生物技术,2002, 21 (1) : 53 –57. Liu T, Zhang C K, Xue Y, et al. Purification and proterties of catechol 2,3-dioxygenase from strian L68. Journal of Food Science and Biotechnology,2002, 21 (1) : 53 –57. |
| [18] | 吴学军, 谢能咏, 刘勇. 薄层层析法分离六种氨基酸. 江汉大学学报(社会科学版),1999, 16 (6) : 11 –13. Wu X J, Xie N Y, Liu Y. TLC separation of six amino acids. Journal of Jianghan University,1999, 16 (6) : 11 –13. |
| [19] | Andrensek S, Golc-Wondra A, Prosek M. Determination of phenylalanine and tyrosine by liquid chromatography/mass spectrometry. Food Composition and Additives,2003, 86 (4) : 753 –758. |
| [20] | Afzal M, Al-Awadhi S, Oommen S. L-phenylalanine and L-tyrosine catabolism by thermophilic Geobacillus stearothermophilus . British Biotechnology Journal,2013, 3 (4) : 581 –591. |
| [21] | Zhou G, Dudgeon C, Li M, et al. Molecular cloning of the HGD gene and association of SNPs with meat quality traits in Chinese red cattle. Molecular Biology Reports,2010, 37 (1) : 603 –611. |
| [22] | Sarthi S G P, Shyamashree B, Kumar B A. Sequence,structural and functional characterization of homogentisate-1,2-dioxygenase of homo sapiens :An in silico analysis. American Journal of Bioinformatics Research,2013, 3 (3) : 42 –61. |
| [23] | Sanchez-Amat A, Ruzafa G, Solano F. Comparative tyrosine degradation in Vibrio cholerae strains. Comparative Biochemistry and Physiology,1998, 119 (3) : 557 –562. |
 2016, Vol. 36
2016, Vol. 36




