文章信息
- 高翠娟, 连思琪, 祁庆生.
- GAO Cui-juan, LIN Carol Sze-ki, QI Qing-sheng.
- 代谢工程构建重组耶氏解脂酵母生产中长链聚羟基脂肪酸酯
- Production of Medium-chain-length Polyhydroxyalkanoates by Recombinant Yarrowia lipolytica Through Metabolic Engineering
- 中国生物工程杂志, 2016, 36(5): 53-58
- China Biotechnology, 2016, 36(5): 53-58
- http://dx.doi.org/DOI:10.13523/j.cb.20160508
-
文章历史
- 收稿日期: 2016-01-05
- 修回日期: 2016-02-02
2. 香港城市大学环境工程学院 香港 999077;
3. 山东大学微生物技术国家重点实验室 济南 250100
2. School of Energy and Environment, City University of Hong Kong, Kowloon 999077, China;
3. State Key Laboratory of Microbial Technology, Shandong University, Jinan 250100, China
聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA)是一大类由微生物合成的天然生物聚酯。PHA具有许多优良性质,如生物可降解性、生物相容性和光学性能等,在生物可降解的包装材料、组织工程材料、缓释材料及电学材料方面有广阔的应用前景[1]。PHA作为聚合物,依其手性单体(R)-羟基脂肪酸[(R)-hydroxyalkanoate]的碳原子数的不同和侧链的不同而有很多种类,现已报道的PHA种类有150多种。同时,PHA的性质根据单体组成和结构的不同而不同[2]。根据单体碳原子数目的不同,PHA被分为三类:短链PHA(short-chain-length PHA,scl-PHA),其单体由3~5个碳原子组成;中长链PHA(medium-chain-length PHA,mcl-PHA),其单体由6~14个碳原子组成;短链和中长链PHA混聚物(scl-co-mcl-PHA)[3]。一般认为,不同分类的PHA是由来源不同的PHA合成酶对不同链长单体的特异性差异决定的。其中,mcl-PHA因其独特的物理与机械属性具有非常广泛的应用。
许多天然假单胞菌能在碳源过量而其他营养耗尽时利用细胞自身的脂肪酸合成途径或β-氧化途径合成mcl-PHA[4-5]。通过基因工程策略在其他宿主中引入mcl-PHA合成途径异源生产mcl-PHA也不失为一种有效方法[6-7]。mcl-PHA在大肠杆菌(Escherichia coli)和酿酒酵母(Saccharomyces cerevisiae)两株模式实验菌株中的异源合成已有较为深入的研究[8-10]。
解脂酵母(Yarrowia lipolytica)作为非传统酵母,因其具有高效的脂、脂肪酸代谢及对抗环境压力等良好性能越来越受到研究人员的青睐[11-12]。利用其活跃的脂和脂肪酸代谢能力可以生产许多种高附加值产品[13]。2013年,Zhu quinn博士带领的科研团队利用代谢工程改造解脂酵母,生物合成omega-3脂肪酸-二十碳五烯酸(eicosapentaenoic acid,EPA)可达细胞干重的15%[14]。在解脂酵母体内重构脂代谢途径,可以生产占总脂43%、超过60mg/g细胞干重的蓖麻油酸(ricinoleic acid,RA)[15]。而在该酵母中共表达来自痤疮丙酸杆菌(Propionibacterium acnes)的亚油酸异构酶和Δ12-去饱和酶基因可以有效合成反-10,顺-12共轭亚油酸(trans-10,cis-12 conjugated linoleic acid,CLA)[16-17]。2010年,Haddouche等[18]首次在解脂酵母中生物合成mcl-PHA,并研究了不同的脂酰辅酶A氧化酶同工酶对脂肪酸β-氧化作用的贡献与影响。
同酿酒酵母一样,解脂酵母的脂肪酸β-氧化途径在每轮循环过程中产生的碳链长度减少两个的(R)-3-羟基-脂酰辅酶A,可以作为PHA合酶的底物用于聚合生产mcl-PHA。此外,解脂酵母拥有16个脂酶同工酶(lipases)负责催化甘油酯的酯键产生自由的脂肪酸和甘油;有6个脂酰辅酶A氧化酶同工酶(acyl-CoA oxidases,Aoxs),负责催化脂肪酸β-氧化的第一步限速反应,氧化脂肪酸为脂酰辅酶A[18-19]。因此,我们推测解脂酵母具有很强的生产mcl-PHA的潜力。本研究利用pINA1312载体上的zeta序列元件及hp4d组成型强启动子[20],在解脂酵母中异源表达来自铜绿假单胞菌PAO1(Pseudomonas aeruginosa PAO1)的、带有PTS1过氧化物酶体定位信号(SKL)的mcl-PHA合酶编码基因PhaC1,研究了重组解脂酵母利用脂肪酸和油脂作为底物生产mcl-PHA的能力。
1 材料与方法 1.1 菌种和质粒解脂酵母Y. lipolytica Po1h(URA3-)、W29(wide type)和质粒pINA1312由法国INRA实验室的Madzak Catherine教授馈赠。产mcl-PHA的PSOC重组酵母菌株为本实验构建。大肠杆菌E. coli DH5α用于常规的克隆和质粒构建。
1.2 质粒构建为保证来自P. aeruginosa PAO1的PHA合成酶基因能在耶氏酵母中正确高效表达,经过密码子优化的oPhaC1基因由南京金斯特公司合成(GenBank: KP784429.1)。采用引物P1(CCGGGATCCGCCACAAT GAGTCAGAAGAACAATAAC)和P2(CGGGGTACCCTA CAGCTTGGATCGTTCATGCACGTAGGT) PCR扩增两端分别带有BamHI和KpnI的目的片段(斜体部分标注酶切位点)。PCR条件为95℃预热5min,95℃ 15s,56℃ 30s,72℃ 90s,30个循环,最后72℃延伸10min。PCR产物经纯化后用BamHI和KpnI双酶切,连接到经同样双酶切的pINA1312载体上,转化E. coli DH5α,得到重组载体pINA1312-oPHA,并经过测序验证序列的准确性。
1.3 菌株工程采用限制性内切核酸酶NotI于37℃单酶切重组载体pINA1312-oPHA,获得线性化片段,借助乙酸锂法转化Y. lipolytica Po1h感受态细胞,然后涂布YNBD基本培养基平板,30℃培养3天。挑取单克隆,用天根生物公司的酵母基因组提取试剂盒(TIANamp Yeast DNA Kit)提取酵母基因组,进行验证PCR,获得的阳性转化子即为重组酵母PSOC。
1.4 发酵培养E. coli DH5α的培养用LB培养基,添加25mg/L的卡那霉素用于质粒维持。酵母转化筛选和种子培养分别用YNBD基本培养基和YPD完全培养基。YNBD含有0.67%(m/V)YNB(Yeast Nitrogen Base without Amino Acids),0.2%(m/V)酸水解酪素(casamino acid),2%(m/V)葡萄糖。YPD培养基含1%(m/V)酵母粉,2%(m/V)蛋白胨,根据需要添加2%或5%的葡萄糖(YPD2或YPD5)。在YPD培养基中添加不同浓度的油酸(0.1%~1.0%,m/V)用于mcl-PHA的发酵。YPTo培养基含有1%酵母粉、2%蛋白胨、2%或5%(V/V)三油酸甘油酯(Triolein)。10%的油酸(0.5%吐温80)母液和25%的三油酸甘油酯(1.5%吐温80)母液需要在冰上超声波乳化15min,并单独灭菌。
1.5 mcl-PHA发酵与分析首先在YPD平板过夜培养活化酵母,然后用接种环挑取单克隆接种至含有50ml YPD2液体培养基的锥形瓶中,30℃培养16~20h。离心收集菌体,用无菌水洗一遍,以5%的接种量接种发酵培养基,30℃、200r/min发酵培养72h。离心收集菌体,冻干后用于PHA检测。
采用GC检测mcl-PHA的含量,其含量定义为mcl-PHA占细胞干重的百分比(wt% DCW)[6-7]。经冻干的细胞首先用65℃甲醇处理4~5遍以去除菌体内的中性脂、游离脂肪酸与脂酰基辅酶A,而PHA不溶于甲醇。离心去除甲醇后,准确称取15mg干细胞于甲酯化专用小瓶内,加入1ml氯仿、1ml含3%(V/V)硫酸的甲醇溶液,100℃处理1h。待样品冷却至室温后,加入1ml蒸馏水,漩涡振荡10min,萃取残留的细胞碎片。静置分层后,用移液枪将氯仿相转移到GC分析专用小瓶中。GC分析仪为带有AOC-20i自动进样器的Shimadzu GC2010气相色谱仪(Kyoto,Japan),柱子为RestekRxi-5色谱柱。检测条件为: 60℃维持3min,每分钟10℃的速率从60℃升到260℃,然后维持6min。PHA标准品(Sigma-Aldrich)也用同样的方法分析。
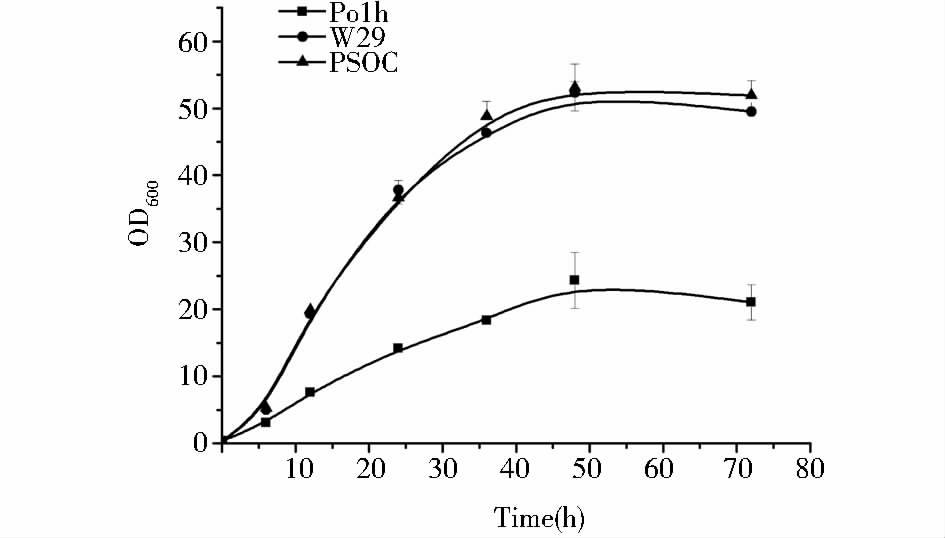
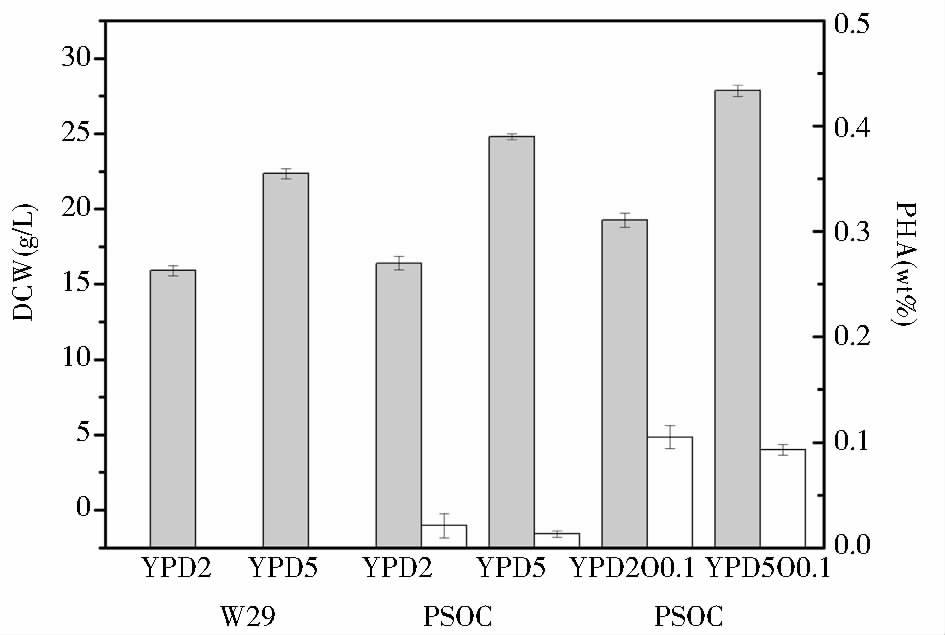
2 结果与分析 2.1 构建产PHA的菌株及mcl-PHA发酵耶氏解脂酵母的脂肪酸β-氧化在过氧化物酶体中进行,它的中间产物(R)-3-羟基-脂酰辅酶A是mcl-PHA生物合成的直接底物,只需外源引入定位至过氧化物酶体的mcl-PHA合成酶即可合成mcl-PHA。为保证外源PHA合成酶基因能在耶氏酵母中正确高效表达,在其C端添加PTS1过氧化物酶体定位信号序列,并对其编码基因PhaC1进行密码子优化得到oPhaC1。利用整合型载体pINA312,将携带优化后的PHA合成酶表达框转化Po1h受体菌,获得阳性转化子PSOC。在YPD5培养基中分析重组菌PSOC的细胞生长情形。由图 1可以看出,PSOC的菌体生长与野生型对照菌株W29非常相似,明显好于受体菌Po1h(URA3-)。三株菌皆在48h时细胞的生物量达到最大,PSOC和W29的最大OD600分别是Po1h的2.2倍和2.1倍。这说明在耶氏酵母细胞中表达外源基因oPhaC1并没有增加细胞的代谢压力,不影响菌体的正常生长。接下来,在YPD2和YPD5中进行了PSOC的mcl-PHA发酵实验。30℃振荡培养72h,离心收集菌体,冻干,GC分析。结果显示,PSOC在YPD5中可以获得比YPD2更高的生物量,分别是24.8g/L DCW(dried cell weight)和16.4 g/L DCW。含不同糖浓度的培养基产生的mcl-PHA相差较小,都不足0.02%PHA(wt%),而对照菌W29不产PHA(图 2)。向培养基中添加0.1%的油酸能明显增加mcl-PHA的产量,经GC分析测定胞内mcl-PHA为0.1%。实验进一步表明,mcl-PHA合酶在Po1h中得到有效表达,重组菌PSOC能利用脂肪酸的β-氧化中间产物(R)-3-羟基-脂酰辅酶A合成mcl-PHA,而葡萄糖作为单一碳源时,不能提供充足的前体物质,只能产生微量的mcl-PHA。
|
| 图 1 不同菌株在YPD5中的生长比较 Figure 1 Comparison of cell growth between strains of PSOC,W29 and Po1h |
|
| 图 2 发酵72h积累生物量和mcl-PHA的分析比较 Figure 2 Comparison of biomass and mcl-PHA accumulation in the strain PSOC and W29 wt%: The percentage of mcl-PHA content in the dried cell weight; O: Oleic acid |
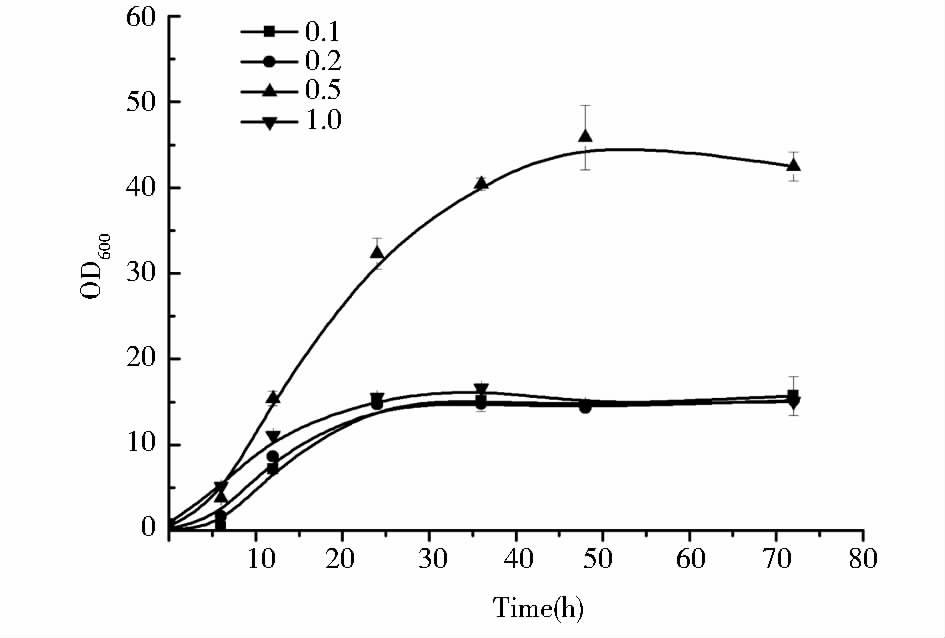
接种量过大或者过小均会影响发酵。过大可能会引起溶氧不足,影响产物合成,而且会过多移入代谢废物;过小会延长延滞期,甚至增加培养时间。首先在YPD5培养基中比较了不同初始OD600对细胞生长的影响。如图 3所示,初始接种量控制OD600为0.5时细胞生长最佳,能够获得最高的生物量。高生物量对积累mcl-PHA有利,因此选择初始OD600为0.5作为此后发酵的初始菌液浓度。
|
| 图 3 不同初始OD600对PSOC菌体生长的影响 Figure 3 Profiles of cell growth under different initial biomass |
油酸作为mcl-PHA发酵的相关底物,它的浓度大小直接影响PHA的发酵产量。由于油酸的溶解度较差,本组实验最高添加了0.5%油酸,考察油酸浓度为0.02%~0.5%时生产mcl-PHA的情形(图 4)。重组菌PSOC在YPD2和YPD5中mcl-PHA的产量随油酸浓度的增加而增加,在含0.5%油酸的培养基中产生最多的mcl-PHA,分别为0.67%和0.58%。YPD5培养基能积累较高的生物量,细胞干重最多达到32.8g/L。

|
| 图 4 重组菌PSOC在不同油酸含量的培养基中发酵生产mcl-PHA与细胞干重比较 Figure 4 Biomass and mcl-PHA accumulation of the strain PSOC in cultures with varied oleic acid wt%:The percentage of mcl-PHA content in the dried cell weight; O:Oleic acid |
向培养基中添加适量脂肪酸能有效增加mcl-PHA的产量。但是由于脂肪酸相对较贵、溶解度差,添加量较多时对细胞有毒害作用,而且发酵时需要葡萄糖作为辅助碳源,细胞才能更好的生长,获得较高的生物量。鉴于此,本实验选择三油酸甘油酯(一种代表性油脂)作为单一碳源进行mcl-PHA发酵。YPTo2和YPTo5培养基分别含有2%和5%的三油酸甘油酯。如表 1所列,在YPTo2和YPTo5中发酵72h的细胞干重分别为20.37g/L和35.24g/L,各产生占细胞干重1.45%和1.51%的mcl-PHA。底物浓度的不同主要影响菌体的生物量,对单位细胞内mcl-PHA的百分含量影响较小。YPTo5产生的mcl-PHA的终浓度最高,达到53.2mg/L。由PHA单体组成可以看出,3-羟基辛酸所占的摩尔百分比最大,这与所采用的PHA合成酶对(R)-3-羟基-辛酰辅酶A的底物专一性最高相一致[21]。
| 培养基 | DCW (g/L) | PHA (wt%) | PHA (mg/L) | 3HHx (mol%) | 3HO (mol%) | 3HD (mol%) | 3HDD (mol%) | 3HTD (mol%) |
| YPTo2 | 20.37 | 1.45 | 29.5 | 6.8 | 50.3 | 25.4 | 15.5 | 1.8 |
| YPTo5 | 35.24 | 1.51 | 53.2 | 7.0 | 49.1 | 26.6 | 15.4 | 2.0 |
| Note: DCW: dried cell weight; 3HHx: 3-hydroxyhexanoate; 3HO: 3-hydroxyoctanoate; 3HD: 3-hydroxydecanoate; 3HDD: 3-hydroxydodecanoate; 3HTD: 3-hydroxytetradecanoate | ||||||||
3 讨 论
mcl-PHA是一大类具有广泛应用的天然生物聚酯,可由一些假单胞菌利用自身的脂肪酸合成途径或β-氧化途径来合成。解脂酵母具有很好的脂/脂肪酸分解代谢能力,但是它缺乏PHA合成酶不能天然(intrinsic)合成mcl-PHA。利用酿酒酵母S. cerevisiae来生产mcl-PHA已有较为深入的研究。通过外源表达定位于过氧化物酶体的PHA合成酶编码基因,可以利用偶数碳原子数和奇数碳原子数的mcl-脂肪酸生产PHA[9-10]。但是PHA产量较低,最高只有细胞干重的0.45%PHA[9]。Haddouche等首次利用解脂酵母生产mcl-PHA,向YNB基本培养基中添加0.2%的十三碳脂肪酸,通过失活β-氧化途径中的MFE2复合体的(R)-3-羟基-酯酰辅酶A脱氢酶以及阻断脂合成途径来进一步提高mcl-PHA的产量[6, 18]。由于脂肪酸的β-氧化被阻断,本策略只能获得单一单体成分的mcl-PHA。
本文采用代谢工程策略构建重组解脂酵母,外源表达PHA合成酶基因PhaC1生产mcl-PHA。选择来自P. aeruginosa PAO1的PHA合成酶,在C端添加PTS1过氧化物酶体定位信号序列(SKL),使其在过氧化物酶体内发挥功能,以便PHA合成酶能更直接地获得前体物质(R)-3-羟基-脂酰辅酶A。利用pINA1312载体构建表达框,借助载体上的zeta元件将PhaC1基因表达框整合至酵母基因组,完成基因的稳定表达,构建重组菌PSOC。PSOC在葡萄糖为唯一碳源的培养基中几乎不产PHA,补加0.1%的油酸时可合成占细胞干重0.1%的mcl-PHA,进一步增加油酸浓度最高产生0.58% mcl-PHA。GC分析mcl-PHA的组成发现,在所有的条件下,(R)-3-羟基-辛酰辅酶A单体的含量最大(50%左右),这验证了P. aeruginosa PAO1的最适底物是(R)-3-羟基-辛酰辅酶A[21]。
在以往的研究中,mcl-PHA发酵一般都选择不同链长的脂肪酸作为相关底物。由于脂肪酸的低溶解度、相对较贵,并且添加量较多时对细胞有毒害作用,本研究又选择三油酸甘油酯作为单一底物发酵生产mcl-PHA。实验结果证实,油脂作为较为廉价的碳源可以被重组菌PSOC利用,同时得到高的生物量和PHA产量。在YPTo5培养基中发酵72h细胞干重为35.24g/L,mcl-PHA含量为1.51%,相当于发酵液中产生了53.2mg/L PHA。油脂作为mcl-PHA发酵底物用于PHA的扩大生产具有非常大的潜力。
本文所构建的重组解脂酵母只是外源引入了PHA合成酶,并未对酵母自身的脂利用/合成、脂肪酸代谢途径进行任何修饰。下一步的工作,包括基因敲除中性脂的合成途径、过量表达脂肪酸β-氧化的限速步骤[脂酰辅酶A氧化酶(AOXs)],都将会提高酵母的脂肪酸利用水平进而增加mcl-PHA的产量。
致谢 本项目同时得到山东大学微生物技术国家重点实验室开放课题(M2014-03)和临沂大学博士启动基金(LYDX2013BS028)资助。
| [1] | Wang Q, Luan Y Q, Cheng X L, et al. Engineering of Escherichia coli for the biosynthesis of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) from glucose. Appl Microbiol Biotechnol,2015, 99 (6) : 2593 –2602. |
| [2] | Hazer B, Steinbuchel A. Increased diversification of polyhydroxyalkanoates by modification reactions for industrial and medical applications. Appl Microbiol Biotechnol,2007, 74 (1) : 1 –12. |
| [3] | Gao X, Chen J C, Wu Q, et al. Polyhydroxyalkanoates as a source of chemicals, polymers, and biofuels. Curr Opin Biotechnol,2011, 22 (6) : 768 –774. |
| [4] | Wang Q, Tappel R C, Zhu C, et al. Development of a new strategy for production of medium-chain-length polyhydroxyalkanoates by recombinant Escherichia coli via inexpensive non-fatty acid feedstocks. Appl Environ Microbiol,2012, 78 (2) : 519 –527. |
| [5] | Wang Q, Zhuang Q Q, Liang Q F, et al. Polyhydroxyalkanoic acids from structurally-unrelated carbon sources in Escherichia coli. Appl Microbiol Biotechnol,2013, 97 (8) : 3301 –3307. |
| [6] | Haddouche R, Poirier Y, Delessert S, et al. Engineering polyhydroxyalkanoate content and monomer composition in the oleaginous yeast Yarrowia lipolytica by modifying the β-oxidation multifunctional protein. Appl Microbiol Biotechnol,2011, 91 (5) : 1327 –1340. |
| [7] | Zhuang Q Q, Wang Q, Liang Q F, et al. Synthesis of polyhydroxyalkanoates from glucose that contain medium-chain-length monomers via the reversed fatty acid beta-oxidation cycle in Escherichia coli. Metab Eng,2014, 24 : 78 –86. |
| [8] | Langenbach S, Rehm B H, Steinbüchel A. Functional expression of the PHA synthase gene phaC1 from Pseudomonas aeruginosa in Escherichia coli results in poly(3-hydroxyalkanoate) synthesis. FEMS Microbiol Lett,1997, 150 (2) : 303 –309. |
| [9] | Poirier Y, Erard N, Petetot J M. Synthesis of polyhydroxyalkanoate in the peroxisome of Saccharomyces cerevisiae by using intermediates of fatty acid beta-oxidation. Appl Environ Microbiol,2001, 67 (11) : 5254 –5260. |
| [10] | Zhang B, Carlson R, Srienc F. Engineering the monomer composition of polyhydroxyalkanoates synthesized in Saccharomyces cerevisiae. Appl Environ Microbiol,2006, 72 (1) : 536 –543. |
| [11] | Dulermo T, Nicaud J M. Involvement of the G3P shuttle and beta-oxidation pathway in the control of TAG synthesis and lipid accumulation in Yarrowia lipolytica. Metab Eng,2011, 13 (5) : 482 –491. |
| [12] | Groguenin A. Genetic engineering of the β-oxidation pathway in the yeast Yarrowia lipolytica to increase the production of aroma compounds. Journal of Molecular Catalysis B: Enzymatic,2004, 28 : 75 –79. |
| [13] | Gardini F, Suzzi G, Lombardi A, et al. A survey of yeasts in traditional sausages of southern Italy. FEMS Yeast Research,2001, 1 (2) : 161 –167. |
| [14] | Xue Z, Sharpe P L, Hong S P, et al. Production of omega-3 eicosapentaenoic acid by metabolic engineering of Yarrowia lipolytica. Nat Biotechnol,2013, 31 (8) : 734 –740. |
| [15] | Beopoulos A, Verbeke J, Bordes F, et al. Metabolic engineering for ricinoleic acid production in the oleaginous yeast Yarrowia lipolytica. Appl Microbiol Biotechnol,2014, 98 (1) : 251 –262. |
| [16] | Zhang B X, Rong C C, Chen H Q, et al. De novo synthesis of trans-10, cis-12 conjugated linoleic acid in oleaginous yeast Yarrowia lipolytica. Microb Cell Fact,2012, 11 : 51 –58. |
| [17] | Zhang B X, Chen H Q, Li M, et al. Genetic engineering of Yarrowia lipolytica for enhanced production of trans-10, cis-12 conjugated linoleic acid. Microb Cell Fact,2013, 12 : 70 –71. |
| [18] | Haddouche R, Delessert S, Sabirova J, et al. Roles of multiple acyl-CoA oxidases in the routing of carbon flow towards beta-oxidation and polyhydroxyalkanoate biosynthesis in Yarrowia lipolytica. FEMS Yeast Res,2010, 10 (7) : 917 –927. |
| [19] | Fickers P, Marty A, Nicaud J M. The lipases from Yarrowia lipolytica: genetics, production, regulation, biochemical characterization and biotechnological applications. Biotechnol Adv,2011, 29 (6) : 632 –644. |
| [20] | Madzak C, Gaillardin C, Beckerich J M. Heterologous protein expression and secretion in the non-conventional yeast Yarrowia lipolytica: a review. J Biotechnol,2004, 109 (1) : 63 –81. |
| [21] | Marchesini S, Poirier Y. Futile cycling of intermediates of fatty acid biosynthesis toward peroxisomal beta-oxidation in Saccharomyces cerevisiae. J Biol Chem,2003, 278 (35) : 32596 –32601. |
 2016, Vol. 36
2016, Vol. 36




