文章信息
- 张晓敏, 王世勇, 李根, 赵红斌.
- ZHANG Xiao-min, WANG Shi-yong, LI Gen, ZHAO Hong-bin.
- Ⅰ型胶原/聚己内酯/凹凸棒石复合支架材料体外诱导成骨的研究
- The Study of Osteogenic Induction of Type Ⅰ Collagen /Poly(caprolactone)/Attapulgite Composite Scaffold Materials in Vitro
- 中国生物工程杂志, 2016, 36(5): 27-33
- China Biotechnology, 2016, 36(5): 27-33
- http://dx.doi.org/DOI:10.13523/j.cb.20160504
-
文章历史
- 收稿日期: 2016-01-11
- 修回日期: 2016-03-02
2. 兰州军区兰州总医院骨科研究所 兰州 730050
2. Institute of Orthopedics, General Hospital of Lanzhou Military Command of the PLA, Lanzhou 730050, China
骨组织工程支架材料是目前组织工程研究的热点[1]。良好的骨支架材料应具有三维多孔结构、良好的生物相容性和骨诱导性[2-3]。凹凸棒石(attapulgite,ATP),是一种含水富镁铝硅酸盐层状黏土矿物,其具有一定的粘性和可塑性,比表面积大,具有一定孔道的纳米材料。提纯的ATP为粉末,化学性能强,黏结力强,具有较强的吸附能力。ATP富含的Si、Mg等微量元素对骨的生长、再生有重要影响[4-5]。基于ATP的理化特征,将ATP作为骨组织工程材料是一种新的尝试,目前尚未见相关的研究报道。胶原(collagen,Col),是骨组织的主要成分,对骨的形成有良好的促进作用[6]。聚己内酯[poly(caprolactone),PCL],由于黏性大、具有一定的柔软性和力学强度,能有效提升材料的机械性能[7]。
基于以上理由,本实验利用溶液浇铸-粒子滤沥法构建ColⅠ/PCL/ATP复合支架材料,通过体外细胞实验评价材料的细胞相容性和成骨效应的影响,旨在获得ATP做为骨修复材料的可行性,以期将ATP用于骨组织工程材料修复骨缺损。
1 材料与方法 1.1 仪器及试剂Ⅰ型胶原(猪皮中提取)、聚己内酯(SIGMA-ALDRICH)、六氟异丙醇(SIGMA-ALDRICH)、D-MEM/F12(GibcoLife Technologies)、胎牛血清(四季青 浙江天杭生物科技有限公司)、冷冻干燥机(中国军事医学科学院实验仪器厂)、JSM5600LV低真空扫描电镜(JEOL公司 日本)、显微镜(倒置IX71、UIS光学系统 BX51 OLYMPUS)、二氧化碳培养箱(Forma371 美国)、Epoch超微量微孔板分光光度计(美国伯爵仪器有限公司)、ABI7300实时荧光定量PCR系统(美国应用生物系统公司)。
1.2 材料的制备ColⅠ0.9g、PCL 0.6g按3∶2溶于15ml的六氟异丙醇(纯度≥99%、浓度1.596g/ml)形成0.1%(m/V)的溶液,分别添加0g、0.17g、0.64g的ATP,磁力搅拌器搅拌过夜。加入2.5g NaCl作为致孔剂,搅拌并超声分散使其均匀分布。将混合物倒入玻璃皿中,并不停搅拌,待80%的HFIP挥发后,装入直径为13mm的模具中,待其干燥凝固后,切成2mm厚的圆形薄片。通风厨中放置3~5h,置37℃烘箱中烘干24h,尽量除去残余HFIP。超纯水脱盐72h,0.1% AgNO3检测洗脱液至无盐洗出,冷冻,真空干燥,得到三种含不同ATP(0%wt、10%wt、30%wt)的支架材料,60Co照射后,常温密封保存备用。
1.3 方 法 1.3.1 D1细胞的培养小鼠骨髓间充质干细胞D1细胞系(CRL-10915,美国ATCC公司)。D1细胞复苏后培养于D/F12完全培养基(10%胎牛血清和1%青霉素-链霉素双抗),置于37℃、5% CO2饱和湿度条件培养箱中培养,每周更换5次培养液,待80%的细胞融合后,0.25%胰蛋白酶消化,按1∶2比例传代培养。
1.3.2 CCK-8检测支架材料上D1细胞的增殖活性将3mm×3mm×2mm的不同ATP材料置96孔板中D/F12半培养基(1%青霉素-链霉素双抗)预湿,设4个复孔,吸取100μl传至第3代的浓度为6×105个/ml的细胞悬液接种于材料上,加入100μl D/F12完全培养基,孵育12h后,材料移至新的96孔板中,加入200μl D/F12完全培养基,37℃、5% CO2饱和湿度条件培养箱中培养,隔2天换液。分别于1~6天时将材料转移到新孔中,加入100μl D/F12完全培养基和10μl CCK-8试剂,37℃培养箱中孵育4h后,每孔吸出80μl到新孔中,于酶标仪450nm处测光密度值。
1.3.3 SEM观察细胞复合支架材料将不同ATP含量的支架材料置于12孔板内用D/F12半培养基预湿,设4个复孔,吸取1ml传至第3代浓度为4×105个/ml D1细胞悬液接种于支架材料上,加入4ml D/F12完全培养基,于37℃,5% CO2饱和湿度条件培养箱中培养,隔2天换液。7天后随机取出材料,2.5% 戊二醛固定24h,脱水、冷冻干燥后制成样品,喷金后SEM观察细胞的黏附性及形态。
1.3.4 H&E和鬼笔环肽染色观察材料与细胞共培养7天后随机取出,4%多聚甲醛固定,石蜡包埋切片,常规脱蜡;切片标本分别行苏木精-伊红染色(H&E)和鬼笔环肽染色。 鬼笔环肽染色按照如下方法进行:0.02mol/L PBS洗3次,5min/次;0.01% TritonX-100作用10min,0.02mol/L PBS洗3次,5min/次;0.02mol/L PBS稀释的1ml 50μg/ml鬼笔环肽(DMSO溶解)鬼笔环肽染色30min,0.02mol/L PBS洗3次,5min/次,0.02mol/L PBS稀释的1ml 5μg/ml DAPI室温避光染核10min,0.02mol/L PBS洗3次,每次5min;50%甘油磷酸缓冲液封片,荧光显微镜下观察拍照。显微镜下观察H&E染色结果并拍照。
1.3.5 实时荧光定量PCR检测不同ATP含量的支架材料于12孔板内用D/F12半培养基预湿,设4个复孔,吸取1ml传至第3代浓度为5×105个/ml的D1细胞悬液接种于材料上,再吸取1ml细胞悬液加入培养皿中,加入4ml D/F12完全培养基培养,隔2天换液。培养皿中细胞与材料上细胞共培养7天、14天、21天后,利用Trizol法裂解材料上和培养皿中细胞提取总RNA,紫外分光光度仪分别检测RNA的浓度和OD260/OD280值,分装后-80℃保存备用。根据Prime ScriptTM RT Master Mix试剂盒说明书进行反转录合成cDNA(反应体系10μl,反应条件:37℃ 15min,85℃ 5s,4℃ 10min)。利用试剂盒SYBR Premix Ex TaqTM Real-time PCR试剂盒进行基因扩增。反应体系20μl;反应条件:95℃预变性30s,95℃变性5s,60℃退火31s,40个循环;引物序列:Runx-2(F:5′-CTGCAAGCAGTATTTACAACA GAGG-3′;R:5′-GGCTCACGTCGCTCATCTT-3′);Osterix (F:5′-AGGCCTTTGCCAGTGCCTA-3′;R:5′-GCCAGATG GAAGCTGTGAAGA-3′),ALP(F:5′-GCAGTATGAATTGAATCGGAACAAC-3′;R:5′-ATGGCCTGGTCCATCTCCAC-3′),OC(F:5′-ACCATCTTTCTGCTCACTCTGCT-3′;R:5′-CCTTATTGCCCTCCTGCTTG-3′),OPN(F:5′-TACGA CCATGAGATTGGCAGTGA-3′;R:5′-TATAGGATCTGGG TGCAGGCTGTAA-3′),Col(F:5′-GACATGTTCAGCTTT GTGGACCTC-3′R:5′-GGGACCCTTAGGCCATTGTGTA-3′),GAPDH(F:5′-CACCACCAACTGCTTAGC-3′;R: 5′-TTCACCACCTTCTTGATGTC-3′)。每组实验重复4次,所得CT值采用2-△△CT方法进行数据处理[8]。
1.3.6 统计学分析采用SPSS 20统计软件进行数据分析,结果以±s表示,采用单因素方差分析,多重比较采用LSD法,以P<0.05为差异性显著,结果具有统计学意义。
2 结 果 2.1 支架材料的形貌干态下支架材料为浅灰色,无特殊气味;触摸时无ATP材料均有一定柔性,可见大小不等的孔隙[图 1(a)],随着ATP含量的增加材料的柔韧性降低,硬度明显增强,结构致密均匀、大小不等的孔隙均匀分布其表面[图 1(b)、1(c)]。

|
| 图 1 ColⅠ/PCL/ATP支架材料的形貌图 Figure 1 The general observation of ColⅠ/PCL/ ATP scaffold materials (a) 0% wt ATP (b) 10% wt ATP (c) 30% wt ATP |
CCK-8检测结果显示,细胞复合于支架材料1~3天时,细胞在不同材料中增殖差异无统计学差异(P>0.05);复合培养4~6天时,30%wt ATP 组支架材料细胞增殖率与0%wt和10%wt ATP组支架材料相比差异具有显著的统计学意义(P<0.05),结果见图 2。

|
| 图 2 支架材料上细胞的增殖 Figure 2 Proliferation of cells on scaffold materials |
细胞与支架材料共培养7天时,SEM结果显示,细胞能在材料表面黏附生长,且呈梭形,其中含ATP材料的细胞数量明显多于无ATP材料的,30%wt ATP材料表面细胞呈多层覆盖且完全融合,结果见图 3。图 3为不接种细胞的支架材料在D/F12完全培养基中浸泡7天后的SEM,从图中可以看出,材料为多孔结构,浸泡之后营养物质贴附在材料表面,更利于细胞的黏附生长。

|
| 图 3 支架材料表面D1细胞的黏附及支架材料在D/F12浸泡后的SEM图(×1 000、×2 000) Figure 3 The SEM observation of D1 cell adhesion on the scaffold materials surface and materials immersed in D/F12 (×1 000,×2 000) (a) 0% wt ATP (b) 10% wt ATP (c) 30% wt ATP |
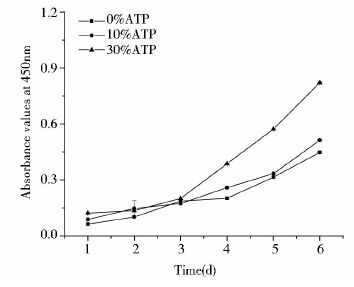
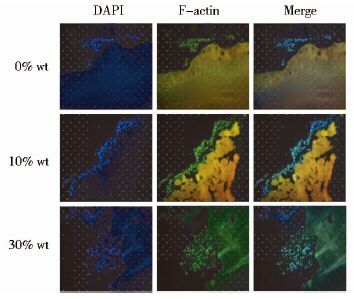
荧光染色结果见图 4,DAPI标记细胞核呈蓝色,鬼笔环肽标记细胞骨架F-actin呈绿色,结果显示含ATP材料细胞数量明显多于无ATP材料的,且材料内可见部分细胞侵润、生长。H&E染色结果与荧光染色结果一致,见图 5。
|
| 图 4 D1细胞在支架材料表面的生长(鬼笔环肽染色 ×200) Figure 4 D1 cell growth on the surface of the scaffold materials (Phalloidin staining × 200) |
|
| 图 5 D1细胞在支架材料表面的生长(H&E ×100) Figure 5 D1 cell growth on the surface of the scaffold materials (H&E ×100) (a) 0% wt ATP (b) 10% wt ATP (c) 30% wt |
Real-time PCR结果显示,7天时30% ATP材料组Runx-2 mRNA表达水平明显上调,与其他组和14天、21天时比较差异极显著(P<0.01),21天时表达水平下调;21天时0%、10% ATP材料组表达水平上调,与7天、14天时比较差异具有统计学意义,结果见图 6(a);14天和21天 时,30% ATP材料组Osterix mRNA表达水平明显上调,与其他组和7天比较差异极显著(P<0.01),结果见图 6(b);14天时30% ATP材料组ALP mRNA表达水平明显上调,与其他组和7天、21天时比较差异极显著(P<0.01),21天时表达水平下调;21天时0%、10% ATP材料组表达水平上调,10% ATP材料组与0%ATP组相比差异极显著(P<0.01),结果见图 6(c);21天时复合ATP材料组Col I mRNA表达水平显著上调,与其他组和7天、14天时比较差异极显著(P<0.01),尤其是30%ATP材料组,且Col I mRNA表达水平上调有时间和ATP剂量依赖效应,结果见图 6(d);14天和21天 时,复合ATP材料组OPN和OC mRNA表达水平与7天时比较显著上调(P<0.01),且OPN和OC mRNA表达水平上调具有时间和ATP剂量依赖效应,结果见图 6(e)和(f)。
|
| 图 6 成骨基因的相对表达量 Figure 6 The relative expression of osteoblastic genes |
理想的支架材料需具备的条件[9]:①有良好的生物相容性;②低免疫原性;③良好的骨传导性和骨诱导性;④有一定的机械耐受性;⑤易于制备加工塑形成需要的形状和大小。基于骨支架材料的上述要求,本实验以ATP为主要材料构建了ColⅠ/PCL/ATP复合材料,主要利用上述材料的独特性能制备一种新型的骨修复材料,其理由一是ColⅠ是骨组织的有机成分,有利于骨的形成和再生[10];二是PCL是FDA认证的具有良好生物相容性和安全性的合成高分子聚合物,具有一定的柔软性能有效提高材料的力学性能[11];三是ATP属硅酸盐无机物,无毒性,已广泛用于医学、食品等行业[12],特别是ATP具有纳米结构,其比表面积大,形成通道易于细胞的生长和组织形成,同时ATP富含SiO 和Ca2+、Mg2+等多种离子。有研究表明,一定浓度的Mg离子可促进BMP-2的表达,具有诱导动物机体新骨生成的能力[5];不同浓度的Si离子在细胞培养基质中诱导出现不同程度的矿化钙结节[13];以Si为基础的生物陶瓷[14]、生物玻璃[15]和纳米硅材料[16]能够刺激成骨分化和体内骨生成;生物活性材料Si能够强烈诱导体外成骨分化和类骨细胞的矿物沉积[17-18]。
本实验结果表明,细胞接种于复合支架材料上共培养后,SEM观察到细胞在支架材料上能很好的黏附生长;CCK-8结果表明细胞在复合ATP支架材料上增殖速率快,支架材料能促进细胞的增殖,特别是含30%wt ATP材料细胞的黏附、生长和增殖效率更为明显。复合ATP的材料具有良好的细胞相容性,该结果提示,复合ATP具有促进细胞黏附、生长和增殖的作用,其原因可能是:
①ATP具有一定黏性,能有效吸附细胞提高了细胞与材料的黏附性能;②ATP的物理特性,即形状为纳米级、大的比表面积和一定的孔道决定了细胞易于在材料内进行营养和代谢物的交换,加速细胞的生长和增殖。
Runx-2和Osterix是成骨细胞分化的关键调控基因,Runx-2是成骨细胞分化的早期调控基因,其表达水平的上调决定细胞向成骨细胞和软骨细胞分化。Osterix是调控细胞向成骨细胞分化的关键基因[19-20],Osterix表达水平的上调决定了细胞向成骨细胞分化,而不是分化为软骨细胞。本实验Real-time PCR结果表明,ATP能促进细胞Runx-2 mRNA早期表达,Osterix则相反,其在后期表达水平明显上调。该结果提示:ATP具有诱导干细胞向成骨细胞定向分化的作用。ALP、Col I、OC和OPN是成骨细胞的标志分子,分化早期主要是ALP表达,ALP被认为是细胞外基质成熟的早期标志[21];分化晚期,细胞进入矿化期,细胞内的ALP活性下降,而与细胞外基质中羟磷灰石沉积相关的基因表达显著上调[22]。该实验结果表明,细胞与材料作用的早期,ATP能有效促进ALP mRNA的表达,相反在细胞与材料作用的后期,Col I、OC和OPN mRNA的表达明显上调,其中OC和OPN mRNA表达的上调具有时间和剂量依赖正效应。以上结果提示,ATP能明显促进干细胞向成骨细胞定向分化,且分化效应一定程度上与ATP的水平有剂量依赖性。ATP促进干细胞向成骨细胞定向分化的机制可能有以下原因:①与ATP的物理特性有关;②ATP富含的SiO和Ca2+、Mg2+等多种离子,是生命活动的重要离子,这些离子与细胞单独或协同作用有可能促进细胞向成骨细胞定向分化;③ATP的空间结构具有多层富含SiO的八面体结构,同时含有内H2O和外H2O层,ATP的特殊空间结构有可能决定细胞向成骨细胞定向分化。本实验首次证明ATP能诱导细胞向成骨细胞定向分化,但是由于其诱导效应有可能是由多因素决定,揭示并阐明其分子机制对ATP的应用具有重要的理论和现实价值,也是我们下一步深入研究的方向和目标。
综上所述,构建的ColⅠ/PCL/ATP复合多孔支架材料具有良好的细胞相容性和骨诱导性,有望成为较理想的组织工程骨缺损修复材料。
| [1] | 朴成哲, 刘军, 刘新, 等. 骨髓间充质细胞复合胶原--壳聚糖材料联合骨搬移修复胫骨缺损:随机对照实验方案. 中国组织工程研究,2015, 19 (32) : 5231 –5235. Piao C Z, Liu J, Liu X, et al. Bone marrow mesenchymal stem cells/collagen/chitosan combined with bone transport for tibial defect repair: study protocol for a randomized controlled trial. Chinese Journal of Tissue Engineering Research,2015, 19 (32) : 5231 –5235. |
| [2] | 李家锋, 徐金霞, 管海虹, 等. 纳米羟基磷灰石/聚己内酯复合大鼠骨髓间充质干细胞的生物相容性. 中国组织工程研究,2012, 16 (38) : 7042 –7046. Li J F, Xu J X, Guan H H, et al. Biocompatibility of nano hydroxyapatite/polycaprolactone compounded with rat bone marrow mesenchymal stem cells. Chinese Journal of Tissue Engineering Research,2012, 16 (38) : 7042 –7046. |
| [3] | 郭宜姣, 李文华. 骨缺损修复生物工程研究进展. 中国骨质疏松杂志,2014, 20 (8) : 988 –993. Guo Y J, Li W H. Research progress of biological engineering on bone defect repairing. Chinese Journal of Osteoporosis,2014, 20 (8) : 988 –993. |
| [4] | Carlisle E M. Silicon: an essential element for the chick. Science,1972, 178 (4061) : 619 –621. |
| [5] | 洪岩松, 杨柯, 张广道, 等. 可降解镁合金的动物体内骨诱导作用. 金属学报,2008, 44 (9) : 1035 –1041. Hong Y S, Yang K, Zhang G D, et al. The role of bone induction of a biodegradable magnesium alloy. Acta Metallurgica Sinica,2008, 44 (9) : 1035 –1041. |
| [6] | Green J, Schotland S, Stauber D J, et al. Cell-matrix interaction in bone: type I collagen modulates signal transduction in osteoblast-like cells. American Journal of Physiology-Cell Physiology,1995, 268 (5) : C1090 –C1103. |
| [7] | Ruckh T T, Carroll D A, Weaver J R, et al. Mineralization content alters osteogenic responses of bone marrow stromal cells on hydroxyapatite/polycaprolactone composite nanofiber scaffolds. Journal of Functional Biomaterials,2012, 3 (4) : 776 –798. |
| [8] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 method. Methods,2001, 25 (4) : 402 –408. |
| [9] | 王欢, 林宏生, 查振刚, 等. 聚左旋乳酸/壳聚糖纳米纤维三维多孔支架复合骨髓间充质干细胞修复兔骨缺损. 中国组织工程研究,2012, 16 (8) : 1331 –1335. Wang H, Lin H S, Zha Z G, et al. Three-dimensional porous poly(L-lactic acid)/chitosan nanofiber scaffolds combined with bone marrow mesenchymal stem cells in repairing of bone defects. Chinese Journal of Tissue Engineering Research,2012, 16 (8) : 1331 –1335. |
| [10] | Daei-Farshbaf N, Ardeshirylajimi A, Seyedjafari E, et al. Bioceramic-collagen scaffolds loaded with human adipose-tissue derived stem cells for bone tissue engineering. Molecular Biology Reports,2013, 41 (2) : 741 –749. |
| [11] | Ye L, Zeng X, Li H, et al. Fabrication and biocompatibility of nano non-stoichiometric apatite and poly (ε-caprolactone) composite scaffold by using prototyping controlled process. Journal of Materials Science: Materials in Medicine,2009, 21 (2) : 753 –760. |
| [12] | Jin X, Hu X R, Wang Q W, et al. Multifunctional cationic polymer decorated and drug intercalated layered silicate (NLS) for early gastric cancer prevention. Biomaterials,2014, 35 (10) : 3298 –3308. |
| [13] | Han P P, Wu C T, Xiao Y. The effect of silicate ions on proliferation,osteogenic differentiation and cell signalling pathways (WNT and SHH) of bone marrow stromal cells. Biomaterials Science,2013, 1 (4) : 379 –392. |
| [14] | Pietak A K, Reid J W, Stott M J, et al. Silicon substitution in the calcium phosphate bioceramics. Biomaterials,2007, 28 (28) : 4023 –4032. |
| [15] | Hench J J, Hench J W, Greenspan D C. Bioglass: a short history and bibliography. Journal of the Australasian Ceramic Society,2004, 40 (1) : 1 –42. |
| [16] | Slowing I, Vivero-Escoto J C, Lin V, et al. Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers. Advanced Drug Delivery Reviews,2008, 60 (11) : 1278 –1288. |
| [17] | Wiens M, Wang X H, Schr der H C, et al. The role of biosilica in the osteoprotegerin/RANKL ratio in human osteoblast-like cells. Biomaterials,2010, 31 (30) : 7716 –7725. |
| [18] | Wang X H, Schr der H C, Müller W E G. Enzyme-based biosilica and biocalcite: biomaterials for the future in regenerative medicine. Trends in biotechnology,2014, 32 (9) : 441 –447. |
| [19] | Nakashima K, Zhou X, Kunkel G, et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation:cell. Cell,2002, 108 (1) : 17 –29. |
| [20] | 张驰. 成骨细胞特异性转录因子Osterix对骨形成作用的分子机制. 北京大学学报(医学版),2012, 44 (5) : 659 –665. Zhang C. Molecular mechanisms of osteoblast-specific transcription factor Osterix effect on bone formation. Journal of PEKING University(Healty Sciences),2012, 44 (5) : 659 –665. |
| [21] | Shi M, Zhou Y, Shao J, et al. Stimulation of osteogenesis and angiogenesis of hBMSCs by delivering Si ions and functional drug from mesoporous silica nanospheres. Acta Biomaterialia,2015, 21 (15) : 178 –189. |
| [22] | Jensen T, Baas J, Dolathshahi‐Pirouz A, et al. Osteopontin functionalization of hydroxyapatite nanoparticles in a PDLLA matrix promotes bone formation. Journal of Biomedical Materials Research Part A,2011, 99 (1) : 94 –101. |
 2016, Vol. 36
2016, Vol. 36




