文章信息
- 李娅莎, 刘星, 毕杨, 杨珂, 赵丽, 龚梦嘉, 郭绮.
- LI Ya-sha, LIU Xing, BI Yang, YANG Ke, ZHAO Li, GONG Meng-jia, GUO Qi.
- BMP9诱导人脐带间充质干细胞体内外成骨分化的作用研究
- BMP9 Induced the Osteogenic Differentiation of Human Umbilical Cord Mesenchymal Stem Cells in vitro and vivo
- 中国生物工程杂志, 2016, 36(5): 20-26
- China Biotechnology, 2016, 36(5): 20-26
- http://dx.doi.org/DOI:10.13523/j.cb.20160503
-
文章历史
- 收稿日期: 2015-10-29
- 修回日期: 2015-12-10
2. 重庆医科大学附属儿童医院骨科 重庆 400014;
3. 重庆医疗器械质量检验中心 重庆 401127
2. Department of Orthopaedic Surgery, The Children's Hospital of Chongqing Medical University, Chongqing 400014, China;
3. Chongqing Quality Testing Inspection Centrer for Medical Devices, Chongqing 401127, China
骨损伤尤其是骨折是临床的常见病、多发病,给患者带来极大痛苦,因此如何加快骨折愈合、防治骨不连是目前迫切需要解决的问题。人脐带间充质干细胞具有取材方便、对供体无伤害、无伦理学争议、相对纯净及免疫原性更低[1]等优点,我们选择其作为临床治疗骨缺损疾病的理想种子细胞,目前hUC-MSCs已经有较为成熟的成骨分化的培养基,但是移植到体内后失去外源性干预因素则无法保持持续的分化能力,因此我们设想找到一类细胞因子能有效持续的诱导UC-MSC向成骨细胞分化。骨形态发生蛋白(bone morphogenetic protein,BMP)在器官发育、干细胞增殖和多向分化过程中起着重要的作用,本课题组在前期实验中明确人骨形态发生蛋白9(bone morphogenetic proteins 9,BMP9)诱导间充质干细胞成骨分化作用明显强于其他家族成员[2],探讨BMP9诱导UC-MSCs成骨分化的作用和修复骨损伤的能力具有重要的潜在临床应用价值。
1 材料与方法 1.1 材 料人脐带间充质干细胞来源于重庆市干细胞治疗工程技术研究中心,重组腺病毒Ad-BMP9、Ad-GFP均由美国芝加哥大学分子肿瘤研究室提供,本研究室保存;裸鼠饲养于重庆医科大学儿童医院动物实验中心,雌性,4~6周大。胎牛血清、DMEM/F12培养基均购自Gibco公司;Polybrene、茜素红S、维生素C、β-甘油磷酸钠等均购自Sigma公司;ALP化学发光检测试剂盒购自BD公司;α-Goat IgG-Biotin,α-Mouse IgG-Biotin,anti-Osteocalcin,anti-Osteopotin均购自Santa Cruz Genome公司;Masson Trichrome染色、Alcain Blue染色试剂盒购自北京雷根生物技术有限公司。
1.2 方 法 1.2.1 UC-MSCs的分离培养和重组腺病毒的感染hUC-MSCs细胞的分离培养和鉴定方法如前所述[3],将P3~9代hUC-MSCs细胞按50%接种于DMEM/F12培养基(10%Aus FBS,100units of Penicillin和100mg of Streptomycin)中,将BMP9或GFP基因表达的重组腺病毒Ad-BMP9或Ad-GFP重组腺病毒分别感染hUC-MSCs,使用的Ad-GFP是仅携带GFP荧光蛋白的空载体腺病毒,感染24h后,用荧光显微镜检测GFP 表达情况以观察Ad-BMP9或Ad-GFP的感染率。
1.2.2 ALP活性定量检测将P3~9代hUC-MSCs以20%~30%的细胞密度接种至24孔板中,分为Ad-BMP9和Ad-GFP对照两组,每组3个重复,待细胞贴壁后用Ad-BMP9或Ad-GFP分别感染hUC-MSCs;感染后第3、5、7天的24孔板,裂解细胞后离心取上清液,用碱性磷酸酶化学发光检测试剂盒(SEAP Chemiluminescent Assay Kit)检测ALP活性;
1.2.3 免疫组织化学染色检测OCN、OPG表达将P3~9代hUC-MSCs以20%~30%的细胞密度接种至12孔板中,按Ad-BMP9处理组和Ad-GFP阴性对照两组分别感染细胞,每组3个重复,感染后培养14天后进行OCN、OPG的免疫组织化学染色。
1.2.4 茜素红S染色实验将P3~9代hUC-MSCs以20%~30%的细胞密度接种至24孔板中,按实验分组分别进行Ad-BMP9和Ad-GFP感染,同时培养基中加入终浓度为 50g /ml的抗坏血酸和10mmol /L的β-磷酸甘油,培养至第21天,进行2%茜素红S染色,镜下观察并照相。
1.2.5 裸鼠皮下注射成骨模型的建立将P3~9代的UC-MSCs以50%的细胞密度接种至100mm2培养皿中,待细胞贴壁后根据分组Ad-GFP/Ad-BMP9分别感染细胞,2天后收集细胞,以PBS重悬细胞并计数,调整浓度至5×107cell/ml;将实验裸鼠随机分为2组,每组4只,分别为 Ad-BMP9感染细胞注射组、Ad-GFP感染细胞注射组(为阴性对照组),以裸鼠背部双侧皮下选取2个注射点,分别将100μl细胞悬液注射至皮下及后肢肌肉中,常规隔离饲养,每3~5天观察动物生存及皮下成骨包块生长情况,3~4周后处死,分离并固定皮下成骨包块。
1.2.6 Micro-CT扫描及分析裸鼠皮下成骨包块采用小动物活体断层扫描仪Scanco vivaCT 40进行扫描,扫描的空间分辨率为19μm,每个标本均进行360°等角度扫描,所有采集得到的数据重建后成为5123的图像柱;所有图像采用μct v6.1图像处理软件进行重建分析,灰度值测量单位为HU(houndsfield units),重建的样本均利用水与空气的相关灰度值进行标准化,将裸鼠皮下成骨包块进行三维CT重建,测量其平均骨密度。
1.2.7 成骨包块的组织化学染色实验将分组后样本,使用脱钙液浸泡3~5天,每天换液1次,然后PBS浸泡2h;将脱钙后的标本分组脱水包埋,将上述标本以5μm厚度切取并制成切片,按试剂操作说明分别作H&E、Alcian Blue和 Masson Trichrome染色并观察。
1.3 统计学分析采用GraphPad Prism 4.0软件进行统计分析,组间比较采用单因素方差分析,P<0.05为差异有显著意义。
2 结 果 2.1 hUC-MSCs的体外培养和重组腺病毒感染率检测体外扩增3~9代的hUC-MSCs生长状态良好,可见细胞形态大多呈短梭形及少量多角形,且呈集落样增殖,铺路石样或漩涡状排列生长;根据实验分组将Ad-GFP和Ad-BMP9分别感染hUC-MSCs 48h,倒置荧光显微镜下观察细胞,可见大多数细胞胞内绿色荧光分布,病毒感染效率在70%以上(图 1)。

|
| 图 1 Ad-BMP9对hUC-MSCs的感染率(100×) Figure 1 Infection efficiency of hUC-MSCs under Green fluorescent light(100×) |
碱性磷酸酶(ALP)是成熟成骨细胞的标志性酶,hUC-MSCs经Ad-GFP/ Ad-BMP9感染后3天、5天、7天的ALP活性读数结果如图 2所示:相比GFP对照组,感染后3天、5天、7天外源性BMP9均可显著提高细胞的ALP活性,并在第5天到达顶峰(P﹤0.05)。

|
| 图 2 BMP9 诱导hUC-MSCs的ALP活性读数 Figure 2 ALP activity of BMP9 induced hUC-MSCs * P<0.05 versus the GFP group |
分组方法同前,实验中分别使用Ad-GFP/Ad-BMP9感染hUC-MSCs后14天对成骨晚期指标骨钙素(Osteocalcin,OCN)及骨桥素(Osteopotin,OPN)活性进行免疫组织化学染色检测。结果如图 3所示,在BMP9感染组可检测到胞内OCN和OPN 广泛的阳性表达,GFP对照组中则表达不明显。

|
| 图 3 OCN和OPG的免疫组织化学染色(200×) Figure 3 Immunohistochemical staining of Osteocalcin/Osteopotin in hUC-MSCs (200×) (a) Osteocalcin staining in BMP9 group (b) Osteocalcin staining in GFP group (c) Osteopotin staining in BMP9 group (d) Osteopotin staining in GFP |
分组方法同前,分别使用Ad-BMP9或Ad-GFP感染hUC-MSCs 21天后对成骨矿化情况进行茜素红染色检测,结果如图 4所示。BMP9感染组有明显的呈橘红色的矿化结节形成,而GFP对照组则基本没有。

|
| 图 4 BMP9 诱导hUC-MSCs 21天后茜素红染色(100×) Figure 4 Alizarin red S staning of BMP9 induced hUC-MSCs(100×) (a) hUC-MSCs infected by Ad-BMP9 (b) hUC-MSCs infected by Ad-GFP |
注射细胞后第1周,在Ad-GFP感染组的裸鼠背部皮下未形成明显包块,而Ad-BMP9感染组的裸鼠背部皮下出现肉眼可见包块,第4周Ad-BMP9感染组的裸鼠背部皮下包块质硬,与周围组织边界清楚;而在Ad-GFP感染组裸鼠背部皮下经肉眼基本无法发现包块。所有实验动物喂养4周后处死并剥离皮下包块,发现Ad-BMP9感染组皮下各注射点均有骨化包块形成;而Ad-GFP感染组裸鼠背部皮下则没形成明显包块。
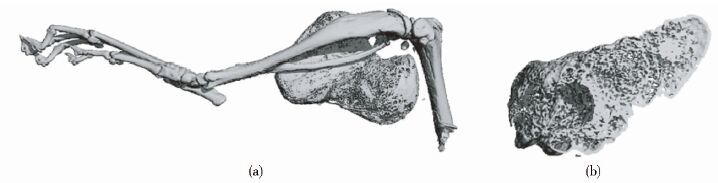
将裸鼠皮下分离得到异位骨组织经Micro-CT扫描和图像三维重建分析,BMP9诱导的hUC-MSCs形成的异位骨骨量明显,骨密度显著高于周围结缔或肌肉组织,平均值为396.05±0.60;结果如图 5所示。
|
| 图 5 裸鼠皮下注射形成包块的Micro-CT扫描、重建及分析 Figure 5 Micro-CT scanning and analysis of bone mass formed by subcutaneously injection of hUC-MSCs (a) Ectopic bone formed in muscle (b) Ectopic bone formed in subcutaneous tissue |
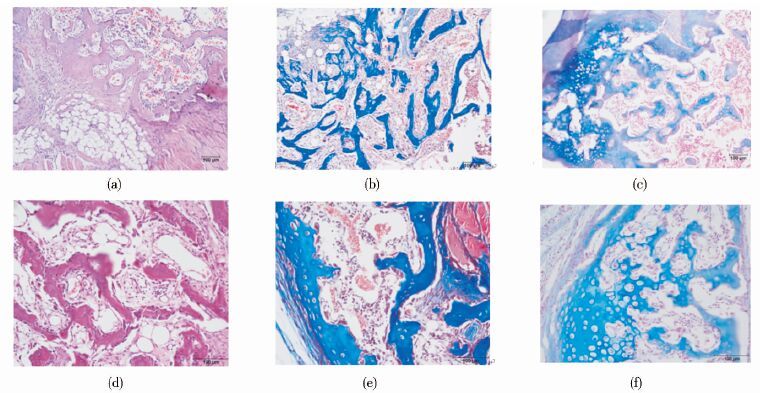
将两组的离体成骨包块经过脱钙切片处理后,分别进行H&E染色、Massion’s Trichrome染色和Alcian Blue染色,结果如图 6所示。
|
| 图 6 皮下注射成骨包块的组织化学染色 Figure 6 Histochemical staining of the bone mass formed by subcutaneously injection of primary UC-MSCs (a) H&E staining(100×) (b) Massion’s Trichrome staining(100×) (c)Alcian Blue staining(100×) (d)H&E staining(200×) (e) Massion’s Trichrome staining(200×) (f) Alcian Blue staining(200×) |
H&E染色显示,Ad-BMP9诱导的hUC-MSCs成骨包块内可见明显的成熟骨基质及骨小梁,大多呈致密度较高的紫红色,连接成网状或梁状,也可见较多未成熟的骨基质,其间杂有部分圆形空泡状的脂肪细胞,以及不规则堆积的未成熟分化的MSCs细胞。
Massion’s Trichrome染色显示,离体骨组织外周可见明显的骨皮质包裹,将细胞与周围结缔组织和红色的肌肉组织明显区分开,其内网状或梁状连接的新生骨小梁中的胶原和骨基质均被染成深蓝色,中间部分分化的未成熟骨基质被染成浅蓝色,其间堆积部分未分化的MSCs细胞其胞质被染成淡红色。
Alcian Blue染色显示,Ad-BMP9诱导的hUC-MSCs成骨包块内可见部分成熟骨基质及骨小梁,染色呈较深的蓝绿色,也亦可见大量含丰富透明质酸的未成熟骨基质、未成熟骨小梁及软骨样细胞,呈较浅的蓝绿色。
3 讨 论骨骼是少数几个在个体成熟后仍保留有潜在再生能力的器官之一,大部分骨折可以自行愈合,但是仍有很多患者发生骨不连而致畸、致残和功能障碍。对于骨不连的治疗,近年来组织工程技术的迅猛发展,为解决传统治疗后骨再生效率低下、骨形成缓慢等技术难点提供了一种有效解决途径,其研究思路主要是从成骨支架、成骨细胞和调控成骨分化的细胞因子三方面着手,通过形成组织工程人工骨,解决骨再生缓慢的问题。
介于成体干细胞和胚胎干细胞之间的围产期干细胞-hUC-MSCs具有良好的自我更新和多向分化潜能,与 ESCs类似的跨胚层分化能力,在体内微环境和体外细胞因子或药物诱导分化成来源于三个不同胚层的多种细胞,如心肌肌纤维母细胞 [4]、内皮样细胞[5]、骨骼肌细胞[6]、成肝样细胞[7]、胰岛样细胞[8]、神经元样细胞[9]、星形胶质细胞和少突胶质细胞[10],视网膜祖细胞[11]等,并相应开展了一系列动物疾病模型中hUC-MSCs移植治疗作用研究。随着它在再生医学中应用和研究的深入,为解决骨组织工程人工骨的种子细胞来源问题提供了新的可行性途径[12]。因此,如何保证hUC-MSCs体内外成骨分化效应是骨再生组织工程技术的关键环节和研究热点。
BMPs家族是一组高度保守的细胞信号分子,属于转化生长因子(transforming growth factor,TGF)超家族的成员,在胚胎发育、组织器官内稳态的维持方面扮演了关键的角色[13-14],在人体内至少有14种不同的亚型存在[15-16],前期研究中分析了这14种亚型的成骨潜力,发现无论是在体外还是在体内BMP9都是诱导MSCs成骨分化的最具潜力因子[2]。尽管BMP9目前还没有像BMP2和BMP7重组蛋白一样被广泛应用于临床骨再生疾病的治疗,但Long等[17]在一项临床前实验研究中发现,BMP9重组蛋白的有效使用剂量远远低于其他BMP家族成员,同时避免了体内非特异性矿化结节形成,这提示BMP9重组蛋白应用于临床治疗的巨大潜力。前期实验中广泛应用于MSCs分化研究的工具细胞,如iMEFs、C3H10T1/2都是来源于小鼠胚胎成纤维细胞,经过导入SV40T或自发永生化而具有类似于MSCs的自我更新和多向分化潜能,无法作为种子细胞来进一步研究,而验证BMP9诱导hUC-MSCs的体内外成骨效应将进一步推进其在骨组织工程方面的临床应用。
我们采用腺病毒载体介导人BMP9基因对hUC-MSCs进行成骨诱导分化,检测其早、中、晚期各个阶段的相应成骨指标,结果表明BMP9诱导hUC-MSCs 分化5天后有明显的碱性磷酸酶表达,14天后有骨钙素和骨桥素的广泛阳性表达,21天后检测到钙盐沉积,碱性磷酸酶是成熟骨细胞的标志酶之一,而钙盐沉积则是骨化的有力证据。裸鼠皮下成骨模型的观察结果显示,空白对照组没有形成肉眼可见的皮下包块,仅感染Ad-BMP9的hUC-MSCs能生成异位骨,且形成的异位骨骨量明显,骨密度平均值为396.05±0.607。H&E染色结果显示,BMP9诱导生成的异位骨中形成部分成熟的骨基质和骨小梁;Masson Trichrome染色结果显示,BMP9明显诱导hUC-MSCs的基质矿化作用;Alcain Blue染色结果显示,BMP9明显诱导hUC-MSCs的软骨内成骨作用。
移植入体内异位成骨的种子细胞存活、增殖、分化的功能主要依靠周边200μm距离体液分泌提供营养供给,异位骨中的新生血管形成是持续保持种子细胞活性和成骨能力的主要条件[18],我们发现离体骨组织中有散在的管腔样结构形成和其中的少量红细胞,保证了MSCs在体内成骨分化过程中的营养供给。BMP9已被证明能促进血管内皮细胞分泌内皮素-1,进而调控内皮细胞管腔样结构形成的作用[19]。Hu等[20]进一步阐明BMP9调控血管生成的信号在BMP9诱导分化MSCs成骨途径中的重要作用,明确BMP9通过Smad1 / 5/8信号通路诱导HIF1α在MSCs中表达上调,从而与BMP9在诱导MSCs向血管内皮细胞和成骨分化的两个信号通路之间发挥协同效应,这一效应在我们的动物体内成骨实验中也有体现。
尽管我们的实验结果证实了BMP9诱导hUC-MSCs体内外成骨分化的明显效应,但Micro-CT分析结果显示,异位骨骨密度与正常骨组织有明显的差异,骨组织形成是多种细胞因子和信号通路共同调节的结果,Notch、Wnt、Hedgehog等信号通路参与协同或拮抗BMP9成骨作用[21-23],探寻对BMP9 介导成骨及骨再生作用产生协同增强效应的多种成骨因子组合,与生物材料缓释技术、三维活细胞打印技术的结合,更有效的诱导促进成骨及骨再生过程,这将是我们下一步研究的方向。
| [1] | Choumerianou D M, Martimianaki G, Stiakaki E, et al. Comparative study of stemness characteristics of mesenchymal cells from bone marrow of children and adults. Cytotherapy,2010, 12 (7) : 881 –887. |
| [2] | Kang Q, Sun M H, Cheng H, et al. Characterization of the distinctorthotopic bone-forming activity of 14 BMPs using recombinantadenovirus-mediated gene delivery. Gene Ther,2004, 11 (17) : 1312 –1320. |
| [3] | Lu L L, Liu Y J, Yang S G, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportivefunction and other potentials. Haematologica,2006, 91 (8) : 1017 –1726. |
| [4] | Breymann C, Schmidt D, Hoerstrup S P. Umbilical cord cells as a source of cardio vascular tissue engineering. Stem Cell Rev,2006, 2 (2) : 87 –92. |
| [5] | Gang E J, Jeong J A, Han S, et al. In vitro endothelial potential of human uc blood-derived mesenchymal stem cells. Cytotherapy,2006, 8 (3) : 215 –227. |
| [6] | Conconi M T, Burra P, Di Liddo R, et al. Cd105(+) cells from wharton's jelly show in vitro and in vivo myogenic differentiative potential. Int J Mol Med,2006, 18 (6) : 1089 –1096. |
| [7] | Campard D, Lysy P A, Najimi M, et al. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology,2008, 134 (3) : 833 –848. |
| [8] | He D, Wang J, Gao Y, et al. Differentiation of PDX1 gene-modified human umbilical cord mesenchymal stem cells into insulin-producing cells in vitro. Int J Mol Med,2011, 28 (6) : 1019 –1024. |
| [9] | Wang X, Wu H, Xue G, et al. Progesterone promotes neuronal differentiation of human umbilical cord mesenchymal stem cells in culture conditions that mimic the brain microenvironment. Neural Regen Res,2012, 7 (25) : 1925 –1930. |
| [10] | Leite C, Silva N T, Mendes S, et al. Differentiation of human umbilical cord matrix mesenchymal stem cells into neural-like progenitor cells and maturation into an oligodendroglial-like lineage. PLoS One,2014, 9 (10) . |
| [11] | Hu Y, Liang J, Cui H, et al. Wharton's jelly mesenchymal stem cells differentiate into retinal progenitor cells. Neural Regen Res,2013, 8 (19) : 1783 –1792. |
| [12] | Hofmann S, Hagenmüller H, Koch A M, et al. Control of in vitro tissue-engineered bone-like structures using human mesenchymal stem cells and porous silk scaffolds. Biomaterials,2007, 28 (6) : 1152 –1162. |
| [13] | Attisano L, Wrana J L. Signal transduction by the TGF-beta superfamily. Science,2002, 296 (5573) : 1646 –1647. |
| [14] | Luu H H, Song W X, Luo X, et al. Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells. J Orthop Res,2007, 25 (5) : 665 –677. |
| [15] | Varga A C, Wrana J L. The disparate role of BMP in stem cell biology. Oncogene,2005, 24 (37) : 5713 –5721. |
| [16] | Zhang J, Li L. BMP signaling and stem cell regulation. Dev Biol,2005, 284 (1) : 1 –11. |
| [17] | Long L, Ormiston M L, Yang X, et al. Selective enhancement of endothelial BMPR-II with BMP9 reverses pulmonary arterial hypertension. Nat Med,2015, 21 (7) : 777 –785. |
| [18] | Hernigou P, Poignard A, Beaujean F, et al. Percutaneous autologous bone-marrow grafting for nonunions.Influence of the number and concentration of progenitor cells. J Bone Joint Surg Am,2005, 87 (7) : 1430 –1437. |
| [19] | Park J, Shao D, Upton P, et al. BMP-9 induced endothelial cell tubule formation and inhibition of migration involves Smad1 driven endothelin-1 production. PLoS One,2012, 7 (1) : e30075 . |
| [20] | Hu N, Jiang D, Huang E, et al. BMP9-regulated angiogenic signaling plays an important role in the osteogenic differentiation of mesenchymal progenitor cells. J Cell Sci,2013, 126 (2) : 532 –541. |
| [21] | Tang N, Song W X, Luo J, et al. BMP-9 induced osteogenic differentiation of mesenchymal progenitors requires functional canonical Wnt/beta-catenin signalling. J Cell Mol Med,2009, 13 (8B) : 2448 –2464. |
| [22] | Zhang H, Wang J, Deng F, et al. Canonical Wnt signaling acts synergistically on BMP9-induced osteo/odontoblastic differentiation of stem cells of dental apical papilla (SCAPs). Biomaterials,2015, 39 : 145 –154. |
| [23] | Huang C, Tang M, Yehling E, et al. Overexpressing sonic hedgehog peptide restores eriosteal bone formation in a murine bone allograft transplantation model. Mol Ther,2014, 22 (2) : 430 –439. |
 2016, Vol. 36
2016, Vol. 36




