文章信息
- 苏稚喆, 王雪华, 杨华, 孙焕, 魏炜
- SU Zhi-zhe, WANG Xue-hua, YANG Hua, SUN Huan, WEI Wei
- 镉胁迫下麻疯树转录组测序分析
- Transcriptome Analysis of Cadmium Exposed Jatropha curcas
- 中国生物工程杂志, 2016, 36(4): 69-77
- China Biotechnology, 2016, 36(4): 69-77
- http://dx.doi.org/10.13523/j.cb.20160411
-
文章历史
- 收稿日期: 2015-10-27
- 修回日期: 2015-12-04
重金属污染是当今世界上普遍关注的环境问题之一,在重金属污染中,镉(Cadmium,Cd)是毒性最强和造成农田污染的最普遍的一种重金属,人体摄入过量镉会影响磷、钙的吸收和代谢,造成骨骼疏松、萎缩、变形,增加致癌和致畸机率,甚至导致死亡[1]。在我国,土壤镉污染也十分普遍,浙江遂昌和温州等地区相继出现过镉中毒事件,两地糙米镉含量分别达到1.17mg/kg和1.30mg/kg[2]。近年来,植物修复为我们提供了一条治理镉污染的新途径,有报道显示宝山堇菜[3],东南景天[4],遏蓝菜[5],麻疯树[6]等植物具有修复Cd污染的能力,但对其具体的调控机制和转录水平的研究却很少。
麻疯树(Jatropha curcas)是大戟科(Euphorbiaceae)麻疯树属的油料植物,大多分布在热带、亚热带地区,在我国主要分布于云南、四川、广西、福建等地。麻疯树是一种经济节约、环境友好型的资源植物,其用途广泛,综合利用价值高,近年来已成为社会关注的焦点。它可以在退化、贫瘠、干旱、盐渍、污染的土壤生长,因此研究Cd胁迫对麻疯树的影响对植物修复有重要意义。
关于麻疯树重金属胁迫的研究多集中在生理生化水平,本研究采用营养液培养试验,通过转录组测序,研究麻疯树对镉的耐受性和镉胁迫条件下其分子和转录水平的变化,分析差异表达基因,探索麻疯树镉胁迫的响应机制。
1 材料与方法 1.1 材 料供试麻疯树种子采自攀枝花地区,种子经筛选萌发,采用Hoagland’s营养液培养幼苗,对照组不加CdCl2,根据前期预实验确定,处理组Cd2+的浓度为100μmol/L,处理时间为8天,处理组和对照组中分别取不同幼苗相同部位的叶片,提取RNA,分别组成混合样品,并对两组样品进行转录组测序。
1.2 方 法 1.2.1 RNA文库构建样品检测合格后,进行文库构建,文库构建和测序反应以及分析过程由北京百迈克公司完成,具体流程:用带有Oligo(dT)的磁珠富集mRNA,加入Fragmentation Buffer将mRNA随机打断,并以mRNA为模板,用六碱基随机引物(random hexamers)合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA polymerase Ⅰ合成第二条cDNA链,利用AMPure XP beads纯化cDNA,纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择,最后通过PCR富集得到cDNA文库。
1.2.2 测序及数据组装库检合格后,用HiSeq2500进行高通量测序,测序读长为PE100。得到Raw Data进行数据过滤,去除其中的接头序列及低质量Reads获得高质量的Clean Data,根据Trinity (http://trinityrnaseq.sourceforge.net/)[7]进行序列组装。
1.2.3 Unigene功能注释使用BLAST比对工具将样本Unigene与公共数据库进行比较,通过基因的相似性进行功能注释,将样本基因序列分别与Nr ,Swiss-Prot,KEGG,COG和GO数据库进行比对,设置E-value≤10-5获取注释信息。
1.2.4 差异表达基因分析使用EBSeq(https://www.biostat.wisc.edu/~kendzior/EBSEQ/)进行差异表达分析[8],采用FDR 作为差异表达基因筛选的指标,以降低假阳性。在筛选过程中,将FDR<0.01且差异倍数FC≥2作为筛选标准,FC表示两样品间表达量的比值。对差异表达基因进行GO,COG,以及KEGG注释,并用DAVID注释工具[9]进一步对差异表达基因进行分析。
1.2.5 利用qRT-PCR进行验证种子萌发和幼苗处理同材料部分一样,同时增加了Cd2+200μmol/L的处理组,处理时间为8天,然后分别取样,提取RNA进行荧光定量验证。qRT-PCR以Jc18S (Genebank accession number: AY823528.1) 为内参,相对表达量用2-ΔΔCT 计算。
2 结果与分析 2.1 测序结果及序列组装共获得11.00Gb Clean Data,各样品Clean Data均达到5.30Gb,Q30碱基百分比在90.55%及以上。De novo组装从两个数据库共得到97 200条Transcript和50 448条Unigene,Transcript与Unigene的N50分别为2 183和1 565,其中长度在1kb以上的Unigene有12 683条,组装完整性较高(图 1)。
 |
| 图 1 Unigene长度分布图 Fig. 1 Length distribution of the assembled unigene X-axis indicates spacing length,y-axis indicates number of Unigenes |
对Unigene进行功能注释,包括与NR、Swiss-Prot、KEGG、COG、GO数据库的比对,共获得26 776条Unigene的注释结果(表 1)。
| 数据库 | 注释数量 | 300≤length<1000 | length≧1000 |
| COG | 9 802 | 2 764 | 5 393 |
| GO | 21 029 | 6 647 | 10 596 |
| KEGG | 6 933 | 2 305 | 3 054 |
| Swiss-prot | 18 438 | 6 130 | 8 827 |
| nr | 26 641 | 9 199 | 12 138 |
| All | 26 776 | 9 247 | 12 141 |
总共有 2 551 条Unigene 在两个样品中差异表达,其中539条上调,2 012条下调,这可能是因为镉胁迫引起了植物生长停滞,这些差异表达基因的详细注释结果见表 2。
| 数据库 | COG | GO | KEGG | Swiss-Prot | nr | Annotated |
| 基因数 | 1 005 | 1 764 | 682 | 1 769 | 2 272 | 2 277 |
对差异表达基因进行GO分类(图 2),共有1 764 条Unigene注释到生物学过程( biological process) 细胞组分( cellular component) 和分子功能( molecular function) 三大类中。在生物学过程中,代谢过程(metabolic process),细胞过程(cellular process),刺激反应(response to stimulus),生物调节(biological regulation),定位(localization),局部构建(establishment of localization),细胞组分的组织和生物合成(cellular component organization or biogenesis),是镉胁迫处理后差异表达基因富集最多的种类;在分子功能一大类中,催化活性(catalytic activity),蛋白结合(binding),结构分子活性(structural molecule activity),转运活性(transporter activity),电子传递体活性(electron carrier activity),是差异表达基因富集注释最多的种类;在细胞组分中,细胞分离(cell part),细胞(cell),细胞器(organelle),生物膜(membrane),细胞器分裂(organelle part),高分子配合物(macromolecular complex),是差异基因富集最多的种类。通过GO分析差异表达基因发现,镉胁迫引起麻疯树刺激反应,催化活性,转运活性,电子传递体活性,以及细胞器分裂和高分子配合物相关途径基因的差异表达,这些过程可能在麻疯树抵抗镉胁迫中起到重要的作用。
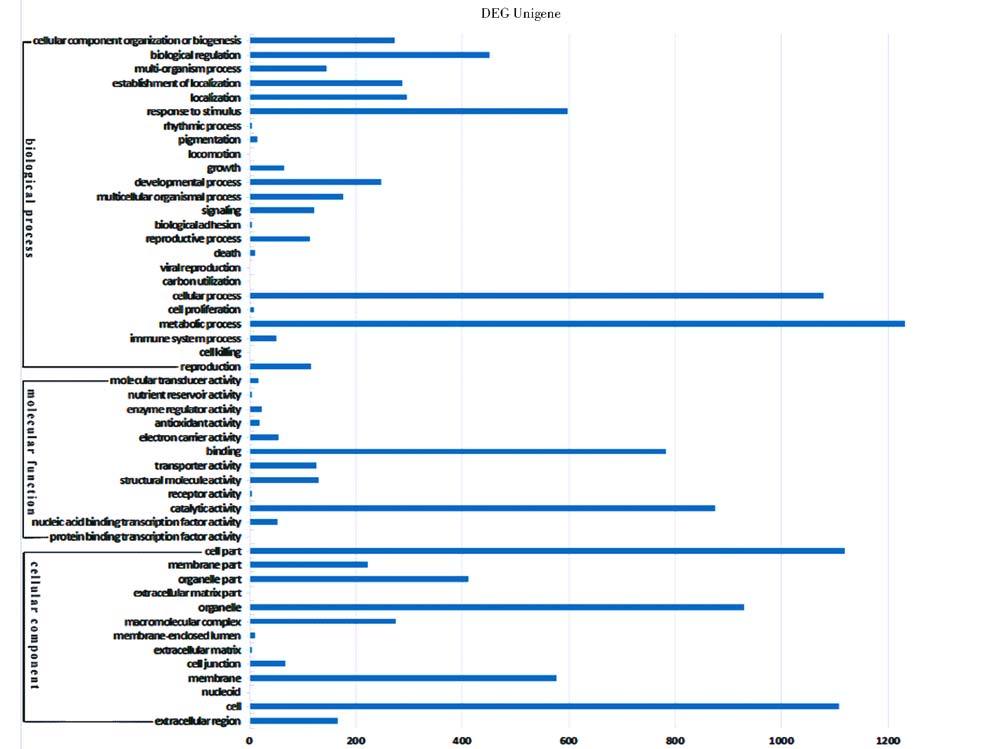 |
| 图 2 差异表达基因的GO功能注释 Fig. 2 GO annotation of differential expression genes X-axis indicates number of Unigenes,y-axis indicates different GO terms |
进一步对差异表达基因进行COG分类(图 3),1 005条差异表达基因比对到COG数据库。其中差异基因富集较多的为:一般功能基因( general function prediction only,203),翻译、核糖体结构与生物合成(Translation,ribosomal structure and biogenesis,161),碳水化合物运输与代谢(Carbohydrate transport and metabolism,107),蛋白质翻译后修饰与转运、分子伴侣(Posttranslational modification,protein turnover,chaperones,84),信号传导机制(Signal transduction mechanisms,72),次生产物合成运输及代谢(Secondary metabolites biosynthesis,transport and catabolism,71),转录(Transcription,71)。从这些信息中可以发现,镉胁迫引起了麻疯树生长,发育以及代谢相关基因的差异表达。同时,镉胁迫也引起了麻疯树蛋白质翻译后修饰与转运、分子伴侣,信号传导机制和次生产物合成运输及代谢相关基因的差异表达,这些信息对于我们深入认识麻疯树镉胁迫响应机制具有重要的指导意义。
 |
| 图 3 差异表达基因的COG分类 Fig. 3 COG annotation of differential expression genes |
为了得到麻疯树Cd胁迫的调控信息,两个数据库中组装得到的所有Unigene注释到KEGG数据库,总共有6 933条Unigene获得注释信息,其中的4 886条归于117个代谢途径。进一步对差异表达基因进行分析,682条差异表达基因比对到100条代谢途径,其中差异表达基因富集最多的途径为:核糖体,氧化磷酸化,糖酵解、糖异生,光合生物的碳固定,光合作用,植物激素信号转导,内质网膜上的蛋白加工,植物病原响应等(表 3)。从这些信息中得出麻疯树镉胁迫可以引起幼苗叶片中的氧化磷酸化,植物激素信号转导,以及病原响应相关途径基因的变化,这对我们认识麻疯树在不同胁迫条件下基因的表达调控有很大的帮助。
| 代谢途径 | 差异表达基因数及其比例 | 所有Unigene的注释情况 | p_value | Pathway ID |
| Ribosome | 120(22.02%) | 618(12.65%) | 5.82E-11 | ko03010 |
| Oxidative phosphorylation | 36(6.61%) | 313(6.41%) | 4.48E-01 | ko00190 |
| Glycolysis / Gluconeogenesis | 32(5.87%) | 218(4.46%) | 6.08E-02 | ko00010 |
| Carbon fixation in photosynthetic organisms | 31(5.69%) | 136(2.78%) | 6.32E-05 | ko00710 |
| Photosynthesis | 28(5.14%) | 71(1.45%) | 4.93E-10 | ko00195 |
| Plant hormone signal transduction | 27(4.95%) | 168(3.44%) | 3.09E-02 | ko04075 |
| Protein processing in endoplasmic reticulum | 26(4.77%) | 291(5.96%) | 9.13E-01 | ko04141 |
| Plant-pathogen interaction | 20(3.67%) | 154(3.15%) | 2.66E-01 | ko04626 |
| Spliceosome | 19(3.49%) | 270(5.53%) | 9.93E-01 | ko03040 |
| RNA transport | 18(3.3%) | 220(4.5%) | 9.44E-01 | ko03013 |
| Photosynthesis - antenna proteins | 17(3.12%) | 33(0.68%) | 1.06E-08 | ko00196 |
| Fructose and mannose metabolism | 16(2.94%) | 81(1.66%) | 1.55E-02 | ko00051 |
| Amino sugar and nucleotide sugar metabolism | 15(2.75%) | 108(2.21%) | 2.19E-01 | ko00520 |
| Starch and sucrose metabolism | 15(2.75%) | 156(3.19%) | 7.69E-01 | ko00500 |
在很多植物中Cd胁迫引起不同转录因子的变化已经有许多报道,包括拟南芥[10],豌豆[11],大麦[12]等。通过与拟南芥数据库比对,我们共得到了107个注释的转录因子(表 4),得到的注释信息不多可能是因为麻疯树已有的信息较少。对这些转录因子进行分析,发现ZIP,SPL和WRKY家族是注释信息较多的种类。ZIP 家族参与镉胁迫在大豆和刚毛柽柳中已有报道[13, 14]。WRKY53在镉处理的遏蓝菜中差异表达,这个基因也能被盐胁迫和旱胁迫调控,同时参与胁迫相关的信号传导途径,调节其他转录因子的活性而不是直接引起基因的表达[15]。在我们的处理中有6个基因属于WRKY家族,10个属于ZIP家族,这些基因可能与麻疯树镉胁迫响应相关。
| 转录因子家族 | 数量 | 转录因子家族 | 数量 |
| WRKY | 6 | HRS | 2 |
| WLIM | 1 | GNC | 2 |
| TTG | 3 | GAI | 2 |
| TGA | 2 | FD | 1 |
| TEM | 1 | FAR | 2 |
| SVP | 2 | EEL | 1 |
| STK | 2 | CAL | 2 |
| SPL | 8 | BZO2H3 | 2 |
| SHP | 2 | BZIP | 4 |
| RGA | 3 | BME | 2 |
| AT-HSFA | 3 | ATBZIP | 6 |
| AP | 4 | AHBP | 1 |
| AG | 3 | PAN | 2 |
| HY | 1 | others | 37 |
| Total No. of TF | 107 | ||
14 059条 Unigene 能够注释到 DAVID 数据库,其中大部分能够比对到蓖麻基因组(10 639),部分比对到毛果杨(2 684),葡萄 (122),苔藓 (85),玉米 (53),拟南芥 (52)等基因组。 接着我们用DAVID分析了与金属离子转运相关的基因,并统计了差异表达量最大的14个基因(图 4)。在我们的处理中,有两个基因(c22890.graph_c0,c37374.graph_c0)明显上调,GO功能注释显示这两个基因与离子转运相关,下调最多的基因为c44095.graph_c0,│log2FC│>3,注释信息为一种铁蛋白。c42073.graph_c0次之,│log2FC│>2.5 ,其可能在卟啉和叶绿素代谢中发挥功能。其余的10个下调最多的基因中,有3条归于P型ATP酶家族,3条与金属转运相关,4条为Na+共转运体。这些结果表明麻疯树镉胁迫引起了叶片中与离子转运相关基因的变化,特别是钠离子和铁离子,同时极大地影响了麻疯树的光合作用。
 |
| 图 4 DAVID分析差异表达量最大的14个基因 Fig. 4 DAVID annotation of the most significant DEGs |
随机选取5个基因进行荧光定量验证,这些基因的详细信息见表 5。荧光定量结果显示c32875.graph_c0和c44110.graph_c0的表达量随镉离子浓度的增加而降低,c38377.graph_c0和c45150.graph_c0的表达量随镉离子浓度的增高而增高,但c46492.graph_c0的表达量随镉离子浓度的增加呈现了一个先增后降的趋势,这些结果表明麻疯树镉胁迫的复杂响应机制。荧光定量的结果和转录组测序结果一致,进一步验证了测序结果的准确性(图 5)。
| 基因 | 注释信息 | 引物序列(5′-3′) | Ta (℃) |
| c32875.graph_c0 | MATE efflux family protein 5 | F:TTTGAAGGACTCTGGCTCG R:TTCCCAATCAGTGCGAGT | 57 |
| c44110.graph_c0 | Auxin-binding protein ABP19a | F:TGACTCCAGCGTTTGTGC R:TGAAGCAGCCCTTGTGGA | 57 |
| c38377.graph_c0 | Ethylene-responsive transcription factor ERF113 | F:TTGGGTCTCGGATTTCGG R:TACCCATCAACCCTACCTT | 58 |
| c45150.graph_c0 | Leucine-rich repeat extensin-like protein 6 | F:CTGGCTGTGAAGGGTTGGTAT R:TACCACCACAACCACAAAGC | 57 |
| c46492.graph_c0 | GDSL esterase/lipase EXL3 | F:TGAAGTTGGAGCAAGGAGA R:ACTCTCTCACTATTCCTCCACCTA | 58 |
| 18S | reference | F:CTCAACCATAAACGATGCCGACC R:TTCAGCCTTGCGACCATACTCCC | 58 |
| F: Forward primer ; R: Reverse primer ;Ta: Annealing temperature | |||
 |
| 图 5 荧光定量分析 Fig. 5 Quantitative RT-PCR analysis of selected genes The relative gene expression levels as expressed by 2-ΔΔCT were determined separately for each treatment. 0: Control; 100: Cadmium concentration of 100μmol/L; 200: Cadmium concentration of 200μmol/L |
新一代测序技术已经在许多无参考基因组的植物中应用,包括橄榄[16],红花苜蓿[17],甘薯[18]等植物中。在我们的研究中利用Illumina测序技术对处理组和对照组进行测序,通过数据组装得到50448条高质量的Unigene。比较对照组和镉胁迫条件的测序结果,在两个样品中发现了2551条差异表达基因,其中539条上调基因,2012条下调基因。通过GO,COG和KEGG注释分析了麻疯树叶中相关表达基因和代谢途径。与拟南芥基因组比对,用DAVID分析差异表达基因,发现镉胁迫引起了麻疯树叶中与离子转运相关基因的变化,影响了麻疯树的光合作用,导致叶片中Na离子和铁离子稳态的变化。通过对处理组和镉胁迫条件下麻疯树叶中差异表达转录因子的分析,发现WRKY和ZIP转录因子在麻疯树镉胁迫中发挥重要作用,镉胁迫一定程度上影响了麻疯树其他胁迫相关基因的变化。
ABA能够介导植物的多种胁迫响应,镉胁迫引起植物ABA的合成已有报道[19]。先前的研究表明,镉胁迫的水稻通过ABA依赖的转录网络介导基因的表达,这个过程同时有ZIP家族蛋白的参与。脯氨酸积累是植物多种胁迫的主要响应机制之一,而这个过程也是通过ABA依赖的途径进行的。在我们的研究中,2个ABA诱导的 PP2C 基因(c31299.graph_c0,c45275.graph_c0)表现了差异表达,同时ABA1 (c44584.graph_c0),ABA2 (c39480.graph_c0,c44546.graph_c0,c46868.graph_c0),ABA4 (c33238.graph_c0) 在我们的处理中也出现了下调表达,另外,胡萝卜素合成途径的差异表达基因出现了上调的趋势,说明镉胁迫引起了麻疯树叶片中色素的变化,同时调节ABA依赖的代谢途径。转录因子和ABA的调控机制有待进一步研究,在麻疯树镉胁迫的研究中区别ABA依赖和ABA非依赖的途径对完全理解麻疯树的耐性机制有重要的意义。
差异表达基因的研究有利于发现麻疯树中与金属转运和信号转导相关的潜在转录因子和耐性基因。值得注意的是,植物抵抗重金属的机制关系到大量分子和基因方面的改变,研究表明:CDF蛋白家族具有逆向转运蛋白的功能[20],HMA与金属转运相关[21],过表达NRAMP基因能够增加拟南芥根和茎对镉离子的耐性[22],过表达植物螯合肽(PC)合成酶基因和金属硫蛋白(MT)基因能够增加植物对镉的耐性[23, 24]。在镉胁迫的麻疯树叶片中,3个Unigene注释为MATE表现了较大的差异表达(c19273.graph_c0;c39801.graph_c0;c32875.graph_c0),2个Unigene注释为PDR也出现了较大的差异表达(c38711.graph_c1;c51721.graph_c0),它们的|log 2 foldchange| >2。镉胁迫引起麻疯树HMA基因的变化不是很明显,可能是因为这些基因的组织特异性,有研究表明植物中HMA基因在金属离子从根部向茎部的转运中发挥作用[25]。这些发现表明了麻疯树对镉胁迫的响应机制的复杂性,我们应该深入研究麻疯树镉胁迫的抗性机制以利于植物基因工程和作物改造的进步,并进一步推动植物修复的发展。
| [1] | Satarug S B, Urbenjapol S. A global perspective on cadmium pollution and toxieity in non-occupationally exposed population. Toxicol Lett, 2003,137:65-83. |
| [2] | 陈飞. 大麦镐吸收与运转机制的研究. 杭州:浙江大学,农业与生物技术学院, 2009. Chen F.Physiological and molecular mechanism of cadmium uptake and translocation in barley. Hangzhou: Zhejiang University, College of Agronomy and Biotechnology, 2009. |
| [3] | 刘威,束文圣,蓝崇钰,等. 宝山堇菜(Viola baoshanensis)-一种新的镉超富集植物. 科学通报, 2003,48(19):2046-2049. Liu W,Shu W S,Lan C Y,et al.Viola baoshanensis—a new plant as cadmium hyperaccumulator.Chinese Science Bulletin,2003,48(19):2046-2049. |
| [4] | 李继光,李廷强,朱恩,等. 氮对超积累植物东南景天生长和镉积累的影响. 水土保持学报, 2007,21(1):54-58. Li J G,Li T Q,Zhu E,et al. Effects of nitrogen fertilizer on growth and cadmium accumulation in hyperaccumulator of sedum alfredii hance.Journal of Soil and Water Conservation,2007,21(1):54-58. |
| [5] | 韩璐,魏嵬,官子楸,等. Zn/Cd超富集植物天蓝遏蓝菜(Thlaapi caeruescens)中TcCalVI2基因的克隆及在酵母中的重金属耐受性分析. 中国科学院研究生院学报, 2007,24(4):465-472. Han L,Wei W,Guan Z Q, et al. A novel CAM gene from heavy metals hyperaccumulator(Thlaspi caerulescens)L.and functional analysis in yeast. Journal of the Graduate School of the Chinese Academy of Sciences,2007,24(4):465-472. |
| [6] | 李清飞,仇荣亮. 麻疯树对镉胁迫的生理耐性及富集特征研究. 农业环境科学学报, 2012,31(1):42-47. Li Q F,Qiu R L.Cadmium physiological tolerance and accumulation characteristics of Jatropha curcas L.. Journal of Agro-Environment Science,2012,31(1):42-47. |
| [7] | Grabherr M G, Yassour M. Full length transcriptome assembly from RNA-Seq data without a reference genome. Nature Biotechnology, 2011,29:644-652. |
| [8] | Leng N D, Thomson J A. EBSeq: An empirical Bayes hierarchical model for inference in RNA-seq experiments. Bioinformatics, 2013,29(8):1035-1043. |
| [9] | Huang D W. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources. Nat Protoc, 2009,4(1):44-57. |
| [10] | Weber M, Trampczynska A, Clemens S, et al.Comparative transcriptome analysis of toxic metal responses in Arabidopsis thaliana and the Cd(2+)-hypertolerant facultative metallophyte Arabidopsis halleri. Plant Cell and Environment, 2006,29:950-963. |
| [11] | Romero-Puertas M C, Corpas F J, Rodríguez-Serrano, et al. Differential expression and regulation of antioxidative enzymes by Cd in pea plants. Journal of Plant Physiology, 2007,164:1346-1357. |
| [12] | Tamas L, Dudikova J, Durcekova K, et al. Alterations of the gene expression, lipid peroxidation, proline and thiol content along the barley root exposed to cadmium. Journal of Plant Physiology, 2008,165:1193-1203. |
| [13] | Wang Y, Gao C, Liang Y, et al. A novel bZIP gene from Tamarix hispida mediates physiological responses to salt stress in tobacco plants. J Plant Physiol, 2010,167:222-230. |
| [14] | Chmielowska-Bak J, Lefèvre Ⅰ, Lutts S, et al. Short term signaling responses in roots of young soybean seedlings exposed to cadmium stress. J Plant Physiol, 2013,170:1585-1594. |
| [15] | Wei W, Zhang Y, Han L, et al. A novel WRKY transcriptionalfactor from Thlaspi caerulescens negatively regulates the osmotic stress tolerance of transgenic tobacco. Plant Cell Reports, 2008,27:795-803. |
| [16] | Kaya H B, Cetin O, Kaya H,et al.SNP discovery by Illuminabased transcriptome sequencing of the Olive and the genetic characterization of Turkish Olive genotypes revealed by AFLP, SSR and SNP Markers. PLoS ONE, 2013,8(9): e73674. doi:10.1371/journal.pone.0073674. |
| [17] | Steven A, Yates M, Igor Chernukin, et al. De novo assembly of red clover transcriptome based on RNA-Seq data provides insight into drought response, gene discovery and marker identification. BMC Genomics, 2014,15:253. |
| [18] | Yan L,Gu Y H,Tao X,et al. Scanning of transposable elements and analyzing expression of transposase genes of Sweet Potato [Ipomoea batatas]. PLoS ONE, 2014,9(3):e90895. doi:10.1371/journal.pone.0090895. |
| [19] | Perfus Barbeoch L, Forestier C. Heavy metal toxicity: cadmium permeates through calcium channels and disturbs the plant water status. Plant J, 2002,32:539-548. |
| [20] | Yuan L Y,Yang S G,Liu X B,et al, Molecular characterization of a rice metal tolerance protein, OsMTP1. Plant Cell Rep, 2012,31:67-79. |
| [21] | Bkgaard L, Persson D P. Acombined zinc/cadmium sensor and zinc/cadmium export regulator in a heavy metal pump. J Biol Chem, 2010,285:31243-31252. |
| [22] | Tiwari M, Sharma D, Dwivedi S, et al. Expression in Arabidopsis and cellular localization reveal involvement of rice NRAMP, OsNRAMP1, in arsenic transport and tolerance. Plant Cell Environ, 2014,37:140-152. |
| [23] | Sekhar K,Priyanka B,Reddy V D,et al,Metallothionein 1(CcMT1)of pigeonpea(Cajanus cajan,L.)confers enhanced tolerance to copper and cadmium in Escherichia coli and Arabidopsis thaliana.Environ Exp Bot,2011,doi:10.1016/j.envexpbot.2011.02.017. |
| [24] | Shukla D, Dwivedi S, Tripathi R D,et al. Expression of Ceratophyllum demersum phytochelatin synthase, CdPCS1, in Escherichia coli and Arabidopsis enhances heavy metal(loid)s accumulation. Protoplasma, 2013,250:1263-1272. |
| [25] | Takahashi R B K, Ishimaru Y, Nishizawa N K, et al. The role of heavy-metal ATPases, HMAs, in zinc and cadmium transport in rice. Plant Signal Behav, 2012,7:1799-1801. |
 2016, Vol. 36
2016, Vol. 36




