文章信息
- 陶嫦立, 黄树林
- TAO Chang-li, HUANG Shu-lin
- TCR基因免疫治疗中优化转TCR基因配对的研究进展
- Advances in Research on Optimization of Transgenic TCR Pairing in TCR Gene Therapy
- 中国生物工程杂志, 2016, 36(3): 87-92
- China Biotechnology, 2016, 36(3): 87-92
- http://dx.doi.org/DOI:10.13523/j.cb.20160313
-
文章历史
- 收稿日期: 2015-11-04
- 修回日期: 2015-11-21
近年来,T细胞受体(TCR)基因修饰T细胞的过继性免疫治疗用于黑色素瘤、直肠癌、滑膜细胞癌等已经取得一些成功,但却面临一些安全问题,其中最为严重的是on-target off-tumor毒性、off target毒性及细胞因子释放综合征[1]。on-target off-tumor毒性的产生是由于特异性TCR除了能与肿瘤组织表达的抗原产生免疫反应外,也能针对正常组织表达的肿瘤相关抗原产生应答[2]。另一个不良反应off-target毒性一方面来自转TCR基因T细胞能识别非靶蛋白上的抗原肽,即所转入的TCR具有交叉反应性;另一方面可能是由错配TCR分子引入的新的免疫原性造成,即外源TCR分子与内源TCR链发生错配产生了杂合TCR分子,而大多数杂合TCR二聚体具有HLA同种异体反应性。虽然目前TCR错配引起的自身反应疾病还没有临床证据,但是临床前试验已经证实TCR错配会产生具有自身反应性的TCR,并最终导致移植物抗宿主病 (GvHD)[3]。在此,本文首先介绍TCR基因在T细胞过继性免疫治疗中的作用,接着重点介绍各种优化转TCR基因配对的策略,最后总结和讨论TCR基因治疗的临床试验。
1 TCR基因在T细胞免疫治疗中的作用TCR是T细胞表面能够识别和结合蛋白质抗原的特异性受体。TCR由两条多肽链(α链和β 链或 γ链和δ 链)组成异二聚体,且两条多肽链均由一个可变区和恒定区组成,并由一个二硫键连接。TCR通过可变区的CDR结构域识别各类抗原,但是它们的胞内区很短,需要通过与T细胞内的CD3分子形成TCR/CD3复合物才将细胞刺激信号传递至胞内。TCR识别特异性抗原后,膜上的TCR/CD3复合物将募集各种信号分子,成为T细胞活化的第一信号,一系列协同刺激分子作为活化的第二信号,在双信号作用下T细胞活化,引发细胞骨架蛋白和转录因子的活化,并促进各种细胞因子转录,最终引起细胞形态改变、细胞因子分泌(IFN-γ、IL-2等多种细胞因子)、细胞黏附性改变等各式各样的免疫效应。
因此,TCR在细胞免疫中发挥着重要的靶向性作用,TCR基因修饰的T细胞过继性转移可以诱导某些特定的T细胞瞬时增殖,并允许引入T细胞池中没有的特异性TCR,使转T细胞表面表达该抗原特异性TCR,成为能够特异性识别肿瘤抗原的CTL,发挥细胞毒作用,增强免疫系统介导的对肿瘤细胞的消除。因此,在转TCR基因免疫治疗中,将识别肿瘤抗原的特异性TCR基因导入患者T细胞,可使患者的无能T细胞重新获得具有肿瘤抗原识别和应答的能力。
2 优化转TCR基因的配对TCR基因治疗所引入的外源TCR α链和 β链不仅能互相配对成针对肿瘤抗原的TCRαβ二聚体,还能与内源性的TCR α 链和β链错配形成杂合TCR二聚体。因此,理论上除了内源性的TCR二聚体(α内β内)和外源性TCR二聚体(α外β外)外还存在两种错配TCR二聚体(α内β外和α外β内)(图 1)。首先,这种错配TCR能与内源性TCR及外源引入的TCR竞争表达于T细胞表面。由于不同的TCR与CD3分子的结合存在竞争性,因此肿瘤特异性外源TCR分子在T细胞表面的表达效率将会降低,同时转基因TCR与特异性的肽-HLA复合物的亲和力也会降低,最终会影响转T细胞抗肿瘤的能力。另外,这种错配 TCR的抗原靶向性不明确,具有诱发自身免疫性疾病的危险[4]。近年来,各种优化转TCR基因配对的策略被提出(图 2)。
 |
| 图 1 外源TCR与內源TCR产生错配TCR Fig. 1 Introduced TCR mispair with endogenous TCR can lead to the formation of mixed TCR dimers |
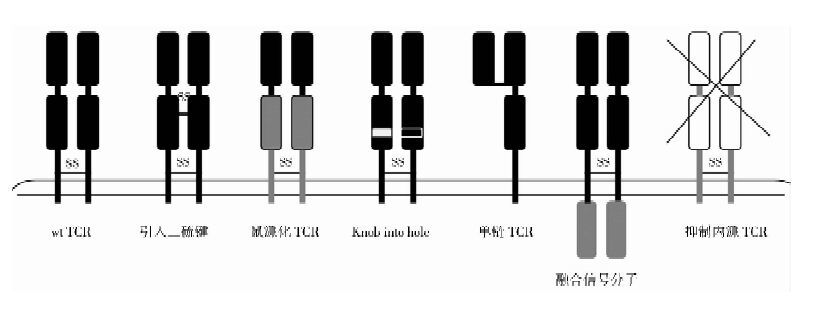 |
| 图 2 对TCR基因修饰的各种策略 Fig. 2 A summary of optimization strategies for TCR |
Cohen等[5]在转导的 TCR α链和β链C区的第48和57位突变为半胱氨酸(Cys),使两个半胱氨酸间形成额外的二硫键。研究发现,TCR α链和β链的保守结构域之间引入二硫键后可提高转TCR在细胞表面的表达并减少与内源TCR的错配。但是Thomas等[6]的实验却发现在C结构域引入二硫键的TCR并不能完全避免与内源性TCR的错配,虽然这种经修饰的TCR相比于未经改造的野生型TCR(wild-type TCR,wtTCR)能更有效的与HLA-A2/WT1结合,但是却没有使转T细胞亲和力增加,也没有导致IFN-γ的分泌和细胞毒作用显著增强。
2.2 将TCR保守区鼠源化有研究表明,用鼠TCR链的保守区域C替换人TCR α链和β链的保守区域C后,鼠源化TCR分子(HV+MC)在细胞表面的表达显著提高,细胞因子的分泌也明显增加[7]。猜测有可能是鼠源化TCR分子中鼠源性的C区能优先配对并且具有更高效结合内源性CD3分子的能力。但是鼠源化TCR存在移植排斥的安全性问题,因此Bialer等[8]对鼠源性C区发挥上述功能的关键氨基酸和片段进行了进一步的研究,发现鼠源TCRβ C区存在一些小片段氨基酸能增强TCR功能,其中一个就是SDVP。Sommermeyer和Uckert[9]的实验也鉴别了9个氨基酸密码子在鼠源化TCR分子表达水平的提高中起着关键作用,其中4个氨基酸密码子在TCR α链C区(SDVP),其余5个位于β链C区。因此可以只替换9个关键氨基酸序列,以降低鼠源化TCR分子产生免疫原性的风险。
2.3 采用knob-into-hole方法为了获得不与内源配对的TCR,Voss 等[10]将TCR-Cα第85位Gly突变为Arg,TCR-Cβ第88位Arg突变为Gly,这使得这对互补作用的氨基酸残基以榫卯结构(knob-into-hole) 的空间构象反转形成卯榫结构(hole-into-knob)的空间构象。由于氨基酸静电作用的改变使得这种反转了Cα 和 Cβ界面的TCR α链和β链不仅减少了与内源TCR的配对,其自身配对能力也大大提高,而其抗原特异性和亲和力仍保留原有水平。
2.4 单链TCR或单链抗体Voss等[11]在VαVβ链之间采用19aa富集Gly/Ser(SL17)的linker连接形成sc-TCRVαVβCβ,并将Cα也与单链TCR一起共转染。虽然这些构建方法能介导T细胞的抗原特异性,但是后来Aggen等[12]研究证明,单链TCR(VαVβCβ)依然能与内源性的α链错配,这是因为单链TCR含有Cβ结构域。之后Aggen等将TCR的保守区域去除,取用Vα/Vβ 单链 TCR (scTv),另外为了避免二聚体错配,将scTv与胞内信号结构域连接。在理论上,单链TCR仅仅含有VαVβ应该能完全避免错配,但是由于缺乏保守区域使得VαVβ不稳定。
2.5 TCR与信号分子融合Reno Debets领导的团队[13]将TCR的C区分别与CD3ζ基因不同结构域融合形成8种TCR:ζ,转入Jurkat T细胞和PBMC进行研究。结果发现,融合完整CD3ζ基因的TCR:ζ不会与内源TCR发生错配,而且外源引入的TCR:ζ链的组装和表达不依赖内源CD3γ、CD3δ和CD3ε。最近,该团队将TCR α链和β链连接CD28和CD3ε基因融合形成TCR:28ε[14]。这对经改造的TCR相比于wtTCR与肽-MHC的结合能力增强并且转T细胞的功能也增强,而且TCR:28ε不仅没有显示出off-target毒性,也避免了错配TCR的产生。
2.6 将αβTCR转入γδT细胞中Lars等[15]将TCRαβ转入γδT细胞,结果显示,αβTCR在γδT细胞中能避免错配,且αβTCR转γδT细胞能在体内增殖并以抗原依赖的方式分泌细胞因子,另外这些γδT细胞在体外能持续存在并能引起再次免疫反应。但是因为大部分的γδT细胞不表达CD4和CD8分子,TCR基因转入γδT细胞需要共同转入CD4或CD8分子,或采用不依赖这些分子的TCR基因来转γδT细胞。
2.7 抑制内源性 TCR 的表达一种方法是利用针对内源TCR的siRNA,将内源性TCR基因“沉默”。Ochi等[16]利用WT1-siTCR载体转导T细胞治疗白血病,结果发现这些转WT1-siTCR的T细胞显示了更强的抗白血病活性,这正是由于siRNA发挥作用使内源TCR被抑制,外源特异性WT1-TCR表达增强所致。另一种方法是利用锌指核酸酶(Zinc-finger nuclease,ZFN)敲除内源性TCR基因。Provasi 等[17]利用ZFN敲除淋巴细胞中内源性TCR基因,使其表面CD3-TCR复合体缺失,再用WT1抗原特异性的TCR基因转导这些T细胞。结果显示,这些经TCR修饰的T细胞表现出更高的表达水平,并且在体内维持抗肿瘤活性的同时没有表现出off-target毒性。
3 TCR基因转T细胞治疗的临床试验目前已经完成的TCR基因治疗临床试验总结于表 1,这些临床研究将为今后增加TCR修饰T细胞治疗反应率和安全方面提供更为深入的了解。
第一次将TCR基因治疗用于临床试验的是Morgan等[18]采用MART-1的特异性TCR基因转T细胞治疗黑色素瘤患者,试验结果观察到 17 名患者中的 2 名肿瘤消退。另外31名接受治疗的黑色素瘤患者中,4名患者的黑色素瘤被观察到缩减[19]。该试验第一次证明了TCR基因治疗在临床应用的可行性,为转TCR基因免疫治疗提供了实践依据。
由于第一次TCR基因治疗的试验中,采用的是低亲和力的TCR,阳性反应率较低,因此紧接着进行了一次针对黑色素瘤抗原MART-1或GP100 的高亲和力TCR基因的临床试验[20],结果发现,20 名患者中的6名(30%) 和 16 名患者中的3名(19%) 分别被观察到肿瘤细胞的衰减,其中1名病灶完全消失。然而,患者正常皮肤、眼睛和耳朵的黑素细胞也被摧毁,即转TCR基因的T细胞在杀伤肿瘤细胞的同时也杀伤与肿瘤细胞表达相同或相近抗原的正常细胞,导致了on-target off-tumor 毒性。
除了黑色素瘤,TCR基因治疗随后在其他肿瘤领域的临床试验也相继开展。癌胚抗原(CEA)广泛存在于一些消化系统癌,血清CEA水平与直肠癌的分期相关,越晚期的病变,CEA浓度越高。2011年,Parkhurst等[21] 完成了利用识别癌胚抗原(CEA)的TCR基因转导的T细胞治疗转移性直肠癌的临床试验,参加临床试验的3名转移性直肠癌患者血清CEA水平全部明显下降,其中1名观察到肿瘤细胞的衰减。但是患者身上均出现了严重的短暂性结肠炎,即同样导致了on-target off-tumor毒性。
睾丸癌抗原(cancer-testis antigen,CTA)在很多癌细胞高表达,而在正常组织表达有限,因此对于TCR修饰T细胞治疗来说比较安全。Robbins 等[22]在2011年完成的一项针对CTA NY-ESO-1的TCR过继性治疗黑色素瘤和滑膜细胞癌的临床研究中,6名滑膜细胞癌患者中观察到4名患者肿瘤细胞衰减,11名黑色素瘤患者中观察到3名患者肿瘤细胞衰减,2名患者病灶完全消失。值得注意的是,参加此临床试验的患者没有出现on-target off-tumor或off-target毒性。这一试验验证了NY-ESO-1对这类型治疗是安全有效性的,因此针对NY-ESO-1的其他癌症大规模随机试验正在进行。
在最近采用的针对自体MAGE-A3特异性TCR转T细胞的临床研究中[23],9名癌症患者中5名患者经历癌症消退的临床反应,1名患者病灶消失,但是2名患者在注射1~2天后陷入昏迷后死亡,死亡原因可能是由该TCR针对脑中表达的MAGE-A12抗原的免疫反应引起的,即该TCR除识别MAGE-A3抗原表位外,还能识别MAGE-A12,从而产生免疫反应导致了脑部神经元细胞的破坏。在另一项TCR靶向MAGEA3治疗黑色素瘤或骨髓瘤的I期临床试验中,两名患者后经历心血管毒性后导致死亡[24, 25],随后的研究显示是由于该TCR的off-target反应性,即靶向MAGE-A3的TCR也能与在心脏表达的一种肌肉特异性蛋白(肌联蛋白)产生免疫反应。
| 靶抗原 | 疾病 | 报道年份 | 患者数目 | 治疗反应 | 临床阶段 | 文献 |
| MART-1 | 黑色素瘤 | 2006 | 17 | 2PR | Ⅰ | [18] |
| 2009 | 31 | 4OR | Ⅰ | [19] | ||
| 2009 | 20 | 6PR | Ⅱ | [20] | ||
| GP100 | 黑色素瘤 | 2009 | 16 | 1CR和2RP | Ⅱ | [20] |
| GP100 | 黑色素瘤 | 2010 | 10 | NI | Ⅰ | [26] |
| P53 | 黑色素瘤 | 2010 | 14 | NI | Ⅱ | [27] |
| CEA | 直肠癌 | 2011 | 3 | 1PR | Ⅰ | [21] |
| NY-ESO-1 | 黑色素瘤和肉瘤 | 2011 | 17 | 2CR和7PR | Ⅱ | [22] |
| 多发性骨髓瘤 | 2012 | 11 | 3CR和7PR | Ⅱ | [28] | |
| MAGE-A3 | 黑色素瘤,食管和滑膜肉瘤 | 2013 | 9 | 1CR和4PR* | Ⅰ/Ⅱ | [23] |
| 黑色素瘤和骨髓瘤 | 2013 | 2 | 2* | Ⅰ | [24, 25] | |
| Note:NOR :objective responses;PR:partial responses;CR:complete response;NI:no information. * Patients died in clinical studies | ||||||
综上所述,本文所介绍的对转TCR基因进行修饰以优化外源TCR配对和表达的策略,有望改善TCR基因转T细胞在临床研究中的抗肿瘤反应,但仍然有许多地方需要改进。例如,在TCR分子的C区引入二硫键虽然减少了T细胞的新免疫原性,但是错配TCR依然存在;鼠源化TCR的免疫排斥问题难以在临床治疗上应用;榫卯结构反转TCR虽然在一定程度上解决了TCR错配,但其优先配对的能力有限,并且pMHC结合能力和T细胞重定向功能都不理想;单链TCR构象不稳定等。对于改造修饰的TCR基因,最重要的是在体内的研究验证,避免on-target off-tumor或是off target毒性。当然,在我们看来,TCR基因免疫治疗最亟需解决的问题是鉴别安全有效的肿瘤特异性抗原。相信随着研究的不断开发和改进,TCR基因转T细胞的免疫治疗将产生更好的临床治疗效果,具有更为广阔的应用前景。
| [1] | Casucci M, Hawkins R E, Dotti G, et al. Overcoming the toxicity hurdles of genetically targeted T cells. Cancer Immunol Immunother, 2015,64 (1):123-130. |
| [2] | Cameron B J, Gerry A B, Dukes J, et al. Identification of a TitinderivedHLA-A1-presented peptide as a cross-reactive target for engineered MAGE A3-directed T cells. Sci Transl Med, 2013,5(197):197ra103. |
| [3] | Bendle G M C, Linnemann A I, Hooijkaas L,et al. Lethalgraft-versus-host disease in mouse models of T cell receptor gene therapy. Nat Med, 2010, 16(5): 565-570. |
| [4] | Sharpe M, Mount N. Genetically modified T cells in cancer therapy: opportunities and challenges. Dis Model Mech,2015, 8(4):337-350. |
| [5] | Cohen C J, Li Y F, El-Gamil M, et al. Enhanced antitumor activity of T cells engineered to express T-cell receptors with a second disulfide bond. Cancer Res, 2007, 67(8):3898-3903. |
| [6] | Thomas S, Xue S A, Cesco-Gaspere M, et al. Targeting the Wilms tumor antigen 1 by TCR gene transfer TCR variants improve tetramer binding but not the function of gene modified human T cells. J Immunol, 2007,179(9):5803-5810. |
| [7] | Cohen C J, Zhao Y, Zheng Z, et al. Enhanced antitumor activity of murine-human hybrid T-cell receptor (TCR) in human lymphocytes is associated with improved pairing and TCR/CD3 stability. Cancer Res, 2006; 66(17): 8878-8886. |
| [8] | Bialer G, Horovitz-Fried M, Ya'acobi S, et al. Selected murine residues endow human TCR with enhanced tumor recognition. J Immunol, 2010, 184 (11): 6232-6241. |
| [9] | Sommermeyer D,Uckert W. Minimal amino acid exchange in human TCR constant regions fosters improved function of TCR gene-modified T cells. J Immunol, 2010,184(11):6223-6231. |
| [10] | Voss R H, Willemsen R A, Kuball J, et al. Molecular design of the Calphabeta interface favors specific pairing of introduced TCRalpha-beta in human T cells. J Immunol, 2008, 180(1): 391-401. |
| [11] | Voss R H, Thomas S, Pfirschke C, et al. Coexpression of the T-cell receptor constant a domain triggers tumor reactivity of single-chian TCR-transduced human Tcells. Blood, 2010, 115(25): 5154-5163. |
| [12] | Aggen D H, Chervin A S, Schmitt T M, et al. Single-chain VαVβ T-cell receptors function without mispairing with endogenous TCR chains. Gene Therapy, 2012,19 (4): 365-374. |
| [13] | Govers C, Sebestyén Z, Berrevoets C, et al. T cell receptor fused to CD3ζ transmembrane domain of CD3ζ prevents TCR mis-pairing whereas complete CD3ζ directs functional TCR expression. The Open Gene Therapy Journal, 2011, 4(1): 11-22. |
| [14] | Govers C, Sebestyén Z, Roszik J, et al. TCRs genetically linked to CD28 and CD3ε do not mispair with endogenous TCR chains and mediate enhanced T cell persistence and anti-melanoma activity. J Immunol. 2014, 193(10):5315-5326. |
| [15] | Lars T, Van der V, Miriam C, et al. αβ T cell receptor transfer to γδ T cells generates functional effector cells without mixed TCR dimers in vivo. J Immunol, 2009,182(1):164-170. |
| [16] | Ochi T, Fujiwara H, Okamoto S, et al. Novel adoptive T-cell immunotherapy using a WT1-specific TCR vector encoding silencers for endogenous TCRs shows marked antileukemia reactivity and safety. Blood, 2011, 118(6):1495-1503. |
| [17] | Provasi E, Genovese P, Lombardo A, et al. Editing T cell specificity towards leukemia by zinc finger nucleases and lentiviral gene transfer. Nat Med, 2012, 18(5):807-815. |
| [18] | Morgan R A, Dudley M E, Wunderlich J R, et al. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science, 2006, 314(5796):126-129. |
| [19] | Burns W R, Zheng Z, Rosenberg S A, et al. Lack of specific gamma-retroviral vector long terminal repeat promoter silencing in patients receiving genetically engineered lymphocytes and activation upon lymphocyte restimulation. Blood, 2009,114(14):2888-2899. |
| [20] | Johnson L A, Morgan R A, Dudley M E, et al. Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen. Blood, 2009,114(3):535-546. |
| [21] | Parkhurst M R, Yang J C, Langan R C, et al. T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis. Mol Ther, 2011, 19 (3): 620-626. |
| [22] | Robbins P F, Morgan R A, Feldman S A, et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J Clin Oncol, 2011,29(7): 917-924. |
| [23] | Morgan R A, Chinnasamy N, Abate-Daga D, et al. Cancer regression and neurological toxicity following anti-MAGE-A3 TCR gene therapy. Immunother, 2013,36 (2):133-151. |
| [24] | Cameron B J, Gerry A B, Dukes J, et al. Identification of a Titin-derived HLA-A1-presented peptide as a cross-reactive target for engineered MAGE A3-directed T cells. Sci Transl Med, 2013, 5(197):197ra103-197ra103. |
| [25] | Linette G P, Stadtmauer E A, Maus M V, et al. Cardiovascular toxicity and titin cross-reactivity of affinity-enhanced T cells in myeloma and melanoma. Blood, 2013, 122(6): 863-871. |
| [26] | Rosenberg S A. Of mice, not men: no evidence for graft-versus-host disease in humans receiving T-cell receptor-transduced autologous T cells. Mol Ther, 2010,18(10):1744-1745. |
| [27] | Davis J L, Theoret M R,Zheng Z, et al. Development of human anti-murine T-cell receptor antibodies in both responding and nonresponding patients enrolled in TCR gene therapy trials. Clin Cancer Res, 2010,16(23):5852-5861. |
| [28] | Rapoport A P, Stadtmauer E A, Vogl D T, et al. Adoptive transfer of gene-modified t-cells engineered to express high-affinity TCRs for cancer-testis antigens (CTAs) NY-ESO-1 or Lage-1, in MM patients post auto-SCT. ASH Annual Meeting Abstr, 2012,120(21):472. |
 2016, Vol. 36
2016, Vol. 36




