文章信息
- 赵志武, 王君实, 马敏, 张少华, 燕炯
- ZHAO Zhi-wu, WANG Jun-shi, MA Min, ZHANG Shao-hua, YAN Jiong
- 下调Perilipin 1基因表达对3T3-L1细胞脂解的影响
- Effect of Down-regulated Perilipin 1 Gene Expression on Lipolysis of 3T3-L1 Adipocytes
- 中国生物工程杂志, 2016, 36(3): 17-22
- China Biotechnology, 2016, 36(3): 17-22
- http://dx.doi.org/DOI:10.13523/j.cb.20160303
-
文章历史
- 收稿日期: 2015-09-17
- 修回日期: 2015-10-10
研究认为,肥胖症的发生与脂质代谢紊乱密切相关[1, 2]。在细胞水平,脂滴作为能量储存的主要细胞器,富含甘油三酯,在脂类合成及分解过程中发挥重要作用。围脂滴蛋白(Perilipin 1,PLIN1)作为脂滴表面蛋白中的重要一员,可双向调节脂肪分解,与脂代谢性疾病、心血管疾病等的发生、发展密切相关[3, 4, 5]。近年来的研究发现,阻断PLIN1基因表达的小鼠脂肪堆积减少,体重下降,可抵制高脂膳食诱导的肥胖症[6, 7],因而PLIN1基因可作为研究肥胖症的靶点。
在肥胖症体外实验研究中发现,PLIN1可保护脂滴中的甘油三酯不被脂肪酶分解,并且可通过FSP27的激活而调节脂代谢[8]。另外,沉默PLIN1基因可加快脂解,促使脂滴减小,但对其具体调节机制尚不清楚。RNA干扰(RNA interference,RNAi)作为特异性沉默相关基因和蛋白质表达的生物技术,已广泛应用于生物医药领域。本次研究通过RNAi技术下调PLIN1基因的表达,探讨其对3T3-L1细胞脂解变化的调节机制,为进一步研究PLIN1与脂代谢之间的关系,以及为相关新药研制提供实验支持。
1 材料与方法 1.1 材 料 1.1.1 主要试剂和细胞Lipofectamine LTX&PLUS、Bodipy 493/503购自Invitrogen公司;PLIN1A、ATGL、HSL和p-HSL抗体购自Abcam公司;牛胰岛素、地塞米松、1-甲基-3-异丁基黄嘌和Hoechst 33258购自Sigma公司;DMEM/F12培养基、胎牛血清、BCA试剂盒、羊抗兔IgG 和超敏ECL化学发光即用型底物购自武汉博士德生物工程有限公司;离心柱质粒小提试剂盒购自天根生化公司;甘油三酯和甘油含量测定试剂盒购自南京建成生物工程研究所;小鼠PKA和cAMP (ELISA)试剂盒由上海西唐生物科技有限公司提供。PLIN1重组质粒委托上海吉凯基因化学技术有限公司合成。小鼠3T3-L1前脂肪细胞由山西医科大学第一附属医院内分泌科惠赠。
1.1.2 主要仪器恒温CO2细胞培养箱(NAPCO-5410,美国Precision Scientific公司);荧光倒置显微镜(DM3000和DM4000B,德国Leica公司);微孔板分光光度计(Eon,美国BioTek公司);高压蒸汽灭菌器购自山东新华医疗器械股份有限公司;Neofuge 23R型台式低温高速离心机购自Heal Force公司;DYY-7c型和DYCZ-24D型电泳仪均购自北京六一仪器厂。
1.2 方 法 1.2.1 shRNA重组载体的构建及鉴定根据NCBI数据库中小鼠PLIN1 mRNA碱基序列(NM_001113471.1),设计3条阳性及1条阴性对照shRNA(small hairpin RNA)序列干扰片段。退火后的shRNA序列与经双酶切回收的质粒(含绿色荧光蛋白序列)在DNA连接酶的作用下16℃连接过夜。连接后的产物进行转化实验,完成构建。3组构建好的阳性重组载体分别命名为sh-PLIN1-1、sh-PLIN1-2、sh-PLIN1-3;阴性对照为sh-PLIN1-4。随后每组各挑取1个单菌落,采用载体多克隆位点两端的引物进行菌液PCR鉴定。各组鉴定为阳性的菌落置于37℃恒温摇床过夜增殖,并按试剂盒说明书要求提取质粒。随后质粒经微孔板分光光度计测定其A260/A280值及浓度。纯度符合实验要求的质粒进行琼脂糖凝胶电泳,鉴定其大小。同时将提取的质粒委托上海吉凯基因化学技术有限公司进行DNA测序鉴定。
1.2.2 细胞培养和诱导分化3T3-L1前脂肪细胞培养于含10%胎牛血清的DMEM/F12基础培养基中。待细胞融合至80%~90%时消化细胞,并以每孔约105个细胞均匀接种于6孔板中。次日,细胞贴壁后加入诱导分化培养基Ⅰ(基础培养基中含牛胰岛素 1mg/L、1-甲基-3-异丁基黄嘌呤0.5mmol/L、地塞米松 1.0μmol/L)。2天后换成诱导分化培养基Ⅱ(基础培养基中含牛胰岛素 1mg/L),继续干预2天。随后更换为基础培养基,培养至诱导分化第6天。
1.2.3 细胞转染细胞诱导分化第6天,用DMEM/F12无血清培养基清洗细胞2次。按本课题组前期优化的转染条件[9],将5μg质粒、10μg脂质体和2ml Opti-MEM 无血清培养基混合均匀,静置30min,并加入每孔,转染细胞6h。随后更换基础培养基继续培养2天。2天后在荧光显微镜下通过明暗场视野比对计算转染效率。
1.2.4 脂滴荧光染色细胞消化后均匀接种于放置盖玻片的6孔板中,并按上述内容诱导分化和转染细胞。用冰甲醇固定细胞,促使绿色荧光消失。用PBS冲洗3次后加入1∶1 000稀释的Bodipy 493/503溶液,染色脂滴30min。随后加入1∶10 000稀释的Hoechst 33258,衬染细胞核20min。用PBS再次冲洗,以甘油封片,在荧光显微镜下拍照,并测定脂滴直径。
1.2.5 细胞内甘油三酯和甘油含量测定用PBS清洗细胞2次,离心后加入0.3ml细胞裂解液,并在冰上裂解30min。甘油三酯测定直接取裂解好的液体,甘油则需70℃灭活脂肪酶10min后取上清液测定。采用酶学方法,严格按照试剂盒说明书要求操作,分别完成细胞内甘油三酯和甘油含量的测定。
1.2.6 Western blot检测PLIN1A、ATGL、HSL和p-HSL蛋白表达细胞干预8天后,每孔加200μl裂解液提取细胞总蛋白质。采用BCA法测定并调平各组蛋白质浓度。各组以30μg总蛋白质上样量进行电泳,并采用湿式转膜法转膜2h。室温封闭3h,随后按说明书推荐比例,分别用封闭液稀释PLIN1A、ATGL、HSL、p-HSL和β-actin抗体,并于4℃孵育转印膜过夜。次日,用PBST洗膜30min,并与1∶10 000稀释的羊抗兔IgG室温孵育2h;再次洗膜后滴加超敏ECL发光液,入暗室进行曝光。蛋白条带通过BIO-RAD软件进行分析,并以β-actin条带作为内参。
1.2.7 ELISA测定细胞中cAMP和PKA浓度用细胞裂解液裂解细胞后,每组各取25μl,测定细胞总蛋白浓度。严格按照ELISA试剂盒说明要求操作,并于450nm波长下测定OD值。分别绘制cAMP及PKA的标准曲线,计算各组浓度,并以总蛋白质浓度校准。
1.2.8 统计学分析实验数据采用均数±标准差(x±s)表示,通过SPSS 17.0统计软件分析结果。两均数比较采用t检验,多样本均数比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
2 结 果 2.1 sh-PLIN1重组载体菌液PCR及质粒鉴定菌液PCR扩增后,琼脂糖凝胶电泳结果显示:sh-PLIN1-1组、sh-PLIN1-2组、sh-PLIN1-3组和sh-PLIN1-4组载体均连入各自的shRNA序列(连入shRNA的PCR片段大小为367bp,未连入的为322bp)。4组质粒经微量分光光度计测定,其A260/A280值均介于1.8左右,符合纯度要求;4组的质粒浓度分别为(171.7±9.5)ng/μl、 (184.2±9.5)ng/μl、(138.0±8.2)ng/μl和(241.1±10.7)ng/μl。质粒琼脂糖凝胶电泳检测发现,4组目的条带均约为6 400bp,与预测结果一致,说明质粒提取准确(图 1)。另外,DNA测序鉴定结果与4组设计的序列完全一致,进一步证实各sh-PLIN1重组载体构建成功。
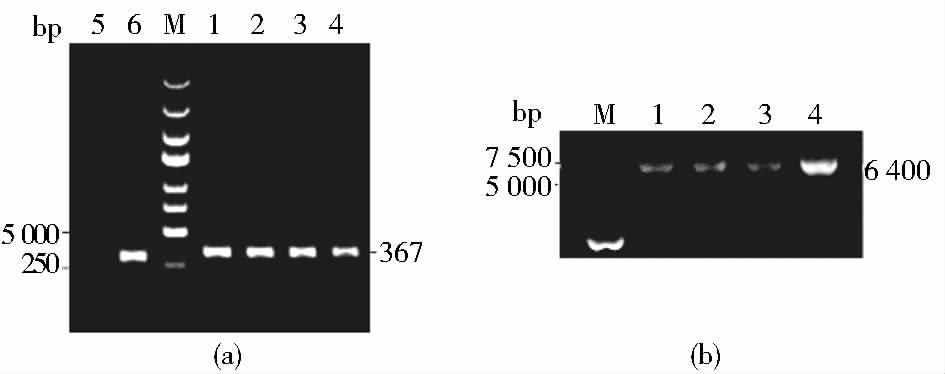 |
| 图 1 sh-PLIN1重组载体鉴定 Fig. 1 Identification of sh-PLIN1 vector(a) Bacterium liquid PCR reaction of sh-PLIN1 recombinant vectors 1: sh-PLIN1-1 group; 2: sh-PLIN1-2 group; 3: sh-PLIN1-3 group; 4: sh-PLIN1-4 group (negative control group); 5: ddH2O group; 6: Empty vector group; M: DNA maker (b) Gel electrophoresis of every recombinant plasmid 1: sh-PLIN1-1 group; 2: sh-PLIN1-2 group; 3: sh-PLIN1-3 group; 4: sh-PLIN1-4 group |
细胞经诱导分化6天和转染2天处理后,sh-PLIN1-1组、sh-PLIN1-2组、sh-PLIN1-3组和sh-PLIN1-4组细胞转染率分别为(47.2±5.4)%、(43.6±6.3)%、(44.2±5.0)%和(48.5±7.1)%,均适用于PLIN1下调效果测定。经Western blot检测,与sh-PLIN1-4组相比,sh-PLIN1-1组、sh-PLIN1-2组和sh-PLIN1-3组PLIN1A蛋白表达量显著下降(P<0.05),而未转染组无明显差异(P>0.05),表明3组阳性sh-PLIN1重组载体均可有效下调PLIN1A蛋白的表达(图 2)。随后用sh-PLIN1-1阳性载体作为sh-PLIN1转染组,sh-PLIN1-4阴性载体作为阴性转染组进行后续实验研究。
 |
| 图 2 3T3-L1细胞中PLIN1A蛋白表达 Fig. 2 Expression of PLIN1A protein in 3T3-L1 adipocytes(a)Western blot assay of PLIN1A expression (b)Relative level of PLIN1A (a),(b) The protein level of PLIN1A 1: sh-PLIN1-1 group; 2:sh-PLIN1-2 group; 3:sh-PLIN1-3 group; 4:sh-PLIN1-4 group (negative control group); 5:No transfection group; a: P<0.05 |
经Bodipy 493/503和Hoechst 33258染色后,3组细胞中脂滴(绿色荧光)均围绕细胞核(蓝色荧光)分布,出现典型的“花环型”结构。与阴性转染组相比,sh-PLIN1转染组中直径大于2μm的脂滴所占比例下降50.1%,而小于1μm的脂滴所占比例增加1.69倍,说明sh-PLIN1转染组中脂滴减小。另外,阴性转染组与未转染组中脂滴形态无明显差异(图 3、图 4)。
 |
| 图 3 脂滴荧光染色 Fig. 3 Fluorescence staining of lipid droplets(rule=25μm) |
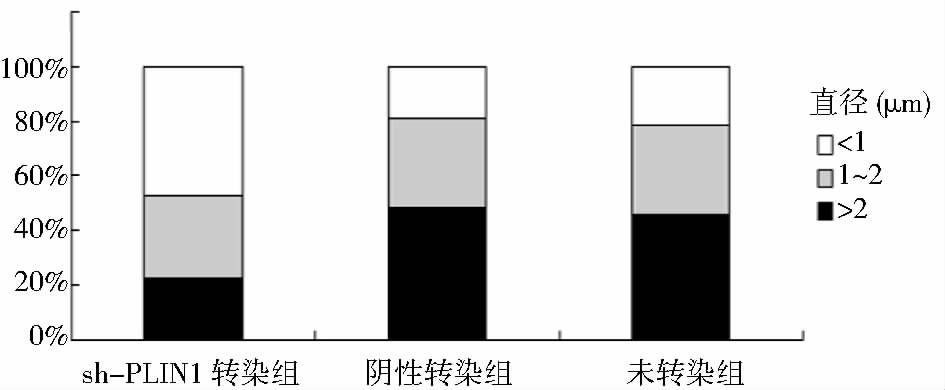 |
| 图 4 脂滴大小分布 Fig. 4 Lipid droplets size distribution |
与阴性转染组比较,sh-PLIN1转染组细胞内甘油三酯含量下降,甘油含量升高,两者差异均有统计学意义(P<0.05),而未转染组无明显变化(P>0.05),说明sh-PLIN1载体可加快细胞内甘油三酯的分解(表 1)。
| 组别 | 甘油三酯(mmol/g protien) | 甘油(mmol/g protien) |
| sh-PLIN1转染组 | 0.0726±0.0054a | 0.0678±0.0114a |
| 阴性转染组 | 0.1031±0.0062 | 0.0442±0.0064 |
| 未转染组 | 0.1083±0.0075 | 0.0438±0.0096 |
| Note:Compared to the negative control group; a: P<0.05 | ||
Western blot检测结果显示(图 5),与阴性转染组相比,sh-PLIN1转染组中ATGL和HSL蛋白表达量显著升高(P<0.05),p-HSL蛋白表达量无明显差异(P>0.05),说明ATGL和HSL参与脂解加快的调节。
 |
| 图 5 ATGL、HSL和p-HSL蛋白的表达 Fig. 5 Expression of ATGL,HSL and p-HSL protein(a)Western blot assay of ATGL、HSL and p-HSL expression (b) Relative level of ATGL (c)Relative level of HSL (d) Relative level of p-HSL (a)~(d) The protein levels of ATGL,HSL and p-HSL 1: sh-PLIN1-1 group; 2: Negative control group; 3: No transfection group; a: P<0.05 |
经ELISA检测,sh-PLIN1转染组、阴性转染组和未转染组中cAMP和PKA的浓度均无显著性差异(P>0.05,)(表 2),说明cAMP/PKA信号通路对脂解加快的调节不明显。
| 组别 | cAMP(pmol/mg protien) | PKA(pg/mg protien) |
| sh-PLIN1转染组 | 69.78±7.96 | 112.02±12.44 |
| 阴性转染组 | 67.00±9.03 | 115.60±8.66 |
| 未转染组 | 62.58±6.30 | 102.03±10.19 |
PLIN1基因可通过不同的剪接转录,生成4种不同长度的mRNA,编码PLIN1A、PLIN1B、PLIN1C和PLIN1D 4种蛋白质。其中,PLIN1A在脂肪细胞中含量最丰富,在能量及脂质代谢过程中发挥重要作用;PLIN1B则含量很少,主要对PLIN1A起辅助支撑作用,而PLIN1C、PLIN1D不在脂肪细胞中表达[10, 11]。此外,PLIN1还是脂滴表面含量最多的一种可磷酸化蛋白。在基础状态下,PLIN1对脂滴具有屏障作用,保护甘油三酯不被水解;而其含量降低或发生磷酸化时,则可加快甘油三酯的分解。近期国内外研究报道认为:沉默PLIN1基因的脂肪细胞中脂滴明显减小,脂解率显著升高[12, 13]。
在脂质分解过程中,主要的水解酶包括ATGL和HSL。ATGL作为甘油三酯第一步水解反应的限速酶,主要位于细胞质中。基础状态下的HSL同样也存在于细胞质中,当其被磷酸化后,水解酶活性会明显增强。脂肪分解时,甘油三酯在ATGL的作用下水解成甘油二酯,然后再由HSL催化甘油二酯水解成甘油一酯,最后甘油一酯水解为甘油[14, 15]。通过甘油三酯和甘油含量的变化可以评价脂解的情况。另外,PLIN1通过CGI-58调节ATGL的表达,进而发挥调控脂解的作用[16]。当PLIN1蛋白表达下降时,ATGL和HSL的活性增加,促进甘油三酯分解[8, 17]。
cAMP/PKA信号通路是参与脂肪分解调控的重要通路。当细胞中cAMP水平升高时,PKA被激活。激活的PKA促使HSL磷酸化,并且磷酸化的HSL会转移至脂滴表面,与甘油三酯反应,加快脂解速率[18]。
本课题组通过菌液PCR检测、DNA测序和质粒大小鉴定证明sh-PLIN1重组载体构建成功。由于PLIN1A蛋白在本次脂解调节机制研究中发挥重要作用,并且含量高,易于检测(PLIN1B含量很低,不易检测),因此PLIN1A蛋白表达的减少可间接说明构建的sh-PLIN1重组载体可有效下调PLIN1基因表达。在下调PLIN1基因表达的成熟3T3-L1细胞中,脂滴变小,甘油三酯含量显著降低,甘油含量显著升高(P<0.05),这些结果均与上述实验报道一致。另外,下调PLIN1基因表达后,细胞中ATGL和HSL的表达量显著增高(P<0.05),而且p-HSL蛋白的表达量,以及cAMP和PKA的浓度均无明显变化(P>0.05)。因此本实验认为,下调PLIN1基因表达引起的脂解加快可能由细胞中ATGL和HSL的高表达所引起,cAMP/PKA信号通路对该脂解变化无明显调节作用,具体的调节机制需进一步探究。
综上所述,本研究证实了PLIN1基因在脂解过程中发挥的作用,为进一步了解其生物学功能,以及为研制预防和治疗肥胖症的生物制剂提供了理论基础。
| [1] | Schmidt A M. The growing problem of obesity: mechanisms, consequences, and therapeutic approaches. Arterioscler Thromb Vasc Biol, 2015, 35(6):e19-23. |
| [2] | Lovren F, Teoh H, Verma S. Obesity and atherosclerosis: mechanistic insights. Can J Cardiol, 2015, 31(2):177-183. |
| [3] | Kozusko K, Tsang V H, Bottomley W, et al. Clinical and molecular characterization of a novel PLIN1 frameshift mutation identified in patients with familial partial lipodystrophy. Diabetes, 2015, 64(1):299-310. |
| [4] | Song W, Yu H, Lin Y, et al. A functional variant in the exon 5 of PLIN1 reduces risk of central obesity by possible regulation of lipid storage. Biochem Biophys Res Commun, 2015, 456(4):896-900. |
| [5] | Liu S, Geng B, Zou L, et al. Development of hypertrophic cardiomyopathy in perilipin-1 null mice with adipose tissue dysfunction.Cardiovasc Res, 2015, 105(1):20-30. |
| [6] | Beylot M, Neggazi S, Hamlat N, et al. Perilipin 1 ablation in mice enhances lipid oxidation during exercise and does not impair exercise performance. Metabolism, 2012, 61(3):415-423. |
| [7] | Lyu Y, Su X, Deng J, et al. Defective differentiation of adipose precursor cells from lipodystrophic mice lacking perilipin 1. PLoS One, 2015, 10(2):e0117536. |
| [8] | Sun Z, Gong J, Wu H, et al. Perilipin1 promotes unilocular lipid droplet formation through the activation of Fsp27 in adipocytes. Nat Commun, 2013, 4:1594-1624. |
| [9] | 师磊. 沉默MCHR1对小鼠3T3-L1细胞脂肪合成的影响及机制研究. 山西:山西医科大学,公共卫生学院, 2014. Shi L. The Effect and Mechanism of MCHR1 Silencing on Fat Synthesis of Mouse 3T3-L1 Cells. Shanxi:Shanxi Medical University, School of Public Health, 2014. |
| [10] | 赵志武, 师磊, 马敏,等. RNA干扰技术在PAT家族蛋白研究中的应用. 中国生化药物杂志, 2014, 34(6):178-180. Zhao Z W, Shi L, Ma M, et al. Application of RNA interference technology in the research of PAT proteins. Chinese Journal of Biochemical Pharmaceutics, 2014, 34(6):178-180. |
| [11] | Ordovás J M, Smith C E. PLIN1 gene: fat keeper and prevention switcher. J Appl Physiol, 2010, 108(3): 477-478. |
| [12] | Lizaso A, Tan K T, Lee Y H. β-adrenergic receptor-stimulated requires lipolysis the RAB7-mediated autolysosomal lipid degradation. Autophagy, 2013, 9(8):1228-1243. |
| [13] | Yang X, Heckmann B L, Zhang X, et al. Distinct mechanisms regulate ATGL-mediated adipocyte lipolysis by lipid droplet coat proteins. Mol Endocrinol, 2013, 27(1):116-126. |
| [14] | Lampidonis A D, Rogdakis E, Voutsinas G E, et al. The resurgence of Hormone-Sensitive Lipase (HSL) in mammalian lipolysis. Gene, 2011, 477(1-2):1-11. |
| [15] | Young S G, Zechner R. Biochemistry and pathophysiology of intravascular and intracellular lipolysis. Genes Dev, 2013, 27(5):459-484. |
| [16] | Granneman J G, Moore H P, Krishnamoorthy R, et al. Perilipin controls lipolysis by regulating the interactions of AB-hydrolase containing 5 (Abhd5) and adipose triglyceride lipase (Atgl). J Biol Chem, 2009, 284(50):34538-34544. |
| [17] | Frühbeck G, Méndez-Giménez L, Fernández-Formoso J A, et al. Regulation of adipocyte lipolysis. Nutr Res Rev, 2014, 27(1):63-93. |
| [18] | Nielsen T S, Jessen N, Jørgensen J O, et al. Dissecting adipose tissue lipolysis: molecular regulation and implications for metabolic disease. J Mol Endocrinol, 2014, 52(3):R199-222. |
 2016, Vol. 36
2016, Vol. 36




